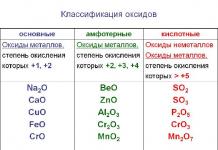
Оксиды – сложные вещества, состоящие из двух элементов, одним из которых является кислород. Оксиды могут быть солеобразующими и несолеобразующими: одним из видов солеобразующих оксидов являются основные оксиды. Чем они отличаются от других видов, и каковы их химические свойства?
Солеобразующие оксиды подразделяются на основные, кислотные и амфотерные оксиды. Если основным оксидам соответствуют основания, то кислотным – кислоты, а амфотерным оксидам соответствуют амфотерные образования. Амфотерными оксидами называют такие соединения, которые в зависимости от условий могут проявлять либо основные, либо кислотные свойства.

Рис. 1. Классификация оксидов.
Физические свойства оксидов очень разнообразны. Они могут быть как газами (CO 2), так и твердыми (Fe 2 O 3) или жидкими веществами (H 2 O).
При этом большинство основных оксидов является твердыми веществами различных цветов.
оксиды, в которых элементы проявляют свою высшую активность называются высшими оксидами. Порядок возрастания кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов.
Химические свойства основных оксидов
Основными оксидами называются оксиды, которым соответствуют основания. Например, основным оксидам K 2 O, СaO соответствуют основания KOH, Ca(OH) 2 .

Рис. 2. Основные оксиды и соответствующие им основания.
Основные оксиды образуются типичными металлами, а также металлами переменной валентности в низшей степени окисления (например, CaO, FeO), реагируют с кислотами и кислотными оксидами, образуя при этом соли:
CaO (основной оксид)+CO 2 (кислотный оксид)=СaCO 3 (соль)
FeO (основной оксид)+H 2 SO 4 (кислота)=FeSO 4 (соль)+2H 2 O (вода)
Основные оксиды также взаимодействуют с амфотерными оксидами, в результате чего происходит образование соли, например:
С водой реагируют только оксиды щелочных и щелочно-земельных металлов:
BaO (основной оксид)+H 2 O (вода)=Ba(OH) 2 (основание щелочнозем. металла)
Многие основные оксиды имеют характер восстанавливаться до веществ, состоящих из атомов одного химического элемента:
3CuO+2NH 3 =3Cu+3H 2 O+N 2
При нагревании разлагаются только оксиды ртути и благородных металлов:

Рис. 3. Оксид ртути.
Список основных оксидов:
| Название оксида | Химическая формула | Свойства |
| Оксид кальция | CaO | негашенная известь, белое кристаллическое вещество |
| Оксид магния | MgO | белое вещество, малорастворимое в воде |
| Оксид бария | BaO | бесцветные кристаллы с кубической решеткой |
| Оксид меди II | CuO | вещество черного цвета практически нерастворимое в воде |
| HgO | твердое вещество красного или желто-оранжевого цвета | |
| Оксид калия | K 2 O | бесцветное или бледно-желтое вещество |
| Оксид натрия | Na 2 O | вещество, состоящее из бесцветных кристаллов |
| Оксид лития | Li 2 O | вещество, состоящее из бесцветных кристаллов, которые имеют строение кубической решетки |
Роль химии в научно-техническом прогрессе велика. Множество простых и сложных веществ применяют в разных областях строительной, производственной и сельскохозяйственной сфер. Среди них достаточное количество неорганических соединений. К важнейшим классам неорганических соединений относят оксиды , основания, кислоты, соли.
Оксиды
Оксид - сложное вещество, включающее в себя два элемента, один из которых кислород в степени окисления - 2. Общая формула оксидов Э х О у, где х - число атомов элемента; у - число атомов кислорода .
Состав оксидов
Состав оксида определяется положительной степенью окисления элемента, образующего оксид.
Название оксида складывается из слова “оксид” и названия элемента. Если элемент проявляет переменную валентность, то рядом с названием оксида ставится валентность в скобках:
Na 2 O - оксид натрия;
SO 3 - оксид серы (VI);
Получение оксидов
Получение оксидов :
a) окислением элементов кислородом
4Al + 3O 2 = 2Al 2 O 3 ;
S + O 2 = SO 2 ;
б) при разложении сложных веществ
Ca(OH) 2 → CaO + H 2 O;
H 2 SO 3 → SO 2 + H 2 O;
в) при окислении сложных веществ
2H 2 S + 3O 2 = 2SO 2 + 2H 2 O.
Классификация оксидов
По химическим свойствам оксиды подразделяются на солеобразующие и несолеобразующие или безразличные (СО, NO, N 2 O, SiO).
Продукты взаимодействия оксидов с водой называются гидроксидами, которые могут быть основаниями (NaOH, Cu(OH) 2), кислотами (H 2 SO 4 , H 3 PO 4), амфотерными гидроксидами (Zn(OH) 2 = H 2 ZnO 2).
Солеобразующие оксиды делятся на основные , кислотные и амфотерные .
Основными называют оксиды, которым соответствует основание: CaO → Ca(OH) 2 , кислотными - которым соответствует кислота: CO 2 → H 2 CO 3 . Амфотерным оксидам соответствуют как кислоты, так и основания:
Zn(OH) 2 ← ZnO → H 2 ZnO 2 .
Основные оксиды образуют металлы, кислотные - неметаллы и некоторые металлы побочных подгрупп, амфотерные - амфотерные металлы.
Химические свойства оксидов
Основные оксиды реагируют:
1) с водой с образованием оснований:
Na 2 О + H 2 O = 2NaОH;
CaO + H 2 O = Ca(OH) 2 ;
2) с соединениями кислотного характера (кислотными оксидами, кислотами) с образованием солей и воды:
CaO + СО 2 = СаСО 3 ;
CaO + 2HCl = CaCl 2 + H 2 O;
3) с соединениями амфотерного характера:
Li 2 O + Al 2 O 3 = 2Li AlO 2 ;
3NaOH + Al(OН) 3 = Na 3 AlO 3 + 3Н 2 О;
Кислотные оксиды реагируют:
1) с водой с образованием кислот:
SO 3 + H 2 O = H 2 SO 4 ;
2) с соединениями основного характера (основными оксидами и основаниями) с образованием солей и воды:
SO 2 + Na 2 O = Na 2 SO 3 ;
CO 2 + 2NaОH = Na 2 CO 3 + H 2 O;
3) с соединениями амфотерного характера
СО 2 + ZnO = ZnCO 3 ;
СО 2 + Zn(OH) 2 = ZnСО 3 + H 2 O;
Амфотерные оксиды проявляют свойства как основных, так и кислотных оксидов. Им отвечают амфотерные гидроксиды:
Кислая среда щелочная среда
Ве(ОН) 2 ВеО Н 2 ВеО 2
Zn(OH) 2 ZnO Н 2 ZnО 2
Аl(OН) 3 Al 2 O 3 H 3 AlО 3 , НАlO 2
Cr(OН) 3 Сr 2 O 3 HCrO 2
Pb(OH) 2 PbO Н 2 PbО 2
Sn(OH) 2 SnO Н 2 SnО 2
Амфотерные оксиды взаимодействуют с соеднинениями кислого и основного характера:
| ZnO + SiO 2 = ZnSiO 3 ; ZnO + H 2 SiO 3 = ZnSiO 3 + H 2 O; | Al 2 O 3 + 3Na 2 O = 2Na 3 AlO 3 ; Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O. |
Металлы с переменной валентностью могут образовывать оксиды всех трех типов. Например:
CrO основной Cr(OH) 2 ;
Cr 2 O 3 амфотерный Cr(OH) 3 ;
Cr 2 O 7 кислотный H 2 Cr 2 O 7 ;
MnO, Mn 2 O 3 основной;
MnO 2 амфотерный;
Mn 2 O 7 кислотный HMnO 4 .
Оксидами называются сложные вещества, в состав молекул которых входят атомы кислорода в степни окисления – 2 и какого-нибудь другого элемента.
могут быть получены при непосредственном взаимодействии кислорода с другим элементом, так и косвенным путём (например, при разложении солей, оснований, кислот). В обычных условиях оксиды бывают в твёрдом, жидком и газообразном состоянии, этот тип соединений весьма распространён в природе. Оксиды содержатся в Земной коре. Ржавчина, песок, вода, углекислый газ – это оксиды.
Они бывают солеобразующими и несолеобразующие.
Солеобразующие оксиды – это такие оксиды, которые в результате химических реакций образуют соли. Это оксиды металлов и неметаллов, которые при взаимодействии с водой образуют соответствующие кислоты, а при взаимодействии с основаниями – соответствующие кислые и нормальные соли. Например, оксид меди (CuO) является оксидом солеобразующим, потому что, например, при взаимодействии её с соляной кислотой (HCl) образуется соль:
CuO + 2HCl → CuCl 2 + H 2 O.
В результате химических реакций можно получать и другие соли:
CuO + SO 3 → CuSO 4 .
Несолеобразующими оксидами называются такие оксиды, которые не образуют солей. Примером могут служить СО, N 2 O, NO.
Солеобразующие оксиды в свою очередь бывают 3-х типов: основными (от слова «
основание»
), кислотными и амфотерными.
Основными оксидами называются такие оксиды металлов, которым соответствуют гидроксиды, относящиеся к классу оснований. К основным оксидам относятся, например, Na 2 O, K 2 O, MgO, CaO и т.д.
 Химические свойства основных оксидов
Химические свойства основных оксидов
1. Растворимые в воде основные оксиды вступают в реакцию с водой, образуя основания:
Na 2 O + H 2 O → 2NaOH.
2. Взаимодействуют с кислотными оксидами, образуя соответствующие соли
Na 2 O + SO 3 → Na 2 SO 4 .
3. Реагируют с кислотами, образуя соль и воду:
CuO + H 2 SO 4 → CuSO 4 + H 2 O.
4. Реагируют с амфотерными оксидами:
Li 2 O + Al 2 O 3 → 2LiAlO 2 .
Если в составе оксидов в качестве второго элемента будет неметалл или металл, проявляющий высшую валентность (обычно проявляют от IV до VII), то такие оксиды будут кислотными. Кислотными оксидами (ангидридами кислот) называются такие оксиды, которым соответствуют гидроксиды, относящие к классу кислот. Это, например, CO 2 , SO 3 , P 2 O 5 , N 2 O 3 , Cl 2 O 5 , Mn 2 O 7 и т.д. Кислотные оксиды растворяются в воде и щелочах, образуя при этом соль и воду.
Химические свойства кислотных оксидов
1. Взаимодействуют с водой, образуя кислоту:
SO 3 + H 2 O → H 2 SO 4 .
Но не все кислотные оксиды непосредственно реагируют с водой (SiO 2 и др.).
2. Реагируют с основанными оксидами с образованием соли:
CO 2 + CaO → CaCO 3
3. Взаимодействуют со щелочами, образуя соль и воду:
CO 2 + Ba(OH) 2 → BaCO 3 + H 2 O.
В состав амфотерного оксида входит элемент, который обладает амфотерными свойствами. Под амфотерностью понимают способность соединений проявлять в зависимости от условий кислотные и основные свойства. Например, оксид цинка ZnO может быть как основанием, так и кислотой (Zn(OH) 2 и H 2 ZnO 2). Амфотерность выражается в том, что в зависимости от условий амфотерные оксиды проявляют либо осно́вные, либо кислотные свойства.
Химические свойства амфотерных оксидов
1. Взаимодействуют с кислотами, образуя соль и воду:
ZnO + 2HCl → ZnCl 2 + H 2 O.
2. Реагируют с твёрдыми щелочами (при сплавлении), образуя в результате реакции соль – цинкат натрия и воду:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O.
При взаимодействии оксида цинка с раствором щелочи (того же NaOH) протекает другая реакция:
ZnO + 2 NaOH + H 2 O => Na 2 .
Координационное число – характеристика, которая определяет число ближайших частиц: атомов или инов в молекуле или кристалле . Для каждого амфотерного металла характерно свое координационное число. Для Be и Zn – это 4; Для и Al – это 4 или 6; Для и Cr – это 6 или (очень редко) 4;
Амфотерные оксиды обычно не растворяются в воде и не реагируют с ней.
Остались вопросы? Хотите знать больше об оксидах?
Чтобы получить помощь репетитора – зарегистрируйтесь .
Первый урок – бесплатно!
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Оксидами называются сложные вещества, в состав молекул которых входят атомы кислорода в степни окисления – 2 и какого-нибудь другого элемента.
могут быть получены при непосредственном взаимодействии кислорода с другим элементом, так и косвенным путём (например, при разложении солей, оснований, кислот). В обычных условиях оксиды бывают в твёрдом, жидком и газообразном состоянии, этот тип соединений весьма распространён в природе. Оксиды содержатся в Земной коре. Ржавчина, песок, вода, углекислый газ – это оксиды.
Они бывают солеобразующими и несолеобразующие.
Солеобразующие оксиды – это такие оксиды, которые в результате химических реакций образуют соли. Это оксиды металлов и неметаллов, которые при взаимодействии с водой образуют соответствующие кислоты, а при взаимодействии с основаниями – соответствующие кислые и нормальные соли. Например, оксид меди (CuO) является оксидом солеобразующим, потому что, например, при взаимодействии её с соляной кислотой (HCl) образуется соль:
CuO + 2HCl → CuCl 2 + H 2 O.
В результате химических реакций можно получать и другие соли:
CuO + SO 3 → CuSO 4 .
Несолеобразующими оксидами называются такие оксиды, которые не образуют солей. Примером могут служить СО, N 2 O, NO.
Солеобразующие оксиды в свою очередь бывают 3-х типов: основными (от слова «
основание»
), кислотными и амфотерными.
Основными оксидами называются такие оксиды металлов, которым соответствуют гидроксиды, относящиеся к классу оснований. К основным оксидам относятся, например, Na 2 O, K 2 O, MgO, CaO и т.д.
 Химические свойства основных оксидов
Химические свойства основных оксидов
1. Растворимые в воде основные оксиды вступают в реакцию с водой, образуя основания:
Na 2 O + H 2 O → 2NaOH.
2. Взаимодействуют с кислотными оксидами, образуя соответствующие соли
Na 2 O + SO 3 → Na 2 SO 4 .
3. Реагируют с кислотами, образуя соль и воду:
CuO + H 2 SO 4 → CuSO 4 + H 2 O.
4. Реагируют с амфотерными оксидами:
Li 2 O + Al 2 O 3 → 2LiAlO 2 .
Если в составе оксидов в качестве второго элемента будет неметалл или металл, проявляющий высшую валентность (обычно проявляют от IV до VII), то такие оксиды будут кислотными. Кислотными оксидами (ангидридами кислот) называются такие оксиды, которым соответствуют гидроксиды, относящие к классу кислот. Это, например, CO 2 , SO 3 , P 2 O 5 , N 2 O 3 , Cl 2 O 5 , Mn 2 O 7 и т.д. Кислотные оксиды растворяются в воде и щелочах, образуя при этом соль и воду.
Химические свойства кислотных оксидов
1. Взаимодействуют с водой, образуя кислоту:
SO 3 + H 2 O → H 2 SO 4 .
Но не все кислотные оксиды непосредственно реагируют с водой (SiO 2 и др.).
2. Реагируют с основанными оксидами с образованием соли:
CO 2 + CaO → CaCO 3
3. Взаимодействуют со щелочами, образуя соль и воду:
CO 2 + Ba(OH) 2 → BaCO 3 + H 2 O.
В состав амфотерного оксида входит элемент, который обладает амфотерными свойствами. Под амфотерностью понимают способность соединений проявлять в зависимости от условий кислотные и основные свойства. Например, оксид цинка ZnO может быть как основанием, так и кислотой (Zn(OH) 2 и H 2 ZnO 2). Амфотерность выражается в том, что в зависимости от условий амфотерные оксиды проявляют либо осно́вные, либо кислотные свойства.
Химические свойства амфотерных оксидов
1. Взаимодействуют с кислотами, образуя соль и воду:
ZnO + 2HCl → ZnCl 2 + H 2 O.
2. Реагируют с твёрдыми щелочами (при сплавлении), образуя в результате реакции соль – цинкат натрия и воду:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O.
При взаимодействии оксида цинка с раствором щелочи (того же NaOH) протекает другая реакция:
ZnO + 2 NaOH + H 2 O => Na 2 .
Координационное число – характеристика, которая определяет число ближайших частиц: атомов или инов в молекуле или кристалле . Для каждого амфотерного металла характерно свое координационное число. Для Be и Zn – это 4; Для и Al – это 4 или 6; Для и Cr – это 6 или (очень редко) 4;
Амфотерные оксиды обычно не растворяются в воде и не реагируют с ней.
Остались вопросы? Хотите знать больше об оксидах?
Чтобы получить помощь репетитора – .
Первый урок – бесплатно!
blog.сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
|
Способы получения. |
Ограничения и примечания |
|
|
1. Окисление простых веществ: |
а) металлов: 2Ca + O 2 2CaO б) неметаллов: 4P + 3O 2 (нед) 2P 2 O 3 4P + 5O 2 (изб) 2P 2 O 5 (Из S – SO 2 , из Fe – Fe 2 O 3 и Fe 3 O 4 , из N 2 – NO) |
С кислородом не реагируют галогены, инертные газы, Au, Pt. Азот реагирует в жестких условиях (2000°C). |
|
2. Окисление сложных веществ: |
а) водородных соединений: 2Н 2 S + 3O 2 2H 2 O + 2SO 2 б) сульфидов, карбидов, фосфидов (бинарных соединений): 2ZnS + 3O 2 2ZnO + 2SO 2 |
Каждый элемент сложного вещества окисляется в соответствии со своими свойствами. |
|
3. Разложение гидроксидов и солей: |
а) гидроксидов (оснований и кислот):2Al(OH) 3 → t Al 2 O 3 + 3H 2 O H 2 SiO 3 → t SiO 2 + H 2 O б) карбонатов: СаСО 3 → t CaO+CO 2 |
Гидроксиды и карбонаты щелочных металлов (Na,K, Rb,Cs) не разлагаются. |
|
4. Окисление кислородом или озоном |
а) кислородом: 2СО + О 2 2СО 2 б) озоном: NO + O 3 NO 2 + O 2 |
Возможна, если элемент имеет несколько оксидов (сера, фосфор, углерод, азот, железо). |
Свойства оксидов.
Основные оксиды – оксиды, которым соответствуют основания. Это оксиды металлов со степенями окисления +1 и +2, кроме амфотерных (ZnO, BeO, SnO, PbO)
Свойства основных оксидов.
|
Свойства |
Примеры реакций |
Ограничения и примечания |
|
1) Реакция с растворами кислот |
Li 2 O + 2HCl= 2LiCl+ H 2 O NiO + H 2 SO 4 = NiSO 4 + H 2 O |
Кислота должна существовать в виде раствора (не реагируют кремниевая, сероводородная, угольная) |
|
2) Реакция с водой |
Li 2 O + H 2 O = 2LiOH BaO + H 2 O = Ba(OH) 2 (только 8 оксидов: IA группа, СаО, SrO, ВаО) |
Оксид реагирует с водой, только если в результате образуется растворимый гидроксид (щелочь). |
|
3) Реакция с кислотными и амфотерными оксидами |
BaO + CO 2 = BaCO 3 , FeO + SO 3 = FeSO 4 , CuO + N 2 O 5 = Cu(NO 3) 2 СаО + SO 2 = CaSO 3 |
Один из реагирующих оксидов (основный или кислотный) должен соответствовать сильному гидроксиду. |
|
4) Восстановление оксида до металла или до низшего оксида : |
MnO + C = Mn + CO (при нагревании), FeO + H 2 = Fe + H 2 O (при нагревании). Fe 2 O 3 + CO = FeO + CO 2 |
В качестве восстановителей используют: СО, С, водород, алюминий, магний. С водородом реагируют оксиды неактивных металлов. |
|
5) Окисление кислородом. |
4FeO + O 2 = 2Fe 2 O 3 |
Если металл имеет несколько оксидов с разными степенями окисления. |
Кислотные оксиды – оксиды, которым соответствуют кислоты.
Кислотные оксиды при комнатной температуре бывают:
*газы (например: СО 2 , SO 2 , NO, SeO 2)*жидкости (например, SO 3 , Mn 2 O 7) *твердые вещества (например: B 2 O 3 , SiO 2 , N 2 O 5 , P 2 O 3 , P 2 O 5 , I 2 O 5 , CrO 3).
Свойства кислотных оксидов.
|
Свойства |
Примеры реакций |
Примечания |
|
1) Реакция с основа - ниями |
CO 2 + Ca(OH) 2 = CaCO 3 + H 2 O SiO 2 + 2KOH = K 2 SiO 3 + H 2 O (при нагревании), SO 3 + 2NaOH = Na 2 SO 4 + H 2 O, N 2 O 5 + 2KOH = 2KNO 3 + H 2 O. |
Реакция возможна со щелочами. Наиболее активные кислотные оксиды (SO 3 , CrO 3 , N 2 O 5 , Cl 2 O 7) могут реагировать и с нерастворимыми (слабыми) основаниями. |
|
2) Реакция с амфотер-ными и основными оксидами |
CO 2 + CaO = CaCO 3 P 2 O 5 + 6FeO = 2Fe 3 (PO 4) 2 (при нагревании) N 2 O 5 + ZnO = Zn(NO 3) 2 |
Один из реагирующих оксидов (основный или кислотный) должен соответствовать сильному гидроксиду . |
|
3) Реакция с водой. Образуют - ся КИСЛОТЫ. |
N 2 O 3 + H 2 O = 2HNO 2 SO 2 + H 2 O = H 2 SO 3 N 2 O 5 + H 2 O = 2HNO 3 SO 3 + H 2 O = H 2 SO 4 |
Оксид реагирует с водой, если в результате образуется растворимый гидроксид. Не реагирует с водой SiO 2 . |
|
4) Реакции с солями летучих кислот. |
SiO 2 + K 2 CO 3 = K 2 SiO 3 + CO 2 (при нагревании) |
Твёрдые, нелетучие оксиды (SiO 2 ,P 2 O 5) вытесняют из солей летучие. |
|
5) Окисле - ние. |
2SO 2 + O 2 ⇆ 2SO 3 |
Низшие оксиды окисляются до высших. |
Амфотерные оксиды – оксиды, способные реагировать и с кислотами, и со щелочами. По химическим свойствам амфотерные оксиды похожи на основные оксиды и отличаются от них только своей способностью реагировать с щелочами , как с твердыми (при сплавлении), так и с растворами, а также с основными оксидами.
Вещества, образуемые катионами амфотерных металлов в щелочной среде:
|
Степень окисления |
В растворе |
В расплаве |
|
(Zn , Be , Sn ) |
Na 2 [ Zn (OH ) 4 ] тетрагидроксоцинкат натрия |
Na 2 ZnO 2 цинкат натрия |
|
(Al , Cr , Fe * ) |
Na [ Al (OH ) 4 ] тетрагидроксоалюминат натрия Na 3 [ Al (OH ) 6 ] гексагидроксоалюминат натрия |
NaAlO 2 метаалюминат натрия и Na 3 AlO 3 ортоалюминат натрия |
|
*) железо не образует устойчивых гидроксокомплексов, амфотерно только в расплаве, образуя NaFeO 2 |
||
СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ.
|
Примеры реакций |
Примечания |
|
|
1) Реагируют с кислотами , так же, как основные оксиды – образуются соли. |
ZnO + 2HCl = ZnCl 2 + H 2 O Al 2 O 3 + 6HNO 3 = 2Al(NO 3) 3 +3H 2 O |
Только с сильными кислотами |
|
2) Взаимодействуют с растворами щелочей – образуются растворы гидроксокомплексов. |
Al 2 O 3 + 2KOH +3H 2 O = 2K или K 3 ZnO +2NaOH +H 2 O=Na 2 | |
|
3) Реагируют с расплавами щелочей – образуя соли, при этом проявляют свойства кислотных оксидов. |
Al 2 O 3 + 2KOH → t 2KAlO 2 + H 2 O (или K 3 AlO 3) ZnO + 2KOH → t K 2 ZnO 2 + H 2 O | |
|
4) При сплавлении могут взаимодействовать с карбонатами щелочных металлов , как со щелочами. |
Al 2 O 3 + Na 2 CO 3 → t 2NaAlO 2 +CO 2 (или Na 3 AlO 3) ZnO + Na 2 CO 3 → t Na 2 ZnO 2 + CO 2 |