1 z 20
Prezentacja na temat:
Slajd nr 1

Opis slajdu:
Slajd nr 2

Opis slajdu:
Struktura części C KIM z chemii w roku 2006 C1. Reakcje redoks C2. Układanie możliwych równań reakcji C3. Łańcuchy przemian w chemii organicznej C4. Zadania obliczeniowe na tematy: „Rozwiązania”, „Obliczenia z wykorzystaniem równania reakcji” C5. Problem z wyprowadzeniem wzoru substancji
Slajd nr 3

Opis slajdu:
Reakcje redoks Podstawowa zasada stosowana przy określaniu produktów reakcji redoks: jeden pierwiastek zmniejsza swój stopień utlenienia, drugi zwiększa swój stopień utlenienia. Produkty reakcji zależą od środowiska. W środowisku kwaśnym zmiana stopnia utlenienia zachodzi głębiej.
Slajd nr 4

Opis slajdu:
Reakcje redoks C1. Korzystając z metody bilansu elektronowego, utwórz równanie reakcji: P + HClO3 + ...= HCl + ... Określ utleniacz i reduktor. ROZWIĄZANIE: Określmy stopień utlenienia i określmy, który pierwiastek obniży stopień utlenienia, a który go zwiększy. P0 + H Cl+5O3+ …= HCl-1 + … W tym równaniu Cl+5 (utleniacz) zamienia się w Cl-1, zatem P0 (reduktor) zwiększy swój stopień utlenienia do P+5 Przeniesienie elektronów: P0 -5e- = P+5 6 Cl+5+6e- = Cl-1 5 Równanie wygląda następująco: 6P + 5HClO3 + 9H2O = 5HCl + 6H3PO4
Slajd nr 5

Opis slajdu:
Reakcje redoks C1. Korzystając z metody bilansu elektronowego, utwórz równanie: Al + K2Cr2O7 + … = … + Cr2(SO4)3 + K2SO4 + H2O ROZWIĄZANIE: Al0 + K2Cr2+6O7 + … = … + Cr2+3(SO4)3 + K2SO4 + H2O Al0 zwiększa stopień utlenienia do +3, Cr+6 obniża stopień utlenienia do Cr+3. Medium jest kwas siarkowy. Przejście elektronowe: Al0 - 3e- = Al+3 2 reduktor 2Cr+6 + 6e- = 2Cr+3 1 utleniacz Równanie wygląda następująco: 2Al + K2Cr2O7 + 7H2SO4 = Al2(SO4)3 + Cr2(SO4)3+ K2SO4+7H2O
Slajd nr 6

Opis slajdu:
Slajd nr 7

Opis slajdu:
Układanie możliwych równań reakcji C2. Podaje się roztwory wodne: siarczek sodu, siarkowodór, chlorek glinu i chlor. Zapisz równania czterech możliwych reakcji pomiędzy tymi substancjami. ROZWIĄZANIE: Na2S + H2S = 2NaHS H2S + 4Cl2 + 4H2O = 8HCl + H2SO4 Na2S + Cl2 = 2NaCl + S 2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3 + 6NaCl + 3H2S
Slajd nr 8

Opis slajdu:
Układanie możliwych równań reakcji C2. Podaje się roztwory wodne: heksahydroksoglinian potasu K3, chlorek glinu, siarkowodór i wodorotlenek rubidu. Zapisz równania czterech możliwych reakcji pomiędzy tymi substancjami. ROZWIĄZANIE: K3 + 3H2S = 3K2S + 2Al(OH)3 + 6H2O H2S + 2RbOH = Rb2S + 2H2O lub H2S + RbOH = RbHS + H2O AlCl3 + 3RbOH = 3RbCl + Al(OH)3 lub AlCl3 + 4RbOH = 3RbCl + Rb 2AlCl3+ 3H2S = Al2S3 + 6HCl Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Slajd nr 9

Opis slajdu:
Układanie możliwych równań reakcji C2. Dane roztwory wodne: heksahydroksochromian sodu Na3, chlorek żelaza (III), dwutlenek siarki i nadtlenek wodoru. Zapisz równania czterech możliwych reakcji pomiędzy tymi substancjami. ROZTWÓR: SO2 + H2O2 = H2SO4 · 2FeCl3 + SO2 + 2H2O = 2FeCl2 + H2SO4 + 2HCl 2Na3 + 3H2O2 = 2Na2CrO4 + 2NaOH + 8H2O Na3 + FeCl3 = Fe(OH)3 + Cr(OH)3 + 3NaCl
Slajd nr 10

Opis slajdu:
Układanie możliwych równań reakcji C2. Podano wodne roztwory heksahydroksoglinianu potasu K3, chlorku chromu (III), węglanu potasu i kwasu węglowego. Zapisz równania czterech możliwych reakcji pomiędzy tymi substancjami. ROZWIĄZANIE: K2CO3 + H2CO3 = 2KHCO3 2CrCl3 + 3K2CO3 + 3H2O = 2Cr(OH)3 + 3CO2 + 6KCl K3 + CrCl3 = Cr(OH)3 + Al(OH)3 + 3KCl 2K3 + 3H2CO3 = 3K2CO3 + 2Al(OH)3 + 6H2O
Slajd nr 11

Opis slajdu:
Wzajemne powiązania substancji organicznych C3. Napisz równania reakcji, na których można przeprowadzić przekształcenia: H2SO4 (stęż.),t Br2 H2O, Hg2+ H2, nr kat. Propanol-1 X1 X2 propyn X3 X4 ROZTWÓR: CH3–CH2–CH2–OH CH3–CH=CH2 + H2O CH3–CH=CH2 + Br2 CH3–CHBr–CH2Br CH3–CHBr–CH2Br + 2KOH 2KBr + 2H2O + CH3–CCH CH3–CCH + HOH CH3–CO–CH3 CH3–CO–CH3 + H2 CH3–CHOH–CH3
Slajd nr 12

Opis slajdu:
Wzajemne powiązania substancji organicznych C3. Zapisz równania reakcji, za pomocą których można przeprowadzić przekształcenia: KOH (alkohol), t t, C akt CH3Cl, AlCl3 KMnO4, H2SO4 C2H4 C2H4Cl2 X1 C6H6 X2 C6H5COOH ROZWIĄZANIE: C2H4 + Cl2 C2H4Cl2 C2H4Cl2 + 2KOH 2KCl + 2H2O + C2H2 3C2H2 C6H6 C6H6 + CH3Cl C6H5CH3 + HCl 5C6H5CH3 + 6KMnO4 + 9H2SO4 5C6H5COOH + 3K2SO4 + 6MnSO4 + 14H2O
Slajd nr 13

Opis slajdu:
Wzajemne powiązania substancji organicznych C3. Napisz równania reakcji, na których można przeprowadzić przekształcenia: H2O, Hg2+ KMnO4, H2SO4 Cl2, P ex. NH3 C2H2 Х1 CH3COOH Х2 Х3 N2 ROZTWÓR: С2H2 + HOH CH3COH 5CH3COH + 2KMnO4 + 3H2SO4 5CH3COOH + K2SO4 + 2MnSO4 + 3H2O CH3COOH + Cl2 CH2ClCOOH + HCl CH2ClCOOH + 2NH3 CH2NH2COOH + NH 4Cl CH2NH2CO OH + HNO2 N2 + CH2OH–COOH + H2O
Slajd nr 14

Opis slajdu:
Slajd nr 15

Opis slajdu:
Obliczenia z wykorzystaniem równań reakcji C4. Do utlenienia określonej ilości siarki potrzebna była objętość tlenu (n.o.), która powstaje podczas rozkładu 215 g chloranu potasu zawierającego 5% zanieczyszczeń beztlenowych. Określ masę siarki, która przereagowała i objętość utworzonego gazowego produktu utleniania. ROZWIĄZANIE: 2KClO3 = 2KCl + 3O2 m(KClO3) = 215 ∙ 0,95 = 204,24 g; n(KClO3) = 1,667 mol Korzystając z równania reakcji obliczamy ilość substancji tlenowej. n(O2) = 2,5 mol S + O2 = SO2 Zgodnie z równaniem reakcji n(S) = n(SO2) = n(O2) = 2,5 mol m(S) = 2,5 mol ∙ 32 g/mol = 8 g V (SO2) = 2,5 mol ∙ 22,4 l/mol = 56 l ODPOWIEDŹ: 56 l SO2; 8 g S.
Slajd nr 16

Opis slajdu:
Obliczenia z wykorzystaniem równań reakcji C4. Przykładowe zadania: a) Do utlenienia określonej ilości amoniaku potrzebna była objętość tlenu (n.o.), która powstała podczas rozkładu 245,6 g nadmanganianu potasu zawierającego 3,5% zanieczyszczeń beztlenowych. Określ masę amoniaku, który dostał się do reakcji i objętość powstałego produktu utleniania zawierającego azot (n.o.). b) Do utlenienia określonej ilości siarki potrzebna była objętość tlenu (n.o), która powstaje podczas rozkładu 330,9 g nadmanganianu potasu zawierającego 4,5% zanieczyszczeń beztlenowych. Określ masę siarki, która przereagowała i objętość powstałego produktu utleniania.
Slajd nr 17

Opis slajdu:
Obliczenia na temat „Rozwiązania” C4. Zmieszano 100 ml 15% roztworu wodorotlenku potasu (gęstość 1,10 g/ml) i 150 ml 10% roztworu kwasu solnego (gęstość 1,05 g/ml). Określ środowisko powstałego roztworu i zawarty w nim udział masowy chlorku potasu. ROZWIĄZANIE: KOH + HCl = KCl + H2O Znajdź masę każdego roztworu i masę substancji. mр-pa(KOH) =100 ∙ 1,1 = 110 g; m(KOH) = 110 ∙ 0,15 = 16,5 g mp-ra (HCl) = 150 ∙ 1,05 = 157,5 g; m(HCl) = 157,5 ∙ 0,1 = 15,75 g Znajdźmy ilość substancji dla każdego związku. n(KOH) = 0,294 mol; n(HCl) = 0,43 mola; n(KCl) = 0,294 mol Ośrodek jest kwaśny Znajdź masę soli m(KCl) = 21,9 g Oblicz masę całego roztworu: m(roztwór) = 110 + 157,5 = 267,5 g Określ udział masowy chlorku potasu w rozwiązanie: = 21,9/267,5 = 0,08
Slajd nr 18

Opis slajdu:
Slajd nr 19

Opis slajdu:
Problemy z wyprowadzeniem wzoru substancji C5. Podczas spalania gazowej substancji organicznej niezawierającej tlenu wydzieliło się 2,24 litra (n.s.) dwutlenku węgla, 1,8 g wody i 3,65 g chlorowodoru. Określ wzór cząsteczkowy spalonej substancji. Rozwiązanie: Ustalmy ilości węgla, wodoru i chloru. 1) 22,4 l CO2 – 1 mol (C) = 0,1 mol 2,24 l CO2 – x mol 2) 36,5 g HCl – 35,5 g Сlz(Cl) = 3,55 g Cl;n (Cl) = 0,1 mol 3,65 g HCl – z g Cl 3) 36,5 g HCl – 1 g H y(H) = 0,1 g; n(H) = 0,1 mol 3,65 g HCl – y g H 18 g H2O – 2 g H y1=0,2 g; n1(H) = 0,2 mol 1,8 g H2O – y1 g H Całkowita ilość substancji wodorowej wynosi 0,3 mol. x:y:z = 0,1: 0,3: 0,1. Wzór CH3Cl.
Slajd nr 20

Opis slajdu:
Obliczenia na temat „Rozwiązania” C5. Przykładowe zadania: a) Ustal wzór na związek nieorganiczny zawierający 20% magnezu, 53,33% tlenu i 26,67% jakiegoś pierwiastka. b) Podczas całkowitego spalenia gazowej substancji organicznej niezawierającej tlenu wydzieliło się 4,48 litra (n.s.) dwutlenku węgla, 1,8 g wody i 4 g fluorowodoru. Określ wzór spalonego związku. c) Podczas rozkładu termicznego nieznanej substancji o masie 49 g uwolniło się 13,44 litra (n.s.) tlenu i pozostała substancja stała zawierająca 52,35% potasu i 47,65% chloru. Określ wzór substancji.
Przygotowanie do jednolitego egzaminu państwowego z chemii Pracę wykonała Larisa Kozina, uczennica klasy 11 „a” 26 Liceum Ogólnokształcącego MBOU. Kierownik: Alekseeva Larisa Aleksandrovna Cele:
- Zapoznaj się z treścią pracy egzaminacyjnej z chemii.
- Sprawdź swoje przygotowanie do egzaminu.
- Poszerzaj doświadczenie w wykonywaniu zadań testowych z chemii
- część „A” w formie testów – 28 zadań z jedną poprawną odpowiedzią;
- część „B” – 9 zadań (B1-6 - do wyboru 4 cyfry - liczby można powtarzać, B7-9 - do wyboru trzy kolejne cyfry
- Część „C” – 5 zadań ze szczegółowymi odpowiedziami. Aby wybrać poprawną odpowiedź na pytanie z części A1-28, należy najechać kursorem na wybraną odpowiedź i kliknąć lewym przyciskiem myszy, jeśli odpowiedź jest prawidłowa, pojawi się słowo „Prawda”, jeśli odpowiedź jest błędna, „ Fałsz” Odpowiedzi i rozwiązania zadań z części C1 – C5 pojawią się po kliknięciu
Tablica Mendelejewa
Tabela rozpuszczalności
1) oba orzeczenia są prawidłowe
2) oba orzeczenia są błędne
4) tylko A jest poprawne
3) tylko B jest poprawne
25. Czy poniższe sądy dotyczące syntezy metanolu i amoniaku w przemyśle są prawdziwe?
A. Reakcje syntezy metanolu i amoniaku są egzotermiczne. B. W produkcji metanolu i amoniaku wykorzystuje się cyrkulację
26. Jaką masę tlenku wapnia należy przygotować, aby przygotować 200 g roztworu wodorotlenku wapnia o ułamku masowym 3,7%?
27. W wyniku reakcji, której równanie termochemiczne
2C2H2 + 5O2 = 4CO2 + 2H2O + 2610 kJ.
Wydzieliło się 652,5 kJ ciepła.
Objętość spalonego acetylenu wynosi
28. Ile litrów tlenu potrzeba do katalitycznego utlenienia 100 litrów tlenku siarki (IV) do tlenku siarki (VI)? Objętości gazu mierzone w identycznych warunkach
B1. Ustal zgodność pomiędzy nazwą substancji a klasą (grupą) związków nieorganicznych, do której ona należy
- 1) alken
- 2) alkohol jednowodorotlenowy
- 3) alkohol wielowodorotlenowy
- 4) prosty eter
- 5) ester
- A) CH3OCH3
- B) HOCH2CH2CH3
- B) HCOOCH2CH3
- D) CH3C(OH)2CH3
B2. Dopasuj nazwę substancji do stopnia utlenienia węgla substancji, stopnia utlenienia C A) metanol 1) –4 B) kwas metanowy 2) –3 C) metan 3) –2 D) etan 4) 0 5) + 2 6) +4
B3. Ustal zgodność pomiędzy substancją i produktem na anodzie podczas elektrolizy jej roztworu, wzór soli to produkt na anodzie A) Na2CO3 1) H2S B) Na2S 2) Cu C) NaNO3 3) O2 D) CuCl2 4) Cl2 5) S 6) CO2
B4. Ustal zgodność pomiędzy wzorem soli a jej zdolnością do hydrolizy. wzór soli 1)Al2S3 2)K2SO3 3)CrCl3 4)K2SO4
związek z hydrolizą
1) przez kation
2) przez anion
3) przez kation i anion
4) nie ulega hydrolizie
B5. Ustal zgodność pomiędzy odczynnikiem a produktem reakcji Odczynniki A) CO2 + H2O B) CO2 + CaO C) CO2 + Ca(OH)2 D) CO2(nadmiar) + Ca(OH)2
Produkty
2) CaCO3 + H2O
3) Ca(HCO3)2
4) Ca(HCO3)2+ H2O
Substancje Odczynnik
B6. Ustal zgodność między dwiema substancjami i odczynnikiem, którego można użyć do rozróżnienia tych substancji:
Substancje Odczynnik A) butanon-2 i etanol 1) HCl (roztwór) B) heksen-1 i mrówczan etylu 2) FeCl3 (wodny) C) anilina i fenol 3) Br2 (wodny) D) benzen i anilina 4) Na 5 ) HNO3
B7. Zarówno benzen, jak i styren charakteryzują się
1) obecność sprzężonego układu elektronicznego w cząsteczce
2) hybrydyzacja sp3 atomów węgla
3) oddziaływanie z wodorem w obecności katalizatora
4) odbarwienie wody bromowej
5) palność
6) dobra rozpuszczalność w wodzie
B8. Metanol reaguje z
- CH3COOH
- Ag2O(NH3)
- Br2(H2O)
- KMnO4(H+)
2) bromoetan
3) kwas siarkowy
4) bromowodór
5) wodorotlenek sodu
6) roztwór nadmanganianu potasu
C1. Korzystając z metody bilansu elektronowego, utwórz równanie reakcji:
NaNO2+NaI+...=NO+...+Na2SO4+...
Wskaż utleniacz i reduktor.
Odpowiedź: 2NaNO2+2NaI+2H2SO4=2NO+I2+2Na2SO4+2H2O
N+3 + e- -> N+2 utleniacz
2I- + 2e- -> I2 środek redukujący
C2. Miedź rozpuszczono w stężonym kwasie siarkowym. Otrzymaną sól potraktowano nadmiarem roztworu wodorotlenku sodu.
Powstały niebieski osad odsączono i kalcynowano. Następnie powstałą substancję kalcynowano węglem.
Zapisz równania czterech opisanych reakcji.
Odpowiedź: 1) Cu+2H2SO4 stęż. = CuSO4 + SO2 + 2H2O
2) CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2
3) Cu(OH)2 = CuO + H2O
4) 2CuO + C = 2Cu + CO2
C3. Napisz równania reakcji, które można zastosować do przeprowadzenia
następujące przekształcenia.
Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
2CH4 → C2H2 + 3H2
C6H6 +Br2 → C6H5Br + HBr
C6H5Br + 3NH3 → C6H2Br(NH2)3 + 3H2
metan X1CH4; acetylen X2CH4; X3C6H6 benzen;
X4C6H5Br bromobenzen; X5 C6H2Br(NH2)3 1-bromo-2,4,6-triaminobenzen
(+H2O) 15000С Sakt. t0 (+Br2), AlBr3 (+NH3), t0, str. 25
Al4C3 → X1 → X2 → X3 → X4 → X5
C4. Siarkowodór powstały podczas oddziaływania nadmiaru stężonego kwasu siarkowego z 1,44 g magnezu przepuszczono przez 160 g 1,5% roztworu bromu. Określ masę osadu, który spadł
1) 5H2SO4stęż. + 4Mg = 4MgSO4 + H2S + 4H2O
Br2 + H2S = 2HBr + S
2) n(Mg) = 1,44/24 = 0,06 (mol)
n(H2S)=0,015 (mol)
n(Br2) = 160⋅0,015/160=0,015 (mol) (obie substancje reagują całkowicie)
3)n(H2S)=n(Br2)=n(S)=0,015 (mol)
m(S)=32g/mol 0,015 mol=0,48g
Odpowiedź: masa osadu = 0,48 g.
C5. Gdy 11,6 g nasyconego aldehydu pod wpływem ogrzewania poddało się reakcji z nadmiarem wodorotlenku miedzi (II), utworzył się osad o masie 28,8 g. Wyprowadź wzór cząsteczkowy aldehydu.
1) СnH2nO + Cu(OH)2 = СnH2n+1O2 + H2O + Cu2O
2) n(Cu2O) = 28,8/144= 0,2 (mol)
n(Cu2O) = n(СnH2nO) = 0,2 mol
M(CnH2nO) = 11,6/0,2 = 58 g/mol
3)M(СnH2nO) = 12n + 2n + 16 = 58
Wzór cząsteczkowy – C3H6O – propanal
X Literatura: 1. Bank zadań Open Unified State Exam http://www.fipi.ru/os11/xmodules/qprint/afrms.php?proj= 2. http://chem.reshuege.ru/test?theme=20 3. http://www.otbet.ru/ege/demo-varianty-ege/demo-himiya/ 4. OS Gabrielian. Chemia, klasa 10. Drop. M. 2012 5. O.S. Gabrielian. Chemia, klasa 11. Drop. M. 2012 6. Szablon Alekseeva L.A.
1 slajd

2 slajd
Struktura części C KIM z chemii w roku 2006 C1. Reakcje redoks C2. Układanie możliwych równań reakcji C3. Łańcuchy przemian w chemii organicznej C4. Zadania obliczeniowe na tematy: „Rozwiązania”, „Obliczenia z wykorzystaniem równania reakcji” C5. Problem z wyprowadzeniem wzoru substancji

3 slajd
Reakcje redoks Podstawowa zasada stosowana przy określaniu produktów reakcji redoks: jeden pierwiastek zmniejsza swój stopień utlenienia, drugi zwiększa swój stopień utlenienia. Produkty reakcji zależą od środowiska. W środowisku kwaśnym zmiana stopnia utlenienia zachodzi głębiej.

4 slajd
Reakcje redoks C1. Korzystając z metody bilansu elektronowego, utwórz równanie reakcji: P + HClO3 + ...= HCl + ... Określ utleniacz i reduktor. ROZWIĄZANIE: Określmy stopień utlenienia i określmy, który pierwiastek obniży stopień utlenienia, a który go zwiększy. P0 + H Cl+5O3+ …= HCl-1 + … W tym równaniu Cl+5 (utleniacz) zamienia się w Cl-1, zatem P0 (reduktor) zwiększy swój stopień utlenienia do P+5 Przeniesienie elektronów: P0 -5e- = P+5 6 Cl+5+6e- = Cl-1 5 Równanie wygląda następująco: 6P + 5HClO3 + 9H2O = 5HCl + 6H3PO4

5 slajdów
Reakcje redoks C1. Korzystając z metody bilansu elektronowego, utwórz równanie: Al + K2Cr2O7 + … = … + Cr2(SO4)3 + K2SO4 + H2O ROZWIĄZANIE: Al0 + K2Cr2+6O7 + … = … + Cr2+3(SO4)3 + K2SO4 + H2O Al0 zwiększa stopień utlenienia do +3, Cr+6 obniża stopień utlenienia do Cr+3. Medium jest kwas siarkowy. Przejście elektronowe: Al0 - 3e- = Al+3 2 reduktor 2Cr+6 + 6e- = 2Cr+3 1 utleniacz Równanie wygląda następująco: 2Al + K2Cr2O7 + 7H2SO4 = Al2(SO4)3 + Cr2(SO4)3+ K2SO4+7H2O

6 slajdów
Reakcje redoks Przykłady reakcji redoks w zadaniach C1: a) SO2 + K2Cr2O7 + … = K2SO4 + … + H2O b) KNO2 + K2Cr2O7 + …= KNO3 + Cr(NO3)3 + H2O c) KIO3 + … + H2SO4 = I2 + K2SO4 + H2O

7 slajdów
Układanie możliwych równań reakcji C2. Podaje się roztwory wodne: siarczek sodu, siarkowodór, chlorek glinu i chlor. Zapisz równania czterech możliwych reakcji pomiędzy tymi substancjami. ROZWIĄZANIE: Na2S + H2S = 2NaHS H2S + 4Cl2 + 4H2O = 8HCl + H2SO4 Na2S + Cl2 = 2NaCl + S 2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3 + 6NaCl + 3H2S

8 slajdów
Układanie możliwych równań reakcji C2. Podaje się roztwory wodne: heksahydroksoglinian potasu K3, chlorek glinu, siarkowodór i wodorotlenek rubidu. Zapisz równania czterech możliwych reakcji pomiędzy tymi substancjami. ROZWIĄZANIE: K3 + 3H2S = 3K2S + 2Al(OH)3 + 6H2O H2S + 2RbOH = Rb2S + 2H2O lub H2S + RbOH = RbHS + H2O AlCl3 + 3RbOH = 3RbCl + Al(OH)3 lub AlCl3 + 4RbOH = 3RbCl + Rb 2AlCl3+ 3H2S = Al2S3 + 6HCl Al2S3 + 6H2O = 2Al(OH)3 + 3H2S

Slajd 9
Układanie możliwych równań reakcji C2. Dane roztwory wodne: heksahydroksochromian sodu Na3, chlorek żelaza (III), dwutlenek siarki i nadtlenek wodoru. Zapisz równania czterech możliwych reakcji pomiędzy tymi substancjami. ROZTWÓR: SO2 + H2O2 = H2SO4 · 2FeCl3 + SO2 + 2H2O = 2FeCl2 + H2SO4 + 2HCl 2Na3 + 3H2O2 = 2Na2CrO4 + 2NaOH + 8H2O Na3 + FeCl3 = Fe(OH)3 + Cr(OH)3 + 3NaCl

10 slajdów
Układanie możliwych równań reakcji C2. Podano wodne roztwory heksahydroksoglinianu potasu K3, chlorku chromu (III), węglanu potasu i kwasu węglowego. Zapisz równania czterech możliwych reakcji pomiędzy tymi substancjami. ROZWIĄZANIE: K2CO3 + H2CO3 = 2KHCO3 2CrCl3 + 3K2CO3 + 3H2O = 2Cr(OH)3 + 3CO2 + 6KCl K3 + CrCl3 = Cr(OH)3 + Al(OH)3 + 3KCl 2K3 + 3H2CO3 = 3K2CO3 + 2Al(OH)3 + 6H2O

11 slajdów
Wzajemne powiązania substancji organicznych C3. Napisz równania reakcji, na których można przeprowadzić przekształcenia: H2SO4 (stęż.),t Br2 H2O, Hg2+ H2, nr kat. Propanol-1 X1 X2 propyn X3 X4 ROZTWÓR: CH3–CH2–CH2–OH CH3–CH=CH2 + H2O CH3–CH=CH2 + Br2 CH3–CHBr–CH2Br CH3–CHBr–CH2Br + 2KOH 2KBr + 2H2O + CH3–C CH CH3–C CH + HOH CH3–CO–CH3 CH3–CO–CH3 + H2 CH3–CHOH–CH3

12 slajdów
Wzajemne powiązania substancji organicznych C3. Zapisz równania reakcji, za pomocą których można przeprowadzić przekształcenia: KOH (alkohol), t t, C akt CH3Cl, AlCl3 KMnO4, H2SO4 C2H4 C2H4Cl2 X1 C6H6 X2 C6H5COOH ROZWIĄZANIE: C2H4 + Cl2 C2H4Cl2 C2H4Cl2 + 2KOH 2KCl + 2H2O + C2H2 3C2H2 C6H6 C6H6 + CH3Cl C6H5CH3 + HCl 5C6H5CH3 + 6KMnO4 + 9H2SO4 5C6H5COOH + 3K2SO4 + 6MnSO4 + 14H2O

Slajd 13
Wzajemne powiązania substancji organicznych C3. Napisz równania reakcji, na których można przeprowadzić przekształcenia: H2O, Hg2+ KMnO4, H2SO4 Cl2, P ex. NH3 C2H2 Х1 CH3COOH Х2 Х3 N2 ROZTWÓR: С2H2 + HOH CH3COH 5CH3COH + 2KMnO4 + 3H2SO4 5CH3COOH + K2SO4 + 2MnSO4 + 3H2O CH3COOH + Cl2 CH2ClCOOH + HCl CH2ClCOOH + 2NH3 CH2NH2COOH + NH 4Cl CH2NH2CO OH + HNO2 N2 + CH2OH–COOH + H2O

Slajd 14
Wzajemne powiązania substancji organicznych C3. Przykładowe zadania: 2HCl, t g. NaOHalcohol, t t, Cact. Cl2, AlCl3 np. NaOH, t Glikol etylenowy X1 X2 C6H6 X3 X4 Na t, kat, (-4H2) AlCl3, CH3Cl KMnO4, H2SO4 NaOH 1-bromopropan X1 X2 X3 C6H5COOH X4

15 slajdów
Obliczenia z wykorzystaniem równań reakcji C4. Do utlenienia określonej ilości siarki potrzebna była objętość tlenu (n.o.), która powstaje podczas rozkładu 215 g chloranu potasu zawierającego 5% zanieczyszczeń beztlenowych. Określ masę siarki, która przereagowała i objętość utworzonego gazowego produktu utleniania. ROZWIĄZANIE: 2KClO3 = 2KCl + 3O2 m(KClO3) = 215 ∙ 0,95 = 204,24 g; n(KClO3) = 1,667 mol Korzystając z równania reakcji obliczamy ilość substancji tlenowej. n(O2) = 2,5 mol S + O2 = SO2 Zgodnie z równaniem reakcji n(S) = n(SO2) = n(O2) = 2,5 mol m(S) = 2,5 mol ∙ 32 g/mol = 8 g V (SO2) = 2,5 mol ∙ 22,4 l/mol = 56 l ODPOWIEDŹ: 56 l SO2; 8 g S.

16 slajdów
Obliczenia z wykorzystaniem równań reakcji C4. Przykładowe zadania: a) Do utlenienia określonej ilości amoniaku potrzebna była objętość tlenu (n.o.), która powstała podczas rozkładu 245,6 g nadmanganianu potasu zawierającego 3,5% zanieczyszczeń beztlenowych. Określ masę amoniaku, który dostał się do reakcji i objętość powstałego produktu utleniania zawierającego azot (n.o.). b) Do utlenienia określonej ilości siarki potrzebna była objętość tlenu (n.o), która powstaje podczas rozkładu 330,9 g nadmanganianu potasu zawierającego 4,5% zanieczyszczeń beztlenowych. Określ masę siarki, która przereagowała i objętość powstałego produktu utleniania.

Slajd 17
Obliczenia na temat „Rozwiązania” C4. Zmieszano 100 ml 15% roztworu wodorotlenku potasu (gęstość 1,10 g/ml) i 150 ml 10% roztworu kwasu solnego (gęstość 1,05 g/ml). Określ środowisko powstałego roztworu i zawarty w nim udział masowy chlorku potasu. ROZWIĄZANIE: KOH + HCl = KCl + H2O Znajdź masę każdego roztworu i masę substancji. mр-pa(KOH) =100 ∙ 1,1 = 110 g; m(KOH) = 110 ∙ 0,15 = 16,5 g mp-ra (HCl) = 150 ∙ 1,05 = 157,5 g; m(HCl) = 157,5 ∙ 0,1 = 15,75 g Znajdźmy ilość substancji dla każdego związku. n(KOH) = 0,294 mol; n(HCl) = 0,43 mola; n(KCl) = 0,294 mol Ośrodek jest kwaśny Znajdź masę soli m(KCl) = 21,9 g Oblicz masę całego roztworu: m(roztwór) = 110 + 157,5 = 267,5 g Określ udział masowy chlorku potasu w rozwiązanie: = 21,9/267,5 = 0,08

20 slajdów
Obliczenia na temat „Rozwiązania” C5. Przykładowe zadania: a) Ustal wzór na związek nieorganiczny zawierający 20% magnezu, 53,33% tlenu i 26,67% jakiegoś pierwiastka. b) Podczas całkowitego spalenia gazowej substancji organicznej niezawierającej tlenu wydzieliło się 4,48 litra (n.s.) dwutlenku węgla, 1,8 g wody i 4 g fluorowodoru. Określ wzór spalonego związku. c) Podczas rozkładu termicznego nieznanej substancji o masie 49 g uwolniło się 13,44 litra (n.s.) tlenu i pozostała substancja stała zawierająca 52,35% potasu i 47,65% chloru. Określ wzór substancji.
Zwracam uwagę na wybór zadań testowych przygotowujących do egzaminu Unified State Exam 2016. Zadania części 1 nr 32 dla badanego elementu treści zajęć z chemii „Charakterystyczne właściwości chemiczne substancji nieorganicznych”. Materiał zawiera 27 zadań testowych. Odpowiedzi są w załączeniu.
Zwracam uwagę na wybór zadań testowych przygotowujących do egzaminu Unified State Exam 2016. Zadania typu A15 dla sprawdzanego elementu z treści zajęć z chemii „Charakterystyczne właściwości chemiczne aldehydów, nasyconych kwasów karboksylowych, estrów. Substancje biologicznie ważne: tłuszcze, węglowodany (monosacharydy, disacharydy, polisacharydy).” Materiał zawiera 30 zadań testowych. Odpowiedzi są w załączeniu.
Grupa docelowa: dla 11 klasy
Zasób edukacyjny przeznaczony jest dla absolwentów szkół podstawowych i średnich, którzy przystąpili do egzaminu z przedmiotu „chemia”. Zawiera materiał teoretyczny na zadany temat. Zawiera zadania do samodzielnego ugruntowania materiału teoretycznego oraz test kontrolny. Można je również wykorzystać w procesie nauczania przedmiotu w klasach 9 i 11.

Grupa docelowa: dla nauczycieli
Zwracam uwagę na wybór zadań testowych przygotowujących do egzaminu Unified State Exam 2016. Zadania typu A14 dla badanego pierwiastka z treści zajęć z chemii „Charakterystyczne właściwości chemiczne nasyconych alkoholi jednowodorotlenowych i wielowodorotlenowych, fenolu”. Materiał zawiera 25 zadań testowych. Odpowiedzi są w załączeniu.
Grupa docelowa: dla 11 klasy
Zwracam uwagę na wybór zadań testowych przygotowujących do egzaminu Unified State Exam 2016. Zadania typu A13 dla badanego elementu z treści zajęć z chemii „Charakterystyczne właściwości chemiczne węglowodorów: alkany, cykloalkany, alkeny, dieny, alkiny, węglowodory aromatyczne (benzen, toluen).” Materiał zawiera 25 zadań testowych. Odpowiedzi są w załączeniu.
Grupa docelowa: dla 11 klasy
Podręcznik ma na celu rozwinięcie praktycznych umiejętności uczniów przygotowujących się do egzaminu Unified State Exam. W pracy przedstawiono przykładowe warianty zadań części C1, C2 wraz z odpowiedziami. A także łańcuchy przemian na przykładzie metali alkalicznych i ich związków z odpowiedziami, problemami z rozwiązaniami. Podręcznik przeznaczony jest dla nauczycieli uczących się w klasie 11.
Grupa docelowa: dla 11 klasy
Chemia zajmuje ważne miejsce w systemie edukacji szkolnej.
Podczas studiowania chemii wykorzystuje się głównie część opisową kursu. Wzorce ilościowe nie są uwzględniane systematycznie. Umiejętność rozwiązywania problemów obliczeniowych jest jednym ze wskaźników poziomu rozwoju myślenia chemicznego u uczniów.
Jeśli tej ważnej kwestii nie poświęci się wystarczającej uwagi, wówczas, jak pokazują arkusze testowe, olimpiady i egzaminy wstępne, uczniowie są słabi w rozwiązywaniu problemów obliczeniowych z chemii.
Wyjściem jest prawidłowe wykorzystanie zadań w procesie edukacyjnym. Epizodyczny charakter nauki rozwiązywania problemów obliczeniowych jest niedopuszczalny.


Grupa docelowa: dla 11 klasy
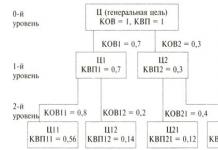
ETAPY PRZYGOTOWANIA STUDENTÓW DO Jednolitego Egzaminu Państwowego z Chemii p/pp/p Treść etapu I okresu Kształtowanie: zainteresowania przedmiotem i motywacji do jego studiowania; silna wiedza podstawowa; umiejętność samodzielnej pracy z literaturą i systematycznego rozwiązywania problemów; umiejętności pracy z różnego rodzaju testami. 8-9 klasa

ETAPY PRZYGOTOWANIA STUDENTÓW DO ZASTOSOWANIA W CHEMII p/pp/p Treść etapu 2 Orientacja profilu studentów Określenie zakresu przedmiotów, do których konieczne jest przygotowanie do Jednolitego Egzaminu Państwowego Uformowanie grupy studentów potrzebujących przygotowania do egzaminu Ujednolicony egzamin państwowy z chemii dla klas 9-10

ETAPY PRZYGOTOWANIA STUDENTÓW DO ZASTOSOWANIA W CHEMII p/pp/p Treść etapu 3. Dogłębne przygotowanie grupy studentów chemii: zróżnicowane podejście do zajęć fakultatywnych zajęcia indywidualne konsultacje

ETAPY PRZYGOTOWANIA STUDENTÓW DO ZASTOSOWANIA W CHEMII p/pp/p Treść etapu 4. Bezpośrednie przygotowanie do egzaminu: zapoznanie się ze strukturą WMP w chemii, dokumenty normatywne; podkreślanie tematów szczególnie trudnych, wybieranie zadań o różnym stopniu złożoności z tych tematów; studiowanie materiału tematycznie, z: - powtarzaniem teorii; - samodzielna praca z zadaniami z egzaminu Unified State Exam związanymi z tym tematem; - analiza wszystkiego, co nie jest zrozumiałe i nierozwiązane. Klasa 11


PRACA Z RODZICAMI Cel pracy: uświadomienie pewnej części z nich, że aby ich dzieci mogły realizować swoje cele życiowe, potrzebują pogłębionego szkolenia z zakresu nauk przyrodniczych. Federalny standard na poziomie podstawowym nie ma na celu przygotowania studentów do podjęcia studiów na uniwersytecie w tym obszarze. Student przystępujący do tego egzaminu powinien zaplanować wykonanie dużej ilości samodzielnej pracy z tego przedmiotu. Zwrócenie uwagi rodziców na rolę ich pomocy w przygotowaniu dzieci. Nauczyciel powinien także porozmawiać o pomocy, jaką jest w stanie zapewnić uczniom w pracy (materiały, konsultacje).

ZRÓŻNICOWANE PODEJŚCIE NA LEKCJACH Przygotowanie małej grupy uczniów do Jednolitego Egzaminu Państwowego. Nauczyciel musi przygotować zadania wyższego poziomu, zadania w formacie Unified State Exam. Nauczyciel oferuje dodatkowe, bezpłatne prace domowe. Zaangażowanie tych uczniów jako asystentów nauczycieli i wychowawców w organizowanie wzajemnego szkolenia i wzajemnej kontroli w procesie edukacyjnym.

NIEZALEŻNA PRACA STUDENTÓW Niektóre testy do samodzielnej pracy można zlecić studentom z gotowymi odpowiedziami. Podczas wykonywania takich testów uczeń sprawdza swoje odpowiedzi „kluczem” i notuje popełnione błędy. Następnie musi je przeanalizować. Błędy powstałe w wyniku nieuwagi oznaczone są specjalnym symbolem, te, które zostały poprawione przy pomocy podręcznika, specjalnym symbolem, a te, których uczeń nie rozumiał, specjalnym symbolem. Wyniki tej analizy uczeń przedstawia nauczycielowi podczas wywiadów/konsultacji lub w dogodnym dla siebie momencie. Mogą też zostać przeprowadzone badania kontrolne, które sprawdzane są bezpośrednio podczas konsultacji.

METODYKA WYKORZYSTANIA TESTÓW NA LEKCJACH Aby pomyślnie pracować nad ujednoliconym egzaminem państwowym i innymi rodzajami kontroli w podobnym formacie, uczniowie muszą znać główne typy zadań testowych, poruszać się po ich strukturze i rozumieć, w jakiej formie muszą udzielić odpowiedzi. Na teście, zwłaszcza krótkim, zawsze istnieje możliwość uzyskania niezasłużonej oceny w wyniku zgadywania. Podczas ich używania mowa ustna i pisemna ucznia nie rozwija się.

METODOLOGIA WYKORZYSTANIA TESTÓW NA LEKCJACH Technika pracy z testami - „Odpowiedz z komentarzami”: Uczeń wykonując zadanie testowe ustnie lub pisemnie, nie tylko wskazuje poprawną odpowiedź, ale także ją komentuje i uzasadnia swój wybór. Motywacją może być ustne wyjaśnienie oparte na właściwościach określonej klasy substancji, sformułowanie definicji, reguły, prawa, ułożenie równania reakcji, rozwiązanie problemu obliczeniowego...

CECHY PRZYGOTOWANIA SILNYCH UCZNIÓW Celem przygotowania do Jednolitego Egzaminu Państwowego dla silnych uczniów jest opanowanie umiejętności wykonywania najtrudniejszych zadań z części C. Muszą jednak regularnie szkolić się, aby wykonać zadania z części A i B. Na jednocześnie otrzymują następujące zadania: a) minimalizowanie błędów popełnianych przez nieuwagę; b) zidentyfikować te tematy na kursie chemii, w których popełniane są błędy z powodu niewiedzy, przestudiować te sekcje i przećwiczyć zdobytą wiedzę na testach tematycznych.

PRZYGOTOWANIE UCZNIÓW SŁABYCH I PRZECIĘTNYCH Koncentruje się na pomyślnym zdaniu Jednolitego Egzaminu Państwowego z oceną co najmniej dostateczną. Aby to zrobić, wystarczy pewnie wypełnić Część A materiałów testowych (30 głównych punktów, które można zdobyć w Części A, odpowiada w przybliżeniu 50 punktom w skali egzaminu Unified State Exam). Przygotowanie należy przeprowadzić w oparciu o najbardziej charakterystyczne właściwości substancji, najczęstsze rodzaje reakcji, najprostsze i najczęściej stosowane algorytmy rozwiązywania problemów.

STRATEGIA EGZAMINU Zasady pierwszego kręgu: Zaznacz te właściwe i pomiń trudne (45 min.) Zasady drugiego kręgu: Sprawdź, co zrobiłeś, odrzuć niewłaściwe, skorzystaj z „trzech ściągawek” i prawa chemii (95 min.) Zasada trzeciego koła: Sprawdź, co zrobiłeś i zgadnij, czego nie udało się znaleźć.