Wodór (kalka z łac.: Hydrogenium - hydro = „woda”, gen = „wytwarzający”; wodoru - „wytwarzający wodę”; oznaczony symbolem H) jest pierwszym elementem układu okresowego pierwiastków. Szeroko rozpowszechniony w przyrodzie. Kationem (i jądrem) najpowszechniejszego izotopu wodoru, 1H, jest proton. Właściwości jądra 1H umożliwiają szerokie zastosowanie spektroskopii NMR w analizie substancji organicznych.
Trzy izotopy wodoru mają swoje własne nazwy: 1H - prot (H), 2H - deuter (D) i 3H - tryt (radioaktywny) (T).
Prosta substancja wodór - H 2 - jest lekkim, bezbarwnym gazem. Po zmieszaniu z powietrzem lub tlenem jest łatwopalny i wybuchowy. Nietoksyczny. Rozpuszczalny w etanolu i wielu metalach: żelazie, niklu, palladzie, platynie.
Fabuła
Uwalnianie łatwopalnego gazu podczas interakcji kwasów i metali zaobserwowano w XVI i XVII wieku, u zarania kształtowania się chemii jako nauki. Michaił Wasiljewicz Łomonosow również bezpośrednio zwrócił uwagę na jego izolację, ale już na pewno miał świadomość, że nie jest to flogiston. Angielski fizyk i chemik Henry Cavendish zbadał ten gaz w 1766 roku i nazwał go „powietrzem palnym”. Podczas spalania „palne powietrze” wytwarzało wodę, ale trzymanie się przez Cavendisha teorii flogistonu nie pozwoliło mu na wyciągnięcie właściwych wniosków. Francuski chemik Antoine Lavoisier wraz z inżynierem J. Meunierem za pomocą specjalnych gazometrów przeprowadzili w 1783 roku syntezę wody, a następnie jej analizę, rozkładając parę wodną za pomocą gorącego żelaza. Ustalił tym samym, że „powietrze palne” jest częścią wody i można z niej uzyskać.
pochodzenie imienia
Lavoisier nadał wodorowi nazwę hydrogène (od starożytnego greckiego ὕδωρ – woda i γεννάω – rodzę) – „rodząc wodę”. Rosyjską nazwę „wodór” zaproponował chemik M. F. Sołowjow w 1824 r. - przez analogię do „tlenu” M. W. Łomonosowa.
Rozpowszechnienie
We wszechświecie
Wodór jest najpowszechniejszym pierwiastkiem we Wszechświecie. Stanowi około 92% wszystkich atomów (8% to atomy helu, udział wszystkich pozostałych pierwiastków razem wziętych jest mniejszy niż 0,1%). Zatem wodór jest głównym składnikiem gwiazd i gazu międzygwiazdowego. W warunkach temperatur gwiazdowych (np. temperatura powierzchni Słońca wynosi ~ 6000°C) wodór występuje w postaci plazmy, w przestrzeni międzygwiazdowej pierwiastek ten występuje w postaci pojedynczych cząsteczek, atomów i jonów i może tworzyć obłoki molekularne różniące się znacznie rozmiarem, gęstością i temperaturą.
Skorupa ziemska i organizmy żywe
Udział masowy wodoru w skorupie ziemskiej wynosi 1% - jest to dziesiąty najpowszechniej występujący pierwiastek. Jednak o jego roli w przyrodzie decyduje nie masa, ale liczba atomów, których udział wśród innych pierwiastków wynosi 17% (drugie miejsce po tlenie, którego udział atomów wynosi ~ 52%). Dlatego znaczenie wodoru w procesach chemicznych zachodzących na Ziemi jest niemal tak duże, jak tlenu. W przeciwieństwie do tlenu, który występuje na Ziemi zarówno w stanie związanym, jak i wolnym, prawie cały wodór na Ziemi ma postać związków; W atmosferze znajduje się bardzo niewielka ilość wodoru w postaci prostej substancji (0,00005% obj.).
Wodór jest częścią prawie wszystkich substancji organicznych i jest obecny we wszystkich żywych komórkach. W żywych komórkach wodór stanowi prawie 50% liczby atomów.
Paragon
Przemysłowe metody wytwarzania substancji prostych zależą od formy, w jakiej dany pierwiastek występuje w przyrodzie, czyli od tego, co może być surowcem do jego produkcji. W ten sposób tlen, który jest dostępny w stanie wolnym, uzyskuje się fizycznie - poprzez oddzielenie od ciekłego powietrza. Prawie cały wodór występuje w postaci związków, dlatego do jego otrzymania stosuje się metody chemiczne. W szczególności można zastosować reakcje rozkładu. Jednym ze sposobów wytwarzania wodoru jest rozkład wody pod wpływem prądu elektrycznego.
Główną przemysłową metodą produkcji wodoru jest reakcja metanu, wchodzącego w skład gazu ziemnego, z wodą. Przeprowadza się go w wysokiej temperaturze:
CH 4 + 2H 2 O = CO 2 + 4H 2 -165 kJ
Jedną z laboratoryjnych metod wytwarzania wodoru, czasami stosowaną w przemyśle, jest rozkład wody pod wpływem prądu elektrycznego. Zwykle wodór wytwarza się w laboratorium w wyniku reakcji cynku z kwasem solnym.
WODÓR, H, pierwiastek chemiczny, numer seryjny 1; masa atomowa 1,008 (1,00775). Wcześniej masę atomową wodoru przyjmowano jako jedność; w tym przypadku masę atomową tlenu należało przyjąć jako równą 15,879, a masy atomowe wielu innych pierwiastków wyrażono w liczbach mieszanych, co okazało się niewygodne w obliczeniach stechiometrycznych; dlatego obecnie przyjęta liczba masy atomowej tlenu wynosi 16; Pod tym względem masa atomowa wodoru okazała się równa 1,008. Ostatnio podjęto próby wyjaśnienia części ułamkowej masy atomowej wodoru za pomocą efektu relatywistycznego. Niezależnie od tego, ostatnie postępy w dziedzinie chemii teoretycznej i fizyki potwierdziły to, co mówiono na samym początku XIX wieku. Zaproponowaliśmy hipotezę, że wodór jest najprostszym pierwiastkiem, z którego zbudowane są wszystkie inne pierwiastki chemiczne. Rzeczywiście, atomy wodoru są uwalniane wraz z atomami helu podczas radioaktywnego i sztucznego rozpadu wielu pierwiastków chemicznych, powodując w niektórych przypadkach uwolnienie bardzo znacznych (względnie) ilości energii. Ta rola wodoru w tworzeniu innych pierwiastków chemicznych odpowiada jego występowaniu we wszechświecie: widma wszystkich ciał świetlnych, w tym Słońca, zawierają linie wodoru, a wiele z nich najwyraźniej składa się wyłącznie z nagromadzeń gorącego gazowego wodoru.
Właściwości fizyczne . Wodór jest gazem bezbarwnym, pozbawionym smaku i zapachu; jest najlżejszą ze wszystkich znanych dotychczas substancji: wodór jest 1472 razy lżejszy od powietrza i 16 razy lżejszy od tlenu. Jeden litr wodoru na 45° szerokości geograficznej waży w normalnych warunkach 0,089871 ± 0,000005 g; temperatura wrzenia -252,7°C; temperatura topnienia -259,1°C; temperatura krytyczna -239,9°C; ciśnienie krytyczne 12,8 atm; gęstość krytyczna 0,531 g cm -3 ; ciężar właściwy wodoru w temperaturze wrzenia 0,07081 (w stosunku do powietrza); współczynnik rozszerzalności wodoru 0,0036613 przy ciśnieniu 760 mm w zakresie od 0 do 100°C; przewodność cieplna 0,0322 w -252°C (Eucken), 0,4994 w 100°C, 0,445 w 40°C (Kundt und Warburg); ciepło właściwe w temperaturze 15°C wynosi 14,5 dżuli na gramatom, w temperaturach od 0 do 2500°C wynosi 2,89 (c v); ciepło cząsteczkowe 5,82 (w temperaturze 0-2500°C); utajone ciepło parowania w temperaturze wrzenia wynosi 0,450 kilodżuli na gram-atom; prędkość dźwięku w wodorze wynosi około 1270 m/s w temperaturze 0°C (Dulong). W zwykłych temperaturach wodór jest gazem doskonałym. Współczynnik dyfuzji wodoru względem tlenu = 0,677 cm 3 s -1 w temperaturze 0°C i 760 mm; 1 g wodoru w temperaturze 0°C i 760 mm zajmuje objętość 11,1176 litrów. W każdym razie masa atomu wodoru (według Spearinga) nie przekracza 2,5 dziesięciomiliardowych części g; lepkość wodoru w temperaturze 20°C wynosi 88,7 x 10-6 puazów; napięcie powierzchniowe w temperaturze wrzenia wynosi 1,91; Współczynnik załamania dla linii Hg 5790 ɐ w temperaturze wrzenia wynosi 1,197. Wodór stawia mniejszy opór przejściu iskry elektrycznej niż tlen, azot z powietrza i tlenek węgla. Wodór jest bardzo dobrze rozpuszczalny w wodzie: w temperaturze 0-24°C w 100 objętościach wody rozpuszcza się 1,93 objętości wodoru. Węgiel drzewny skrapla wodór na swojej powierzchni, a 1 cm 3 węgla drzewnego adsorbuje (w temperaturze 0°C) 1,5 cm 3 wodoru. Wodór może przenikać przez ciała porowate w zwykłych temperaturach; przez platynę, pallad i żelazo - przy czerwonym ogniu; w temperaturze około 1300°C wodór dyfunduje nawet przez ścianki rurek ze stopionego kwarcu; Wodór dyfunduje przez porowatą ścianę glinianego naczynia z prędkością 4 razy większą niż tlen. Różne metale znajdujące się w atmosferze wodoru pochłaniają wodór i uwalniają go z powrotem dopiero wtedy, gdy temperatura wzrasta; na zimno absorpcja ta jest niewielka, w czerwonym upale jest bardzo znacząca; Ta okluzja, czyli rozpuszczalność wodoru w metalach, wyjaśnia fakt, że wodór może przenikać metale; Wodór najłatwiej przenika przez pallad; kalcynowane liście palladu absorbują 376 objętości wodoru w zwykłej temperaturze, 643 w 97°C; Co więcej, ciekawe jest to, że w próżni metale nie oddają wodoru, lecz uwalniają go dopiero w temperaturze zbliżonej do ciepła czerwonego. Absorpcja wodoru przez metale zależy również od stanu metalu: proszek metalu w większości przypadków pochłania więcej wodoru niż metal stopowy, walcowany lub kuty. Procesowi absorpcji wodoru przez metale towarzyszy wydzielanie się znacznej ilości ciepła. Ciekły wodór jest przezroczystą, bezbarwną cieczą o niskim napięciu powierzchniowym. Temperatura krytyczna wodoru wynosi 239,9°C, ciśnienie krytyczne wynosi 12,8 atm. Ciekły wodór nie przewodzi prądu, jego ciepło parowania w pobliżu temperatury wrzenia wynosi 200 cal; ciepło właściwe 6,4; objętość atomowa w temperaturze wrzenia wynosi 14,3 cm3, a gęstość 0,07. Kiedy gazowy wodór jest wystawiony na działanie łuku galwanicznego pomiędzy elektrodami wolframowymi lub gdy wodór przepuszcza się przez strefę wyładowań elektrycznych, wodór cząsteczkowy dysocjuje na atomy szczególnie aktywnego wodoru atomowego, które łączą się z powrotem w cząsteczki H2 z wydzieleniem znacznej ilości ciepła (około 100 000 kalorii).
Właściwości chemiczne . W zwykłych temperaturach wodór jest pierwiastkiem mało aktywnym, łącząc się jedynie z fluorem (z którym reaguje już w temperaturze -210°C) i litem. Kiedy wodór ogrzewa się z metalami alkalicznymi, ziem alkalicznych (z wyjątkiem magnezu i berylu) oraz z metalami ziem rzadkich o bardziej zasadowym charakterze, powstają wodorki tych metali, na przykład: KH, CaH2, LaH3. W wodorkach alkalicznych (takich jak LiH) wodór działa raczej jako anion niż kation. Wodór łączy się z chlorem w ciemności w temperaturze pokojowej bardzo powoli, ale jeśli mieszaninę jednej objętości wodoru z jedną objętością chloru oświetli się chemicznie aktywnymi promieniami, wówczas oba gazy łączą się wybuchowo. Wodór reaguje z innymi halogenami i pierwiastkami grupy tlenowej dopiero w wyższych temperaturach. Wodór zmieszany z tlenem w stosunku 2:1 tworzy mieszaninę wybuchową, która pali się po zapaleniu lub przejściu iskry elektrycznej w wyniku silnego wybuchu. Podczas spalania 2,02 g wodoru z 16 g tlenu uwalnia się 68360 cal. Prędkość rozprzestrzeniania się wybuchu gazu wybuchowego wynosi 2500 m/s. Drobno pokruszona platyna może zapalić mieszaninę wodoru z tlenem lub powietrzem. Wodór łączy się z azotem bardzo powoli: nawet przy czerwonym ogniu szybkość reakcji jest wyjątkowo niska; ale nawet przy dalszym wzroście temperatury warunki równowagi dla odwracalnej reakcji łączenia wodoru z azotem są takie, że w mieszaninie reagujących gazów nie powstaje znaczne stężenie NH3. Wodór działa redukująco na roztwory soli srebra i chlorek platyny już pod ciśnieniem jednego atm; przy podwyższonym ciśnieniu wodoru inne metale są również redukowane z ich soli (na przykład Hg z soli kwasu rtęciowego). W wysokich temperaturach wodór redukuje wiele związków nieorganicznych: tlenki, związki siarki itp. Przy wysokich ciśnieniach i temperaturach wodór redukuje, jak wykazali V.N. Ipatiev i jego szkoła, szereg soli, działając w roztworach wodnych. W obecności niektórych katalizatorów metalicznych, zwłaszcza Ni, Co, a także niektórych tlenków metali, wodór ma zdolność uwodornienia nienasyconych związków aromatycznych po podgrzaniu, a także redukcji innych związków organicznych (Sabatier i Sanderen, Ipatiev). W obecności koloidalnych Pt i Pd szereg podobnych procesów zachodzi również na zimno (Paal Skita, Willstatter, Fokin, Zelinsky). Pod wpływem emisji promieni α lub wyładowań elektrycznych pod zmniejszonym ciśnieniem wodór przechodzi z jednoczesnym zmniejszeniem swojej objętości do aktywny wodór. Aktywny wodór może bezpośrednio łączyć się z siarką i fosforem oraz redukować As 2 O 3 i KMnO 4 .
Produkcja wodoru w technologii . Najprostsze metody wytwarzania wodoru są jednocześnie najmniej opłacalne, jeśli zostaną zastosowane w technologii; dlatego używa się ich tylko w warunkach wojennych; Metody te obejmują produkcję wodoru poprzez działanie kwasów na metale, działanie żrących zasad na aluminium, cynk lub żelazokrzem (krzem) itp. Technologia wojskowa opracowała szereg metod i preparatów (wodorogenit, hydrolit, amalgamat glinu , hydron, czyli stop sodu z ołowiem), które są wygodne w transporcie i umożliwiają łatwą i szybką produkcję wodoru w dziedzinie aeronautyki przy użyciu jednostek mobilnych. Jednak techniczna produkcja wodoru na cele przemysłowe jest wielokrotnie większa niż zapotrzebowanie na wodór na potrzeby wojskowe i opiera się na zupełnie innych procesach. Znaczna część wodoru produkowanego przez światowy przemysł jest zużywana do syntezy amoniaku metodą Habera. Jednak w tym procesie początkowy wodór nie trafia do procesu produkcyjnego metodą BASF w czystej postaci, ale jest już zmieszany z wymaganą ilością azotu. Mieszanina gazu generatorowego, gazu wodnego i pary wodnej, przechodząc przez masę kontaktową (tlenki metali z grupy żelaza), wchodzi w interakcję chemiczną, a tlenek węgla CO zawarty w wodzie i gazie generatorowym reaguje z parą wodną zgodnie z zasadą równanie:
Dwutlenek węgla jest absorbowany przez wodę pod wysokim ciśnieniem; Mieszaninę oczyszcza się z pozostałego CO przepuszczając ją przez amoniakalny roztwór tlenku miedziawego. W rezultacie przy odpowiedniej proporcji zmieszania gazu wodnego z gazem generatorowym, który oprócz innych gazów zawiera niezmieniony azot z powietrza, otrzymuje się mieszaninę azotu i wodoru bezpośrednio w proporcji N 2: 3H 2 wymaganej do syntezy amoniaku.
W przypadkach, gdy d.b. Jeśli otrzymuje się sam wodór, bez domieszki azotu, do oddzielenia wodoru od pary wodnej konieczne jest użycie gazu wodnego zamiast gazu generatorowego zawierającego azot. W tym przypadku oddziaływanie pary wodnej z gazem redukującym przebiega według równania (I). Proces ten jest odwracalny, a położenie jego równowagi zależy w dużej mierze od temperatury, a szybkość reakcji zależy także od zastosowania odpowiednich katalizatorów. Kiedy para wodna oddziałuje z gorącym koksem w temperaturze 800°C, powstaje głównie wodór i dwutlenek węgla zgodnie z równaniem:
natomiast w temperaturach powyżej 1000°C tworzy się gaz wodny, czyli mieszanina wodoru z tlenkiem węgla zgodnie z równaniem (I). Metoda ta, opracowana przez BASF, pozwala na produkcję ponad 400 milionów m 3 (35 000 ton) wodoru rocznie. Aby wydzielić wodór z mieszaniny gazów, najlepiej najpierw uwolnić go od CO 2 [poprzez przemycie wodą pod wysokim ciśnieniem, absorpcję CO 2 zasadami lub solami dwutlenku węgla, impregnację węgla solami siarczanowymi, krzemianowymi i chlorkowymi (An. P. 7718, 7719, 7720, Diefenbach i Moldenhauer)]. Oddzielenie wodoru od CO jest znacznie trudniejsze. Jednakże wraz ze spadkiem temperatury szybkość reakcji znacznie maleje; dlatego należy przeprowadzić reakcję według równania (I) i znaleźć dogodne metody oddzielenia wodoru od CO z gazu wodnego powstającego w wyższej temperaturze. Metody te opierają się na wiązaniu CO pod wysokim ciśnieniem (ponad 100 atm) z amoniakalnym roztworem tlenku miedziawego. Jednocześnie odkryto, że chlorek miedziawy ma niewielkie zastosowanie w tym celu ze względu na jego destrukcyjny wpływ na żelazne części sprzętu; dlatego też, według GP 289694, do absorpcji CO stosuje się tlenek miedziawy rozpuszczony w amoniaku lub węglanie amonu. Aby zapobiec obserwowanemu osadzaniu się metalicznej miedzi na żelaznych częściach sprzętu, do gazu wodnego dodaje się niewielkie ilości tlenu lub powietrza, co powoduje utlenienie metalicznej miedzi z powrotem do tlenku miedziawego. Proponuje się także dodanie do mieszaniny gazowej większej ilości tlenu, tak aby część Cu2O utleniła się do CuO; tlenek miedzi z kolei utlenia CO, redukując ponownie do Cu 2 O. Ponadto tlenek węgla, jak wskazują niektóre patenty, może. ulega przekształceniu w kwas mrówkowy sodu po potraktowaniu pod ciśnieniem 50 atm roztworem bardzo stężonego wodorotlenku sodu.
Wraz z tą metodą szeroko stosowana jest metoda rozkładu pary wodnej w kontakcie z żelazem (w szczególności najpopularniejsza jest metoda Messerschmitta, prowadzona przez firmę Karl Frank w Bremie, a zwłaszcza metoda BAMAG). W 1918 roku zakłady BAMAG produkowały do 125 mln m3 wodoru rocznie. Metoda ta umożliwia również otrzymanie całkiem czystego wodoru oddzielnie, niezależnie od azotu. Według metody Franka i Caro (G.P. 174324) wstępnie wysuszony gaz wodny zawierający około 50% H2, 40% CO, 5% CO2, 4,5% N2 i 0,5% O2 przepuszcza się w wysokiej temperaturze nad węglikiem wapnia ; już po pierwszym przejściu otrzymuje się gaz zawierający od 99 do 99,6% H2; N2 łączy się z węglikiem, tworząc cyjanamid, a CO, CO2 i O2 łączą się, tworząc CaO i CaCO3; Jednocześnie wśród produktów reakcji tworzy się także grafit. Jednak zrealizowany przez Towarzystwo Linde pomysł A. Franka, polegający na zastosowaniu metody kondensacyjnej przy użyciu maszyn chłodniczych do oddzielenia wodoru od gazu wodnego, nabrał znacznie większego znaczenia technicznego. Metoda ta – Linde-Frank-Caro – została opracowana przy pomocy firmy BAMAG (G.P. 254043 i 261735 oraz Swiss P. 56594). Biorąc pod uwagę fakt, że temperatura wrzenia H2 wynosi 20,4°K, a temperatura wrzenia CO wynosi 82°K, oba te gazy mogą. oddzielone od siebie poprzez frakcjonowaną kondensację. W temperaturze wrzenia ciekłego powietrza i pod ciśnieniem atmosferycznym nie można stosować mieszaniny 50% H 2 i 50% CO. podzielone w określony sposób. Jednak w temperaturze -197°C część CO skrapla się w ciecz; w -205°C cząstkowa prężność par ciekłego CO nie przekracza 1/7 atm, a gaz destylacyjny zawiera tylko 14% CO. Dalsze obniżanie temperatury lub zwiększanie ciśnienia można osiągnąć jeszcze korzystniejsze wyniki. Zatem przy ciśnieniu 50 Atm i temperaturze -197°C ciśnienie cząstkowe CO wynosi 0,5 Atm, a ciśnienie cząstkowe H2 wynosi 49,5 Atm, czyli zawartość CO w mieszaninie wynosi 0,5:50 = 1 % . W temperaturze -203°C i ciśnieniu 50 atm wodór zawiera jedynie 0,3% zanieczyszczeń CO. Tak znaczne ochłodzenie gazu wodnego możliwe jest jedynie przy zastosowaniu ciekłego powietrza (lub ciekłego azotu pod obniżonym ciśnieniem; ten drugi jest bardziej opłacalny), gdyż gaz wodny ze względu na znaczną zawartość w nim H 2 wykazuje jedynie bardzo nieznaczne ochłodzenie przy spadku ciśnienia (znikomy efekt Joule'a - Thomsona).
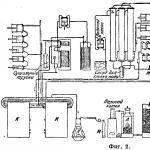
Schemat procesu skraplania CO przedstawiono na rys. 1. Gaz wodny d. b. oczyszczony z CO2. Aby zaoszczędzić na zużyciu NaOH, Bedford zaproponował „płukanie” gazu wodnego wodą pod wysokim ciśnieniem, po czym zawiera on tylko 0,3–0,5% CO2.
Aby oczyścić gaz i usunąć ślady CO2, poddaje się go działaniu wapna sodowanego pod ciśnieniem. Dopływa sprężony gaz wodny A i jest chłodzony zimnymi gazami przeciwprądowymi; w tym przypadku CO skrapla się w ciecz i gromadzi się B. Zawór V obniża ciśnienie pary CO, po czym ulatnia się G Poprzez D w temperaturze pokojowej. Z kolei wodór opuszcza mi. Ciekłe powietrze potrzebne do chłodzenia znajduje się (schematycznie) w H. Wodór wyizolowany opisaną metodą nie zawiera łatwo kondensujących zanieczyszczeń (CO 2, O 2, CH 4 = 0%), ale zawiera także od 2 do 1,7% CO i od 1,0 do 0,8% N 2; To. zawartość czystego wodoru wynosi 97,0-97,5%. Taki wodór o ciężarze właściwym 0,094 jest całkiem odpowiedni dla inżynierii metali, metalurgii i aeronautyki. Skroplony w tym procesie tlenek węgla zawiera 80-85% CO i wykorzystywany jest jako gaz palny do pokrycia kosztów paliwa w przedsiębiorstwie. Powstały tlenek węgla CO wystarcza do tego już w instalacjach o wydajności 100 m 3 /h wodoru. Przy dużych instalacjach występuje nawet nadmiar CO, który można wykorzystać jako paliwo w procesie frakcjonowania zużytego ciekłego powietrza na O 2 i Na. Pierwszy służy do spawania autogenicznego, drugi do syntezy amoniaku. Ostatnio otworzyły się nowe perspektywy wykorzystania tlenku węgla w związku z genialnymi odkryciami Vergiusa i ks. Fischera, obiecując prowadzić syntetyczną produkcję ciekłych węglowodorów i licznych produktów syntezy organicznej bezpośrednio z węgla lub z pierwszego produktu jego spalania, CO. Udoskonalenie chemicznych metod technologicznych w tym obszarze powinno przynieść bezprecedensową rewolucję w całej dziedzinie chemii stosowanej i jednocześnie dotknąć wszystkie gałęzie światowego przemysłu.
Na ryc. Na rysunku 2 przedstawiono schemat całej instalacji metodą Linde-Frank-Caro. Z generatora A gaz do czyszczenia doprowadzany jest do płuczki B i komory czyszczenia na sucho C, po czym gromadzony jest w zbiorniku gazu G.

Stąd gaz zawierający jeszcze do 3% CO 2 trafia do sprężarek, które po dwustopniowym sprężaniu przesyłają go w celu „wypłukania” CO 2 do wież ciśnień, skąd gaz wpływa do chłodzonych zbiorników K i K, gdzie pozostała część CO2 jest absorbowany przez CO2 obecny w tych naczyniach NaOH. K i K pracują na zmianę, raz w tygodniu, więc proces może odbywać się w sposób ciągły. W K i K wodór oddziela się od CO skondensowanego w ciecz i wypływa pod ciśnieniem 50 atm. Sprężarka L dodatkowo zwiększa ciśnienie wodoru wchodzącego do stalowych butli M.
Obecnie najważniejszą metodą wytwarzania wodoru na skalę techniczną jest metoda polegająca na utlenianiu metalicznego żelaza w temperaturze do czerwoności za pomocą pary wodnej do wolnego wodoru:
Po tym procesie następuje odwrotny proces redukcji tlenków żelaza, który zwykle osiąga się poprzez działanie na nie gazu wodnego; następnie żelazo ponownie reaguje z parą wodną itp. Proces ten został po raz pierwszy odkryty przez Lavoisiera (1783), a w 1794 r., po jego opracowaniu przez Preinera i Saint-Clair-Deville, został zastosowany w armii francuskiej do napełniania kul powietrznych. Aby proces się powiódł, żelazo ładowane do pieca redukcyjnego musi posiadać szczególne właściwości: musi być porowate, nie może się kruszyć ani stopić. Żelazo takie otrzymywano przez redukcję niektórych rud w odpowiednich warunkach (połysk żelaza) lub przez redukcję tlenków żelaza pozostałych podczas wypalania próbek pirytów żelaza niezawierających arsenu i cynku (Internationale Wasserstoff-A.-G., G.P. 220889). Diefenbach i Moldenhauer z wielkim sukcesem wykorzystali do tego celu kalcynowane żelazne drzewce. Obecność tlenków żelaza, związków siarki i tlenku węgla w gazie stosowanym do odwrotnej redukcji tlenków żelaza ma bardzo szkodliwy wpływ na proces redukcji pary wodnej żelazem; w tym drugim przypadku zredukowane żelazo pokrywa się powłoką węgla, co zapobiega dalszemu tworzeniu się wodoru. Lane i Zauberman (G.P. 234175) jako masę kontaktową zastosowali rudę żelaza (w dużych kawałkach), zredukowaną w temperaturze 800°C gazami niezawierającymi węglowodorów i zawierającymi nieznaczny % CO w porównaniu z zawartością H2; oni to zrozumieli. wysoce porowate żelazo gąbczaste. Internationale Wasserstoff-A.-G. stosowano masę kontaktową zredukowaną z rudy w temperaturze 800°C pod działaniem blaug technicznych; Messerschmitt zaproponował obciążenie aparatu masą, która oprócz porowatego żelaza zawierała także żelazo kompaktowe (GP 258053). Aby uniknąć zatykania rur luźną masą kontaktową oraz uniknąć jej spiekania i stopienia, ten sam Messerschmitt zaproponował stosowanie żelaza w postaci wąskich rurek, które miałyby kontakt z gazami redukującymi zarówno od zewnątrz, jak i od wewnątrz. Diefenbach i Moldengauer (GP 270704) mieszają Mn, Cr, W, Ti i inne metale w masie kontaktowej, które są utleniane przez parę wodną wraz z żelazem, ale nie są redukowane jak to ostatnie przez gazy redukujące. Dlatego tworzą ze swoich tlenków rodzaj szkieletu dla porowatego żelaza, nie topiąc się i nie zapobiegając spiekaniu żelaznej masy kontaktowej. Neger i Noding jako masę kontaktową stosują żeliwne żerdzie, które łatwiej odbudować i nie zmieniają kształtu tygodniami w temperaturze 1000°C (temperatura topnienia żeliwa wynosi ok. 1200°C), jednak w tym przypadku palenisko jest D. B. oleju, ponieważ przy spalaniu generatora i gazu wodnego osiągane są temperatury powyżej 1200°C. Gerhartz proponuje wdmuchiwanie pary wodnej do roztopionych metali, w wyniku czego woda utlenia część metali (podobnie jak w procesie Bessemera i Thomasa), a wodór wydziela się w stanie gazowym. Szereg innych patentów: Belu (G.P. 43989), F. Krupna (G.P. 73978 i 67827), Strache (G.P. 77350), G. Schimming (G.P. 95071), Yu. Pincha (G.P. 283160), Elworthy i Williamson (G.P. 164350 ), Caro (G.P. 249269), zawierają pewne ulepszenia, rozdz. przyr. w sensie bardziej oszczędnego wykorzystania energii, a także skuteczniejszego doboru i obróbki masy kontaktowej czy najbardziej racjonalnej kolejności poszczególnych etapów procesu. Pod tym względem za najbardziej skuteczną metodę należy uznać opatentowaną przez firmę BAMAG (G.P. 294039), która polega na tym, że po wstępnym utlenieniu masy kontaktowej nie następuje od razu odwrotny proces jej redukcji gazem generatorowym pierwszy proces, ale przez pewien czas pomiędzy obydwoma procesami przez masę kontaktową przepuszczane jest powietrze, powodując całkowite utlenienie tej ostatniej, w przeciwieństwie do częściowego utlenienia masy kontaktowej pod wpływem pary wodnej. W tym przypadku uwalniana jest tak znaczna ilość ciepła, że jest ona więcej niż wystarczająca do obsługi całego procesu. Szereg patentów zgłoszonych przez Messerschmitta (G.P. 263391 i inne) z dużym powodzeniem rozwiązuje problem regulacji nagrzewania kontaktowej masy żelaznej. Wodór produkowany jest w piecu szybowym. Wstępne nagrzewanie generatora do temperatury 700-900°C odbywa się za pomocą gazu wodnego i trwa 7-8 godzin, natomiast przy powtarzaniu ta faza procesu nie zajmuje więcej niż 17-19 minut. Po przywróceniu całej masy kontaktowej ostatnie ślady wody, gazu i powietrza usuwa się poprzez przedmuchanie przez 5-10 sekund. gaz wodny i przełączyć proces w przeciwnym kierunku zgodnie z równaniem:
Faza ta trwa około 8 minut, następnie 3-5 minut. przedmuchaj powietrze, aby spalić osadzony węgiel (a czasem siarkę); generuje to znaczną ilość ciepła; następnie ponownie następuje faza odzyskiwania, itd. Metoda BAMAG (GP 267944 i 300711) jest bardzo podobna do opisanej powyżej metody Messerschmitta. Faza tworzenia wodoru trwa tutaj około 5 minut. Zmiana fazy utleniania i redukcji odbywa się automatycznie. Metoda ta pozwala na otrzymanie produktu zawierającego 98,5% wodoru.
Na ryc. 3 przedstawia schematyczny diagram aparatu Griggsa, podobnego typu do aparatu K. Franka-Messerschmitta. W tym aparacie proces przebiega w następującej kolejności. 1) Faza redukcji: przechodzi mieszanina powietrza i gazu redukującego A i nagrzewa się w komorze B, po czym podgrzewa ruszty szamotowe stanowiące środkową część urządzenia; następnie przepuszcza się nadmiar gazu redukującego, który redukuje zawarte w nim tlenki żelaza V. 2) Faza tworzenia wodoru: przedostawanie się oparów G, przechodzą przez część aparatu zawierającą kratki szamotowe, a następnie wchodzą V, po czym wychodzą D. 3) Faza przenikania pary: przedostaje się para wodna D, iść przez V, zejdź wzdłuż środkowej części i wyjdź przez nią G. 4) Faza napowietrzania: przedostaje się powietrze A.

Produkując wodór poprzez działanie żelaza na parę wodną, należy przede wszystkim martwić się o poprawę wykorzystania termicznego, gdyż jeśli nie zadbamy o odzysk, wówczas marnuje się 90% ciepła gazu wodnego. Piece wykonane są ze specjalnych stopów, które dobrze wytrzymują zmiany temperatury. Przepływ i wylot gazów do pieca jest regulowany automatycznie (np. patent Dempstona: amerykański P. 104115/16, patent Bath, belgijski P. 137674/19 itp.). Aparat typu Messerschmitt (z jednym piecem) ma najwyraźniej przewagę nad aparatem z kilkoma piecami (typu Lane). Coraz częściej jako zamiennik gazu wodnego stosuje się redukujące gazy przemysłowe, np. gazy piecowe (aparat Griggsa - ang. P. 142882/20), gazy koksownicze, które zawierają do 50% H2, który zwykle pozostaje bezużyteczny, gaz oświetleniowy. Ta ostatnia okoliczność umożliwia łatwe przystosowanie pieców koksowniczych lub instalacji gazowych do produkcji wodoru (Soc. Oxyhydrique Frangaise, F.P. 563600). Metodę fabryki Electron w Griesheim kontynuuje Ch. przyr. cel polegający na jak największej eliminacji tlenku węgla poprzez przepuszczenie mieszaniny gazów przez katalizatory i wapno oraz przez oddzielenie od siebie dwóch głównych gazów reakcyjnych (Greenwood, angielski P. 137340/18). Metoda Diefenbacha i Moldenhauera umożliwia w tym samym procesie otrzymanie gazu wodnego, utlenienie go parą wodną i absorpcję CO2 (Catalysateurs Griesheim, Prius; angielski P. 128273/17 Neville et Taylor). Metoda Graera (belgijska P. -561409/22) polega na rozpraszaniu wapna, w związku z czym gaz wodny przepuszczany jest przez wapno wodne przy braku pary wodnej.
Inne metody separacji fizycznej. Claude (F.P. 130092, 130358/18) zaproponował wykorzystanie znacznie mniejszej rozpuszczalności wodoru w rozpuszczalnikach organicznych (np. eterze) w porównaniu z innymi gazami koksowniczymi do oddzielania wodoru od innych gazów. Krzywe na ryc. 4 wyrażają stosunek rozpuszczalności tlenku węgla i wodoru w eterze. Jednak metoda upłynniania najwyraźniej zachowuje swoją zaletę. Claude skrapla gazy koksownicze i oddziela od nich wodór. Jednocześnie możliwa jest także izolacja tych węglowodorów zawartych w gazach koksowniczych, które mają zastosowanie przemysłowe.

W ostatnim czasie coraz większego znaczenia nabierają metody polegające na rozszczepianiu węglowodorów i innych związków organicznych w wysokich temperaturach lub pod działaniem katalizatorów z wydzieleniem wolnego wodoru. Innym rodzajem metody produkcji wodoru jest oddziaływanie w wysokich temperaturach węglowodorów zmieszanych z parą wodną, w wyniku czego powstaje czysty wodór i tlenek lub dwutlenek węgla. BASF osiąga ten cel przepuszczając mieszaninę przez bardzo krótką warstwę masy kontaktowej, na przykład przez oczka z drutu niklowego. Rozkład węglowodorów w temperaturze czerwoności osiąga się jeszcze szybciej i pełniej, gdy jako katalizator stosuje się tlenek niklu lub nikiel metaliczny, drobno pokruszony i nanoszony w tym stanie na materiały ogniotrwałe. Według Rinkera i Woltera (G.P. 174253, 210435) wodór można otrzymać także z gazu naftowego. Opary oleju lub smoły węglowej wprowadzane są do generatora wypełnionego gorącym koksem (lub wtryskiwane są do niego od góry pozostałości oleju lub smoły węglowej). Opary przepuszczane są przez warstwy koksu, gdzie ulegają rozszczepieniu iw odpowiednio wysokiej temperaturze tworzą końcowy gaz zawierający do 96% wodoru. Z uwagi na fakt, że temperatura generatora, ze względu na endotermiczność reakcji rozkładu oleju gazowego, jest znacznie obniżona, należy okresowo przerywać dodawanie oleju gazowego i zwiększać temperaturę generatora za pomocą podgrzanych gazów . Metoda Rinkera-Woltera początkowo oznaczała jedynie produkcję gazu oświetlającego o niewielkiej zawartości węgla z ropy naftowej lub jej pozostałości. Jednak BAMAG udoskonalił tę metodę do tego stopnia, że możliwe jest otrzymanie produktu o ciężarze właściwym 0,087-0,090 i zawartości wodoru dochodzącej do 98% (reszta to azot).
W przypadku gdy zastosowanie wodoru nie pozwala na obecność w nim toksycznych zanieczyszczeń „zatruwających” katalizator biorący udział w procesie produkcyjnym, w którym wykorzystuje się wodór (także przy produkcji wodoru do żarówek), najwygodniej jest używać wodór elektrolityczny(zwłaszcza jeśli dostępność zasobów hydroelektrycznych i możliwość jednoczesnego wykorzystania otrzymywanego jako produkt uboczny tlenu powoduje obniżenie ceny wodoru elektrolitycznego). W takich przypadkach można preferencyjnie zastosować wodór elektrolityczny zamiast wodoru wytwarzanego innymi metodami, w którym konieczne jest oczyszczenie wodoru z nieuniknionych zanieczyszczeń toksycznych. Wodór elektrolityczny jest oczywiście całkowicie czysty. Do elektrolizy stosuje się wodę, do której dodano pewną ilość kwasu, zasady żrącej i zasady węglowej. Elektrody wykonane są z żelaza (dla reakcji w roztworach alkalicznych) lub ołowiu (dla roztworów kwaśnych). Aby uniknąć mieszania się H 2 z O 2, elektrody są oddzielone od siebie membraną wykonaną z porowatego (tkaniny azbestowej) nieprzewodzącego materiału. W oparciu o tę zasadę zaprojektowano w Chalet-Meudon instalację wodoru dla celów lotnictwa wojskowego (metoda Repart). Do elektrolizy stosuje się napięcie 2,25–2,5 V w temperaturze elektrolitu 50–70 ° C. Urządzenia zbudowane na tej zasadzie wytwarzają wodór o czystości 99,8%. Inna zasada projektowania urządzeń do elektrolizy zakłada obecność przegrody pomiędzy elektrodami wykonanej z materiału przewodzącego prąd elektryczny.
Szczególne znaczenie dla elektrolitycznej produkcji wodoru nabrała instalacja O. Schmita (G.P. 111131). Elektrolizer ten składa się z układu elektrod połączonych ze sobą niczym prasa filtracyjna. Budowę całego urządzenia widać wyraźnie na ryc. 5a - schematyczny widok z boku aparatu, 5b - przekrój poziomy, 5c - przekrój przez jedną ramę (widok z przodu) i 5d - przekrój przez oddzielacz gazu; ee - elektrody podwójne, d - przepony; każda płytka elektrody na górze i na dole ma dwa otwory o, o i o", o".


Przez te otwory przechodzą dwa kanały: dolny dostarcza wodę do przestrzeni elektrodowych, górny służy do usuwania powstających gazów. Dalsze ulepszenie tej instalacji polega na całkowitym odizolowaniu płyt od ich uchwytów poprzez wprowadzenie krótkich warstw porcelany, szkła i innych materiałów izolacyjnych pomiędzy płytami a uchwytami. Fabryka Oerlikon produkuje (G.P. 275515) elektrolizery na 20, 40, 75 i 125 A, urządzenia na napięcia 65, 110 i 220 V. Elektrolit to 10% roztwór potażu. Do wytworzenia 1 m3 wodoru o temperaturze 40°C potrzeba 6 kW. Ze względu na zamknięty charakter całego aparatu, gazy mogą otrzymany pod ciśnieniem. Odmianami tego samego układu elektrolizera są urządzenia Aikena, Leroya i Moritza, a także elektrolizer Francuskiego Towarzystwa Anonimowego (Societe Anonyme Oxyhydrique). Urządzenia systemu Levina (G.P. 288776) wyróżniają się szczególnie wygodną konstrukcją, różnicą od opisanych powyżej jest możliwość regulacji ciśnienia hydrostatycznego i gazu każdej celi z osobna dzięki temu, że na dnie kolektorów gazu znajdują się kanały z wygiętymi na bok otworami, za pomocą których Gazy z poszczególnych kolektorów gazu dostają się do wspólnego kolektora. Zmieniając wysokość poziomu wylotu, można regulować ciśnienie gazu i poziom cieczy w każdej komorze oddzielnie. Urządzenia Levine są produkowane w Nowym Jorku w International Oxygen C°.
Znaczne ilości wodoru powstają jako produkt uboczny przy produkcji alkoholu butylowego metodą fermentacji pod wpływem czystych kultur Clostridium acetobutilicum. Fabryki Commercial Solvents Corporation w USA wytwarzają tą metodą dziennie około 69 000 m 3 wodoru jako produktu ubocznego oraz półtorakrotną ilość CO 2 . Tak znaczny uzysk wodoru pozwala na wykorzystanie go na miejscu do produkcji syntetycznego amoniaku.
W czasie wojny stosowano metody produkcji wodoru (niezależnie od kalkulacji kosztu wodoru), które zapewniały możliwość szybkiej produkcji wodoru przy użyciu łatwo przemieszczalnych instalacji. Metody te obejmują: metodę silikonową (Jaubert lub Lelorge - działanie zasad na żelazokrzem), metodę wodoritową (działanie NaOH na krzem), metodę hydrolityczną (działanie wody na CaH 2), metodę działania kwasu na cynk lub żelazo, działanie glinu na roztwor sody kaustycznej, metodę Morino-Beaupre (wpływ amalgamatu glinu na sodę kaustyczną), metodę hydronową (wpływ stopu sodu i ołowiu na wodę), metodę Metoda Rinkera-Voltera dostosowana do sytuacji terenowej i inne.
Zastosowania wodoru . Przed wojną 1914-18. zużycie i produkcja wodoru były stosunkowo bardzo ograniczone. Wodór wykorzystywano w lotnictwie, do (bardzo słabo rozwiniętej wówczas) produkcji syntetycznego amoniaku, do autogenicznego spawania metali, gdzie wodór stopniowo zastępowano acetylenem. Dopiero wojna, wysunąwszy ogromne zapotrzebowanie na wodór, w znacznym stopniu przyczyniła się do udoskonalenia metod jego produkcji i rozwoju przemysłu wodorowego. Syntetyczny amoniak był potrzebny w ogromnych ilościach zarówno na cele nawozowe, ze względu na trudności w transporcie chilijskiej saletry, jak i jako produkt wyjściowy do jej utleniania metodą Ostwalda do kwasu azotowego, niezbędnego do produkcji materiałów wybuchowych. Zapotrzebowanie na wodór dla aeronautyki w czasie wojny również osiągnęło znaczne rozmiary. Po zakończeniu wojny produkcja syntetycznego amoniaku na cele nawozowe nie tylko nie spadła, ale znacznie wzrosła (same zakłady BASF zużywają dziennie 2 mln m3 wodoru do produkcji syntetycznego amoniaku). Podobnie znacznie wzrosło zużycie wodoru do uwodornienia tłuszczów, umożliwiając otrzymywanie tłuszczów stałych nadających się do spożycia, a także do produkcji mydła, z niskowartościowych tłuszczów roślinnych i niejadalnego oleju rybnego. Produkcja tłuszczów uwodornionych jest bardzo dobrze rozwinięta we Francji (Marsylia), USA i Japonii. W 1922 roku Japonia produkowała 62 tony uwodornionego tłuszczu dziennie. Przed wojną w Rosji działało kilka fabryk uwodornienia tłuszczów (Wołga Spółka Akcyjna „Salolin” w Petersburgu i N. Nowogrodzie). W ZSRR produkcja tłuszczów uwodornionych dostępna jest m.in. w zakładach salamas w Rostowie nad Donem, w Moskwie w dawnych Newskich Zakładach Stearyny i w innych miejscach. Przemysł tego typu rozwija się bardzo szybko, zużywając coraz większe ilości wodoru. Wodór jest szeroko stosowany w technologii i laboratoriach badawczych do uwodornienia innych nienasyconych związków organicznych (z wyjątkiem tłuszczów), takich jak węglowodory aromatyczne (np. przy produkcji dekaliny, tetraliny z naftalenu, do uwodornienia acetylenu i węglowodorów otrzymywanych przez suchej destylacji węgla kamiennego i brunatnego oraz do uwodornienia pozostałości naftowych przetwarzanych w obecności katalizatorów z dodatkiem wodoru do produktów uwodornionych). Ponadto wodór wykorzystuje się w szeregu gałęzi przemysłu chemicznego, np. do produkcji amin z nitrozwiązków, alkoholi z aldehydów (np. alkoholu winnego z aldehydu octowego), do produkcji metanu z tlenku węgla, do produkcji kwasu mrówkowego w wyniku działania wodoru na dwutlenek węgla lub wodorowęglany pod wpływem ciemnych wyładowań elektrycznych. W wyniku działania wodoru na alkaloidy, lecytynę i inne związki organiczne otrzymuje się wiele leków farmaceutycznych. W ostatnich latach zapotrzebowanie na wodór zostało zaspokojone przez nowy przemysł, który ma odegrać główną rolę w przemyśle chemicznym. Ten obszar zastosowań wodoru wiąże się z odkryciem tzw. metod przez Bergiusa i Fischera. upłynnianie węgla, czyli metody dodawania wodoru do węgla pod wysokim ciśnieniem i przy udziale katalizatorów z utworzeniem ciekłych węglowodorów palnych, a także metody dodawania wodoru pod wysokim ciśnieniem do nienasyconych związków organicznych. Na uwagę zasługuje także praca szwajcarskiego prof. Fiertz, który opracował metodę dodawania wodoru do celulozy. Nic więc dziwnego, że w ostatnim czasie we wszystkich krajach intensywnie rozwijane są metody wytwarzania wodoru i że we wszystkich krajach w niewiarygodnym tempie rośnie liczba patentów związanych z tymi metodami.
Informacje na temat produkcji wodoru zob.
Ma swoją specyficzną pozycję w układzie okresowym, która odzwierciedla właściwości, jakie wykazuje i mówi o jego strukturze elektronowej. Jednak wśród nich wszystkich jest jeden specjalny atom, który zajmuje dwie komórki jednocześnie. Znajduje się w dwóch grupach pierwiastków, które są całkowicie przeciwne pod względem właściwości. To jest wodór. Takie cechy czynią go wyjątkowym.
Wodór to nie tylko pierwiastek, ale także prosta substancja, a także integralna część wielu złożonych związków, pierwiastek biogenny i organogenny. Dlatego rozważmy bardziej szczegółowo jego cechy i właściwości.
Wodór jako pierwiastek chemiczny
Wodór jest pierwiastkiem pierwszej grupy podgrupy głównej, a także siódmej grupy podgrupy głównej w pierwszym mniejszym okresie. Okres ten składa się tylko z dwóch atomów: helu i pierwiastka, który rozważamy. Opiszmy główne cechy pozycji wodoru w układzie okresowym.
- Liczba atomowa wodoru wynosi 1, liczba elektronów jest taka sama, a zatem liczba protonów jest taka sama. Masa atomowa - 1,00795. Istnieją trzy izotopy tego pierwiastka o liczbach masowych 1, 2, 3. Jednak właściwości każdego z nich są bardzo różne, ponieważ wzrost masy wodoru nawet o jeden jest natychmiast dwukrotnie większy.
- Fakt, że zawiera tylko jeden elektron na swojej zewnętrznej powierzchni, pozwala z powodzeniem wykazywać zarówno właściwości utleniające, jak i redukujące. Dodatkowo po oddaniu elektronu pozostaje on ze swobodnym orbitalem, który bierze udział w tworzeniu wiązań chemicznych zgodnie z mechanizmem donor-akceptor.
- Wodór jest silnym środkiem redukującym. Dlatego za jego główne miejsce uważa się pierwszą grupę głównej podgrupy, w której kieruje najbardziej aktywnymi metalami - alkaliami.
- Jednakże w przypadku interakcji z silnymi środkami redukującymi, takimi jak metale, może być również środkiem utleniającym, przyjmującym elektron. Związki te nazywane są wodorkami. Zgodnie z tą cechą stoi na czele podgrupy halogenów, z którymi jest podobny.
- Ze względu na bardzo małą masę atomową wodór jest uważany za najlżejszy pierwiastek. Ponadto jego gęstość jest również bardzo niska, więc jest to również punkt odniesienia dla lekkości.
Zatem oczywiste jest, że atom wodoru jest pierwiastkiem całkowicie unikalnym, w przeciwieństwie do wszystkich innych pierwiastków. W związku z tym jego właściwości są również wyjątkowe, a powstające substancje proste i złożone są bardzo ważne. Rozważmy je dalej.

Prosta substancja
Jeśli mówimy o tym elemencie jako o cząsteczce, to musimy powiedzieć, że jest on dwuatomowy. Oznacza to, że wodór (prosta substancja) jest gazem. Jego wzór empiryczny zostanie zapisany jako H2, a jego wzór graficzny zostanie zapisany za pomocą pojedynczej zależności sigma H-H. Mechanizm tworzenia wiązań między atomami jest kowalencyjny niepolarny.
- Reforming metanu parowego.
- Zgazowanie węgla - proces polega na podgrzaniu węgla do temperatury 1000 0 C, w wyniku czego powstaje wodór i węgiel wysokowęglowy.
- Elektroliza. Metodę tę można stosować tylko w przypadku wodnych roztworów różnych soli, ponieważ stopy nie powodują wypływu wody na katodzie.
Laboratoryjne metody wytwarzania wodoru:
- Hydroliza wodorków metali.
- Wpływ rozcieńczonych kwasów na metale aktywne i średnią aktywność.
- Oddziaływanie metali alkalicznych i metali ziem alkalicznych z wodą.
Aby zebrać powstały wodór, należy trzymać probówkę do góry nogami. Przecież tego gazu nie da się zebrać w taki sam sposób jak np. dwutlenek węgla. To wodór, jest znacznie lżejszy od powietrza. Szybko odparowuje, a w dużych ilościach po zmieszaniu z powietrzem eksploduje. Dlatego probówkę należy odwrócić. Po napełnieniu należy go zamknąć gumowym korkiem.
Aby sprawdzić czystość zebranego wodoru, należy przyłożyć do szyi zapaloną zapałkę. Jeśli klaskanie jest tępe i ciche, oznacza to, że gaz jest czysty i zawiera minimalne zanieczyszczenia powietrza. Jeśli jest głośny i gwiżdże, oznacza to, że jest brudny i zawiera dużą ilość obcych składników.

Obszary zastosowań
Podczas spalania wodoru uwalniana jest tak duża ilość energii (ciepła), że gaz ten uznawany jest za najbardziej opłacalne paliwo. Co więcej, jest przyjazny dla środowiska. Jednakże, jak dotąd, jego zastosowanie w tym obszarze jest ograniczone. Wynika to z nieprzemyślanych i nierozwiązanych problemów syntezy czystego wodoru, który nadawałby się do wykorzystania jako paliwo w reaktorach, silnikach i urządzeniach przenośnych, a także w domowych kotłach grzewczych.
W końcu metody wytwarzania tego gazu są dość drogie, dlatego najpierw należy opracować specjalną metodę syntezy. Takiego, który pozwoli uzyskać produkt w dużych ilościach i przy minimalnych kosztach.
Istnieje kilka głównych obszarów, w których rozważany przez nas gaz jest wykorzystywany.
- Syntezy chemiczne. Uwodornienie stosuje się do produkcji mydeł, margaryn i tworzyw sztucznych. Przy udziale wodoru syntetyzuje się metanol i amoniak oraz inne związki.
- W przemyśle spożywczym - jako dodatek E949.
- Przemysł lotniczy (nauka o rakietach, produkcja samolotów).
- Przemysł elektroenergetyczny.
- Meteorologia.
- Paliwo przyjazne dla środowiska.
Oczywiście wodór jest równie ważny, jak występuje w przyrodzie w dużych ilościach. Różne związki, które tworzy, odgrywają jeszcze większą rolę.

Związki wodoru
Są to złożone substancje zawierające atomy wodoru. Istnieje kilka głównych rodzajów takich substancji.
- Halogenowodory. Ogólny wzór to HHal. Wśród nich szczególne znaczenie ma chlorowodór. Jest to gaz, który rozpuszcza się w wodzie tworząc roztwór kwasu solnego. Kwas ten jest szeroko stosowany w prawie wszystkich syntezach chemicznych. Co więcej, zarówno organiczne, jak i nieorganiczne. Chlorowodór jest związkiem o wzorze empirycznym HCL i jest jednym z największych produkowanych w naszym kraju rocznie. Halogenowodory obejmują także jodowodór, fluorowodór i bromowodór. Wszystkie tworzą odpowiednie kwasy.
- Lotne Prawie wszystkie z nich to dość trujące gazy. Na przykład siarkowodór, metan, silan, fosfina i inne. Jednocześnie są bardzo łatwopalne.
- Wodorki to związki z metalami. Należą do klasy soli.
- Wodorotlenki: zasady, kwasy i związki amfoteryczne. Koniecznie zawierają atomy wodoru, jeden lub więcej. Przykład: NaOH, K 2, H 2 SO 4 i inne.
- Wodorotlenek. Związek ten jest lepiej znany jako woda. Inna nazwa to tlenek wodoru. Wzór empiryczny wygląda następująco - H 2 O.
- Nadtlenek wodoru. Jest to silny środek utleniający, którego wzór to H 2 O 2.
- Liczne związki organiczne: węglowodory, białka, tłuszcze, lipidy, witaminy, hormony, olejki eteryczne i inne.
Jest oczywiste, że różnorodność związków rozważanego pierwiastka jest bardzo duża. To po raz kolejny potwierdza jego duże znaczenie dla przyrody i człowieka, a także wszystkich żywych istot.
- to najlepszy rozpuszczalnik
Jak wspomniano powyżej, potoczną nazwą tej substancji jest woda. Składa się z dwóch atomów wodoru i jednego tlenu, połączonych kowalencyjnymi wiązaniami polarnymi. Cząsteczka wody jest dipolem, co wyjaśnia wiele jej właściwości. W szczególności jest to uniwersalny rozpuszczalnik.
To właśnie w środowisku wodnym zachodzą niemal wszystkie procesy chemiczne. Wewnętrzne reakcje metabolizmu plastycznego i energetycznego w organizmach żywych przeprowadza się również za pomocą tlenku wodoru.
Woda jest słusznie uważana za najważniejszą substancję na planecie. Wiadomo, że żaden żywy organizm nie może bez niego żyć. Na Ziemi może istnieć w trzech stanach skupienia:
- płyn;
- gaz (para);
- ciało stałe (lód).
W zależności od izotopu wodoru zawartego w cząsteczce wyróżnia się trzy rodzaje wody.
- Światło lub protium. Izotop o liczbie masowej 1. Wzór - H 2 O. Jest to zwykła forma używana przez wszystkie organizmy.
- Deuter lub ciężki, jego wzór to D 2 O. Zawiera izotop 2 H.
- Superciężki lub tryt. Wzór wygląda jak T 3 O, izotop - 3 H.
Zasoby świeżej wody protium na planecie są bardzo ważne. W wielu krajach już go brakuje. Opracowywane są metody uzdatniania słonej wody w celu uzyskania wody pitnej.

Nadtlenek wodoru jest uniwersalnym lekarstwem
Związek ten, jak wspomniano powyżej, jest doskonałym środkiem utleniającym. Jednak przy silnych przedstawicielach może również zachowywać się jak konserwator. Ponadto ma wyraźne działanie bakteriobójcze.
Inna nazwa tego związku to nadtlenek. W tej postaci jest stosowany w medycynie. 3% roztwór krystalicznego hydratu omawianego związku jest lekiem stosowanym w leczeniu małych ran w celu ich odkażania. Udowodniono jednak, że wydłuża to czas gojenia się rany.
Nadtlenek wodoru stosowany jest także w paliwie rakietowym, w przemyśle do dezynfekcji i wybielania oraz jako środek spieniający do produkcji odpowiednich materiałów (np. pianki). Dodatkowo nadtlenek pomaga w czyszczeniu akwariów, wybielaniu włosów i wybielaniu zębów. Wyrządza jednak szkody tkankom, dlatego nie jest zalecany przez specjalistów do tych celów.
Występowanie w przyrodzie. V. jest szeroko rozpowszechniony w przyrodzie, jego zawartość w skorupie ziemskiej (litosferze i hydrosferze) wynosi 1% wagowo i 16% liczby atomów. V. jest częścią najpowszechniejszej substancji na Ziemi - wody (11,19% V. wagowo), w składzie związków tworzących węgiel, ropę, gazy ziemne, gliny, a także organizmy zwierzęce i roślinne (tj. w składzie białka, kwasy nukleinowe, tłuszcze, węglowodany itp.). W stanie wolnym V. jest niezwykle rzadki, występuje w małych ilościach w gazach wulkanicznych i innych gazach naturalnych. W atmosferze występują niewielkie ilości wolnego wodoru (0,0001% liczby atomów). W przestrzeni bliskiej Ziemi promieniowanie tworzy wewnętrzny pas promieniowania Ziemi („protonowy”) w postaci strumienia protonów. W przestrzeni V. jest najpowszechniejszym elementem. W postaci plazmy stanowi około połowę masy Słońca i większości gwiazd, większość gazów ośrodka międzygwiazdowego i mgławic gazowych. V. występuje w atmosferze wielu planet i komet w postaci wolnego H2, metanu CH4, amoniaku NH3, wody H2O, rodników takich jak CH, NH, OH, SiH, PH itp. W postaci przepływu protonów energia jest częścią korpuskularnego promieniowania Słońca i promieni kosmicznych.
Izotopy, atom i cząsteczka. Zwykły witriol składa się z mieszaniny dwóch stabilnych izotopów: lekkiego witriolu lub protu (1H) i ciężkiego witriolu, czyli deuteru (2H lub D). W związkach naturalnych na 1 atom 2H przypada średnio 6800 atomów 1H. Sztucznie wytworzono radioaktywny izotop - superciężki V., czyli tryt (3H lub T), z miękkim promieniowaniem β i okresem półtrwania T1/2 = 12,262 lat. W naturze tryt powstaje na przykład z azotu atmosferycznego pod wpływem neutronów promieniowania kosmicznego; w atmosferze jest zaniedbywalnie mała (4-10-15% całkowitej liczby atomów V). Otrzymano wyjątkowo niestabilny izotop 4H. Liczby masowe izotopów 1H, 2H, 3H i 4H, odpowiednio 1,2, 3 i 4, wskazują, że jądro atomu protu zawiera tylko 1 proton, deuter – 1 proton i 1 neutron, tryt – 1 proton i 2 neutrony, 4H - 1 proton i 3 neutrony. Duża różnica mas izotopów V. powoduje bardziej zauważalną różnicę w ich właściwościach fizykochemicznych niż w przypadku izotopów innych pierwiastków.
Atom V. ma najprostszą budowę spośród atomów wszystkich pozostałych pierwiastków: składa się z jądra i jednego elektronu. Energia wiązania elektronu z jądrem (potencjał jonizacji) wynosi 13,595 eV. Neutralny atom może również dodać drugi elektron, tworząc jon ujemny H-; w tym przypadku energia wiązania drugiego elektronu z atomem obojętnym (powinowactwo elektronowe) wynosi 0,78 eV. Mechanika kwantowa umożliwia obliczenie wszystkich możliwych poziomów energii atomu, a tym samym daje pełną interpretację jego widma atomowego. Atom V służy jako atom modelowy w obliczeniach mechaniki kwantowej poziomów energii innych, bardziej złożonych atomów. Cząsteczka B. H2 składa się z dwóch atomów połączonych kowalencyjnym wiązaniem chemicznym. Energia dysocjacji (tj. rozpadu na atomy) wynosi 4,776 eV (1 eV = 1,60210-10-19 J). Odległość międzyatomowa w położeniu równowagi jąder wynosi 0,7414-Å. W wysokich temperaturach wodór cząsteczkowy dysocjuje na atomy (stopień dysocjacji w temperaturze 2000°C wynosi 0,0013, w temperaturze 5000°C 0,95). Atom V. powstaje również w różnych reakcjach chemicznych (na przykład w wyniku działania Zn na kwas solny). Jednak istnienie wodoru w stanie atomowym trwa tylko przez krótki czas, atomy łączą się ponownie w cząsteczki H2.
Fizyczne i chemiczne właściwości. V. jest najlżejszą ze znanych substancji (14,4 razy lżejszą od powietrza), gęstość 0,0899 g/l przy 0°C i 1 atm. Hel wrze (upłynnia) i topi się (zestala) odpowiednio w temperaturach -252,6°C i -259,1°C (tylko hel ma niższe temperatury topnienia i wrzenia). Temperatura krytyczna wody jest bardzo niska (-240°C), dlatego jej upłynnienie jest obarczone dużymi trudnościami; ciśnienie krytyczne 12,8 kgf/cm2 (12,8 atm), gęstość krytyczna 0,0312 g/cm3. Ze wszystkich gazów V. ma największą przewodność cieplną, wynoszącą 0,174 W/(m-K) w temperaturze 0°C i 1 atm, tj. 4,16-0-4 cal/(s-cm-°C). Ciepło właściwe V. w temperaturze 0°C i 1 atm Ср 14,208-103 J/(kg-K), tj. 3,394 cal/(g-°C). V. jest słabo rozpuszczalny w wodzie (0,0182 ml/g w temperaturze 20°C i 1 atm), ale dobrze rozpuszczalny w wielu metalach (Ni, Pt, Pd itp.), zwłaszcza w palladzie (850 objętości na 1 objętość Pd) . Rozpuszczalność V. w metalach jest związana z jego zdolnością do dyfundowania przez nie; Dyfuzji przez stop węgla (na przykład stal) czasami towarzyszy zniszczenie stopu w wyniku interakcji węgla z węglem (tzw. Dekarbonizacja). Ciecz V. jest bardzo lekka (gęstość w -253°C 0,0708 g/cm3) i płynna (lepkość w -253°C 13,8 spuaz).
W większości związków V. wykazuje wartościowość (dokładniej stopień utlenienia) +1, podobnie jak sód i inne metale alkaliczne; zwykle jest uważany za analog tych metali, wiodący 1 gram. System Mendelejewa. Jednakże w wodorkach metali jon B jest naładowany ujemnie (stopień utlenienia -1), tj. wodorek Na+H- ma strukturę podobną do chlorku Na+Cl-. To i kilka innych faktów (podobieństwo właściwości fizycznych V. i halogenów, zdolność halogenów do zastąpienia V. w związkach organicznych) dają podstawę do zaklasyfikowania V. również do VII grupy układu okresowego (więcej szczegółów w artykule patrz Układ Okresowy Pierwiastków). W normalnych warunkach molekularny V. jest stosunkowo mało aktywny, bezpośrednio łącząc się tylko z najbardziej aktywnymi niemetalami (z fluorem iw świetle z chlorem). Jednak po podgrzaniu reaguje z wieloma pierwiastkami. Atomic V. ma zwiększoną aktywność chemiczną w porównaniu do molekularnej. Z tlenem V. tworzy wodę: H2 + 1/2O2 = H2O z wydzieleniem 285,937-103 J/mol, tj. 68,3174 kcal/mol ciepła (w temperaturze 25°C i 1 atm.). W normalnych temperaturach reakcja przebiega niezwykle powoli, powyżej 550°C wybucha. Granice wybuchowości mieszaniny wodorowo-tlenowej wynoszą (objętościowo) od 4 do 94% H2, a mieszaniny wodorowo-powietrznej od 4 do 74% H2 (mieszanina 2 objętości H2 i 1 objętości O2 nazywa się gaz detonujący). V. służy do redukcji wielu metali, ponieważ usuwa tlen z ich tlenków:
CuO + H2 = Cu + H2O,
Fe3O4 + 4H2 = 3Fe + 4H2O itd.
W przypadku halogenów V. tworzy halogenowodory, na przykład:
H2 + Cl2 = 2HCl.
Jednocześnie V. eksploduje fluorem (nawet w ciemności i przy -252°C), reaguje z chlorem i bromem dopiero po oświetleniu lub podgrzaniu, a z jodem dopiero po podgrzaniu. V. reaguje z azotem tworząc amoniak: 3H2 + N2 = 2NH3 tylko na katalizatorze i w podwyższonych temperaturach i ciśnieniach. Po podgrzaniu V. reaguje energicznie z siarką: H2 + S = H2S (siarkowodór), znacznie trudniej z selenem i tellurem. V. może reagować z czystym węglem bez katalizatora tylko w wysokich temperaturach: 2H2 + C (amorficzny) = CH4 (metan). V. reaguje bezpośrednio z niektórymi metalami (alkaliczne, ziem alkalicznych itp.), tworząc wodorki: H2 + 2Li = 2LiH. Duże znaczenie praktyczne mają reakcje wodoru z tlenkiem węgla, podczas których w zależności od temperatury, ciśnienia i katalizatora powstają różne związki organiczne, np. HCHO, CH3OH itp. (patrz Tlenek węgla). Węglowodory nienasycone reagują z wodorem, stając się nasycone, np.: CnH2n + H2 = CnH2n+2 (patrz Uwodornienie).
Celem dzisiejszej publikacji jest dostarczenie nieprzygotowanemu czytelnikowi wyczerpujących informacji nt czym jest wodór, jakie są jego właściwości fizykochemiczne, zakres stosowania, znaczenie i metody produkcji.
Wodór występuje w zdecydowanej większości materii organicznej i komórek, w których stanowi prawie dwie trzecie atomów.
Fot. 1. Wodór uważany jest za jeden z najpowszechniejszych pierwiastków w przyrodzie
W układzie okresowym pierwiastków Mendelejewa wodór zajmuje honorowe pierwsze miejsce z masą atomową równą jeden.
Nazwa „wodór” (po łacinie - Wodór) pochodzi od dwóch starożytnych greckich słów: ὕδωρ - „” i γεννάω - „Rodzę” (dosłownie „rodzić”) i został po raz pierwszy zaproponowany w 1824 r. przez rosyjskiego chemika Michaiła Sołowjowa.
Wodór jest jednym z pierwiastków tworzących wodę (obok tlenu) (wzór chemiczny wody to H 2 O).
Ze względu na swoje właściwości fizyczne wodór charakteryzuje się tym, że jest gazem bezbarwnym (lżejszym od powietrza). Po zmieszaniu z tlenem lub powietrzem jest skrajnie łatwopalny.
Jest w stanie rozpuścić się w niektórych metalach (tytan, żelazo, platyna, pallad, nikiel) i w etanolu, ale jest bardzo słabo rozpuszczalny w srebrze.
Cząsteczka wodoru składa się z dwóch atomów i jest oznaczona jako H2. Wodór ma kilka izotopów: prot (H), deuter (D) i tryt (T).
Historia odkrycia wodoru
Już w pierwszej połowie XVI wieku, prowadząc doświadczenia alchemiczne, mieszając metale z kwasami, Paracelsus zauważył nieznany dotąd palny gaz, którego nie był w stanie oddzielić od powietrza.
Prawie półtora wieku później – pod koniec XVII wieku – francuskiemu naukowcowi Lemery’emu udało się oddzielić wodór (jeszcze nie wiedząc, że to wodór) z powietrza i udowodnić jego palność.

Fot. 2. Henry Cavendish - odkrywca wodoru
Doświadczenia chemiczne przeprowadzone w połowie XVIII wieku pozwoliły Michaiłowi Łomonosowowi zidentyfikować proces wydzielania się w wyniku pewnych reakcji chemicznych określonego gazu, który jednak nie jest flogistonem.
Prawdziwego przełomu w badaniach gazu palnego dokonał angielski chemik. Henry’ego Cavendisha, któremu przypisuje się odkrycie wodoru (1766).
Cavendish nazwał ten gaz „łatwopalnym powietrzem”. Przeprowadził także reakcję spalania tej substancji, w wyniku której powstała woda.
W 1783 roku francuscy chemicy pod przewodnictwem Antoine’a Lavoisiera przeprowadzili syntezę wody, a następnie rozkład wody z wydzieleniem „palnego powietrza”.
Badania te ostatecznie wykazały obecność wodoru w wodzie. To Lavoisier zaproponował nazwanie nowego gazu wodorem (1801).
Przydatne właściwości wodoru
Wodór jest czternaście i pół razy lżejszy od powietrza.
Wyróżnia się także najwyższą przewodnością cieplną spośród innych gazów (ponad siedmiokrotnie większą przewodnością cieplną powietrza).
W przeszłości balony i sterowce napełniano wodorem. Po serii katastrof w połowie lat trzydziestych XX wieku, które zakończyły się eksplozjami sterowców, projektanci musieli szukać zamiennika wodoru.
Teraz takie samoloty korzystają z helu, który jest znacznie droższy od wodoru, ale nie tak wybuchowy.

Fot. 3. Wodór wykorzystywany jest do produkcji paliwa rakietowego
W wielu krajach trwają badania nad stworzeniem oszczędnych silników na wodór do samochodów osobowych i ciężarowych.
Samochody napędzane paliwem wodorowym są znacznie bardziej przyjazne dla środowiska niż ich odpowiedniki benzynowe i diesla.
W normalnych warunkach (temperatura pokojowa i naturalne ciśnienie) wodór niechętnie reaguje.
Kiedy mieszaninę wodoru i tlenu ogrzeje się do temperatury 600°C, rozpoczyna się reakcja, która kończy się utworzeniem cząsteczek wody.
Tę samą reakcję można wywołać za pomocą iskry elektrycznej.
Reakcje z udziałem wodoru kończą się dopiero po całkowitym zużyciu składników biorących udział w reakcji.
Temperatura spalania wodoru sięga 2500-2800°C.
Wodór służy do oczyszczania różnego rodzaju paliw na bazie ropy naftowej i produktów naftowych.
W przyrodzie żywej nic nie zastąpi wodoru, ponieważ jest on obecny w każdej materii organicznej (w tym w oleju) i we wszystkich związkach białkowych.
Bez udziału wodoru byłoby to niemożliwe.
Stany skupione wodoru
Wodór może występować w trzech głównych stanach skupienia:
- gazowy;
- płyn;
- twardy
Normalnym stanem wodoru jest gaz. Obniżając temperaturę do -252,8°C, wodór przechodzi w ciecz, a po przekroczeniu progu temperatury -262°C wodór przechodzi w stan stały.

Fot. 4. Od kilkudziesięciu lat zamiast taniego wodoru do napełniania balonów używa się drogiego helu.
Naukowcy sugerują, że wodór może znajdować się w dodatkowym (czwartym) stanie skupienia - metalicznym.
Aby to zrobić, wystarczy wytworzyć ciśnienie dwóch i pół miliona atmosfer.
Niestety, na razie jest to tylko hipoteza naukowa, ponieważ nikomu nie udało się jeszcze uzyskać „metalicznego wodoru”.
Ze względu na swoją temperaturę ciekły wodór w kontakcie z ludzką skórą może spowodować poważne odmrożenia.
Wodór w układzie okresowym
Rozkład pierwiastków chemicznych w układzie okresowym opiera się na ich masie atomowej, obliczonej w stosunku do masy atomowej wodoru.

Zdjęcie 5. W układzie okresowym wodór ma przypisane ogniwo o numerze seryjnym 1
Przez wiele lat nikt nie był w stanie temu podejściu zaprzeczyć ani potwierdzić.
Wraz z pojawieniem się na początku XX wieku, a zwłaszcza pojawieniem się słynnych postulatów Nielsa Bohra, wyjaśniających budowę atomu z punktu widzenia mechaniki kwantowej, możliwe stało się udowodnienie słuszności hipotezy Mendelejewa.
Dzieje się też odwrotnie: to właśnie zgodność postulatów Nielsa Bohra z prawem okresowym leżącym u podstaw układu okresowego stała się najbardziej przekonującym argumentem na rzecz uznania ich prawdziwości.
Udział wodoru w reakcji termojądrowej
Izotopy wodoru, deuter i tryt, są źródłami niezwykle potężnej energii uwalnianej podczas reakcji termojądrowej.

Fot. 6. Wybuch termojądrowy bez wodoru byłby niemożliwy
Reakcja ta jest możliwa w temperaturach nie niższych niż 1060°C i zachodzi bardzo szybko – w ciągu kilku sekund.
Na Słońcu reakcje termojądrowe zachodzą powoli.
Zadaniem naukowców jest zrozumienie, dlaczego tak się dzieje, aby zdobytą wiedzę wykorzystać do stworzenia nowych – praktycznie niewyczerpalnych – źródeł energii.
Co to jest wodór (wideo):
>