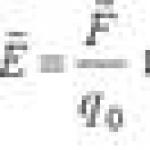Биогенные s-, р-, d- элементы. Биологическая роль и значение их в медицине Лектор ассистент кафедры фармацевтической химии Бурмас Наталья Ивановна
План лекции План лекции 1. Биогенные элементы. Классификация биоэлементов по Вернадскому 2. Свойства и биологическая роль некоторых s-элементов 3. Свойства и биологическая роль некоторых р- элементов 4. Свойства и биологическая роль некоторых d-элементов 5. Биологическая роль воды в организме 1. Биогенные элементы. Классификация биоэлементов по Вернадскому 2. Свойства и биологическая роль некоторых s-элементов 3. Свойства и биологическая роль некоторых р- элементов 4. Свойства и биологическая роль некоторых d-элементов 5. Биологическая роль воды в организме

1. Биогенные элементы. Классификация биоэлементов по Вернадскому. 1. Биогенные элементы. Классификация биоэлементов по Вернадскому. Л. П. Виноградов считал, что концентрация элементов в живом веществе прямо пропорциональна его содержанию в среде обитания с учетом растворимости их соединений. По мнению А. П. Виноградова химический состав организма определяется составом окружающей среды. Биосфера содержит 100 млрд тонн живого вещества. Около 50% массы земной коры приходится на кислород, более 25% на кремний. Восемнадцать элементов (О, Si, Al, Fe, Ca. Na, К, Mg, H, Ti, С, Р, N, S, Cl, F, Мn, Ва) составляют 99,8% массы земной коры.


Содержание некоторых элементов в организме по сравнению с окружающей средой повышенное – это называют биологическим концентрированием элемента. Например, углерода в земной коре 0,35%, а по содержанию в живых организмах занимает второе место (21%). Однако эта закономерность наблюдается не всегда. Так, кремния в земной коре 27,6%, а в живых организмах его мало, алюминия – 7,45%, а в живых организмах -1·10 -5 %. В составе живого вещества найдено более 70 элементов. Элементы необходимые организму для построения и жизнедеятельности клеток и органов, называют биогенными элементами. Содержание некоторых элементов в организме по сравнению с окружающей средой повышенное – это называют биологическим концентрированием элемента. Например, углерода в земной коре 0,35%, а по содержанию в живых организмах занимает второе место (21%). Однако эта закономерность наблюдается не всегда. Так, кремния в земной коре 27,6%, а в живых организмах его мало, алюминия – 7,45%, а в живых организмах -1·10 -5 %. В составе живого вещества найдено более 70 элементов. Элементы необходимые организму для построения и жизнедеятельности клеток и органов, называют биогенными элементами.

Классификация биоэлементов по Вернадскому. Существует несколько классификаций биогенных элементов: А) По их функциональной роли: 1) органогены, в организме их 97,4% (С, Н, О, N, Р, S), 2) элементы электролитного фона (Na, К, Ca, Mg, Сl). Данные ионы металлов составляют 99% общего содержания металлов в организме; 3) Микроэлементы – это биологически активные атомы центров ферментов, гормонов (переходные металлы). Б) По концентрации элементов в организме биогенные элементы делят: Б) По концентрации элементов в организме биогенные элементы делят: 1) макроэлементы; 2) микроэлементы; 3) ультрамикроэлементы.

Биогенные элементы, содержание которых превышает 0,01% от массы тела, относят к макроэлементам. К ним отнесены 12 элементов: органогены, ионы электролитного фона и железо. Еще более поразительно, что 99% живых тканей содержат только шесть элементов: С, Н, О, N, Р, Ca. Биогенные элементы, содержание которых превышает 0,01% от массы тела, относят к макроэлементам. К ним отнесены 12 элементов: органогены, ионы электролитного фона и железо. Еще более поразительно, что 99% живых тканей содержат только шесть элементов: С, Н, О, N, Р, Ca. Элементы К, Na, Mg, Fe, Сl, S относят к олигобиогенным элементам. Содержание их колеблется от 0,1 до 1%. Элементы К, Na, Mg, Fe, Сl, S относят к олигобиогенным элементам. Содержание их колеблется от 0,1 до 1%. Биогенные элементы, суммарное содержание которых составляет величину порядка 0,01%, относят к микроэлементам. Содержание каждого из них 0,001% (10-3 – 10-5%). Большинство микроэлементов содержится в основном в тканях печени. Это депо микроэлементов. Биогенные элементы, суммарное содержание которых составляет величину порядка 0,01%, относят к микроэлементам. Содержание каждого из них 0,001% (10-3 – 10-5%). Большинство микроэлементов содержится в основном в тканях печени. Это депо микроэлементов. Элементы, содержание которых меньше чем %, относят к ультрамикроэлементам. Данные о количестве и биологической роли многих элементов невыяснены до конца.


Таблица 1. Суточное поступление химических элементов в организм человека Химический элементСуточное потребление, в мг ВзрослыеДети Калий Натрий Кальций Магний Цинк155 Железо Марганец2-51,3 Медь1,5-3,01,0 Титан0,850,06 Молибден0,075-0,250- Хром0,05-0,200,04 КобальтОколо 0,2 витамин B 12 0,001 Хлор РО SO – Йод0,150,07 Селен0,05-0, 07– Фтор1,5-4,00, 6

2. Свойства и биологическая роль некоторых s-элементов. Биогенные элементы подразделяют на три блока: s-, р-, d– блоки. Химические элементы, в атомах которых заполняются электронами, s-подуровень внешнего уровня, называют s-элементами. Строение их валентного уровня ns¹-². Небольшой заряд ядра, большой размер атома способствуют тому, что атомы s-элементов – типичные активные металлы; показателем этого является невысокий потенциал их ионизации. Биогенные элементы подразделяют на три блока: s-, р-, d– блоки. Химические элементы, в атомах которых заполняются электронами, s-подуровень внешнего уровня, называют s-элементами. Строение их валентного уровня ns¹-². Небольшой заряд ядра, большой размер атома способствуют тому, что атомы s-элементов – типичные активные металлы; показателем этого является невысокий потенциал их ионизации.

Натрий (Na) - один из основных элементов, участвующих в минеральном обмене животных и человека. Содержится главным образом во внеклеточных жидкостях (в эритроцитах человека около 10 ммоль/кг, в сыворотке крови 143 ммоль/кг); участвует в поддержании осмотического давления и кислотно- щелочного равновесия, в проведении нервных импульсов. Суточная потребность человека в хлористом натрии колеблется от 2 до 10г и зависит от количества этой соли, теряемой с потом. Концентрация ионов натрия в организме регулируется в основном гормоном коры надпочечников - альдостероном.

Применение соединений натрия в медицине. 1) Гипертонический раствор натрия хлора. В следствии большого астматического давления обезвоживает клетки и способствует плазмолизу бактерий. В следствии большого астматического давления обезвоживает клетки и способствует плазмолизу бактерий. Такой раствор применяют наружно при лечении гнойных ран, Такой раствор применяют наружно при лечении гнойных ран, воспалительных процессов полости рта и обширных ожогах. воспалительных процессов полости рта и обширных ожогах. 2) Пероксид натрия. Применяют в замкнутых объектах. Применяют в замкнутых объектах. 3) Натрий гидрокарбонат В водном растворе в результате гидролиза по аниону возникает слабо щелочная В водном растворе в результате гидролиза по аниону возникает слабо щелочная среда,которая оказывает антимикробное действие. среда,которая оказывает антимикробное действие. Применяют для понижения кислотности и для нейтрализации кислот Применяют для понижения кислотности и для нейтрализации кислот попавших на кожу. Также его используют как отхаркивающее средство в микстурах. попавших на кожу. Также его используют как отхаркивающее средство в микстурах.


Калий (K) - один из биогенных элементов, постоянная составная часть растений и животных. Суточная потребность в калие у взрослого человека (2-3 г) покрывается за счёт мяса и растительных продуктов; у грудных детей потребность в калие (30 мг/кг) полностью покрывается грудным молоком, в котором мг% К. Многие морские организмы извлекают калий из воды. Растения получают калий из почвы. У животных содержание калия составляет в среднем 2,4 г/кг. В отличие от натрия, калий сосредоточен главным образом в клетках, во внеклеточной среде его много меньше.

Натрий и калий Натрий и калий функционируют в паре. Скорость диффузии ионов Na +, и K + через мембрану в покое мала, разность их концентрации вне клетки и внутри должна была выровняться, если бы в клетке не существовало натрий – калиевого насоса, который обеспечивает выведение из протоплазмы проникающих в неё ионов натрия и введение ионов калия. Источником энергии для работы насоса является расщепление фосфорных соединений – АТФ, которое происходит под влиянием фермента – аденозинтрифосфатазы. Торможение активности этого фермента приводит к нарушению работы насоса. По мере старения организма градиент концентрации ионов калия и натрия на границе клеток падает, а при наступление смерти выравнивается. Соль - NaCl

Кальций (Ca) - превалирующий катион организма, минеральный компонент скелета, макроэлемент с множеством физиологических функций. 99% кальция организма содержится в костях скелета и зубах в виде гидроксиапатитов - соединений кальция с фосфатами. Лишь около 1% кальция находится в крови и дру гих биологических жидкостях организма. Концентрация цитоплазматического кальция составляет менее 1/1000 от содержания его во внеклеточной жидкости. 99% кальция организма содержится в костях скелета и зубах в виде гидроксиапатитов - соединений кальция с фосфатами. Лишь около 1% кальция находится в крови и дру гих биологических жидкостях организма. Концентрация цитоплазматического кальция составляет менее 1/1000 от содержания его во внеклеточной жидкости.


Магний (Mg) Магний (Mg) Суточная потребность человека в магние - 0,3-0,5 г; в детском возрасте, а также при беременности и лактации эта потребность выше. Нормальное содержание магния в крови - примерно 4,3 мг%; при повышенном содержании наблюдаются сонливость, потеря чувствительности, иногда паралич скелетных мышц. В организме магний накапливается в печени, затем значительная его часть переходит в кости и мышцы. В мышцах магний участвует в активировании процессов анаэробного обмена углеводов.

3. Свойства и биологическая роль некоторых р- элементов Фосфор (P) - один из важнейших биогенных элементов, необходимый для жизнедеятельности всех организмов. Присутствует в живых клетках в виде орто- и пирофосфорной кислот и их производных, а также входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, фосфорных эфиров углеводов, многих коферментов и др. органических соединений. Биологическая роль фосфора: необходим для нормального функционирования почек способствует росту и восстановлению организма нормализует обмен веществ важен для хорошей работы сердца является источником энергии способствует делению клеток регулирует кислотно-щелочной баланс активизирует действие витаминов уменьшает боли при артритах укрепляет зубы, десна и костную ткань участвует в регуляции нервной системы


Сера (S) Сера (S) В виде органических и неорганических соединений сера постоянно присутствует во всех живых организмах и является важным биогенным элементом. Биологическая роль серы определяется тем, что она входит в состав широко распространённых в живой природе соединений: аминокислот (метионин, цистеин), и следовательно белков и пептидов; коферментов (кофермент А, липоевая кислота), витаминов (биотин, тиамин), глутатиона и другие Сульфгидрильные группы (- SH) остатков цистеина играют важную роль в структуре и каталитическая активности многих ферментов. Образуя дисульфидные связи (- S - S -) внутри отдельных полипептидных цепей и между ними, эти группы участвуют в поддержании пространственной структуры молекул белков. В организме среднего человека (масса тела 70 кг) содержится около 1402 г серы. Суточная потребность взрослого человека в сере около 4. В виде органических и неорганических соединений сера постоянно присутствует во всех живых организмах и является важным биогенным элементом. Биологическая роль серы определяется тем, что она входит в состав широко распространённых в живой природе соединений: аминокислот (метионин, цистеин), и следовательно белков и пептидов; коферментов (кофермент А, липоевая кислота), витаминов (биотин, тиамин), глутатиона и другие Сульфгидрильные группы (- SH) остатков цистеина играют важную роль в структуре и каталитическая активности многих ферментов. Образуя дисульфидные связи (- S - S -) внутри отдельных полипептидных цепей и между ними, эти группы участвуют в поддержании пространственной структуры молекул белков. В организме среднего человека (масса тела 70 кг) содержится около 1402 г серы. Суточная потребность взрослого человека в сере около 4.

Дефицит Серы При недостатке Серы наблюдаются: тахикардия, нарушения функций кожи, выпадение волос, запоры, в тяжелых случаях - жировая дистрофия печени, кровоизлияние в почки, нарушения углеводного обмена и белкового обмена, перевозбуждение нервной системы, раздражительность и другие невротические реакции. Кроме того, недостаточность Серы может вызвать болезненность суставов, высокий уровень сахара и высокий уровень триглицеридов в крови. При недостатке Серы наблюдаются: тахикардия, нарушения функций кожи, выпадение волос, запоры, в тяжелых случаях - жировая дистрофия печени, кровоизлияние в почки, нарушения углеводного обмена и белкового обмена, перевозбуждение нервной системы, раздражительность и другие невротические реакции. Кроме того, недостаточность Серы может вызвать болезненность суставов, высокий уровень сахара и высокий уровень триглицеридов в крови.

Препараты, содержащие иод, обладают антибактериальными и противогрибковыми свойствами, она оказывают также противовоспалительное и отвлекающее действие; их применяют наружно для обеззараживания ран, подготовки операционного поля. При приёме внутрь препараты иода оказывают влияние на обмен веществ, усиливают функцию щитовидной железы. Малые дозы иода (микроиод) тормозят функцию щитовидной железы, действуя на образование тиреотропного гормона передних долей гипофиза. Поскольку иод влияет на белковый и жировой (липидный) обмен, он нашёл применение при лечении атеросклероза, так как снижает содержание холестерина в крови; повышает также фибринолитическую активность крови. Для диагностических целей используют рентгеноконтрастные вещества, содержащие иод.

Хлор - один из биогенных элементов, постоянный компонент тканей растений и животных. Содержание хлора. в растениях (много хлора. в галофитах) - от тысячных долей процента до целых процентов, у животных - десятые и сотые доли процента. Суточная потребность взрослого человека в хлоре. (2-4 г) покрывается за счёт пищевых продуктов. С пищей хлор поступает обычно в избытке в виде хлорида натрия и хлорида калия. Особенно богаты хлором хлеб, мясные и молочные продукты. В организме животных хлор - основное осмотически активное вещество плазмы крови, лимфы, спинномозговой жидкости и некоторых тканей. Играет роль в водно-солевом обмене, способствуя удержанию тканями воды. Хлор - один из биогенных элементов, постоянный компонент тканей растений и животных. Содержание хлора. в растениях (много хлора. в галофитах) - от тысячных долей процента до целых процентов, у животных - десятые и сотые доли процента. Суточная потребность взрослого человека в хлоре. (2-4 г) покрывается за счёт пищевых продуктов. С пищей хлор поступает обычно в избытке в виде хлорида натрия и хлорида калия. Особенно богаты хлором хлеб, мясные и молочные продукты. В организме животных хлор - основное осмотически активное вещество плазмы крови, лимфы, спинномозговой жидкости и некоторых тканей. Играет роль в водно-солевом обмене, способствуя удержанию тканями воды.

Наибольшее содержание брома отмечают в мозговом веществе почек, щитовидной железе, ткани головного мозга, гипофизе. Бром входит в состав желудочного сока, влияя (наряду с хлором) на его кислотность. Суточная потребность в броме составляет 0,5-2 мг. Введённые в организм животных и человека бромиды усиливают концентрацию процессов торможения в коре головного мозга, содействуют нормализации состояния нервной системы, пострадавшей от перенапряжения тормозного процесса. Одновременно, задерживаясь в щитовидной железе, бром вступает в конкурентные отношения с йодом, что влияет на деятельность железы, а в связи с этим - и на состояние обмена веществ.

Фтор (F) постоянно входит в состав животных и растительных тканей; микроэлемент. В виде неорганических соединений содержится главным образом в костях животных и человека мг/кг; особенно много фтора. в зубах. Поступает в организм животных и человека преимущественно с питьевой водой, оптимальное содержание фтора в которой 1-1,5 мг/л. При недостатке фтора у человека развивается кариес зубов, при повышенном поступлении - флюороз. Фтор (F) постоянно входит в состав животных и растительных тканей; микроэлемент. В виде неорганических соединений содержится главным образом в костях животных и человека мг/кг; особенно много фтора. в зубах. Поступает в организм животных и человека преимущественно с питьевой водой, оптимальное содержание фтора в которой 1-1,5 мг/л. При недостатке фтора у человека развивается кариес зубов, при повышенном поступлении - флюороз. Высокие концентрации ионов фтора опасны ввиду их способности к ингибированию ряда ферментативных реакций, а также к связыванию важных в биологическом отношении элементов (Р, Ca, Mg и др.), нарушающему их баланс в организме.

Самая высокая концентрация селена регистрируется в миокарде, печени, почках, гипофизе и скелетных мышцах. Содержание селена в крови отображает его уровень в организме и колеблется в среднем от 100 до 130 мкг / л. Самая высокая концентрация селена регистрируется в миокарде, печени, почках, гипофизе и скелетных мышцах. Содержание селена в крови отображает его уровень в организме и колеблется в среднем от 100 до 130 мкг / л. Селен оказывает на организм антигистаминное, антиаллергенно, антитератогенно, антиканцерогенное, радиопротекторное, детоксикационную и другие действия. Микроэлемент тормозит старение организма, поддерживает эластичность тканей, участвует в детоксикации солей тяжелых металлов (кадмия, ртути, мышьяка, свинца, никеля), хлорорганических соединений, элементного фосфора и инсулина. Соединения микроэлемента повышают светочувствительность сетчатки глаза, стимулируют активность неспецифических факторов иммунитета. С дефицитом селена в организме связывают патогенез атеросклероза, панкреатита, артрита, гематозу, других заболеваний.

4. Свойства и биологическая роль некоторых d-элементов В организме здорового человека содержится приблизительно 4-5 граммов железа. Железо (Fe) выполняет в организме такие функции: участвует в процессах кроветворения и внутриклеточного обмена участвует в процессах кроветворения и внутриклеточного обмена необходимо для образования гемоглобина и миоглобина необходимо для образования гемоглобина и миоглобина обеспечивает транспортировку кислорода в организме обеспечивает транспортировку кислорода в организме нормализует работу щитовидной железы нормализует работу щитовидной железы влияет на метаболизм витаминов группы В влияет на метаболизм витаминов группы В входит в состав некоторых ферментов (в том числе рибонуклеотид-редуктаз, который участвует в синтезе ДНК) входит в состав некоторых ферментов (в том числе рибонуклеотид-редуктаз, который участвует в синтезе ДНК) необходимо для процессов роста организма необходимо для процессов роста организма регулирует иммунитет (обеспечивает активность интерферона и клеток-киллеров) регулирует иммунитет (обеспечивает активность интерферона и клеток-киллеров) оказывает детоксикационное действие (входит в состав печени и принимает участие в обезвреживании токсинов) оказывает детоксикационное действие (входит в состав печени и принимает участие в обезвреживании токсинов) является компонентом многих окислительных ферментов является компонентом многих окислительных ферментов предупреждает развитие анемии предупреждает развитие анемии улучшает состояние кожи, ногтей, волос улучшает состояние кожи, ногтей, волос

Гемоглобин - сложный белок, который содержит и небелковую гемм-группу (около 4% массы гемоглобина). Гемм представляет собой комплекс железа (II) с макроциклическим лигандом - порфирином и имеет плоское строение. В этом комплексе атом железа связанный с четырьмя атомами азота - донорами макрокольца так, что атом железа находится в центре этого порфиринового кольца. Пятая связь атома железа образует с атомом азота имидазольной группы гистидина - аминокислотного остатка глобина

Медь (Cu) Взрослому человеку достаточно 2 мг меди в день. В организме медь концентрируется в костях и мышцах, в мозге, крови, почках и печени. Биологическая роль меди: - принимает активное участие в построении многих необходимых нам белков и ферментов, а также в процессах роста и развития клеток и тканей; - снабжения клеток всеми веществами, необходимыми для нормального обмена; - вместе с аскорбиновой кислотой медь поддерживает иммунную систему в активном состоянии; - способность меди уничтожать возбудителей заболеваний.

Цинк (Zn) Биологическая роль цинка: * иммуностимулирующее * Регуляция уровня мужских половых гормонов * Хорошее протекание беременности * Улучшение качества зрения * Регуляция функций нервной системы. * Нормализация процессов пищеварения * Антиоксидантная * Нормализация уровня сахара в крови Содержится в: * Устрицы, креветки, сельдь, макрель, * Мясо, говяжья печень, мясо птицы, молоко, сыр, яйца * Семена тыквы, подсолнечника, бобовые, грибы, овсяная и гречневая крупы, грецкий орехи, чеснок, цветная и кочанная капуста, спаржа, чеснок, картофель, свекла, морковь, * Яблоки, груши, сливы, вишня Суточная потребность: мг

* участвует в процессе кроветворения, образовании эритроцитов, участвует в усвоении железа; * нормализует обмен веществ, способствует восстановлению клеток; * стимулирует рост костной ткани; * имеет антиатеросклеротическое и иммуностимулирующее действие; * предотвращает обострение нервных заболеваний.

Витамин В 12 (цианокобаламин) Витамин В12 предотвращает появление анемии, важен для нормального роста и улучшения аппетита, усиливает иммунитет, играет важную роль в регуляции функции кроветворных органов, увеличивает энергию, поддерживает нервную систему в здоровом состоянии, улучшает концентрацию, память и равновесие, снижает раздражительность. Цианокобаламин является одним из веществ, необходимых для здоровья репродуктивных органов мужчин и женщин, так, он способен корректировать снижение содержания сперматозоидов в семенной жидкости.

Марганец (Mn) Суточная потребность взрослого организма составляет 3– 5 мг Mn. Биологическая роль марганца: - участвует в основных нейрохимических процессах в центральной нервной системе; - участвует в образовании костной и соединительной тканей; - участвует в регуляции жирового и углеводного обмена, обмене витаминов С, Е, холина и витаминов группы В; - оказывает влияние на процессы кроветворения и иммунную защиту кроветворения и иммунную защиту организма. организма.

5. Биологическая роль воды в организме В целом организм человека состоит на 86-50% из воды (86% у новорожденного и 50% в старческом организме). * В качестве наполнителя - вода поддерживает не только внешнюю форму отдельных органов и внешний вид человека в целом, но и обеспечивает нормальное их функционирование. * Как универсальный растворитель - вода растворяет питательные вещества для их проникновения в клетку, участвует в химических процессах при пищеварении, а также вымывает продукты жизнедеятельности и выходит из организма через почки и кожу, унося с собой вредные вещества. * Вода проявляет и терморегулирующие свойства - поддерживает необходимую температуру тела. * Транспортная функция воды осуществляется благодаря ее высокому поверхностному благодаря ее высокому поверхностному натяжению. натяжению.

Жесткость воды Жесткость воды определяется наличием в ней растворимых солей, в основном сульфатов и бикарбонатов кальция, магния, железа. Жесткость воды выражают в градусах. Один градус жесткости соответствует мг-екв/л, что в перерасчете на СаО и MgО составляет 10 и 7.2мг/л соответственно. Жесткость воды, обусловленная гидрокарбонатами Са(ІІ), Mg(II), Fe(II), называется временной жесткостью. Временная твердость устраняется кипячением: гидрокарбонаты превращаются в средние карбонаты: М(НСО 3) 2 МСО 3 + СО 2 + Н 2 О и выпадают в осадок. В результате этого содержание солей в воде снижается. Если повысить рН воды, добавив щелочной реагент (Na 2 CO 3 або Ca(OH) 2) наблюдается тот же эффект.

Постоянную жесткость воды не возможно устранить простым кипячением воды; она обусловлена присутствием относительно хорошо растворимых сульфатов, силикатов, хлоридов, которые не разрушаются при кипячении. Для устранения постоянной жесткости воды разработаны разные методы, например: СaSO 4 + Na 2 CO 3 CaCO 3 + Na 2 SO 4.

Дайте пожалуйста ответы на данные вопросы: 1. Какие элементы называются биогенными? 2. Какие химические элементы относятся к s-, p-, d-элементам? 3. Какая биологическая роль железа в организме? 4. Какая биологическая роль воды в организме? Ваши ответы присылайте на данный Ваши ответы присылайте на данный

БИОХИМИЯ ПИТАНИЯ
Пептиды
Имеют в своем составе от трех до нескольких десятков аминокислотных остатков. Функционируют только в высших отделах нервной системы.
Эти пептиды, как и катехоламины, выполняют функцию не только нейромедиаторов, но и гормонов. Передают информацию от клетки к клетке по системе циркуляции. Сюда относятся:
а) Нейрогипофизарные гормоны (вазопрессин, либерины, статины). Эти вещества одновременно и гормоны и медиаторы.
б) Гастроинтестинальные пептиды (гастрин, холецистокинин). Гастрин вызывает чувство голода, холецистокинин вызывает чувство насыщения, а также стимулирует сокращение желчного пузыря и функцию поджелудочной железы.
в) Опиатоподобные пептиды (или пептиды обезболивания). Образуются путем реакций ограниченного протеолиза белка-предшественника проопиокортина. Взаимодействуют с теми же рецепторами, что и опиаты (например, морфин), тем самым имитируют их действие. Общее название - эндорфины - вызывают обезболивание. Они легко разрушаются протеиназами, поэтому их фармакологический эффект незначителен.
г) Пептиды сна. Их молекулярная природа не установлена. Известно лишь, что их введение животным вызывает сон.
д) Пептиды памяти (скотофобин). Накапливается в мозге крыс при тренировке на избегание темноты.
е) Пептиды - компоненты РААС-системы. Показано, что введение ангиотензина-II в центр жажды головного мозга вызывает появление этого ощущения и стимулирует секрецию антидиуретического гормона.
Образование пептидов происходит в результате реакций ограниченного протеолиза, разрушаются также под действием протеиназ.
Полноценное питание должно содержать:
1. ИСТОЧНИКИ ЭНЕРГИИ (УГЛЕВОДЫ, ЖИРЫ, БЕЛКИ).
2. НЕЗАМЕНИМЫЕ АМИНОКИСЛОТЫ.
3. НЕЗАМЕНИМЫЕ ЖИРНЫЕ КИСЛОТЫ.
4. ВИТАМИНЫ.
5. НЕОРГАНИЧЕСКИЕ (МИНЕРАЛЬНЫЕ) КИСЛОТЫ.
6. КЛЕТЧАТКУ
ИСТОЧНИКИ ЭНЕРГИИ.
Углеводы, жиры и белки являются макропитательными веществами. Их потребление зависит от роста, возраста и пола человека и определяется в граммах.
Углеводы составляют основной источник энергии в питании человека - самая дешевая пища. В развитых странах около 40% потребления углеводов приходится на рафинированные сахара, а 60% составляет крахмал. В менее развитых странах доля крахмала возрастает. За счет углеводов образуется основная часть энергии в организме человека.
Жиры - это один из основных источников энергии. Перевариваются в желудочно-кишечном тракте (ЖКТ) гораздо медленнее, чем углеводы, поэтому лучше способствуют возникновению чувства сытости. Триглицериды растительного происхождения являются не только источником энергии, но и незаменимымых жирных кислот: линолевой и линоленовой.
Белки - энергетическая функция не является для них основной. Белки - это исочники незаменимых и заменимых аминокислот, а также предшественники биологически активных веществ в организме. Однако при окислении аминокислот образуется энергия. Хотя она и невелика, но составляет некоторую часть энергетического рациона.
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru
Реферат на тему:
«Биохимические составляющие жизни»
Введение
Современная химия представляет собой широкий комплекс наук, постепенно сложившийся в ходе ее длительного исторического развития. Практическое знакомство человека с химическими процессами восходит к глубокой древности. В течение многих столетий теоретическое объяснение химических процессов основывалось на натурфилософском учении об элементах-качествах. В модифицированном виде оно послужило основой для алхимии, возникшей примерно в III-IV вв. н.э. и стремившейся решить задачу превращения неблагородных металлов в благородные. Не добившись успеха в решении этой задачи, алхимики, тем не менее, выработали ряд приемов исследования веществ, открыли некоторые химические соединения, чем в определенной степени способствовали возникновению научной химии.
Химический взгляд на природу, истоки и современное состояние
Химия активно интегрируется с остальными науками, результатом чего было появление биохимии, молекулярной биологии, космохимии, геохимии, биогеохимии. Первые изучают химические процессы в живых организмах, геохимия - закономерности поведения химических элементов в земной коре. Биогеохимия - это наука о процессах перемещения, распределения, рассеяния и концентрации химических элементов в биосфере при участии организмов. Основоположником биогеохимии является В.И. Вернадский. Космохимия изучает химический состав вещества во Вселенной, его распространенность и распределение по отдельным космическим телам.
Резкое укрепление взаимосвязи химии с биологией произошло в результате создания А.М.
Бутлеровым теория химического строения органических соединений. Руководствуясь этой теорией, химики-органики вступили в соревнование с природой. Последующие поколения химиков проявили большую изобретательность, труд, фантазию и творческий поисках направленном синтезе вещества.
Поступательное развитие науки XIX в., приведшее к раскрытию структуры атома и детальному познанию строения и состава клетки, открыло перед химиками и биологами практические возможности совместной работы над химическими проблемами учения о клетке, над вопросами о характере химических процессов в живых тканях, об обусловленности биологических функций химическими реакциями.
Если посмотреть на обмен веществ в организме с чисто химической точки зрения, как это сделал А.И. Опарин, мы увидим совокупность большого числа сравнительно простых и однообразных химических реакций, которые сочетаются между добей во времени, протекают не случайно, а в строгой последовательности, в результате чего образуются длинные цепи реакций. И этот порядок закономерно направлен, к постоянному самосохранению и самовоспроизведению всей живой системы в целом в данных условиях окружающей среды.
Словом, такие специфические свойства живого, как рост, размножение, подвижность, возбудимость, способность реагировать на изменения внешней среды, связаны с определенными комплексами химических превращений.
Значение химии среди наук, изучающих жизнь, исключительно велико. Именно химией выявлена важнейшая роль хлорофилла как химической основы фотосинтеза, гемоглобина как основы процесса дыхания, установлена химическая природа передачи нервного возбуждения, определена структура нуклеиновых Кислот и т.д. Но главное заключается в том, что объективно в самой основе биологических процессов, функций живого лежат химические механизмы. Все функции и процессы, происходящие в живом организме, оказывается возможным изложить на языке химии, в виде конкретных химических процессов.
Разумеется, было бы неверным сводить явления жизни к химическим процессам. Это было бы грубым механистическим упрощением. И ярким свидетельством этого выступает специфика химических процессов в живых системах по сравнению с неживыми. Изучение этой специфики раскрывает единство и взаимосвязь химической и биологической форм движения материи. Об этом же говорят и другие науки, возникшие на стыке биологии, химии и физики: биохимия - наука об обмене веществ и химических процессов в живых организмах; биоорганическая химия - наука о строении, функциях и путях синтеза соединений, составляющих живые организмы; физико-химическая биология как наука о функционировании сложных систем передачи информации и регулировании биологических процессов на молекулярном уровне, а также биофизика, биофизическая химия и радиационная биология.
Крупнейшими достижениями этого процесса стали определение химических продуктов клеточного метаболизма (обмена веществ в растениях, животных, микроорганизмах), установление биологических путей и циклов биосинтеза этих продуктов; был реализован их искусственный синтез, сделано открытие материальных основ регулятивного и наследственного молекулярного механизма, а также в значительной степени выяснено значение химических процессов» энергетике процессов клетки и вообще живых организмов.
Сейчас для химии особенно важным становится применение биологических принципов, в которых сконцентрирован опыт приспособления живых организмов к условиям Земли в течение многих миллионов лет, опыт создания наиболее совершенных механизмов и процессов. На этом пути есть уже определенные достижения.
Более столетия назад ученые поняли, что основой исключительной эффективности биологических процессов является биокатализ. Поэтому химики ставят своей целью создать новую химию, основанную на каталитическом опыте живой природы. В ней появится новое управление химическими процессами, где начнут применяться принципы, синтеза себе подобных молекул, по принципу ферментов будут созданы катализаторы с таким разнообразием качеств, которые далеко превзойдут существующие в нашей промышленности.
Несмотря на то, что ферменты обладают общими свойствами, присущими всем катализаторам, тем не менее, они не тождественны последним, поскольку функционируют в рамках живых систем. Поэтому все попытки использовать опыт живой природы для ускорения химических процессов в неорганическом мире сталкиваются с серьезными ограничениями. Пока речь может идти только о моделировании некоторых функций ферментов и использовании этих моделей для теоретического анализа деятельности живых систем, а также частично-практического применения выделенных ферментов для ускорения некоторых химических реакций.
Здесь самым перспективным направлением, очевидно, являются исследования, ориентированные на применение принципов биокатализа в химии и химической технологии, для чего нужно изучить весь каталитический опыт живой природы, в том числе и опыт формирования самого фермента, клетки и даже организма.
Теория саморазвития элементарных открытых каталитических систем, в самом общем виде выдвинутая профессором МГУ А.П. Руденко в 1964 г., является общей теорией химической эволюции и биогенеза. Она решает вопросы о движущих силах и механизмах эволюционного процесса, то есть о законах химической эволюции, об отборе элементов и структур и их причинной обусловленности, о высоте химической организации и иерархии химических систем как следствии эволюции.
Теоретическим ядром этой теории является положение о том, что химическая эволюция представляет собой саморазвитие каталитических систем и, следовательно, эволюционирующим веществом являются катализаторы. В ходе реакции происходит естественный отбор тех каталитических центров, которые обладают наибольшей активностью. Саморазвитие, самоорганизация я самоусложнение каталитических систем происходит за счет постоянного притока трансформируемой энергии. А так как основным источником энергии является базисная реакция, то максимальные эволюционные преимущества получают каталитические системы, развивающиеся на базе экзотермических реакций. Отсюда базисная реакция является не только источником энергии, но и орудием отбора наиболее прогрессивных эволюционных изменений катализаторов.
Развивая эти взгляды, А.П. Руденко сформулировал основной закон химической эволюции, согласно которому с наибольшей скоростью и вероятностью образуются те пути эволюционных изменений катализатора, на которых происходит максимальное увеличение его абсолютной активности.
Практическим следствием теории саморазвития открытых каталитических систем является так называемая «нестационарная технология», то есть технология с меняющимися условиями реакции. Сегодня исследователи приходят к выводу, что стационарный режим, надежная стабилизация которого казалась залогом высокой эффективности промышленнoro процесса, является лишь частным случаем нестационарного режима. При этом обнаружено множество нестационарных режимов, способствующих интенсификации реакции.
В настоящее время уже видны перспективы возникновения и развития новой химии, на основе которой будут созданы малоотходные, безотходные и энергосберегающие промышленные технологии.
Сегодня химики пришли к выводу, что, используя те же принципы, на которых построена химия организмов, в будущем (не повторяя в точности природу) можно будет построить принципиально новую химию, новое управление химическими, процессами, где начнут применяться принципы синтеза себе подобных молекул. Предвидится создание преобразователей, использующих с большим КПД солнечный свет, превращая его в химическую и электрическую энергию, а также химическую энергию в свет большой интенсивности.
Для освоения каталитического опыта живой природы и реализации полученных знаний в промышленном производстве химики наметили рад перспективных путей.
Первый - развитие исследований в области металлокомплексного катализа с ориентацией на соответствующие объекты живой природы. Этот катализ обогащается приемами, которыми пользуются живые организмы в ферментативных реакциях, а также способами классического гетерогенного катализа.
Второй путь заключается в моделировании биокатализаторов. В настоящее время за счет искусственного отбора структур удалось построить модели многих ферментов характеризующихся высокой активностью и селективностью, иногда" почти такой же, как и у оригиналов, или с большей простотой строения.
Правда, пока все же полученные модели не в состоянии заменить природные биокатализаторы живых систем. На данном этапе развития химических знании проблема эта решается чрезвычайно сложно. Фермент выделяется из живой системы, определяется его структура, он вводится в реакцию для осуществления каталитических функций. Но работает непродолжительное время и быстро разрушается, поскольку является выделенным из целого, из клетки. Цельная клетка со всем ее ферментным аппаратом - более важный объект, чем одна, выделенная из нее деталь.
Третий путь к освоению механизмов лаборатории живей природы связывается с достижениями химии иммобилизованных систем. Сущность иммобилизации состоит в закреплении выделенных из живого организма ферментов на твердой поверхности путем адсорбции, которая и превращает их в гетерогенный катализатор и обеспечивает его стабильность и непрерывное действие.
Четвертый путь в развитии исследований, ориентированных на применение принципов биокатализа в химии и химической технологии, характеризуется постановкой самой широкой задачи - изучением и освоением всего каталитического опыта живой природы, в том числе и формирования фермента, клетки и даже организма. Это ступень, на которой основы эволюционной химии как действенной науки с ее рабочими функциями. Ученые утверждают, что это движение химической науки к принципиально новой химической технологии с перспективой создания аналогов живых систем. Решение названной задачи займет важнейшее место в создании химии будущего.
Химические элементы в организме человека
химический биокатализ каталитический элемент
Все живые организмы на Земле, в том числе и человек, находятся в тесном контакте с окружающей средой. Пищевые продукты и питьевая вода способствуют поступлению в организм практически всех химических элементов. Они повседневно вводятся в организм и выводятся из него. Анализы показали, что количество отдельных химических элементов и их соотношение в здоровом организме различных людей примерно одинаковы.
Мнение о том, что в организме человека можно обнаружить практически все элементы периодической системы Д.И. Менделеева, становится привычным. Однако предположения ученых идут дальше - в живом организме не только присутствуют все химические элементы, но каждый из них выполняет какую-то биологическую функцию. Вполне возможно, что эта гипотеза не подтвердится. Однако по мере того как развиваются исследования в данном направлении, выявляется биологическая роль все большего числа химических элементов. Несомненно, время и труд ученых прольют свет и на этот вопрос.
Биоактивность отдельных химических элементов. Экспериментально установлено, что в организме человека металлы составляют около 3% (по массе). Это очень много. Если принять массу человека за 70 кг., то на долю металлов приходится 2,1 кг. По отдельным металлам масса распределяется следующим образом: кальций (1700 г.), калий (250 г.), натрий (70 г.), магнии (42 г.), железо (5 г.), цинк (3 г.). Остальное приходится на микроэлементы. Если концентрация элемента в организме превышает 10 2 %, то его считают макроэлементом. Микроэлементы находятся в организме в концентрациях 10 3 -10 5 % . Если концентрация элемента ниже 10 5 %, то его считают ультрамикроэлементом. Неорганические вещества в живом организме находятся в различных формах. Большинство ионов металлов образуют соединения с биологическими объектами. Уже сегодня установлено, что многие ферменты (биологические катализаторы) содержат ионы металлов. Например, марганец входит в состав 12 различных ферментов, железо - в 70, медь - в 30, а цинк - более чем в 100. Естественно, что недостаток этих элементов должен сказаться на содержании соответствующих ферментов, а значит, и на нормальном функционировании организма. Таким образом, соли металлов совершенно необходимы для нормального функционирования живых организмов. Это подтвердили и опыты по бессолевой диете, которая применялась для кормления подопытных животных. Для этой цели многократным промыванием водой из пищи удаляли соли. Оказалось, что питание такой пищей приводило к гибели животных
Шесть элементов, атомы которых входят в состав белков и нуклеиновых кислот: углерод, водород, азот, кислород, фосфор, сера. Далее следует выделить двенадцать элементов, роль и значение которых для жизнедеятельности организмов известны: хлор, иод, натрий, калий, магний, кальций, марганец, железо, кобальт, медь, цинк, молибден. В литературе имеются указания на проявление биологической активности ванадием, хромом, никелем и кадмием
Имеется большое число элементов, являющихся ядами для живого организма, например ртуть, таллий, свиней и др. Они оказывают неблагоприятное биологическое влияние, но без них организм может функционировать. Существует мнение, что причина действия этих ядов связана с блокированием определенных групп в молекулах протеинов или же с вытеснением из некоторых ферментов меди и цинка. Бывают элементы, которые в относительно больших количествах являются ядом, а в низких концентрациях оказывают полезное влияние на организм. Например, мышьяк является сильным ядом, нарушающим сердечнососудистую систему и поражающим печень и почки, но в небольших дозах он прописывается врачами для улучшения аппетита человека. Ученые считают, что микродозы мышьяка повышают устойчивость организма к действию вредных микробов. Широко известно сильное отравляющее вещество иприт S(СН 2 СН 2 С1) 2 . Однако в разбавленном в 20 000 тыс. раз вазелином под названием «Псориазина» его применяют против чешуйчатого лишая. Современная фармакотерапия пока еще не может обойтись без значительного числа лекарственных средств, в состав которых входят токсичные металлы. Как здесь не вспомнить поговорку, что в малых количествах лечит, а в больших - калечит.
Интересно, что хлорид натрия (поваренная соль) в десятикратном избытке в организме по сравнению с нормальным содержанием является ядом. Кислород, необходимый человеку для дыхания, в высокой концентрации и особенно под давлением оказывает ядовитое действие. Из этих примеров видно, что концентрация элемента в организме иногда играет весьма существенное, а порой и катастрофическое значение.
Железо входит в состав гемоглобина крови, а точнее в красные пигменты крови, обратимо связывающие молекулярный кислород. У взрослого человека в крови содержится около 2,6 г. железа. В процессе жизнедеятельности в организме происходит постоянный распад и синтез гемоглобина. Для восстановления железа, потерянного с распадом гемоглобина, человеку необходимо суточное поступление в организм около 25 мг. Недостаток железа в организме приводит к заболеванию - анемии. Однако избыток железа в организме тоже вреден. С ним связан сидероз глаз и легких - заболевание, вызываемое отложением соединений железа в тканях этих органов. Недостаток в организме меди вызывает деструкцию кровеносных сосудов. Кроме того, считают, что его дефицит служит причиной раковых заболеваний. В некоторых случаях поражение раком легких у людей пожилого возраста врачи связывают с возрастным снижением меди в организме. Однако избыток меди приводит к нарушению психики и параличу некоторых органов (болезнь Вильсона). Для человека вред причиняют лишь большие количества соединений меди. В малых дозах они используются в медицине как вяжущее и бактериостазное (задерживающее рост и размножение бактерий) средство. Так, например, сульфат меди (II) CuSO 4 используют при лечении конъюнктивитов в виде глазных капель (0,25%-ный раствор), а также для прижиганий при трахоме в виде глазных карандашей (сплав сульфата меди (II), нитрата калия, квасцов и камфоры). При ожогах кожи фосфором производят ее обильное смачивание 5%-ным раствором сульфата меди (II).
Давно замечено бактерицидное (вызывающее гибель различных бактерий) свойство серебра и его солей. Например, в медицине раствор коллоидного серебра, (колларгол) применяют для промывания гнойных ран, мочевого пузыря при хронических циститах и уретритах, а также в виде глазных капель при гнойных конъюнктивитах и бленнорее. Нитрат серебра AgNO 3 в виде карандашей применяют для прижигания бородавок, грануляций и т.п. В разбавленных растворах (0,1-0,25%-ные) его используют как вяжущее и противомикробное средство для примочек, а также в качестве глазных капель. Ученые считают, что прижигающее действие нитрата серебра связано с его взаимодействием с белками тканей, что приводит к образованию белковых солей серебра - альбуминатов.
В настоящее время, бесспорно, установлено, что всем живым организмам присуще явление ионной асимметрии - неравномерное распределение ионов внутри и вне клетки. Например, внутри клеток мышечных волокон, сердца, печени, почек имеется повышенное содержание ионов калия по сравнению с внеклеточным. Концентрация ионов натрия, наоборот, выше вне клетки, чем внутри нее. Наличие градиента концентраций калия и натрия - экспериментально установленный факт. Исследователей волнует загадка о природе калий-натриевого насоса и его функционирования. На разрешение этого вопроса направлены усилия многих коллективов ученых, как в нашей стране, так и за рубежом. Интересно, что по мере старения организма градиент концентраций ионов калия и натрия на границе клетки падает. При наступлении смерти концентрация калия и натрия внутри и вне клетки сразу же выравнивается.
Биологическая функция ионов лития и рубидия в здоровом организме пока не ясна. Однако имеются сведения, что введением их в организм удается лечить одну из форм маникально-депрессивного психоза.
Биологам и медикам хорошо известно, что важнуюроль в организме человека играют гликозиды. Некоторые природные гликозиды (извлекаемые из растений) активно действуют на сердечную мышцу, усиливая сократительные функции и замедление ритма сердца. При попадании в организм большого количества сердечного гликозида может произойти полная остановка сердца. Ионы некоторых металлов влияют на действие гликозидов. Например, при введении в кровь ионов магния действие гликозидов на сердечную мышцу ослабляется Ионы кальция, наоборот, усиливают действие сердечных гликозидов
Некоторые соединения ртути также чрезвычайно ядовиты. Известно, что ионы ртути (II) способны прочно соединяться с белками. Ядовитое действие хлорида ртути (II) HgCl 2 (сулемы) проявляется, прежде всего, в некрозе (омертвлении) почек и слизистой оболочки кишечника. В результате ртутного отравления почки теряют способность выделять из крови продукты жизнедеятельности организма.
Интересно, что хлорид ртути (I) Hg 2 Cl 2 (древнее название каломель) безвреден для организма человека. Вероятно, это объясняется чрезвычайно низкой растворимостью соли, в результате чего ионы ртути не попадают в заметных количествах в организм.
Цианистый калий (Цианид калия) KCN - соль синильной кислоты HCN . Оба соединения являются быстродействующими и сильными ядами
При остром отравлении синильной кислотой и ее солями теряется сознание, наступает паралич дыхания и сердца. На начальной стадии отравления человек испытывает головокружение, ощущение давления во лбу, острую головную боль, учащенное дыхание, сердцебиение. Первая помощь при отравлении синильной кислотой и ее солями - свежий воздух, кислородное дыхание, тепло. Противоядиями являются нитрит натрия NaNO 2 и органические нитросоединения: амилнитрит C 5 H 11 ONO и пропилнитрит C 3 H 7 ONO . Считают, что действие нитрита натрия сводится к превращению гемоглобина в мета-гемоглобин. Последний прочно связывает цианидные ионы в цианметагемоглобин. Этим путем дыхательные ферменты освобождаются от цианидных ионов, что и приводит к восстановлению дыхательной функции клеток и тканей.
В качестве противоядий на синильную кислоту широко используют серосодержащие соединения: коллоидную серу, тиосульфат натрия Na 2 S 2 O 3 , тетратионат натрия Na 2 S 4 O 6 , а также серосодержащие органические соединения, в частности, аминокислоты - глутатион, цистеин, цистин. Синильная кислота и ее соли при взаимодействии с серой превращаются в тиоцианаты в соответствии с уравнением
HCN + S > HNCS
Тиоцианаты же совершенно безвредны для человеческого организма.
С давних пор при опасности отравления цианидами рекомендовалось держать за щекой кусочек сахара. В 1915 г. немецкие химики Рупп и Гольце показали, что глюкоза взаимодействует с синильной кислотой и некоторыми цианидами с образованием нетоксичного соединения циангидрина глюкозы:
ОН ОН ОН ОН ОН Н ОН OH OН ОН ОН Н
| | | | | | | | | | | |
СН 2 -СН-СН-СН-СН-С = О + HCN > СН 2 -СН-СН-СН-СН-С-ОН
глюкоза циангидрин глюкозы
Свинец и его соединения являются довольно сильными ядами. В организме человека свинец накапливается в костях, печени и почках.
Весьма токсичны соединения химического элемента таллия, который относят к числу редких.
Следует указать, что все цветные и особенно тяжелые (расположенные в конце периодической системы) металлы в количествах выше допустимых ядовиты.
Углекислый газ в больших количествах содержится в организме человека и потому не может быть ядовитым. За 1 ч взрослый человек выдыхает примерно 20 л (около 40 г.) этого газа. При физической работе количество выдыхаемого углекислого газа увеличивается до 35 л. Он образуется в результате сгорания в организме углеводов и жиров. Однако при большом содержании СО 2 в воздухе наступает удушье из-за недостатка кислорода. Максимальная продолжительность пребывания человека в помещении с концентрацией СО 2 до 20% (по объему) не должна превышать 2 ч. В Италии имеется получившая широкую известность пещера («Собачья пещера»), в которой человек стоя может находиться длительное время, а забежавшая туда собака задыхается и гибнет. Дело в том, что примерно до пояса человека пещера заполнена тяжелым (по сравнению с азотом и кислородом) углекислым газом. Поскольку голова человека находится в воздушном слое, то он не ощущает никаких неудобств. Собака же при ее росте оказывается в атмосфере углекислого газа и потому задыхается.
Врачи и биологи установили, что при окислении в организме углеводов до воды и углекислого газа на одну затраченную молекулу кислорода выделяется одна молекула СО 2 . Таким образом, отношение выделенного СО 2 к поглощенному О 2 (величина дыхательного коэффициента) равна единице. В случае окисления жиров дыхательный коэффициент равен примерно 0,7. Следовательно, определяя величину дыхательного коэффициента, можно судить, какие вещества преимущественно сгорают в организме. Экспериментально установлено, что при кратковременных, но интенсивных мышечных нагрузках энергия получается за счет окисления углеводов, а при длительных - преимущественно за счет сгорания жиров. Полагают, что переключение организма на окисление жиров связано с истощением резерва углеводов, что обычно наблюдается через 5-20 мин после начала интенсивной мышечной работы.
Антидоты
Антидоты - вещества, устраняющие последствия воздействия ядов на биологические структуры и инакгавирующие яды посредством химической
Жёлтая кровяная соль K 4 образует малорастворимые соединения с ионами многих тяжелых металлов. Это свойство используют на практике для лечения отравлений солями тяжелых металлов.
Хорошим антидотом при отравлениях соединениями мышьяка, ртути, свинца, кадмия, никеля, хрома, кобальта и других металлов является унитиол:
СН 2 -СН -CH 2 SO 3 Na Н 2 О
Универсальным антидотом является молоко.
Заключение
Современная биохимия представлена множеством различных направлений развития знаний о природе вещества и способах его преобразования. В то же время химия является не просто суммой знаний о веществах, а высоко упорядоченной, постоянно развивающейся системой знаний, имеющей свое место в ряду других естественных наук.
Химия изучает качественное многообразие материальных носителей химических явлений, химической формы движения материи.
Одним из наиболее существенных объективных оснований выделения химии в качестве самостоятельной естественнонаучной дисциплины является признание специфичности химизма взаимоотношения веществ, проявляющегося, прежде всего, в комплексе сил и различных типов взаимодействий, обусловливающих существование двух- и многоатомных соединений. Этот комплекс принято характеризовать как химическую связь, возникающую либо разрывающуюся в ходе взаимодействия частиц атомного уровня организации материи. Для возникновения химической связи характерно значительное перераспределение электронной плотности по сравнению с простым положением электронной плотности несвязанных атомов или атомных фрагментов, сближенных на расстояние связи. Эта особенность наиболее точно отделяет химическую связь от разного рода проявлений межмолекулярных взаимодействий.
Происходящее ныне неуклонное возрастание в рамках естествознания роли биохимии как науки сопровождается быстрым развитием фундаментальных, комплексных и прикладных исследований, ускоренной разработкой новых материалов с заданными свойствами и новых процессов в области технологии производства и переработки веществ.
Список используемой литературы
1. Большой энциклопедический словарь. Химия. М., 2001.
2. Грушевицкая T.T., Садохин А.П. Концепции современного естествознания. М., 1998.
3. Кузнецов В.И., Идлис ГМ., Гутина В.Н. Естествознание. М., 1996.
4. Химия // Химический энциклопедический словарь. М., 1983.
5. http://n-t.ru/ri/kk/hm16.htm
6. http://www.alhimik.ru/kunst/man"s_elem.html
Размещено на Allbest.ru
Подобные документы
Химический взгляд на природу, истоки и современное состояние. Предмет познания химической науки и ее структура. Взаимосвязь химии и физики. Взаимосвязь химии и биологии. Химия изучает качественное многообразие материальных носителей химических явлений.
реферат , добавлен 15.03.2004
Презентация по химии. Живые системы – найденные в них химические элементы. Тесный контакт живых систем, так же человека, с окружающей средой. Состав организма человека. Нарушения минерального обмена в человеческом организме. Патологические состояния.
презентация , добавлен 24.12.2008
реферат , добавлен 11.10.2011
Основные химические элементы, распространенные в организме человека, характерные признаки и симптомы недостатка некоторых из них. Общее описание свойств йода, его открытие и значение в организме. Порядок определения его недостатка и механизм восполнения.
презентация , добавлен 27.12.2010
Физиологическая роль бериллия в организме человека, его синергисты и антагонисты. Роль магния в организме человека для обеспечения протекания различных жизненных процессов. Нейтрализация избыточной кислотности организма. Значение стронция для человека.
реферат , добавлен 09.05.2014
Физико-химические свойства таллия, агрегатное состояние, давление насыщенных паров, теплота парообразования при нормальных условиях и чувствительность к нагреванию. Пути проникновения и превращения в организме. Источники поступления в окружающую среду.
контрольная работа , добавлен 24.10.2014
Химические свойства металлов, их присутствие в организме человека. Роль в организме макроэлементов (калия, натрия, кальция, магния) и микроэлементов. Содержание макро- и микроэлементов в продуктах питания. Последствия дисбаланса определенных элементов.
презентация , добавлен 13.03.2013
Понятие, общая характеристика и предназначение процесса каталитического риформинга. Химические основы процесса риформинга: превращение алканов, циклоалканов, аренов. Катализаторы и макрокинетика процесса. Промышленные установки каталитического процесса.
курсовая работа , добавлен 13.10.2011
Определение эквивалентной массы металла и соли методом вытеснения водорода. Ход и данные опыта, характеристика приборов. Использование магния в качестве металла, его основные химические свойства. Расчет абсолютной и относительной погрешностей опыта.
лабораторная работа , добавлен 05.05.2013
Низкомолекулярные органические соединения различной химической природы, необходимые для осуществления процессов, протекающих в живом организме. Водорастворимые и жирорастворимые витамины. Суточная потребность человека в витаминах и их основные функции.
Системы биологических (биохимических) элементов
Известно, что построение и функционирование сложных информационных устройств базируется на применении типовых унифицированных узлов и элементов. К примеру, все информационные процессы в цифровой технике основаны на использовании различных типовых логических элементов, выполняющих элементарные логические функции и простейшие действия по преобразованию двоичной информации. Логические элементы служат как для построения электронных схем, так и для переработки двоичной информации. А теоретической основой при анализе переключательных схем являются законы и принципы алгебры логики. В алгебре логики рассматриваются переменные, которые могут принимать только два значения: 1 и 0. В основу типовых структур логических интегральных схем, как правило, закладывают элементы, выполняющие операции - И, ИЛИ, И-НЕ, ИЛИ-НЕ. Все сколь угодно сложные цифровые устройства микроэлектронной техники строятся на базе логических элементов, которые реализуют простейшие логические операции и функции двоичной арифметики. Базовые элементы являются своего рода строительно-функциональными единицами и используются как при проектировании, так и при построении цифровых информационных систем. Они реализуют функционально полный набор логических операций, поэтому при их применении можно получить логическую функцию любой сложности. При этом каждая типовая логическая схема элемента выполнена на основе отдельных дискретных физических компонентов - транзисторов, резисторов, конденсаторов и диодов.
Удивительно, но и при рассмотрении живых молекулярных систем наблюдаются такие же закономерности. Живые молекулярные системы тоже имеют свою унифицированную био-логическую (биохимическую) элементную базу. Поэтому и здесь возможен обобщенный подход, основанный на применении простых органических молекул (мономеров), которые играют роль составных элементов различных биологических молекул и структур. А “теоретической и технологической” основой применения молекулярной базы служат свои универсальные законы и принципы, которые, по соответствующей аналогии, можно отнести к закономерностям “молекулярной биохимической логики”. Биохимическая логика предусматривает и такое понятие как “молекулярный био-логический элемент”. Этот факт лишний раз напоминает нам о том, что любая живая клетка является информационной системой. Поэтому, чтобы понять закономерности её функционирования, - в первую очередь следует разобраться с элементной базой живой формы материи и принципами и правилами её использования. Это основная тема данной статьи.
Известно, что все живые организмы состоят из одних и тех же молекулярных строительных блоков - стандартного набора более чем трёх десятков типовых биохимических (био-логических) элементов: нуклеотидов, аминокислот, простых сахаров, жирных кислот и др. Число этих мономеров невелико, и они имеют одно и то же строение у всех видов организмов. Причем, каждый элемент в отдельности, также представляет собой простейшую схему, структурными компонентами которой могут быть несколько химических элементов - водород, кислород, углерод, азот, фосфор и сера.
А наличие тех или иных типовых функциональных атомных групп, боковых групп и атомов в составе каждого элемента позволяет прогнозировать не только его поведение в химических реакциях, но и предвидеть ту структурно-информационную роль, которую элемент будет играть в составе макромолекулы.
Таким образом, живые системы при построении различных биологических молекул и структур применяют свои особые, сугубо специфические молекулярные элементы. Эти элементы (в составе живой материи) реализуют функционально полный набор элементарных биохимических функций и операций, поэтому при их использовании живая природа может получить био-логическую функцию любой сложности. При этом, естественно, наблюдается как аналогия, так и существенные различия между технической и биологической элементными базами и технологиями их применения.
К примеру, микросхемы технических устройств могут состоять из сотен, тысяч и более логических элементов нескольких типов, соединенных между собой соответствующим образом. Биологические макромолекулы также могут состоять из сотен, тысяч и более биохимических элементов нескольких типов, которые ковалентно соединяются между собой и размещаются в цепях биомолекул в виде линейной позиционной последовательности. Разница также состоит в том, что живые системы используют свои принципы и методы кодирования, передачи и реализации информации, и отличаются от технических систем не только субстратным носителем, но и методами представления информации.
Более того, если логический элемент в цифровой технике является простейшим преобразователем двоичной информации, то каждый био-логический элемент в живой системе сам играет роль элементарной структурной и информационно-функциональной единицы. В технической и биологической системах информационные сообщения осуществляются в различных формах. В технических устройствах используются элементарные сигналы 1 и 0 двоичного кода. То есть для передачи информационных сообщений применяется всего лишь два цифровых символа. Обычно символу 1 соответствует потенциал высокого уровня, символу 0 - низкого. Двоичные коды получили широкое применение главным образом из-за сравнительно простой аппаратурной реализации логических операций и арифметических действий, а также устройств для передачи и запоминания сообщений. Здесь каждый логический элемент служит для простейших преобразований двоичной информации, то есть для преобразования двоичных символов. Таким образом, в технических устройствах применяется аппаратный способ преобразования информации.
Однако в биологических системах, - наряду с аппаратным способом преобразования информации, применяется также и информационный способ построения и преобразования самой аппаратной части. Это - уникальная особенность информационных процессов в живых молекулярных системах.
Причем, единицей информации служит сам биохимический элемент, который и является буквой или символом информации. Поэтому при помощи химических букв и символов (элементов) строится аппаратная система клетки и, одновременно, в её структуры записывается программная информация. То есть, на первом этапе информационные сообщения передаются фиксированной позиционной последовательностью расположения букв или символов в “линейных” цепях биологических молекул. Значит, если в технической системе применяется только аппаратный способ преобразование информации, то в молекулярно-биологической системе, - с помощью генетической информации и элементной базы сначала идёт построение и преобразование различных биомолекул и структур, и только потом эти средства могут участвовать в различных информационных процессах. В связи с этим аппаратная часть клетки становится носителем и реализатором соответствующей программной и молекулярной биологической информации.
Получается так, что если в технической системе аппарат является преобразователем информационных символов, то в живой клетке наоборот, - молекулярные буквы и символы, организованные в различные молекулярные последовательности информационных сообщений, сами выступают в роли преобразователей аппаратной части. Причем, функции биомолекул полностью определяются элементарными функциями составляющих их био-логических элементов (букв или символов), - то есть информацией. А каждый элемент в составе биомолекулы всегда взаимодействует с другими элементами или молекулами воды по особым принципам и правилам, которые вполне можно назвать закономерностями молекулярной биохимической логики. Поэтому биохимические элементы здесь, по-видимому, становятся ещё и теми программными элементами, с помощью которых строятся алгоритмы функционального поведения различных биологических молекул и структур. Таким образом, чтобы изменить функциональную направленность деятельности клетки - ей, в определённой мере, с помощью новых информационных сообщений, необходимо частично менять свою аппаратную систему. Смена аппаратной системы, естественно, связана с синтезом новых биомолекул и разрушением старых, которые отслужили свой срок и выполнили свою задачу. Поэтому, после выполнения своих функций, каждая биомолекула расчленяется на элементарные структурно-информационные единицы, которые вновь могут быть вовлечены в информационные процессы. Использованная информация как бы стирается и ликвидируется, а отдельные составляющие её буквы или символы, то есть “молекулярный биологический шрифт” рассыпается для того, чтобы вновь быть использованным в новых информационных сообщениях или других клеточных процессах. Такова основная отличительная особенность информационных передач в молекулярно-биологических системах.
Живая клетка экономна во всём. Если вспомнить, что химические буквы и символы (элементы) строятся на базе отдельных атомов и атомных групп, то можно себе представить, какое колоссальное количество информации хранится в генетической памяти и циркулирует в живой клетке, размеры которой в длину подчас составляют сотые доли миллиметра. К примеру, зигота содержит всю информацию необходимую для развития целостного организма.
Для изменения управляющих воздействий, клетке постоянно нужно обновлять информационные сообщения, что, соответственно, приводит и к обновлению аппаратной части клетки. Поэтому в живой клетке идет постоянное движение информации и вещества. С одной стороны идёт процесс переработки и обновление управляющей информации, а значит ферментов и других белковых молекул, с другой - это приводит к изменению химических управляемых процессов, которые осуществляются ферментами.
В случае необходимости данные процессы поддерживаются дозовой циркуляцией химической энергии в форме АТФ.
Можно убедиться в том, что для построения различных классов высокомолекулярных соединений, таких как нуклеиновые кислоты, белки, полисахариды или липиды, живая клетка использует различные системы (алфавиты) биохимических элементов. Заметим, что с информационной точки зрения, эти классы биологических молекул, представляют собой ничто иное, как различные виды и формы молекулярной информации. Поэтому, для представления молекулярной информации в различных её видах и формах в живых системах существуют системы био-логических элементов разных типов:
- 1) нуклеотиды, - система структурно-функциональных и информационных биохимических элементов ДНК и РНК (алфавит нуклеиновых кислот);
- 2) аминокислоты, - система структурно-функциональных и информационных элементов белков (алфавит белковых молекул), для которых существует генетический код в виде тройки нуклеотидов;
- 3) простые сахара, - структурно-функциональные элементы и информационные символы (алфавит) полисахаридов;
- 4) жирные кислоты, - структурно-функциональные элементы и информационные символы (алфавит) липидов и др.
Более четкой идентификацией и классификацией био-логических элементов, по всей вероятности, должна заниматься отдельная дисциплина, такая как “молекулярная биологическая информатика”.
Наличие в живой клетке систем молекулярных биохимических элементов (мономеров) существенно упрощает процессы построения различных классов макромолекул и структурных компонентов, повышает технологичность их изготовления и, одновременно, расширяет их функциональные и информационные возможности.
Как мы видим, каждый типовой набор организован в свою систему элементов, которая обладает общими биохимическими, структурными и технологическими особенностями, образует однотипные связи между элементами, совместимые по своим физико-химическим параметрам. В основном из этих молекулярных элементов в различных сочетаниях, составе и последовательности построены все структурные и функциональные компоненты живой клетки. Следует отметить, что каждая система биохимических элементов в клетке является отдельным алфавитом и характеризуется своим способом кодирования, а также видом и формой представления молекулярной биологической информации. Это, соответственно, и является первопричиной появления различных классов и великого разнообразия биологических молекул в живых системах.
Удивительно, но факт - всё живое на Земле, от ничтожной бактерии до человека, состоит из одинаковых строительных блоков - стандартного набора более чем трёх десятков типовых функциональных био-логических (биохимических) элементов.
В состав этого уникального набора входят:
- 1) восемь нуклеотидов, - “четыре из них играют роль кодирующих единиц ДНК, а другие четыре используются для записи информации в структуру РНК” ;
- 2) двадцать различных стандартных аминокислот, которые кодируются в ДНК и служат для матричного построения белковых молекул;
- 3) несколько жирных кислот, - сравнительно небольшое число простых стандартных органических молекул, служащих для построения липидов;
4) родоначальниками большинства полисахаридов является несколько простых сахаров (моносахаридов).
Все эти элементы были отобраны в процессе эволюции, вследствие их уникальной пригодности к выполнению различных - химических, энергетических, молекулярных, информационных и других биологических функций в живых клетках.
Как мы видим, основой каждой системы являются свои индивидуальные молекулярные био-логические (биохимические) элементы. А на базе различных систем био-логических элементов, - молекулярных алфавитов, могут быть “сконструированы” разнообразные макромолекулы клетки - ДНК, РНК, белки, полисахариды и липиды. Поэтому элементная база представляет собой те системы биохимических элементов, используя которые живая клетка способна информационным путём строить различные биологические молекулы и структуры, а затем с помощью этих средств осуществлять любые биологические функции и химические превращения.
“Структурные схемы” базовых молекулярных элементов, их природные свойства и особенности достаточно наглядно рассмотрены и представлены в различных учебниках по биохимии. Наша задача - больше уделить внимания информационным аспектам применения таких биохимических единиц.
Структура, свойства и функции белков.
Выяснение структуры белков является одной из главных проблем современной биохимии.
Белковые молекулы представляют собой высокомолекулярные соединения, образованные аминокислотами.
Большинство белков имеют 4 уровня организации (4 структуры белковой молекулы).
Первичная структура белка.
В настоящее время расшифрована первичная структура около 2500 белков, а в природе имеется 10 12 разнообразных белков.
Первичная структура – это последовательность (порядок) соединения аминокислотных остатков с помощью пептидной связи.
Пептидная связь образуется за счет карбоксильной группы одной аминокислоты и аминогруппы другой аминокислоты.
В образовании первичной структуры участвуют -аминокислоты.
Пептидная связь образует остов полипептидной цепи, она является повторяющимся фрагментом.
Особенности пептидной связи:
Копланарность – все атомы, входящие в пептидную связь, находятся в одной плоскости.
Заместители по отношению связи C-N-связи находятся в транс положении.
Пептидная связь способна к образованию двух водородных связей с другими группами, в том числе с пептидными.
Пептидная связь – прочная ковалентная связь, энергия связи равняется 110 ккал/моль.
Свойства первичной структуры белка
Детерминированность – последовательность аминокислот в белке генетически закодирована. Информация о последовательности аминокислот содержится в ДНК.
Уникальность – для каждого белка в организме характерна определенная последовательность аминокислот.
Аминокислоты, входящие в состав белков делят на 2 группы:
Взаимозаменяемые аминокислоты – это амиокислоты, сходные по структуре и свойствам.
Невзаимозаменяемые аминокислоты, отличающиеся по структуре и свойствам.
В белковой молекуле различают 2 вида замен аминокислот:
Консервативная – замена одной аминокислоты на другую сходную по структуре. Такая замена не приводит к изменению свойств белка.
Примеры: гли-ала, асп-глу, тир-фен, вал-лей.
Радикальная замена – замена одной аминокислоты на другую отличающуюся по структуре. Такая замена приводит к изменению свойств белка.
Примеры: глу-вал, сер-цис, про-три, фен-асп, илей-мет.
При радикальной замене возникает белок с другими свойствами, что может привести к патологии.
Радикальная замена глу на вал в шестом положении в молекуле гемоглобина приводит к развитию серповидно-клеточной анемии. При этой патологии эритроциты в условиях низкого парциального давления приобретают форму серпа. После отдачи кислорода такой гемоглобин превращается в плохо растворимую форму и начинает выпадать в осадок в виде веретенообразных кристаллоидов, названных тактоидами. Тактоиды деформируют клетку и эритроциты приобретают форму серпа. При этом происходит гемолиз эритроцитов. Болезни протекает остро и дети погибают. Эта патология называется серповидно-клеточной анемией.
Универсальность первичной структуры. Белки, выполняющие одинаковые функции в разных организмах имеют одинаковую или близкую первичную структуру.
В природных белках одна и та же аминокислота не встречается подряд больше 3 раз.
Вторичная структура белка.
Вторичная структура – это способ укладки полипептидной цепи в спиральную или складчатую конформацию.
Конформация – это пространственное расположение в органической молекуле замещающих групп, способных свободно изменять свое положение в пространстве без разрыва связей, благодаря свободному вращению вокруг одинарных углеродных связей.
Различают 2 вида вторичной структуры белка:
1. -спираль
2. -складчатость.
Вторичную структуру стабилизируют водородные связи. Водородные связи возникают между атомом водорода в NH группе и карбоксильным кислородом.
Характеристика -спирали.
Для каждого белка характерна своя степень спирализации полипептидной цепи. Спирализованные участки чередуются с линейными. В молекуле гемоглобина и -цепи спирализованы на 75%, в лизоциме – 42%, пепсине – 30%.
Степень спирализации зависит от первичной структуры белка.
Спирализации белковой молекулы препятствует аминокислота пролин.
Складчатость имеет слабоизогнутую конфигурацию полипептидной цепи.
Для - складчатости характерны водородные связи в пределах одной полипептидной цепи или сложных полипептидных цепей.
В белках возможны переходы от -спирали к -складчатости и обратно вследствие перестройки водородных связей.
Складчатость имеет плоскую форму.
Спираль имеет стержневую форму.
Водородные связи – слабые связи, энергия связи 10 – 20 ккал/моль, но большое количество связей обеспечивает стабильность белковой молекулы.
В молекуле белка имеются прочные (ковалентные) связи, а также слабые, что обеспечивает с одной стороны стабильность молекулы, а с другой лабильность.
Третичная структура белка.
Третичной структурой белка называется способ укладки полипептидной цепи в пространстве.
По форме третичной структуры белка делят на глобулярные и фибриллярные.
В стабилизации третичной структуры белковой молекулы участвуют ковалентные связи (пептидные и дисульфидные). Основную роль в стабилизации играют нековалентные связи: водородные, электростатические взаимодействия заряженных групп, межмолекулярные ван-дер-вальсовы силы, взаимодействия неполярных боковых радикалов аминокислот, так называемые гидрофобные взаимодействия.
Гидрофобные радикалы аминокислот ала, вал, изолей, мет, фен в водной среде взаимодействуют друг с другом. При этом неполярные гидрофобные радикалы аминокислот как бы погружаются внутрь белковой молекулы, образуя там сухие зоны, а полярные радикалы оказываются ориентированными в сторону воды.
При укладке полипептидная цепь белка стремится принять энергетически выгодную форму с меньшим запахом энергии.
При формировании третичной структуры полипептидная цепь изгибается в местах нахождения пролина, глицина.
Глобулярные белки растворимы в воде, а фибриллярные нет.
Четвертичная структура белка.
Белки, состоящие из одной полипептидной цепи, имеют только третичную структуру (лизоцим, пепсин, миоглобин, трипсин).
Для белков, состоящих из нескольких полипептидных цепей, характерна четвертичная структура.
Под четвертичной структурой понимают объединение отдельных полипептидных цепей с третичной структурой в функционально активную молекулу белка. Каждая отдельная полипептидная цепь называется протомером и чаще не обладает биологической активностью.
В молекуле белка может быть несколько протомеров, которые при объединении образуют олигомер или мультимер.
Для белков с четвертичной структурой характерно понятие субъединицы.
Субъединица – это функционально активная часть молекулы белка.
Примером белка с четвертичной структурой является гемоглобин, состоящий из 4 протомеров: 2 и 2 -цепей.
Взаимодействие полипептидных цепей при формировании олигомера происходит за счет полярных групп аминокислотных остатков. Между полярными группами образуется ионная, водородные связи, гидрофобные взаимодействия.
Денатурация.
Денатурация – это процесс нарушения высших уровней организации белковой молекулы (вторичного, третичного, четвертичного) под действием различных факторов.
При этом полипептидная цепь разворачивается и находится в растворе в развернутом виде или в виде беспорядочного клубка.
При денатурации утрачивается гидратная оболочка и белок выпадает в осадок и при этом утрачивает нативные свойства.
Денатурацию вызывают физические факторы: температура, давление, механические воздействия, ультразвуковые и ионизирующие излучения; химические факторы: кислоты, щелочи, органические растворители, алкалоиды, соли тяжелых металлов.
Различают 2 вида денатурации:
Обратимая денатурация – ренатурация или ренактивация – это процесс, при котором денатурированный белок, после удаления денатурирующих веществ вновь самоорганизуется в исходную структуру с восстановлением биологической активности.
необратимая денатурация – это процесс, при котором биологическая активность не восстанавливается после удаления денатурирующих агентов.
Свойства денатурированных белков.
Увеличение числа реактивных или функциональных групп по сравнению с нативной молекулой белка (это группы COOH, NH 2 , SH, OH, группы боковых радикалов аминокислот).
Уменьшение растворимости и осаждение белка (связано с потерей гидратной оболочки), развертыванием молекулы белка, с «обнаружением» гидрофобных радикалов и нейтрализации зарядов полярных групп.
Изменение конфигурации молекулы белка.
Потеря биологической активности, вызванная нарушением нативной структуры.
Более легкое расщепление протеолитическими ферментами по сравнению с нативным белком – переход компактной нативной структуры в развернутую рыхлую форму облегчает доступ ферментов к пептидным связям белка, которые они разрушают.
Ферментные методы гидролиза основаны на избирательности действия протеолитических ферментов расщепляющих пептидные связи между определенными аминокислотами.
Пепсин расщепляет связи, образованные остатками фенилаланина, тирозина и глутаминовой кислоты.
Трипсин расщепляет связи между аргинином и лизином.
Химотрипсин гидролизует связи триптофана, тирозина и фенилаланина.
ЗАНЯТИЕ 3
Структура и свойства ферментов.
Ферменты (энзимы) – специфические белки, входящие в состав всех клеток и тканей живых организмов, играющие роль биологических катализаторов.
Доказательства белковой природы ферментов.
Изоэлектрическая точка ферментов.
Поведение ферментов при изменении концентрации водородных генов.
Высокая специфичность ферментов.
Ферменты не способны проникать через полупроницаемые мембраны.
Сохранение активности ферментами после действия водоотнимающими средствами (ацетон, спирт, нейтральные соли щелочных металлов).
Инативация ферментов при нагревании. Инактивация ферментов совпадает с денатурацией белка. Ферменты разрушаются также под действием минеральных кислот, щелочей, солей, алкалоидов, при облучении рентгеновскими и ультрафиолетовыми лучами.
Электрохимические свойства ферментов.
Для ферментов и неорганических катализаторов характерны общие свойства:
Неорганические катализаторы и биологические катализаторы – ферменты требуются в небольшом количестве для проведения реакции.