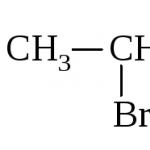Niższe alkeny (C 2 - C 5) produkowane są na skalę przemysłową z gazów powstających podczas termicznej obróbki ropy i produktów naftowych. Alkeny można również wytwarzać metodami syntezy laboratoryjnej.
4.5.1. Dehydrohalogenacja
Gdy haloalkany traktuje się zasadami w bezwodnych rozpuszczalnikach, na przykład alkoholowym roztworem wodorotlenku potasu, eliminuje się halogenowodór.
4.5.2. Odwodnienie
Podczas ogrzewania alkoholi z kwasem siarkowym lub fosforowym następuje odwodnienie wewnątrzcząsteczkowe ( - eliminacja).
Dominującym kierunkiem reakcji, podobnie jak w przypadku dehydrohalogenacji, jest utworzenie najbardziej stabilnego alkenu (reguła Zajcewa).
Odwodnienie alkoholi można przeprowadzić przepuszczając pary alkoholu przez katalizator (tlenki glinu lub toru) w temperaturze 300 - 350 o C.
4.5.3. Dehalogenacja sąsiadujących dihalogenków
Dzięki działaniu cynku w alkoholu dibromki zawierające halogeny przy sąsiednich atomach (w pobliżu) można przekształcić w alkeny.

4.5.4. Uwodornienie alkinów
Podczas uwodorniania alkinów w obecności katalizatorów platynowych lub niklowych, których aktywność zmniejsza się przez dodatek niewielkiej ilości związków ołowiu (trucizna katalityczna), powstaje alken, który nie ulega dalszej redukcji.
4.5.5. Redukcyjna kombinacja aldehydów i ketonów
Po potraktowaniu wodorkiem litowo-glinowym i chlorkiem tytanu (III) z dwóch cząsteczek aldehydu lub ketonu powstają di- lub tetra-podstawione alkeny z dobrą wydajnością.

5. ALKIN
Alkiny to węglowodory zawierające potrójne wiązanie węgiel-węgiel –СС–.
Ogólny wzór prostych alkinów to C n H 2n-2. Najprostszym przedstawicielem klasy alkinów jest acetylen H–СС–H, dlatego alkiny nazywane są także węglowodorami acetylenowymi.
5.1. Struktura acetylenu
Atomy węgla acetylenu są w środku sp- stan hybrydowy. Przedstawmy konfigurację orbitalną takiego atomu. Podczas hybrydyzacji 2s-orbitale i 14:00-orbitale są uformowane w dwa równe sp-orbitale hybrydowe położone na tej samej linii prostej, pozostawiając dwa niezhybrydyzowane R-orbitale.

Ryż. 5.1 Schemattworzeniesp -orbitale hybrydowe atomu węgla
Kierunki i kształty orbitali SR-hybrydyzowany atom węgla: zhybrydyzowane orbitale są równoważne, maksymalnie oddalone od siebie
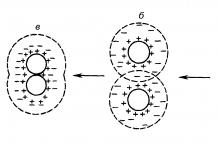
W cząsteczce acetylenu występuje wiązanie pojedyncze ( - wiązanie) pomiędzy atomami węgla powstaje w wyniku nałożenia się dwóch sp-orbitale hybrydowe. Dwa wzajemnie prostopadłe - wiązania powstają, gdy dwie pary niezhybrydyzowanych par nakładają się bocznie 2p- orbitale, - chmury elektronów pokrywają szkielet tak, że chmura elektronów ma symetrię zbliżoną do cylindrycznej. Wiązania z atomami wodoru powstają w wyniku sp-orbitale hybrydowe atomu węgla i 1 S-orbitale atomu wodoru, cząsteczka acetylenu jest liniowa.

Ryż. 5.2 Cząsteczka acetylenu
a - boczne nakładanie się 14:00 daje dwa orbitale - komunikacja;
b - cząsteczka jest liniowa, -chmura ma kształt cylindryczny
W propynie istnieje proste połączenie ( - komunikacja z sp-Z sp3 krótszy niż podobne połączenie C sp-Z sp2 w alkenach wyjaśnia to fakt, że sp- orbital jest bliżej jądra niż sp 2 - orbitalny .
Potrójne wiązanie węgiel-węgiel C C jest krótsze niż wiązanie podwójne, a całkowita energia wiązania potrójnego jest w przybliżeniu równa sumie energii jednego pojedynczego wiązania C – C (347 kJ/mol) i dwóch wiązań (259 2 kJ/mol) (Tabela 5.1).
Węglowodory alkenowe (olefiny) to jedna z klas substancji organicznych, które mają swoje własne właściwości. Rodzaje izomerii alkenów u przedstawicieli tej klasy nie powtarzają się z izomerią innych substancji organicznych.
W kontakcie z
Charakterystyka klasy
Nazywa się je olefinami etylenowymi jedna z klas węglowodorów nienasyconych zawierająca jedno wiązanie podwójne.
Według właściwości fizycznych przedstawicielami tej kategorii związków nienasyconych są:
- gazy,
- płyny,
- związki stałe.
Cząsteczki zawierają nie tylko wiązanie „sigma”, ale także wiązanie „pi”. Powodem tego jest obecność we wzorze strukturalnym hybrydyzacji „ sp2", który charakteryzuje się ułożeniem atomów związku w tej samej płaszczyźnie.
W takim przypadku powstaje między nimi kąt co najmniej stu dwudziestu stopni. Orbitale niezhybrydyzowane” R» charakteryzuje się położeniem zarówno na górze płaszczyzny molekularnej, jak i poniżej niej.
Ta cecha strukturalna prowadzi do powstania dodatkowych wiązań - „pi” lub „ π ».
Opisane wiązanie jest słabsze w porównaniu do wiązań „sigma”, ponieważ zachodzenie na boki ma słabą przyczepność. Całkowity rozkład gęstości elektronowych utworzonych wiązań charakteryzuje się niejednorodnością. Podczas obracania się w pobliżu wiązania węgiel-węgiel nakładanie się orbitali „p” zostaje zakłócone. Dla każdego alkenu (olefiny) ten wzór jest cechą charakterystyczną.
Prawie wszystkie związki etylenu mają wysokie temperatury wrzenia i topnienia, które nie są charakterystyczne dla wszystkich substancji organicznych. Przedstawiciele tej klasy węglowodanów nienasyconych szybko rozpuszczają się w innych rozpuszczalnikach organicznych.
Uwaga! Acykliczne związki nienasycone, węglowodory etylenu, mają ogólny wzór - C n H 2n.
Homologia
Opierając się na fakcie, że ogólny wzór alkenów to C n H 2n, mają one pewną homologię. Homologiczna seria alkenów zaczyna się od pierwszego przedstawiciela, etylenu lub etenu. Substancja ta w normalnych warunkach jest gazem i zawiera dwa atomy węgla i cztery atomy wodoru -C2H4. Po eterze homologiczna seria alkenów jest kontynuowana z propenem i butenem. Ich wzory są następujące: „C 3 H 6” i „C 4 H 8”. W normalnych warunkach są to również gazy cięższe, co oznacza, że należy je zbierać probówką odwróconą do góry nogami.
 Ogólny wzór alkenów pozwala obliczyć kolejnego przedstawiciela tej klasy, który ma co najmniej pięć atomów węgla w łańcuchu strukturalnym. Jest to penten o wzorze „C 5 H 10”.
Ogólny wzór alkenów pozwala obliczyć kolejnego przedstawiciela tej klasy, który ma co najmniej pięć atomów węgla w łańcuchu strukturalnym. Jest to penten o wzorze „C 5 H 10”.
Zgodnie z właściwościami fizycznymi wskazana substancja należy do cieczy, a także do kolejnych dwunastu związków linii homologicznej.
Wśród alkenów o tych cechach znajdują się również ciała stałe zaczynające się od wzoru C 18 H 36. Ciekłe i stałe węglowodory etylenowe nie rozpuszczają się w wodzie, ale gdy dostaną się do rozpuszczalników organicznych, reagują z nimi.
Opisany ogólny wzór alkenów implikuje zastąpienie wcześniej używanego przyrostka „an” na „en”. Jest to zapisane w zasadach IUPAC. Niezależnie od tego, jaki reprezentatywny jest dla tej kategorii związków, wszystkie mają opisany przyrostek.
Nazwy związków etylenu zawsze zawierają pewną liczbę, która wskazuje miejsce we wzorze wiązania podwójnego. Przykładami są: „buten-1” lub „penten-2”. Numeracja atomowa rozpoczyna się od krawędzi, do której konfiguracja podwójna jest najbliższa. Ta zasada jest „żelazna” we wszystkich przypadkach.
Izomeria
W zależności od rodzaju hybrydyzacji alkenów charakteryzują się one pewnymi rodzajami izomerii, z których każdy ma swoją własną charakterystykę i strukturę. Rozważmy główne typy izomerii alkenów.
Typ konstrukcyjny
Izomeria strukturalna dzieli się na izomery według:
- szkielet węglowy;
- położenie wiązania podwójnego.
Izomery strukturalne szkieletu węglowego powstają, gdy pojawiają się rodniki (odgałęzienia głównego łańcucha).
Izomerami alkenów o wskazanej izomerii będą:
CH2=CH — CH 2 — CH 3.
2-metylopropen-1:
CH2=C — CH 3
│
Prezentowane związki mają wspólną liczbę atomów węgla i wodoru (C 4 H 8), ale inną budowę szkieletu węglowodorowego. Są to izomery strukturalne, chociaż ich właściwości nie są takie same. Buten-1 (butylen) ma charakterystyczny zapach i właściwości narkotyczne, które podrażniają drogi oddechowe. 2-metylopropen-1 nie ma tych cech.
W tym przypadku etylen (C2H4) nie ma izomerów, ponieważ składa się tylko z dwóch atomów węgla, w których nie można podstawić rodników.
Rada! Rodnik może być umieszczony na środkowych i przedostatnich atomach węgla, ale nie wolno umieszczać ich w pobliżu skrajnych podstawników. Zasada ta dotyczy wszystkich węglowodorów nienasyconych.
Ze względu na położenie wiązania podwójnego wyróżnia się izomery:
CH2=CH — CH 2 — CH2-CH3.
CH3-CH = CH — CH2-CH3.
Ogólny wzór alkenów w przedstawionych przykładach to:C5H10,, ale lokalizacja jednego wiązania podwójnego jest inna. Właściwości tych związków będą się różnić. Jest to izomeria strukturalna.

Izomeria
Typ przestrzenny
Izomeria przestrzenna alkenów jest związana z naturą ułożenia podstawników węglowodorowych.
Na tej podstawie wyróżnia się izomery:
- „Cis”;
- "Trans".
Ogólny wzór alkenów pozwala na utworzenie „izomerów trans” i „izomerów cis” tego samego związku. Weźmy na przykład butylen (buten). Dla niego możliwe jest utworzenie izomerów o strukturze przestrzennej poprzez różne ułożenie podstawników względem wiązania podwójnego. Na przykładach izomeria alkenów będzie wyglądać następująco:
„izomer cis” „izomer trans”

Buten-2 Buten-2
Z tego przykładu jasno wynika, że „izomery cis” mają dwa identyczne rodniki po jednej stronie płaszczyzny podwójnego wiązania. W przypadku „izomerów trans” zasada ta nie działa, ponieważ mają one dwa różne podstawniki umiejscowione względem łańcucha węglowego „C=C”. Biorąc pod uwagę ten wzór, możesz samodzielnie skonstruować izomery „cis” i „trans” dla różnych acyklicznych węglowodorów etylenu.
Przedstawione „izomer cis” i „izomer trans” butenu-2 nie mogą zostać przekształcone w siebie, ponieważ wymaga to rotacji wokół istniejącego podwójnego łańcucha węglowego (C=C). Aby przeprowadzić tę rotację, potrzebna jest pewna ilość energii, aby rozerwać istniejące „wiązanie p”.
Na podstawie powyższego możemy stwierdzić, że izomery „trans” i „cis” są odrębnymi związkami o określonym zestawie właściwości chemicznych i fizycznych.
Który alken nie ma izomerów? Etylen nie posiada izomerów przestrzennych ze względu na identyczny układ podstawników wodorowych względem podwójnego łańcucha.
Międzyklasowe
Izomeria międzyklasowa w węglowodorach alkenowych jest szeroko rozpowszechniona. Powodem tego jest podobieństwo wzoru ogólnego przedstawicieli tej klasy do wzoru cykloparafin (cykloalkanów). Te kategorie substancji mają tę samą liczbę atomów węgla i wodoru, co stanowi wielokrotność składu (C n H 2n).
Izomery międzyklasowe będą wyglądać następująco:
CH2=CH — CH 3.
Cyklopropan:
Okazuje się, że formułaC3H6Odpowiedzią są dwa związki: propen-1 i cyklopropan. Struktura strukturalna pokazuje różne ułożenie węgla względem siebie. Właściwości tych związków są również różne. Propen-1 (propylen) jest związkiem gazowym o niskiej temperaturze wrzenia. Cyklopropan charakteryzuje się stanem gazowym o ostrym zapachu i ostrym smaku. Właściwości chemiczne tych substancji również się różnią, ale ich skład jest identyczny. W organicznych ten typ izomerów nazywany jest międzyklasowym.
Alkeny. Izomeria alkenów. Ujednolicony egzamin państwowy. Chemia organiczna.
Alkeny: budowa, nazewnictwo, izomeria
Wniosek
Izomeria alkenów jest ich ważną cechą, dzięki której w przyrodzie pojawiają się nowe związki o różnych właściwościach, które znajdują zastosowanie w przemyśle i życiu codziennym.
Zawierające wiązanie pi są węglowodorami nienasyconymi. Są pochodnymi alkanów, w których cząsteczkach wyeliminowano dwa atomy wodoru. Powstałe wolne wartościowości tworzą nowy typ wiązania, które jest zlokalizowane prostopadle do płaszczyzny cząsteczki. W ten sposób powstaje nowa grupa związków – alkeny. W tym artykule rozważymy właściwości fizyczne, produkcję i zastosowanie substancji tej klasy w życiu codziennym i przemyśle.
Seria homologiczna etylenu
Ogólny wzór wszystkich związków zwanych alkenami, odzwierciedlający ich skład jakościowy i ilościowy, to C n H 2 n. Nazwy węglowodorów zgodnie z nomenklaturą systematyczną mają następującą postać: w określeniu odpowiedniego alkanu następuje zmiana przyrostka z -ane na -ene, np.: etan - eten, propan - propen itp. W niektórych źródłach można znaleźć inna nazwa związków tej klasy - olefiny. Następnie zbadamy proces tworzenia wiązań podwójnych i właściwości fizyczne alkenów, a także określimy ich zależność od struktury cząsteczki.
Jak powstaje wiązanie podwójne?
Na przykładzie etylenu elektronową naturę wiązania pi można przedstawić następująco: atomy węgla w jego cząsteczce mają postać hybrydyzacji sp2. W tym przypadku powstaje wiązanie sigma. Dwa kolejne orbitale hybrydowe, po jednym z atomów węgla, tworzą proste wiązania sigma z atomami wodoru. Dwie pozostałe wolne chmury hybrydowe atomów węgla zachodzą na siebie powyżej i poniżej płaszczyzny cząsteczki – powstaje wiązanie pi. To właśnie określa właściwości fizyczne i chemiczne alkenów, które zostaną omówione dalej.

Izomeria przestrzenna
Związki, które mają ten sam ilościowy i jakościowy skład cząsteczek, ale różne struktury przestrzenne, nazywane są izomerami. Izomeria występuje w grupie substancji zwanych substancjami organicznymi. Na właściwości olefin duży wpływ ma zjawisko izomerii optycznej. Wyraża się to tym, że homologi etylenu, zawierające różne rodniki lub podstawniki przy każdym z dwóch atomów węgla przy wiązaniu podwójnym, mogą występować w postaci dwóch izomerów optycznych. Różnią się między sobą położeniem podstawników w przestrzeni względem płaszczyzny wiązania podwójnego. Właściwości fizyczne alkenów w tym przypadku również będą inne. Dotyczy to na przykład temperatur wrzenia i topnienia substancji. Zatem olefiny o prostym szkielecie węglowym mają wyższą temperaturę wrzenia niż związki izomeryczne. Ponadto temperatury wrzenia izomerów cis alkenów są wyższe niż izomery trans. Jeśli chodzi o temperatury topnienia, obraz jest odwrotny.
Charakterystyka porównawcza właściwości fizycznych etylenu i jego homologów
Pierwsi trzej przedstawiciele olefin to związki gazowe, następnie począwszy od pentenu C 5 H 10 aż do alkenu o wzorze C 17 H 34, są to ciecze, a następnie są ciała stałe. Wśród homologów etenu można zaobserwować następującą tendencję: spada temperatura wrzenia związków. Przykładowo dla etylenu wskaźnik ten wynosi -169,1°C, a dla propylenu -187,6°C. Jednak temperatura wrzenia wzrasta wraz ze wzrostem masy cząsteczkowej. Zatem dla etylenu jest to -103,7°C, a dla propenu -47,7°C. Podsumowując to, co zostało powiedziane, możemy wyciągnąć krótki wniosek: właściwości fizyczne alkenów zależą od ich masy cząsteczkowej. Wraz ze wzrostem zmienia się stan skupienia związków w kierunku: gaz – ciecz – ciało stałe, a temperatura topnienia maleje, a temperatura wrzenia wzrasta.

Charakterystyka etenu
Pierwszym przedstawicielem homologicznej serii alkenów jest etylen. Jest to gaz słabo rozpuszczalny w wodzie, ale dobrze rozpuszczalny w rozpuszczalnikach organicznych i nie ma koloru. Masa cząsteczkowa - 28, eten jest nieco lżejszy od powietrza, ma subtelny słodkawy zapach. Łatwo reaguje z halogenami, wodorem i halogenowodorami. Niemniej jednak właściwości fizyczne alkenów i parafin są dość podobne. Na przykład stan agregacji, zdolność metanu i etylenu do silnego utleniania itp. Jak rozróżnić alkeny? Jak rozpoznać nienasycony charakter olefiny? W tym celu istnieją reakcje jakościowe, które omówimy bardziej szczegółowo. Przypomnijmy, jaką osobliwość mają alkeny w strukturze cząsteczki. O właściwościach fizycznych i chemicznych tych substancji decyduje obecność w ich składzie wiązania podwójnego. Aby wykazać jego obecność, należy przepuścić gaz węglowodorowy przez fioletowy roztwór nadmanganianu potasu lub wodę bromową. Jeśli odbarwią się, oznacza to, że związek zawiera w swoich cząsteczkach wiązania pi. Etylen wchodzi w reakcję utleniania i odbarwia roztwory KMnO 4 i Br 2.
Mechanizm reakcji addycji
Rozszczepienie wiązania podwójnego kończy się dodaniem atomów innych pierwiastków chemicznych do wolnych wartościowości węgla. Na przykład, gdy etylen reaguje z wodorem, co nazywa się uwodornieniem, powstaje etan. Wymagany jest katalizator, taki jak sproszkowany nikiel, pallad lub platyna. Reakcja z HCl kończy się utworzeniem chloroetanu. Alkeny zawierające w cząsteczkach więcej niż dwa atomy węgla poddawane są addycji halogenowodorów z uwzględnieniem reguły W. Markownikowa.

Jak homologi etenu oddziałują z halogenowodorami
Jeśli stoimy przed zadaniem „Scharakteryzuj właściwości fizyczne alkenów i ich przygotowanie”, musimy bardziej szczegółowo rozważyć regułę V. Markownikowa. W praktyce ustalono, że homologi etylenu reagują z chlorowodorem i innymi związkami w miejscu rozerwania wiązania podwójnego, według określonego schematu. Polega ona na tym, że atom wodoru jest przyłączony do najbardziej uwodornionego atomu węgla, a jon chloru, bromu lub jodu do atomu węgla zawierającego najmniejszą liczbę atomów wodoru. Ta cecha występowania reakcji dodawania nazywa się regułą V. Markownikowa.
Hydratacja i polimeryzacja
Kontynuujmy rozważania na temat właściwości fizycznych i zastosowań alkenów na przykładzie pierwszego przedstawiciela szeregu homologicznego – etenu. Jego reakcja z wodą wykorzystywana jest w przemyśle syntezy organicznej i ma ogromne znaczenie praktyczne. Proces ten został po raz pierwszy przeprowadzony w XIX wieku przez A.M. Butlerow. Reakcja wymaga spełnienia szeregu warunków. To przede wszystkim zastosowanie stężonego kwasu siarkowego lub oleum jako katalizatora i rozpuszczalnika etenowego, ciśnienie około 10 atm i temperatura w granicach 70°. Proces hydratacji przebiega w dwóch fazach. Najpierw w miejscu rozerwania wiązania pi cząsteczki kwasu siarczanowego łączą się z etenem, w wyniku czego powstaje kwas etylosiarkowy. Następnie powstała substancja reaguje z wodą, tworząc alkohol etylowy. Etanol jest ważnym produktem stosowanym w przemyśle spożywczym do produkcji tworzyw sztucznych, kauczuków syntetycznych, lakierów i innych organicznych produktów chemicznych.

Polimery na bazie olefin
Kontynuując badania zagadnienia stosowania substancji należących do klasy alkenów, będziemy badać proces ich polimeryzacji, w którym mogą brać udział związki zawierające w składzie swoich cząsteczek nienasycone wiązania chemiczne. Istnieje kilka rodzajów reakcji polimeryzacji, w wyniku których powstają produkty o dużej masie cząsteczkowej - polimery, na przykład polietylen, polipropylen, polistyren itp. Mechanizm wolnorodnikowy prowadzi do produkcji polietylenu o dużej gęstości. Jest to jeden z najczęściej stosowanych związków w przemyśle. Typ kationowo-jonowy zapewnia produkcję polimeru o stereoregularnej strukturze, np. polistyrenu. Uważany jest za jeden z najbezpieczniejszych i najwygodniejszych w użyciu polimerów. Wyroby styropianowe są odporne na działanie substancji agresywnych: kwasów i zasad, są niepalne i łatwe do malowania. Innym rodzajem mechanizmu polimeryzacji jest dimeryzacja, która prowadzi do produkcji izobutenu, który jest stosowany jako dodatek przeciwstukowy do benzyny.
Metody uzyskiwania
Alkeny, których właściwości fizyczne badamy, uzyskuje się w laboratorium i przemyśle różnymi metodami. W eksperymentach na szkolnym kursie chemii organicznej wykorzystuje się proces odwadniania alkoholu etylowego za pomocą środków odwadniających, na przykład pięciotlenku fosforu lub kwasu siarczanowego. Reakcję prowadzi się przez ogrzewanie i jest ona odwrotnością procesu wytwarzania etanolu. W przemyśle znalazła zastosowanie inna powszechna metoda wytwarzania alkenów, a mianowicie: ogrzewanie halogenowych pochodnych węglowodorów nasyconych, np. chloropropanu, ze stężonymi alkoholowymi roztworami zasad - wodorotlenkiem sodu lub potasu. W reakcji eliminuje się cząsteczkę chlorowodoru i tworzy się wiązanie podwójne w miejscu, w którym pojawiają się wolne wartościowości atomów węgla. Końcowym produktem procesu chemicznego będzie olefina – propen. Kontynuując rozważanie właściwości fizycznych alkenów, zatrzymajmy się na głównym procesie produkcji olefin - pirolizie.

Produkcja przemysłowa nienasyconych węglowodorów z grupy etylenu
Tanie surowce – gazy powstające podczas krakingu ropy naftowej, służą jako źródło do produkcji olefin w przemyśle chemicznym. W tym celu stosuje się schemat technologiczny pirolizy - rozszczepienie mieszaniny gazów, które następuje wraz z zerwaniem wiązań węglowych i utworzeniem etylenu, propenu i innych alkenów. Pirolizę przeprowadza się w specjalnych piecach składających się z pojedynczych wężownic do pirolizy. Wytwarzają temperaturę około 750-1150°C i zawierają parę wodną jako rozcieńczalnik. Reakcje zachodzą poprzez mechanizm łańcuchowy z utworzeniem rodników pośrednich. Produktem końcowym jest etylen lub propen, produkowane są w dużych ilościach.

Szczegółowo zbadaliśmy właściwości fizyczne, a także zastosowania i metody wytwarzania alkenów.
1. Utlenianie alkenów.
1.1 Spalanie.
W nadmiarze powietrza lub tlenu wszystkie alkeny spalają się do dwutlenku węgla i wody:
CH 3 – CH = CH 2 + 4,5 O 2 3 CO 2 + 3 H 2 O
W silnikach spalinowych nie stosuje się spalania alkenów, ponieważ podczas przechowywania benzyny stają się one żywiczne, a żywice zatykają osprzęt paliwowy (wtryskiwacz).
Należy uwzględnić możliwość spalania alkenów podczas transportu i przechowywania w zakładach chemicznych.
1.2 Utlenianie alkenów obliczoną ilością tlenu atmosferycznego w obecności srebra.
Związki epoksydowe służą do tworzenia klejów o różnym przeznaczeniu.
1.3 Utlenianie alkenów jednoprocentowym roztworem nadmanganianu potasu w wodzie - reakcja jakościowa na alkeny według E.E. Wagnera.
Reakcję po raz pierwszy opisał E.E. Wagnera w czasopiśmie Rosyjskiego Towarzystwa Fizycznego i Chemicznego w 1886 r. Utlenianie alkenów lub innych związków nienasyconych zachodzi w temperaturze pokojowej i towarzyszy mu zanik fioletowej barwy jonu nadmanganianu i utworzenie się brązowego osadu dwutlenku manganu. Niezależnie od budowy alkenu (ale nie alkadienu, np. przykład), współczynniki w reakcji Wagnera są zawsze takie same (324-322). Poniżej znajdują się przykłady utleniania określonych alkenów oraz pokazują reakcje połówkowe i całkowity ORR w postaci jonowej i molekularnej:

 :
:
Jak widać w reakcji Wagnera, końcowymi produktami organicznymi są alkohole diwodorotlenowe. Nazywa się je również glikolami. Na przykład 1,2-etanodiol nazywany jest glikolem etylenowym.
1.4 Utlenianie alkenów silnymi utleniaczami w fazie ciekłej w środowisku kwaśnym.
W zależności od budowy alkenów, utleniając się w tych warunkach, otrzymuje się różne produkty, a mianowicie CO 2, kwasy karboksylowe i ketony. Schemat utleniania alkenów o różnych strukturach pokazano poniżej.





Aby zilustrować zastosowanie tego schematu, podano przykład utleniania 2-metylopentenu nadmanganianem potasu w środowisku kwasu siarkowego. Zgodnie ze schematem utleniania końcowymi produktami organicznymi tego alkenu są kwas karboksylowy i keton:

Połowa reakcji na ten proces:
 Inny przykład: utlenianie 2-etylobutenu-1 dwuchromianem potasu w kwasie siarkowym. Zgodnie z zasadami schematu utleniania w tym przypadku otrzymuje się keton i dwutlenek węgla:
Inny przykład: utlenianie 2-etylobutenu-1 dwuchromianem potasu w kwasie siarkowym. Zgodnie z zasadami schematu utleniania w tym przypadku otrzymuje się keton i dwutlenek węgla:


Trzeci przykład: utlenianie cis- Bizmutan 3,4,5-trimetylohepteno-3 sodu w rozcieńczonym kwasie azotowym. Zgodnie z zasadami schematu utleniania w tym przypadku otrzymuje się dwa ketony:


1.5 Ozonoliza
Ozonoliza jest procesem dwuetapowym, w pierwszym etapie do alkenu dodaje się ozon i powstaje ozonek, a w drugim etapie ozonek ten jest albo powoli niszczony przez wodę, z wytworzeniem nadtlenku wodoru, aldehydów i ketonów, lub szybko redukowany przez pył cynkowy z utworzeniem tlenku cynku i tych samych aldehydów i ketonów.
Poniżej znajduje się przykład ozonolizy 3-metylo- cis-hepten-3.
Ozonoliza wytwarza dwa różne ketony:

Formaldehyd (metanal) można otrzymać jako jeden z produktów utleniania, jeśli do reakcji zostanie wzięty końcowy alken:

2. Reakcje addycji przy wiązaniu podwójnym alkenów.
Do podwójnego wiązania alkenów można dodać zarówno cząsteczki niepolarne, jak i polarne.
Niepolarny: H 2, Cl 2, Br 2, J 2. Fluor F2 nie dodaje się do alkenów, ale spala je do CF4 i HF:
CH 3 – CH = CH – CH 3 + 12 F 2 → 4 CF 4 + 8 HF
2.1 Dodatek wodoru.
Dodawanie zachodzi tylko w obecności katalizatora. Najczęściej w przemyśle wykorzystuje się pallad lub platynę, które łatwo regeneruje się poprzez kalcynację. Nikiel praktycznie nie jest stosowany, gdyż w konwencjonalnych warunkach kalcynacji zamienia się w tlenek, którego redukcja jest nieopłacalna ekonomicznie.
CH 3 – CH = CH 2 + H 2 CH 3 – CH 2 – CH 3
2.2 Dodatek chloru.
Przechodzi do dwóch atomów przy podwójnym wiązaniu. Otrzymuje się dichloropochodne alkanów. Reakcja może zachodzić albo w roztworze wodnym w temperaturze pokojowej lub w niższych temperaturach, albo w rozpuszczalnikach organicznych, na przykład czterochlorku węgla CCl 4 lub dichloroetanie C 2 H 4 Cl 2:
2.3 Dodatek bromu.
Podobnie zachodzi zarówno z wodą bromową w temperaturach do 0 0 C, jak i w tych samych rozpuszczalnikach organicznych. W tym drugim przypadku reakcja może zachodzić w temperaturach do – 25 0 C, czyli na mrozie.
Reakcja z bromem jest jakościowym testem na obecność alkenów w mieszaninach gazowych i ciekłych, gdyż towarzyszy jej odbarwienie pomarańczowych roztworów bromu:
2.4 Reakcja z jodem.
Reakcja jest szeroko stosowana do określenia całkowitego nienasycenia tłuszczów, które są pochodnymi nienasyconych kwasów tłuszczowych zawierających podwójne wiązania, jak w alkenach:


Masę jodu w gramach potrzebną do całkowitego jodowania 100 g tłuszczu nazywa się liczbą jodową. Im jest ona wyższa, tym tłuszcz jest korzystniejszy dla człowieka, gdyż organizm syntetyzuje hormony wyłącznie z wielonienasyconych kwasów tłuszczowych. Przykładowe liczby jodowe: olej palmowy – 12, tłuszcz jagnięcy – 35, oliwa z oliwek – 80, olej sojowy – 150, olej śledziowy – 200, olej fokowy – 280
2.5 Reakcje z cząsteczkami polarnymi.
Do cząsteczek polarnych typu H-A zaliczają się: H-F, H-Cl, H-Br, H-J, H-OH,
H-O-R (alkohole) i kwasy karboksylowe –
Dodawanie chlorowodoru i innych cząsteczek polarnych przebiega odpowiednio, to znaczy atom wodoru z cząsteczki polarnej preferencyjnie przyłącza się do bardziej uwodornionego atomu węgla przy podwójnym wiązaniu, a reszta A do innego atomu przy podwójnym wiązaniu.

Zatem reakcja jest słabo selektywna.
Wraz ze wzrostem różnicy w uwodornieniu wzrasta selektywność reakcji. Rzeczywiście, różnica w uwodornieniu atomów 1 i 2 w propenie wynosi jeden atom wodoru, a 85% chloru trafia do mniej uwodornionego atomu węgla, podczas gdy w
W 2-metylopropenie różnica w uwodornieniu między atomami 1 i 2 wynosi już dwa atomy wodoru, a ponad 98% chloru trafia do atomu 2:
Dodawanie HF, HBr, HJ przebiega podobnie:

W przeciwnym razie dodaje się HBr (i tylko HBr, a nie HCl, HF i HI) w obecności nadtlenku wodoru H 2 O 2:
Według Karasa reakcja ta nazywa się dodaniem HBr. Selektywność w nim praktycznie zmienia się na odwrotną w porównaniu do dodatku HBr przy braku nadtlenku wodoru (zgodnie z regułą Markownikowa).
Bardzo interesująca jest reakcja alkenów z chlorem w temperaturze 500°C.W tych warunkach reakcja dodawania chloru przy podwójnym wiązaniu jest odwracalna, ponadto równowaga w niej jest silnie przesunięta w stronę substancji wyjściowych. Wręcz przeciwnie, znacznie wolniejsza, ale nieodwracalna reakcja podstawienia rodnika w pozycji allilowej, czyli obok wiązania podwójnego, prowadzi do końca:

Reakcja ta ma ogromne znaczenie praktyczne. Przykładowo jednym z etapów wielkoskalowej przemysłowej syntezy gliceryny jest chlorowanie propenu do
3-chloropropen-1.
Po dodaniu wody do alkenów w obecności katalitycznych ilości kwasu siarkowego lub fosforowego otrzymuje się alkohole. Łączenie odbywa się zgodnie z regułą Markownikowa:

Po dodaniu alkoholi do alkenów otrzymuje się etery:


Te izomeryczne etery można nazwać zarówno alkanami zawierającymi podstawniki alkoksylowe, jak i eterami. W pierwszym przypadku wybiera się najdłuższy łańcuch atomów węgla i numeruje go od strony najbliższej podstawnikowi alkoksylowemu. Na przykład do transmisji Iłańcuch numerowany cyframi w nawiasach. Odpowiednia nazwa jest również w nawiasach. Dla izomeru II, wręcz przeciwnie, liczby w nawiasach numerują łańcuch rozpoczynający się od atomu węgla związanego z atomem tlenu. Nazwę w tym przypadku tworzy się następująco: najpierw wymienia się prostszy rodnik związany z atomem tlenu, potem bardziej złożony, a na końcu dodaje się „eter”.
Po dodaniu kwasów karboksylowych do alkenów otrzymuje się estry:


Nazwy estrów powstają w następujący sposób: najpierw nazywa się rodnik węglowodorowy związany z tlenem. W tym przypadku za atom nr 1 uważa się atom węgla stykający się z tlenem. Od tego atomu numerowany jest najdłuższy istniejący łańcuch. Grupy atomów nie zawarte w głównym łańcuchu są uważane za podstawniki i są wymienione zgodnie ze zwykłymi zasadami. Następnie dodaje się „ester takiego i takiego kwasu”.