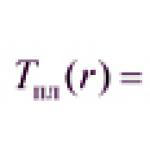Wyślij swoją dobrą pracę do bazy wiedzy jest prosta. Skorzystaj z poniższego formularza
Studenci, doktoranci, młodzi naukowcy, którzy wykorzystują bazę wiedzy w swoich studiach i pracy, będą Państwu bardzo wdzięczni.
Wysłany dnia http://www.allbest.ru/
Ministerstwo Zdrowia Republiki Uzbekistanu
Ministerstwo Szkolnictwa Wyższego i Specjalnego Republiki Uzbekistanu
PRAKTYKA Z CHEMII OGÓLNEJ
Taszkent – 2004
Recenzenci:
Profesor Katedry Chemii Bioorganicznej i Biologicznej II TashGosMI Kasymova S.S.
doc. Katedra Chemii Ogólnej TashPMI Arifdzhanov S.Z.
A.D.Juraev, N.T.Alimkhodzhaeva i inni.
Warsztaty z chemii ogólnej: Podręcznik dla studentów medycyny
Podręcznik zawiera treści zajęć laboratoryjnych z chemii ogólnej dla studentów instytutów medycznych. Dla każdej lekcji cele i zadania tego tematu, zagadnienia omawiane na lekcji, znaczenie badanego tematu, blok informacji na ten temat, zadania szkoleniowe ze standardami ich rozwiązania, zadania sytuacyjne, pytania, zadania i testy sprawdzające opanowanie tego tematu, podane są metody przeprowadzania badań laboratoryjnych, prace i zadania do samodzielnego rozwiązania.
Warsztaty zostały opracowane zgodnie z nowym programem nauczania przedmiotu „Chemia ogólna” dla studentów instytutów medycznych.
PRZEDMOWA
Chemia jest jedną z podstawowych ogólnych dyscyplin teoretycznych. Jest ściśle powiązana z innymi naukami przyrodniczymi: biologią, geografią, fizyką. Wiele działów współczesnej chemii powstało na styku chemii fizycznej, biochemii, geochemii itp. We współczesnej chemii powstało wiele niezależnych działów, z których najważniejsze to chemia nieorganiczna, chemia organiczna, chemia analityczna, chemia polimerów, chemia fizyczna itp. Chemia ogólna bada podstawowe pojęcia chemiczne, a także najważniejsze prawa związane z przemianami chemicznymi. Chemia ogólna obejmuje podstawy z różnych działów współczesnej nauki: chemii fizycznej, kinetyki chemicznej, elektrochemii, chemii strukturalnej itp. Do najważniejszych funkcji chemii ogólnej zalicza się, po pierwsze, tworzenie podstaw teoretycznych do pomyślnego opanowania dyscyplin specjalnych, po drugie, rozwój procesu nauczania nowoczesnych form myślenia teoretycznego przez uczniów, co jest niezwykle istotne, ponieważ wśród wymagań współczesnego specjalisty na pierwszym miejscu znajduje się potrzeba zarówno teoretycznego spojrzenia na przedmioty, jak i zjawiska studiowanych oraz umiejętność samodzielnego myślenia, umiejętność myślenia z perspektywy naukowej, wychodzenia poza ramy wąskiej specjalności w rozwiązywaniu złożonych problemów i nabywania praktycznych umiejętności podczas wykonywania analiz obiektów biologicznych.
Rola chemii w systemie edukacji medycznej jest dość duża. Studiowanie tak ważnych dziedzin medycyny jak biologia molekularna, genetyka, farmakologia, biochemia kwantowa itp. nie jest możliwa bez znajomości teorii budowy materii i powstawania wiązań chemicznych, termodynamiki chemicznej, mechanizmu reakcji chemicznych i innych zagadnień.
Jedną z sekcji chemii ogólnej według programu dla instytutów medycznych jest chemia bionieorganiczna, która powstała na bazie chemii nieorganicznej, biochemii, biologii i biogeochemii.
Chemia bionieorganiczna bada skład, strukturę, transformację biomolekuł zawierających jony metali i ich modelowanie. Nauka ta bada mechanizmy udziału jonów nieorganicznych w przebiegu procesów biochemicznych.
Korzystając z osiągnięć chemii bionieorganicznej, można wyjaśnić zachowanie pierwiastków chemicznych w układach biologicznych.
A dziś stwierdzenie wielkiego rosyjskiego naukowca M.V. Łomonosowa jest bardzo prawdziwe: „Lekarz nie może być doskonały bez dogłębnej znajomości chemii”.
WSTĘP
Podręcznik ten został opracowany, aby pomóc studentom medycyny studiującym chemię ogólną. Jest to niezbędne do samodzielnego przygotowania studentów do zajęć laboratoryjnych i praktycznych.
Celem tego podręcznika jest rozwinięcie u studentów, w oparciu o współczesne osiągnięcia, umiejętności jakościowego i ilościowego przewidywania produktów przemian substancji w organizmie żywym w oparciu o badanie typowych reakcji chemicznych, a także usystematyzowanie wiedzy z najważniejszych teoretycznych uogólnień chemii; uczyć zastosowania tej wiedzy do zjawisk zachodzących w organizmie żywym w warunkach normalnych i patologicznych.
W wyniku opanowania kursu chemii bionieorganicznej:
Uczeń powinien wiedzieć:
Badanie roztworów, na podstawie których ocenia się właściwości nieelektrolitów i elektrolitów w celu przewidywania wpływu środowiska na przebieg reakcji (procesów) biochemicznych; sposoby wyrażania składów roztworów; kierować się protolityczną teorią kwasów i zasad jako podstawą rozważań o oddziaływaniach kwasowo-zasadowych w organizmach żywych;
Podstawowe pojęcia i prawa związane z termodynamiką procesów chemicznych decydujące o kierunku i głębokości reakcji biochemicznych;
Podstawowe prawa kinetyki chemicznej w zastosowaniu do układów biologicznych;
Podstawowe wzorce procesów redoks i procesów wytrącania do przewidywania prawdopodobnych produktów przemian substancji w układach biochemicznych i leków stosowanych w medycynie;
Podstawowe zasady teorii budowy i reaktywności związków złożonych do przewidywania powstawania najbardziej prawdopodobnych produktów w organizmach żywych pomiędzy jonami metali i bioligandami do ich zastosowania w medycynie;
Typowe właściwości związków pierwiastków s, p, d w powiązaniu z ich lokalizacją w układzie okresowym pierwiastków D.I. Mendelejewa do przewidywania przemian pierwiastków chemicznych w układach biologicznych.
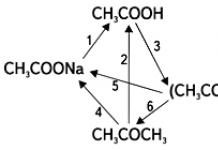
Rodzaje reakcji chemicznych. Reakcje egzotermiczne i endotermiczne
W wyniku opanowania kursu chemii bionieorganicznej
Uczeń musi to umieć:
samodzielnie pracować z literaturą dydaktyczną i referencyjną, wykorzystywać jej dane do rozwiązywania typowych problemów stosowanych w układach biologicznych;
wybrać warunki reakcji, w celu otrzymania konkretnych związków;
przewidzieć możliwość wystąpienia reakcji chemicznych i sporządzić równania reakcji na ich wystąpienie;
posiadać nowoczesną technologię laboratorium chemicznego do prowadzenia analiz jakościowych i ilościowych preparatów medycznych i obiektów biologicznych;
Kompiluj streszczenia przeprowadzonych analiz i uzasadniaj naukowo dane eksperymentalne uzyskane w zastosowaniu do praktyki medycznej.
Podręcznik zawiera cele i zadania tego tematu, zagadnienia omawiane na lekcji, znaczenie badanego tematu, blok informacji na ten temat, zadania szkoleniowe ze standardami ich rozwiązania, które stanowią orientacyjną podstawę do działania, gdy zastosowanie zasad teoretycznych do konkretnych zadań, a także zadań sytuacyjnych, pytań, zadań i testów w celu ustalenia opanowania tego tematu, sposobów prowadzenia pracy laboratoryjnej i zadań do samodzielnego rozwiązania.
Podręcznik ten opiera się na pracach, które były wykorzystywane od wielu lat w procesie edukacyjnym w I Państwowym Instytucie Medycznym w Taszkencie i Taszkencie PMI podczas studiowania kursu chemii ogólnej. Warsztaty opracowano zgodnie z programem nauczania przedmiotu „Chemia ogólna” dla studentów instytutów medycznych.
Podczas opracowywania podręcznika szczególną uwagę zwrócono na medyczne nastawienie nauczania chemii ogólnej.
Zasady pracy w laboratorium chemicznym
Technologia współczesnych badań chemicznych jest złożona i różnorodna. Początkowym etapem ich realizacji są laboratoryjne zajęcia praktyczne z chemii ogólnej, podczas których nabywane są podstawowe umiejętności pracy w laboratorium chemicznym ze sprzętem chemicznym, naczyniami szklanymi itp. w celu wykonywania prostych eksperymentów.
Każdy student pracujący w laboratorium chemicznym ma obowiązek bezwzględnie przestrzegać następujących zasad pracy:
I. Każdej osobie pracującej w laboratorium przydzielane jest stanowisko pracy, którego nie wolno zaśmiecać niepotrzebnymi przedmiotami, a także stawiać na stole teczek, książek, paczek itp. Miejsce pracy powinno być utrzymywane w porządku i czystości.
2. Przed każdą pracą laboratoryjną należy zapoznać się z materiałem teoretycznym z nią związanym, doświadczenia należy rozpoczynać dopiero po dokładnym zapoznaniu się z instrukcją (instrukcją) i wyjaśnieniu wszelkich niejasnych kwestii. Wszystkie prace laboratoryjne muszą być wykonywane indywidualnie.
3. Ostrożnie używaj odczynników, gazu, wody i prądu. Do eksperymentów należy przyjmować minimalne ilości substancji. Niewykorzystanych lub nadmiarowych odczynników nie wolno wrzucać do butelek. Pozostałości rzadkich, drogich i toksycznych związków wlewa się do specjalnych naczyń, którymi opiekuje się asystent laboratoryjny.
4. Natychmiast zamknąć wszystkie butelki z odczynnikami i roztworami korkami, których nie wolno wymieszać po użyciu. Zabrania się zabierania do lokalu odczynników publicznych. Nie zaleca się stawiania butelek z odczynnikami na książkach i zeszytach.
5. W laboratorium należy pracować w fartuchach laboratoryjnych, obowiązuje całkowity zakaz spożywania posiłków, palenia tytoniu i głośnego mówienia.
6. Po zakończeniu pracy należy umyć zużyte naczynia, dokładnie oczyścić miejsce pracy, wyłączyć gaz, wodę i prąd.
7. Wszystkie dane z wykonanych prac laboratoryjnych należy odnotować w dzienniku laboratoryjnym. Zawiera: materiał teoretyczny niezbędny do wykonania tej pracy, metody wykonywania prac laboratoryjnych, obserwacje, równania reakcji, obliczenia, odpowiedzi na pytania, rozwiązania problemów, naukowe wyniki analiz, wnioski wyciągnięte z badań. Wpis w dzienniku powinien być dokładny i opracowany w taki sposób, aby chemik niezaznajomiony z tą pracą po jej przeczytaniu mógł jasno wyobrazić sobie, w jaki sposób przeprowadzono eksperymenty, co w nich zaobserwowano i jakie wnioski wyciągnął eksperymentator przyszedł do. Zeszyt laboratoryjny należy wypełnić w trakcie przeprowadzanej analizy. Zabrania się stosowania jakichkolwiek przeciągów. Zakrywanie lub zmienianie liczb w protokole eksperymentu jest surowo zabronione.
Zasady bezpieczeństwa podczas pracy w laboratorium chemicznym
Podczas wykonywania prac laboratoryjnych w laboratorium chemicznym należy przestrzegać przepisów bezpieczeństwa.
Prace laboratoryjne są zwykle wykonywane na stole chemicznym. Stół musi być czysty. Przed rozpoczęciem prac laboratoryjnych należy upewnić się, że wszystkie odczynniki i naczynia szklane są dostępne.
Eksperyment należy przeprowadzić ściśle w kolejności wskazanej w jego opisie. Podczas podgrzewania nie trzymaj probówek i kolb otworem skierowanym w stronę siebie lub osoby pracującej w pobliżu; Nie wolno pochylać się nad otworem naczynia, w którym zachodzi reakcja.
Pracować z substancjami łatwopalnymi z dala od ognia.
Jeśli zapali się benzen, eter lub benzyna, nie można ugasić ognia wodą; należy wypełnić ogień piaskiem.
Pracować z substancjami żrącymi, toksycznymi i zapachowymi pod wyciągiem. Wlać stężone kwasy i zasady pod ciąg. Ich szczątków w żadnym wypadku nie należy wlewać do zlewu, lecz do specjalnie przeznaczonych do tego butelek. Pod napięciem należy wykonywać wszystkie reakcje, którym towarzyszy wydzielanie się toksycznych gazów lub oparów.
Gorące urządzenia i naczynia ustawiaj na specjalnych stojakach.
Jeżeli na twarzy lub dłoniach pojawi się kwas, należy go zmyć silnym strumieniem wody z kranu, a następnie przemyć zanieczyszczone miejsce rozcieńczonym roztworem sody herbacianej; W przypadku dostania się alkaliów na skórę należy dokładnie spłukać miejsce wodą, a następnie rozcieńczonym roztworem kwasu octowego.
W przypadku poparzenia gorącymi przedmiotami należy przykryć oparzone miejsce gazą nasączoną słabym roztworem nadmanganianu potasu. W przypadku skaleczenia szkłem krew należy przemyć słabym roztworem nadmanganianu potasu lub alkoholu, ranę nasmarować roztworem jodu i zabandażować.
Pamiętaj, że sole zawierające rtęć, arsen, bar i ołów są trujące; Po ich użyciu należy dokładnie umyć ręce.
Podczas badania gazu na podstawie zapachu trzymaj probówkę w lewej ręce tak, aby otwór znajdował się poniżej poziomu nosa, a prawą ręką kieruj w swoją stronę słaby strumień powietrza.
Musimy dobrze pamiętać, że w laboratorium chemicznym wymagana jest szczególna staranność, sumienność i dokładność podczas wykonywania prac laboratoryjnych. To zapewni sukces w pracy.
Każdy student może wykonywać pracę laboratoryjną dopiero po zapoznaniu się z zasadami bezpieczeństwa pracy w laboratorium chemicznym.
Zsposoby wyrażania stężenia roztworów w układzieSI.
Cel lekcji. Naucz się przeprowadzać obliczenia ilościowe w celu przygotowania roztworów o różnych stężeniach niezbędnych do analizy obiektów biologicznych. Naucz się eksperymentalnie sporządzać roztwory o zadanym stężeniu stosowane w praktyce lekarskiej.
Znaczenie badanego tematu. Roztwory ciekłe, przede wszystkim roztwory wodne, mają ogromne znaczenie w biologii i medycynie. Stanowią wewnętrzne środowisko organizmów żywych, w którym zachodzą procesy życiowe, przede wszystkim metabolizm. Płyny biologiczne: osocze krwi, limfa, sok żołądkowy, mocz itp. są złożonymi mieszaninami białek, lipidów, węglowodanów, soli rozpuszczonych w wodzie. Przy ich stosowaniu w leczeniu bierze się pod uwagę rozpuszczalność leków w wodzie. Roztwory produktów leczniczych w praktyce medycznej stosuje się zawsze z liczbowym wyrażeniem ich składu. Dlatego dla lekarza konieczna jest znajomość jednostek miary stężenia roztworów. Wykonywanie obliczeń ilościowych w celu przygotowania roztworów o danym stężeniu jest bardzo ważne w praktyce lekarskiej, ponieważ w analizach klinicznych, sanitarno-higienicznych i innych leki stosuje się w postaci roztworów o znanym stężeniu.
Początkowy poziom wiedzy:
1.Rozpuszczalność substancji w wodzie;
2. Pojęcia: substancja rozpuszczona, rozpuszczalnik, roztwór;
3. Chemiczna teoria tworzenia roztworów D.I. Mendelejewa;
4. Stężenie roztworów;
5. Roztwory są nasycone, nienasycone, przesycone, stężone, rozcieńczone.
N.L. Glinka. Chemia ogólna. L., 1976, s. 213.
S.S. Olenin, G.N. Fadeev. Chemia nieorganiczna. M., 1979, s. 107.
A.V.Babkov, G.N.Gorshkova, A.M.Kononov. Warsztaty z chemii ogólnej z elementami analizy ilościowej. M., 1978, s. 32.
Podczas zajęć zostaną poruszone następujące pytania::
Sposoby wyrażania stężeń roztworów:
I.1. udział masowy składnika - w(X), w(X)%:
I.2. ułamek molowy -N(X); udział objętościowy - f(X);
I.3. stężenie molowe-c(X);
I.4. stężenie molowe-in(X);
I.5. stężenie molowe równoważnika c(feq(x)x) = c(
I. 6. Współczynnik równoważności feq(x) = (
I.7. odpowiednik f eq(x)x = (
I.8. masa molowa równoważnika M f eq(x)x = M(
I.9. ilość równoważnika substancji n (f eq(x)x) = n(
I.10.Miano roztworu - t(x)
Rozwiązywanie problemów na dany temat.
3. Praca laboratoryjna
Binformacje o lokalizacji
Podstawowe pojęcia i jednostki miary stężenia roztworów w układzie SI.
Rozwiązania to jednorodne układy składające się z dwóch lub więcej elementów i produktów ich interakcji. . Do najważniejszych należą roztwory substancji stałych, ciekłych i gazowych w ciekłych rozpuszczalnikach, najczęściej wodzie.
Pewna ilość substancji rozpuszczonej zawarta w określonej ilości wagowej lub określonej objętości roztworu lub rozpuszczalnika nazywana jest stężeniem roztworu.
W związku z wprowadzeniem Międzynarodowego Układu Jednostek Miar (SI) nastąpiły pewne zmiany w sposobie wyrażania składu rozwiązania. W tym systemie podstawową jednostką masy, jak wiadomo, jest kilogram (kg), gram (g), jednostką objętości jest litr (l), mililitr (ml), jednostką ilości substancji jest kret.
Ilość substancji w układzie wynosiN(X) - wymiarowa wielkość fizyczna charakteryzująca się liczbą cząstek strukturalnych zawartych w układzie - atomów, cząsteczek, jonów, elektronów itp. Jednostką miary ilości substancji jest mol. Jest to ilość substancji zawierającej tyle cząstek rzeczywistych lub warunkowych, ile jest atomów zawartych w 0,012 kg izotopu węgla o masie 12. Na przykład: n(HCl) = 2 mol lub 2000 mmol; n(H+)= 3 x 10-3 mol; n(Mg2+) = 0,03 mol lub 30 mmol
Masa cząsteczkowa M(X) - Masa jednego mola substancji w układzie to stosunek masy substancji do jej ilości. Jednostki miary - kg/mol, g/mol.
M(X)=, g/mol
M(X)- masa molowa substancji X układu;
M(X)- masa substancji X układu;
N(X)- ilość substancji X układu.
Na przykład:
M(Cl2)=70,916 g/mol; M(Ca2+)=40,08 g/mol; M (NaCl) = 58,50 g/mol.
Udział masowy składnika -sch(X),sch%(X) - wartość względna reprezentująca stosunek masy danego składnika zawartego w układzie (roztworze) do całkowitej masy tego układu (roztworu) (zamiast pojęcia stężenia procentowego). Wyrażane w ułamkach jednostki i jako procent (%).
; ;
Na przykład: sch %(NaCl)=20%; sch %(HCl)=37%.
Molowy(molowa) część składnika -N ( X ) - wartość względna równa stosunkowi ilości substancji składnika zawartej w danym układzie (roztworze) do całkowitej ilości substancji układu (roztworu).
Ułamek molowy jest często oznaczany literą N(X).
Udział objętościowy składnika -F (X) - wartość względna równa stosunkowi objętości składnika zawartego w układzie (roztworze) do całkowitej objętości układu (roztworu).
Stężenie molowe -s(X) stosunek ilości substancji (X) w układzie (roztworze) do objętości tego układu (roztworu).
Z (X)= =, mol/l
Z (NSl) = 0,1 mol/l; c(Cty2+)= 0,2378 mol/l
Stężenie molowe -B(X) - stosunek ilości substancji (X) zawartej w układzie (roztworze) do masy rozpuszczalnika.
V(X) = mol/kg
Na przykład
w (NSl) = 0,1 mola/kg.
Współczynnik równoważności- F równanie(X)= - bezwymiarowa wielkość wskazująca, jaki ułamek rzeczywistej cząstki substancji (X) jest równoważny jednemu jonowi wodoru w reakcji kwasowo-zasadowej lub jednemu elektronowi w reakcji redoks. Współczynnik równoważności oblicza się na podstawie stechiometrii danej reakcji. Na przykład:
NaOH+H2SO4=Na2SO4+H2O; f równ.(NaOH)=1, Frównoważnik(H2WIĘC4 )=
Odpowiednik -F równanie (X) - ilość bezwymiarowa - rzeczywista lub warunkowa cząstka substancji (X), która w danej reakcji kwasowo-zasadowej łączy się z jednym molem wodoru lub jest mu w jakiś sposób równoważna lub równoważna jednemu elektronowi w reakcjach redoks.
Równoważnik masy molowej -M( F równanie(x)) = M masa jednego równoważnika molowego substancji, równa iloczynowi współczynnika równoważności i masy molowej substancji:
M(f eq(x)x) = M() = f eq(x)MM(x), g/mol
M(H2SO4) = M(H2SO4) = 49,0 g/mol
DOilość równoważnika substancji
N ( F równanie ( X ) X ) = N (
- ilość substancji, której cząsteczki są równoważne:
N(= , kret; N(Ok2+)= 0,5 mola
Równoważnik stężenia molowego
Z( F równanie(x)x)=c(
- stosunek ilości substancji równoważnej w układzie (roztworze) do objętości tego układu (roztworu):
Z(Frównanie(x)x)= s= =mol/l = 0,1 mol/l
Miano roztworu -T ( X )- masa substancji (X) zawarta w 1 ml roztworu:
T (X) = -,g/ml
T(HCl)= 0,003278 g/ml
Zadania szkoleniowe i standardy ich rozwiązania.
M(H2 O)=200,00g
M(CuSO4,5Н2О) =50,00g
M(CuSO4) = 342,16 g/mol
M(CuSO4·5Н2О)=25000 g/mol
sch%(CuSO4·5H2O)=?
sch% (CuSO4)=?
Odniesienie do rozwiązania
Znajdź masę powstałego rozwiązania:
M(P- P)= M(w-w)+M(H2 O)=50,00 g+200,C g=250,00 g.
M(p-p)=250,00G.
Znajdź udział masowy CuSO4 · 5H2O w roztworze:
sch% (CuSO45H2O) =
sch%( CuSO45H2O)=
Obliczamy masę bezwodnej soli w 50,00 g siarczanu miedzi. Masa molowa CuSO4·5H2O wynosi 250,00 g/mol, masa molowa CuSO4 wynosi 160,00 g/mol. Jeden mol CuSO4·5H2O zawiera jeden mol CuSO4. Zatem I mol x 250,00 g/mol = 250,00 g CuSO4 · 5H2O zawiera I mol x 160,00 g/mol = 342,16 g CuSO4:
w 250,00 g CuSO4 · 5H2O -160,00 g CuSO4
Tworzymy proporcję: 250,00:160,00 = 50,00:x.
Rozwiązując to, znajdujemy masę bezwodnego siarczanu miedzi:
Znajdź ułamek masowy bezwodnej soli:
sch%( CuSO4)=
sch%( CuSO4)=
sch%( CuSO4·5Н2О)=20%;sch%( CuSO4) = 25,60%
Zadanie nr 2 Ile ml 96% (masowego) roztworu H2SO4 (c = 1,84 g/ml) należy pobrać, aby przygotować 2 litry roztworu H2SO4 o stężeniu 0,1000 mol/l?
sch%(H2WIĘC4)=96%;
Z= 1,84 g/ml
V(P- P)=2,00l
Z(H2 WIĘC4)=0,1000 mol/l
M(H2WIĘC4) = 98,0 g/mol
V(H2WIĘC4)=?
Odniesienie do rozwiązania
1. Znajdź masę H2SO4 zawierającego w 2 litrach roztworu stężenie molowe 0,1000 mol/l. Wiadomo, że
Z(H2 WIĘC4)= , Następnie
M(H2WIĘC4)= c(H2 WIĘC4) M(H2WIĘC4) V(P- P)
M(H2WIĘC4)=0,1000 M98 M2,00 G
M(H2WIĘC4) = 19,60 g.
2. Znajdź masę 96% (masowego) roztworu H2SO4 zawierającego 19,60 g H2SO4
sch%(H2WIĘC4)=
M(P- P)=
3. Znajdź objętość roztworu H2SO4, znając jego gęstość.
M(P- P)= V(P- P) MZ (P- P); Następnie V(P- P)=
V(P- P)= 20,42/1,84 = 11,10 ml
V(H2 WIĘC4) = 11,10 ml
Zadanie nr 3. Określ stężenie molowe 200 g antyseptycznego 2,0% (wag.) roztworu alkoholu w kolorze zieleni brylantowej („zielonej”). M (jasnozielony) = 492 g/mol; (c=0,80 g/ml).
sch%(in-va)=2,0%
Z(roztwór) = 0,80 g/ml
M(v-v)=492,0g/mol
s(w-w)=?
Standard rozwiązania.
Znajdź masę substancji w 200,00 g jaskrawo zielonego roztworu.
Znajdź objętość roztworu alkoholu:
V(p-p)=V(p-p)=
Znajdź stężenie molowe c(v) w roztworze:
s(w-w)=s(w-w)=
s(cale)=0,06500mol/l
Zadanie nr 4. Miano roztworu NaOH, szeroko stosowanego w analizie leków, wynosi 0,003600 g/ml. W reakcji z kwasem siarkowym tworzy sól kwasową. Jakie jest stężenie molowe równoważnego roztworu w jego reakcji z kwasem siarkowym; udział masowy NaOH (%) w roztworze? Oblicz ilość NaOH potrzebną do przygotowania 1 litra takiego roztworu.
T(NaOH) = 0,003800 g/ml
V(P- P)=1,00 l
M(NaOH)=40,0 g/mol
Z (P- P) = 1,0 g/ml
Z(NaOH)=?m(NaOH)=?
sch%(NaOH)=?
Standard rozwiązania.
Równanie zachodzącej reakcji to:
H2SO4 + NaOH = Na HSO4 + H2O
Frówn(H2SO4)=1; Frówn(NaOH) = 1.
Zatem w tym przypadku powinniśmy mówić o stężeniu molowym roztworu NaOH.
Znajdź masę NaOH potrzebną do przygotowania 1000 ml roztworu:
t(NaOH)=
m(NaOH)= t(NaOH)V(p-p)
M(NaOH)=0,003800 1000gml/ml=3,8g
Znajdź stężenie molowe roztworu:
Z(NaOH) =
Z(NaOH) ==0,0950mol/l
Znajdź masę 1 litra roztworu:
M(roztwór)=1000ml 1 g/ml=1000g
4. Znajdź udział masowy NaOH (%) w roztworze:
sch%(NaOH)=
sch%(NaOH)=
Odpowiedź: Z(NaOH) = 0,0950 mola/l
sch%(NaOH)= 0,38%
M(NaOH) = 3,8 g
Zadania sytuacyjne.
1. Ile ml 30% (m.) roztworu HCl (c = 1,152 g/ml) należy pobrać, aby przygotować 1 litr 3% (m.) jego roztworu, przeznaczonego do użytku wewnętrznego w przypadku niedostatecznej kwasowości sok żołądkowy? Jakie jest stężenie molowe i miano powstałego roztworu. (Roztwór jest standaryzowany NaOH).
Odpowiedź: V(HCl) = 84,60 ml; c(HCl) = 0,8219 mol/l.
2. Oblicz stężenie molowe fizjologicznego roztworu NaCl. Ile wody należy dodać do 200 ml 20% roztworu NaCl (=1,012 g/ml), aby przygotować 5 l soli fizjologicznej?
Odpowiedź: c (NaCl) = 0,000147 mol/l
V(H2O) = 4504 ml
3. Kwas nikotynowy – witamina PP – odgrywa znaczącą rolę w życiu organizmu, będąc grupą szeregu enzymów prostaty. Jej niedobór prowadzi do rozwoju pelagry u ludzi. Ampułki do celów leczniczych zawierają 1 ml 0,1% (wag.) kwasu nikotynowego. Określ stężenie molowe równoważnika i miano tego roztworu
Standaryzację przeprowadza się za pomocą roztworu NaOH.
Odpowiedź: t(H-R)=0,00100g/ml
c(H-R)=0,08130 mol/l
Pytania testowe
Oblicz współczynnik równoważności Н2S04 w tej reakcji
Н2S04+KOH = KHS04 + H2O
a) 1b) 2c) 1/2d) 1/3d) 3
Miano roztworu NaOH wynosi 0,03600 g/ml. Znajdź stężenie molowe tego roztworu.
a) 9 mol/l b) 0,9 mol/l c) 0,09 mol/l d) 0,014 mol/l e) 1,14 mol/l
Do którego rozwiązania odnosi się wartość rozpuszczalności V?< V кристаллизация.
a) roztwór nasyconyc) roztwór przesycony
b) roztwór nienasycony d) roztwór rozcieńczony
e) stężony roztwór
Znajdź ułamek masowy (%) glukozy w roztworze zawierającym 280 g wody i 40 g glukozy
a) 24,6% b) 12,5% c) 40% d) 8% e) 15%
Określ współczynnik równoważności H2SO4 w tej reakcji
Mg(OH)2+2H2SO4=Mg(HSO4)2+2H2O
a) 2 b) 1 c) 1/2 d) 4 d) 3
Stężenie molowe substancji w roztworze określa się ze wzoru:
a) liczba molowa substancji w 1 litrze roztworu
b) liczba molowa substancji w 1 ml roztworu
c) liczba molowa substancji w 1 kg roztworu
d) liczba molowa substancji w 1 g roztworu
Ile jest rodzajów stanów skupionych rozwiązania?
a) 2b) 3c) 1 d) 4
9. Określ stężony roztwór NaOH:
a) 0,36% b) 0,20% c) 0,40% d) 36%
Znajdź stężenie molowe fizjologicznego roztworu NaCl.
n% (NaCl) = 0,85%
a) 1 mol/l b) 0,14 mol/l c) 1,5 mol/l e) 9,31 mol/l d) 10 mol/l
PRACA LABORATORYJNA 1
1.1 Przygotowanie roztworów o zadanym stężeniu
Istnieją trzy metody przygotowania roztworu o danym stężeniu:
rozcieńczanie bardziej stężonego roztworu
użycie określonej masy substancji stałej.
sposób stosowania fixanalu.
1. Przygotowanie 0,1 molowego roztworu kwasu siarkowego przez rozcieńczenie więcej niż stężony roztwór:
Do zlewki wlać roztwór kwasu siarkowego i za pomocą areometru określić gęstość tego roztworu. Następnie korzystając z tabeli określ udział masowy kwasu siarkowego w tym roztworze.
Odmierz wymaganą objętość kwasu siarkowego w małej zlewce i ostrożnie za pomocą lejka wlej go do kolby miarowej o pojemności 100 ml wypełnionej do połowy wodą destylowaną. Ochłodzić mieszaninę w kolbie miarowej do temperatury pokojowej i ostrożnie dodać wodę do kreski. Zamknąć kolbę miarową pokrywką i po dokładnym wymieszaniu przekazać ją laborantowi.
Przygotowanie roztworu poprzez rozpuszczenie określonej części ciała stałego:
Zapytaj nauczyciela, jakie stężenie roztworu musisz przygotować. Następnie wykonaj obliczenia: ile gramów soli należy rozpuścić, aby otrzymać roztwór o zadanym stężeniu i odważ potrzebną ilość soli z dokładnością do 0,01 g.
Mieszać roztwór szklanym prętem z gumową końcówką, aż sól całkowicie się rozpuści. Jeżeli podczas procesu rozpuszczania zaobserwuje się wzrost lub spadek temperatury, należy poczekać, aż roztwór osiągnie temperaturę pokojową.
Powstały roztwór wlać do suchego cylindra i za pomocą areometru zmierzyć gęstość powstałego roztworu. Korzystając z tabeli, określ ułamek masowy rozpuszczonej substancji odpowiadający gęstości.
% błąd = (shteor-schpractic) · 100/shteor
Wwewprowadzenie do analizy miareczkowej
Cel lekcji: Zapoznanie z podstawami analizy miareczkowej, jako jednej z ilościowych metod badawczych stosowanych w praktyce lekarskiej do analizy obiektów biologicznych i leków oraz do oceny sanitarnej środowiska.
Znaczenie badanego tematu. Metoda analizy miareczkowej (objętościowej) jest szeroko stosowana w badaniach biomedycznych w celu określenia składu ilościowego obiektów biologicznych, preparatów leczniczych i farmakologicznych.
Bez wiedzy na temat składu różnych środowisk organizmów żywych nie jest możliwe zrozumienie istoty procesów w nich zachodzących, ani opracowanie naukowo uzasadnionych metod leczenia. Rozpoznanie wielu chorób opiera się na porównaniu wyników badań danego pacjenta z prawidłową zawartością określonych składników we krwi, moczu, soku żołądkowym oraz innych płynach i tkankach ustrojowych. Dlatego lekarze, zwłaszcza lekarze, muszą znać podstawowe zasady i metody analizy miareczkowej.
Początkowy poziom wiedzy.
Podstawy teorii dysocjacji elektrolitycznej kwasów, zasad, soli;
Rodzaje reakcji chemicznych (w postaci molekularnej i jonowej);
Metody wyrażania stężeń roztworów.
Materiał edukacyjny do samodzielnej nauki.
1. V.N. Aleksiejew. Analiza ilościowa. M., 1972, s. 193.
2. AA Seleznev. Chemia analityczna. M., 1973, s. 164.
I.K. Citowicz. Kurs chemii analitycznej. M., 1985, s.212.
Lekcja będzie dotyczyć następujących pytań:
1. Zagadnienia chemii analitycznej
2. Istota metod analizy miareczkowej
2.1. Podstawowe pojęcia: rozwiązania stosowane w analizie miareczkowej
2.2. Punkt równoważności
2.3. Wymagania dotyczące reakcji stosowanych w analizie miareczkowej
2.4. Szkło miarowe: biurety, pipety, kolby miarowe, cylindry miarowe.
2.5. Technika miareczkowania.
2.6. Obliczenia metodą miareczkową
2.7. Klasyfikacja metod analizy miareczkowej
Zastosowanie metod analizy miareczkowej w praktyce lekarskiej.
4. Praca laboratoryjna
Blok informacyjny
Chemia analityczna to nauka badająca metody określania jakościowego i ilościowego składu chemicznego substancji lub ich mieszanin. Dzieli się ją na analizę jakościową i ilościową. Metody analizy jakościowej służą do określenia, z jakich pierwiastków chemicznych, atomów, jonów lub cząsteczek składa się analizowana substancja. Metody analizy ilościowej służą do ustalenia stosunków ilościowych składników badanego związku.
Analizę ilościową przeprowadza się różnymi metodami. Powszechnie stosowane są metody chemiczne, w których ilość substancji określa się na podstawie ilości odczynnika zużytego na miareczkowanie, ilości osadu itp. Do najważniejszych należą trzy metody: grawimetryczna, miareczkowa (objętościowa) i kolorymetryczna.
Istotą analizy grawimetrycznej jest całkowite wyodrębnienie składnika analizowanej substancji z roztworu w postaci osadu, który zbiera się na filtrze, suszy, kalcynuje w tyglu i waży. Znając masę powstałego osadu, zawartość pożądanego składnika określa się za pomocą wzoru chemicznego tego ostatniego.
W analizie miareczkowej (objętościowej) ilościowe oznaczenie składników analitu przeprowadza się poprzez dokładny pomiar objętości odczynnika o znanym stężeniu, który wchodzi w reakcję chemiczną z analitem.
Kolorymetryczna metoda analizy polega na porównaniu intensywności barwy roztworu badawczego z barwą roztworu, którego stężenie jest dokładnie znane.
W analizie klinicznej najpowszechniej stosowane są metody analizy miareczkowej, gdyż nie wymagają dużo czasu, są łatwe w wykonaniu i pozwalają na uzyskanie w miarę dokładnych wyników.
Metoda analizy miareczkowej polega na precyzyjnym pomiarze objętości odczynnika zużytego w reakcji z analitem X. Proces dodawania jednego roztworu w biurecie do drugiego w celu określenia stężenia jednego z nich (przy znanym stężeniu drugi) nazywa się miareczkowaniem. Termin miareczkowanie pochodzi od słowa miano, które oznacza zawartość odczynnika w gramach w 1 ml roztworu.
Roztwór odczynnika o dokładnie znanym stężeniu nazywany jest roztworem roboczym miareczkowanym lub roztworem wzorcowym. Roztwór o dokładnie znanym stężeniu można otrzymać rozpuszczając dokładną próbkę substancji w znanej objętości roztworu lub wyznaczając stężenie innym roztworem, którego stężenie jest z góry znane. W pierwszym przypadku otrzymuje się roztwór o przygotowanym mianie, w drugim - o ustalonym mianie.
Do przygotowania roztworu o danym stężeniu nadają się tylko te substancje, które można otrzymać w bardzo czystej postaci, mają stały skład i nie zmieniają się w powietrzu ani podczas przechowywania. Substancje te obejmują wiele soli (tetraboran sodu Na2B4O7·10H2O, szczawian sodu Na2C2O4, dichromian potasu K2Cr2O7, chlorek sodu NaCl); kwas szczawiowy H2C2O4 2H2O i kilka innych. Substancje spełniające wymienione wymagania nazywane są początkowymi lub standardowymi.
Dokładne określenie stężenia roztworów roboczych jest jednym z głównych warunków uzyskania dobrych wyników analizy objętościowej. Starannie przygotowane i przetestowane roztwory robocze przechowywane są w warunkach uniemożliwiających zmiany stężenia roztworu na skutek odparowania, rozkładu substancji lub zanieczyszczenia z otoczenia. Stężenie roztworów roboczych sprawdza się okresowo za pomocą roztworów wzorcowych.
Do przygotowania miareczkowanych roztworów można także użyć dostępnych na rynku utrwalaczy. Są to ampułki szklane zawierające dokładnie odważone ilości różnych substancji stałych lub dokładnie odmierzone objętości cieczy niezbędne do przygotowania 1 litra roztworu o dokładnym równoważniku stężenia molowego. Aby przygotować roztwór z fixanalu, zawartość ampułki przenosi się do 1-litrowej kolby miarowej, po czym substancję rozpuszcza się i objętość dostosowuje do kreski.
Podczas miareczkowania należy ustalić punkt końcowy reakcji, tj. punkt równoważności, gdy ilości reagentów w mieszaninie stają się równoważne. W tym celu analiza miareczkowa wykorzystuje wskaźniki. Wskaźniki to substancje dodawane w małych ilościach do roztworów podczas miareczkowania i zmieniające kolor w punkcie równoważności.
Aby określić moment równoważności, oprócz koloru, można zastosować zmiany innych właściwości roztworu, ale wymaga to pomiarów fizykochemicznych. Te ostatnie są coraz częściej stosowane w analizie wolumetrycznej.
W analizie miareczkowej wykorzystuje się tylko te reakcje, które spełniają następujące warunki:
interakcja między analitem a odczynnikiem musi zachodzić w określonych stosunkach stechiometrycznych;
reakcja między analitem a odczynnikiem musi przebiegać z dużą szybkością;
reakcja chemiczna pomiędzy analitem i odczynnikiem musi przebiegać całkowicie, tj. Odwracalność reakcji nie jest dozwolona;
reakcji pomiędzy analitem a odczynnikiem nie powinny towarzyszyć żadne reakcje uboczne.
Do dokładnego odmierzania objętości stosuje się przyrządy pomiarowe: biurety, pipety, kolby miarowe i cylindry miarowe.
Biurety przeznaczone są do miareczkowania i dokładnego pomiaru objętości zużytego odczynnika. Są to probówki szklane ze skalą, których dolny koniec jest zwężany i wyposażony w kran ze szlifowanego szkła lub gumową rurkę z korkiem kulkowym połączoną z pipetą. Biurety wykonywane są o pojemnościach od 10 do 100 ml. Do szczególnie dokładnych analiz wykorzystuje się mikrobiurety o pojemności 1 i 2 ml. Najczęściej stosowane biurety mają pojemność od 10 do 50 ml. Podziałka biurety rozpoczyna się od góry, stamtąd duże podziałki o pojemności 1 ml schodzą do dolnego znaku. Całe mililitry dzieli się na części dziesiąte. Objętość cieczy wylewanej z biurety określa się na podstawie różnicy poziomów przed i po miareczkowaniu. Odczyty poziomu cieczy muszą być wykonywane bardzo dokładnie. Dokładność odczytów utrudnia fakt, że biureta posiada wklęsły menisk. Widoczny kształt menisku zależy od warunków oświetleniowych, dlatego podczas wykonywania pomiarów biały papier należy umieszczać tuż za biuretą. Podczas liczenia oczy powinny znajdować się na poziomie menisku. Biurety napełnia się za pomocą lejka. Górna część biurety jest przykryta nakrętką, która zapobiega przedostawaniu się do wnętrza kurzu. Przed napełnieniem roztworem biuretę należy trzykrotnie przepłukać tym samym roztworem.
Pipety stosuje się w przypadkach, gdy konieczne jest odmierzenie określonej dokładnej objętości cieczy z przygotowanego roztworu i przeniesienie jej do innego naczynia. Pipety to szklane rurki z rozszerzeniem w środku i lekkim zwężeniem w dolnym końcu. Pojemność pipety jest podana na górze. Pipety produkowane są w pojemnościach od 1 ml do 100 ml. Pipety z podziałką mają podziałkę 25, 10, 5, 2, 1 ml. Do pomiaru tysięcznych części mililitra stosuje się również mikropipety o pojemności 0,2 i 0,1 ml. Pipety przechowywane są na specjalnych stojakach w pozycji pionowej. Napełnij pipetę roztworem za pomocą gumowej gruszki lub pobierz roztwór do pipety ustami przez górną część probówki. Ta ostatnia metoda nie jest zalecana ze względu na możliwość przedostania się płynu do ust. Napełniając pipetę roztworem, należy zassać ten ostatni nieco powyżej oznaczenia, a następnie szybko zacisnąć palcem wskazującym górny otwór, tak aby płyn nie wylał się z pipety. Napełnioną pipetę podnosi się lekko tak, aby końcówka wychodziła tylko z roztworu, a nie z naczynia, z którego pobierany jest roztwór. Następnie trzymając oko na wysokości znaku, ostrożnie zwolnij nacisk palca, lekko unosząc jego koniec, a ciecz zacznie wypływać kropla po kropli. Gdy dolna część menisku osiągnie linię zaznaczenia, otwór pipety szczelnie zamyka się palcem, a odmierzoną ciecz przelewa się do innego naczynia. Opróżnianie roztworu z pipety odbywa się poprzez przyłożenie końcówki pipety do ścianki naczynia, do którego wlewa się roztwór. Zwykle należy pozwolić roztworowi swobodnie spłynąć lub spowolnić jego opróżnianie, zakrywając palcem część górnego otworu pipety. Po wylaniu całego płynu należy odczekać 20–30 sekund, a następnie wyjąć pipetę z naczynia. Kropla cieczy pozostająca na końcówce pipety nie powinna zostać wydmuchana, gdyż brano to pod uwagę podczas kalibracji pipety. Podczas pracy z pipetą, przed napełnieniem jej roztworem, należy kilkakrotnie przepłukać pipetę tym samym roztworem.
Po zakończeniu pracy pipetę należy przepłukać wodą destylowaną.
Kolby miarowe służą głównie do sporządzania roztworów o określonym stężeniu. Są to naczynia płaskodenne z wąską i długą szyją. Na szyjce znajduje się znak w postaci pierścienia, do którego należy napełnić kolbę (wzdłuż dolnej krawędzi menisku cieczy), aby uzyskać objętość wskazaną na szerokiej części kolby. Kolby miarowe przeznaczone są do pojemności 50, 100, 200, 500, 1000, 5000 ml. Pojemność kolby podana jest w napisie na kolbie. Kolbę zamyka się szlifowanym szklanym korkiem. Napełnij kolbę najpierw przez włożony do niej lejek, a następnie za pomocą pipety tak, aby dolny menisk znajdował się naprzeciwko linii.
Cylindry miarowe służą do odmierzania określonych objętości roztworów, gdy dokładność nie ma większego znaczenia. Są wygodne do mieszania i rozcieńczania roztworów o określonej objętości. Wzdłuż wysokości cylindra znajdują się podziały. Podczas pomiaru oko powinno zawsze znajdować się na poziomie dolnej łąkotki. Cylindry miarowe nie służą do dokładnego pomiaru objętości.
Naczynia szklane przeznaczone do wykonywania analiz chemicznych należy dokładnie umyć. Jest to jeden z najważniejszych elementów pracy zapewniający dokładne wyniki. Kryterium czystości wyrobów szklanych jest wypływ kropelek wody z wewnętrznych ścianek. Jeśli podczas płukania na ścianach pojawią się krople, to przed rozpoczęciem pracy należy ponownie umyć naczynia. Możesz użyć specjalnych pędzli. Następnie naczynia wypełnia się mieszaniną chromu, która utlenia ślady substancji organicznych na szkle i utrzymuje przez pewien czas (do pół godziny). Po umyciu naczyń mieszaninę chromu zbiera się do ponownego użycia. Po wlaniu mieszaniny chromu do butelki zbierającej, naczynia płucze się najpierw wodą wodociągową, a następnie wodą destylowaną. Jeśli naczynia muszą być używane na sucho, suszy się je w specjalnych suszarniach.
Miareczkowanie przeprowadza się w następujący sposób:
Czystą biuretę przepłukuje się 2-3 razy niewielką ilością roztworu roboczego w celu usunięcia resztek wody.
Zamocuj biuretę pionowo w nodze statywu i napełnij ją miareczkowanym roztworem do poziomu nieco powyżej zera.
Część roztworu wlewa się do dostarczonego szkła, aby wyprzeć powietrze z gumowej rurki i pipety.
Doprowadź poziom cieczy do zera. Na końcówce biurety nie powinna pozostać kropla roztworu (usuwa się ją poprzez dotknięcie szkła).
Roztwór testowy odpipetowuje się do kolby miareczkowej.
Stopniowo wlewaj ciecz z biurety do kolby, aż do ustalenia punktu równoważności.
Podczas odczytywania płynu oko trzyma się dokładnie na poziomie menisku. W przypadku roztworów kolorowych odczytu dokonuje się wzdłuż górnego menisku, dla roztworów bezbarwnych – wzdłuż dolnego.
Po zakończeniu pracy biuretę napełnia się wodą powyżej podziałki zerowej i zamyka od góry probówką.
Podczas analiz chemicznych mogą wystąpić błędy, dlatego przeprowadza się kilka równoległych pomiarów. Błędy systematyczne w analizie miareczkowej mogą wynikać z nieprawidłowego określenia stężenia roztworów roboczych, zmian stężenia podczas przechowywania, niedokładności naczyń miarowych, nieprawidłowego doboru wskaźnika itp.
Źródłem błędów losowych są: niedokładność w napełnieniu biurety do podziałki zerowej, niedokładność odczytu objętości na skali biurety, niepewność co do nadmiaru odczynnika po dodaniu ostatniej kropli roztworu roboczego podczas miareczkowania.
Obliczenia w analizie miareczkowej przeprowadza się wg prawo ekwiwalentów: przy tych samych stężeniach molowych równoważnika roztwory oddziałują ze sobą w równych objętościach. Przy różnych stężeniach objętości roztworów substancji oddziałujących są odwrotnie proporcjonalne do ich stężeń:
V1 s(1/z X1) = V2 s(1/z X2) (1)
Dla obu reagentów iloczyn stężenia molowego odpowiednika jego roztworu i objętości jest wartością stałą. W oparciu o prawo ekwiwalentów można przeprowadzić różne obliczenia ilościowe.
Na przykład, znając stężenie molowe odpowiednika jednego roztworu, a także objętości roztworów zużytych na miareczkowanie, możesz określić stężenie molowe i miano innego roztworu. Na przykład:
Do zneutralizowania 20,00 ml roztworu kwasu siarkowego zużyto 12,00 ml roztworu zasady o stężeniu molowym 0,2000 mol/l. Oblicz stężenie molowe równoważnika i miano kwasu siarkowego w tym roztworze.
2 NaOH + H2SO4 = Na2SO4 + 2 H2O
NaOH + S H2SO4 = S Na2SO4 + H2O
Z równania jasno wynika, że współczynnik równoważności H2SO4 jest równy ½, a współczynnik równoważności NaOH jest równy 1. Podstawiając wartości do wzoru (1) otrzymujemy:
c(S H2SO4) = 0,2000 mol/l · 12,00 ml / 20,00 ml = 0,1200 mol/l
t(Н2SO4) = с(1/2 H2SO4) · M(1/2 H2SO4) / 1000, g/ml
Zatem t(H2SO4) = 0,1200 mol/l 49 g/m/1000 = 0,005880 g/mol
Obliczenia w analizie miareczkowej muszą być przeprowadzane z dużą dokładnością.
Objętości roztworów odmierza się z dokładnością do setnych mililitra, np.: V (HCl) = 10,27 ml lub V (NaOH) = 22,82 ml. Stężenie roztworów oblicza się z dokładnością do czwartej cyfry znaczącej, na przykład:
c(NSI)=0,1025 mol/l
C (NaOH)=0,09328 mol/l
T(NSI) = 0,003600 g/ml
W zależności od reakcji będącej podstawą oznaczenia, metody analizy wolumetrycznej można podzielić na następujące grupy:
Metody miareczkowania kwasowo-zasadowego lub metoda neutralizacji
Metody oksydacyjno-redukcyjne lub oksydometryczne
Metoda kompleksometryczna
Metody opadów
Zadania i standardy edukacyjne oraz ich rozwiązania
Zadanie nr 1. W medycynie nadmanganian potasu stosuje się jako środek antyseptyczny zewnętrznie do przemywania ran i gardła - roztwór 0,1-0,5%, do płukania - roztwór 001 - 01%, do płukania żołądka - roztwór 0,02 - 0,1%. Którą metodę analizy miareczkowej można zastosować do obliczenia stężenia roztworu nadmanganianu potasu, jeśli dostępny jest miareczkowany roztwór kwasu szczawiowego?
Odniesienie do rozwiązania
Nadmanganian potasu jest utleniaczem, kwas szczawiowy jest reduktorem. Ponieważ reakcja pomiędzy tymi składnikami ma charakter redoks, do określenia stężenia nadmanganianu potasu można zastosować metodę permanganatometrii.
Zadanie nr 2. Określ stężenie molowe równoważnika i miano chlorowodoru, jeśli do miareczkowania 20,00 ml tego roztworu użyto 19,87 ml 0,1 mol/l roztworu NaOH.
V(HCl) = 20,00 ml
V(NaOH) = 19,87 ml
c(NaOH) = 0,1000 mol/l
M(HCl) = 36,5 g/mol
C(HCl) =?T(HCl) =?
Standard rozwiązania.
Równanie zachodzącej reakcji to:
NaOH + HCl = NaCl + H2O
Zatem: f eq (NaOH) = 1, f eq (HCl) = 1.
Korzystając z prawa równoważników, znajdujemy stężenie molowe roztworu HCl:
c(NaOH) V(NaOH) = c(NSl) V(HCl)
C(HCl) =mol/l
Na podstawie wartości c(HCl) obliczamy miano tego roztworu:
t(HCl) =
T(HCl)= 0,003627 g/ml
Odpowiedź: c(HCl) = 0,09935 mol/l
t(HCl) = 0,003627 g/ml
Zadania sytuacyjne.
Odpowiedź: V(NaOH) = 12,33 ml.
2. W jakich przypadkach punkt równoważności leży przy pH=7, przy pH<7, при рН>7?
Odpowiedź: Podczas miareczkowania mocnego kwasu zasadą punkt równoważny pokrywa się z punktem neutralnym; podczas miareczkowania słabego kwasu zasadą punkt równoważny leży przy wartościach pH<7, при титровании слабого основания сильной кислотой эквивалентная точка лежит выше нейтральной точки.
3. Octan ołowiu – Pb(CH3COO)2 – działa ściągająco na zapalne choroby skóry. Stosuje się 0,5% roztwór. Oblicz masę tej substancji, aby przygotować 100 ml 0,5% (masowego) roztworu. Jaki jest udział masowy ołowiu (%) w tym roztworze? P= 1 g/ml.
Odpowiedź: m(Pb(CH3COO)2 = 0,5 g w% = (Pb) = 0,32%.
Pytania testowe.
1. Jaka wartość miana roztworu t(HCl) odzwierciedla wymagany stopień dokładności oznaczeń w analizie miareczkowej
a) 0,03 g/ml b) 0,003715 g/ml c) 0,0037578 g/ml) 3,7 g/ml d) 0,0037 g/ml
2. Jakie wartości objętości są spójne w analizie miareczkowej?
a) 2,51 ml; 10,52 ml; 8,78 ml d) 15,27 ml; 15,22 ml; 15,31ml
b) 5,73 ml; 7,02 ml; 15,76 ml c) 1,07 ml; 5,34 ml; 0,78ml.
3. Jakiego przyrządu pomiarowego używa się do określenia objętości miareczkowanego roztworu?
a) pipeta c) kolba miarowa b) biureta c) kolba
4. Jaka reakcja jest podstawą miareczkowania kwasowo-zasadowego?
a) reakcja redoks
b) reakcja neutralizacji
c) reakcja tworzenia związków kompleksowych
d) reakcja zachodząca z wydzieleniem ciepła
5. Który roztwór nazywa się miareczkowanym?
a) roztwór o nieznanym stężeniu
b) świeżo przygotowany roztwór
c) roztwór odczynnika o dokładnie znanym stężeniu
d) roztwór, którego stężenie należy oznaczyć
6.Co to jest punkt równoważności?
a) jest to punkt końcowy reakcji b) jest to punkt początkowy reakcji
c) oddziaływanie dwóch substancji d) punkt, w którym objętości są równe
7. Na jakim prawie opierają się obliczenia w analizie miareczkowej?
a) prawo zachowania masy materii b) prawo równoważników
c) Prawo rozcieńczenia Ostwalda d) Prawo Raoulta
8. W jakim celu stosuje się pipety?
a) do pomiaru dokładnej objętości roztworu b) do miareczkowania
c) do przygotowania roztworów d) do rozcieńczania roztworu
9. Jakie jest miano roztworu?
a) jest to liczba gramów rozpuszczonej substancji w 1 litrze roztworu
b) jest to liczba moli rozpuszczonej substancji w 1 litrze roztworu
c) jest to liczba moli substancji rozpuszczonej w 1 kg roztworu
d) jest to liczba gramów substancji rozpuszczonej w 1 ml roztworu
10.Jakich substancji używa się do wyznaczania punktu równoważności?
a) wskaźniki b) inhibitory c) promotory d) katalizatory
LPRACA ABORACJA 2
2.1 Techniki pracy z laboratoryjnym szkłem pomiarowym stosowanym w tytanie analiza rymetryczna (na wodzie)
...Podobne dokumenty
Podstawowe pojęcia termodynamiki chemicznej. Standardowa entalpia spalania substancji. Wnioski z prawa Hessa. Rola chemii w rozwoju nauk medycznych i praktycznej opieki zdrowotnej. Elementy termodynamiki chemicznej i bioenergetyki. Termochemia.
prezentacja, dodano 01.07.2014
Istota i przedmiot chemii analitycznej jako nauki. Zadania i metody analizy jakościowej i ilościowej substancji chemicznych. Przykłady jakościowych reakcji na kationy. Charakterystyka zjawisk towarzyszących reakcjom drogą mokrą (w roztworach) i suchą.
prezentacja, dodano 27.04.2013
Zastosowanie analizy jakościowej w farmacji. Określanie autentyczności, badanie czystości farmaceutyków. Metody przeprowadzania reakcji analitycznych. Praca z odczynnikami chemicznymi. Reakcje kationów i anionów. Systematyczna analiza substancji.
poradnik, dodano 19.03.2012
Pochodzenie terminu „chemia”. Główne okresy rozwoju nauk chemicznych. Rodzaje najwyższego rozwoju alchemii. Okres narodzin chemii naukowej. Odkrycie podstawowych praw chemii. Podejście systemowe w chemii. Współczesny okres rozwoju nauk chemicznych.
streszczenie, dodano 11.03.2009
Teoretyczne podstawy chemii analitycznej. Spektralne metody analizy. Związki chemii analitycznej z naukami ścisłymi i przemysłem. Znaczenie chemii analitycznej. Zastosowanie precyzyjnych metod analizy chemicznej. Złożone związki metali.
streszczenie, dodano 24.07.2008
Główne etapy rozwoju chemii. Alchemia jako zjawisko kultury średniowiecznej. Powstanie i rozwój chemii naukowej. Początki chemii. Lavoisier: rewolucja w chemii. Zwycięstwo nauki atomowo-molekularnej. Geneza współczesnej chemii i jej problemy w XXI wieku.
streszczenie, dodano 20.11.2006
Pojęcie refrakcji jako miara polaryzacji elektronowej atomów, cząsteczek, jonów. Ocena współczynnika załamania światła do identyfikacji związków organicznych, minerałów i substancji leczniczych, ich parametrów chemicznych, analiza ilościowa i strukturalna.
praca na kursie, dodano 05.06.2011
Metoda potencjometryczna jest metodą analizy jakościowej i ilościowej polegającą na pomiarze potencjałów powstających pomiędzy roztworem badanym a zanurzoną w nim elektrodą. Krzywe miareczkowania potencjometrycznego.
test, dodano 09.06.2006
„Sztuka probiercza” i historia powstania laboratoriów. Twórczy rozwój zachodnioeuropejskiej nauki chemicznej. Łomonosow M.V. jako chemik analityczny. Rosyjskie osiągnięcia w dziedzinie analizy chemicznej w XVIII-XIX wieku. Rozwój chemii gospodarczej w XX wieku.
praca na kursie, dodano 26.10.2013
Od alchemii do chemii naukowej: droga prawdziwej nauki o przemianach materii. Rewolucja w chemii i naukach atomowo-molekularnych jako podstawa pojęciowa współczesnej chemii Problemy środowiskowe składnika chemicznego współczesnej cywilizacji.
Federalna Agencja Edukacji Tomski Państwowy Uniwersytet Architektury i Inżynierii Lądowej
I.A. KURZINA, T.S. SZEPELENKO, G.V. LYAMINA, I.A. BOŻKO, E.A. WAYTULEWICZ
PRAKTYKA LABORATORYJNA Z CHEMII OGÓLNEJ I NIEORGANICZNEJ
Instruktaż
Wydawnictwo Tomskiego Państwowego Uniwersytetu Architektury i Inżynierii Lądowej
UDC 546 (076,5) L 12
Warsztaty laboratoryjne z chemii ogólnej i nieorganicznej [Tekst]: podręcznik / I.A. Kurzina, T.S. Shepelenko, G.V. Lyamina [i inni]; pod. wyd. I.A. Kurzina.
Tomsk: Wydawnictwo Tom. państwo architekt-buduje Uniwersytet, 2006. – 101 s. – ISBN 5–93057–172–4
W Podręcznik zawiera informacje teoretyczne dotyczące głównych części kursu ogólnego
I chemia nieorganiczna (klasy związków nieorganicznych, podstawowe prawa i pojęcia chemii, skutki energetyczne reakcji chemicznych, kinetyka chemiczna, roztwory, elektrochemia, podstawowe właściwości niektórych pierwiastków z grup I – VII układu okresowego D.I. Mendelejewa). W części doświadczalnej opisano metody wykonania siedemnastu prac laboratoryjnych. Podręcznik pozwoli studentom efektywniej przygotować się do zajęć praktycznych i zaoszczędzić czas przy sporządzaniu sprawozdań z pracy laboratoryjnej. Podręcznik przeznaczony jest dla wszystkich specjalności i wszystkich form kształcenia.
Chory. 14, stół. 49, bibliogr. 9 tytułów Wydane decyzją rady redakcyjnej i wydawniczej TSASU.
Recenzenci:
Profesor nadzwyczajny Katedry Chemii Analitycznej Wydziału Chemicznego UJ, dr hab. V.V. Shelkovnikov profesor nadzwyczajny, Wydział Chemii Ogólnej, TPU, dr hab. GA Voronova profesor nadzwyczajny, Wydział Chemii, TSASU, dr. T.M. Juzakowa
Uniwersytet, 2006
Wstęp........................... |
||||
Zasady pracy w laboratorium chemicznym............................................ .................. .............. |
||||
Praca laboratoryjna nr 1. Klasy związków nieorganicznych................................... |
||||
Praca laboratoryjna nr 2. Oznaczanie masy cząsteczkowej tlenu................... |
||||
Praca laboratoryjna nr 3. Oznaczanie efektu cieplnego reakcji chemicznej.... |
||||
Praca laboratoryjna nr 4. Kinetyka reakcji chemicznych............................................ |
||||
Praca laboratoryjna nr 5. Oznaczanie stężenia roztworu. Twardość wody... |
||||
Praca laboratoryjna nr 6. Reakcje w roztworach elektrolitów. Hydroliza soli............ |
||||
Praca laboratoryjna nr 7. Procesy elektrochemiczne............................................. |
||||
Praca laboratoryjna nr 8. Właściwości chemiczne metali. Korozja........................ |
||||
Praca laboratoryjna nr 9. Aluminium i jego właściwości.................................................... |
||||
Praca laboratoryjna nr 10. Krzem. Spoiwa hydrauliczne................................. |
||||
Praca laboratoryjna nr 11. Związki azotu i fosforu............................................. |
||||
Praca laboratoryjna nr 12. Siarka i jej właściwości............................................................... |
||||
Praca laboratoryjna nr 13. Elementy podgrupy chromu.............................................. |
||||
Praca laboratoryjna nr 14. Halogeny .................................................. ...................................... |
||||
Praca laboratoryjna nr 15. Pierwiastki podgrupy manganu......................................... |
||||
Praca laboratoryjna nr 16. Podgrupa rodziny żelaza............................................. |
||||
Wniosek................................................. .................................................. ...................... |
||||
Aneks 1. Lista niezbędnych kwasów........................................................................ |
||||
Dodatek 2. Charakterystyka kwas-zasada wskaźniki .................................. |
||||
Załącznik 3. Najważniejsze fizykochemiczne ilości .................................................. .... |
||||
Załącznik 4. Najważniejsze fizykochemiczne stałe .................................................. .... |
||||
Dodatek 5. Zależność pomiędzy jednostkami miary........................................... |
||||
Załącznik 6. Przedrostki wielokrotności i podwielokrotności.................................................... |
||||
Dodatek 7. Stałe krioskopowe i ebulioskopowe niektórych ras |
||||
twórcy .................................................. .................................................... .................................. |
||||
Dodatek 8. |
dysocjacja elektrolityczna (α) z najważniejszych |
|||
elektrolity w roztworach 0,1 N w temperaturze 25°C............................................................................. |
||||
Załącznik 9. |
Stałe |
dysocjacja |
niektóre elektrolity w wodzie |
|
roztwory w temperaturze 25°C............................................................................................................... |
||||
Załącznik 10. |
rozpuszczalność |
związki nieorganiczne przy |
||
temperatura pokojowa......................................................................................................... |
||||
Załącznik 11. Zakres napięcia elektrochemicznego i elektroda wzorcowa |
||||
potencjałów w temperaturze 25°C........................................................................................................... |
||||
Dodatek 12. Procesy zachodzące podczas elektrolizy roztworów wodnych |
||||
sole .................................................. .................................................... .................................. |
||||
Dodatek 13. Układ okresowy pierwiastków D.I. Mendelejew .................................................. |
||||
WSTĘP
Chemia odnosi się do nauk przyrodniczych, które badają otaczający nas świat materialny. Przedmiotami materialnymi stanowiącymi przedmiot badań chemii są pierwiastki chemiczne i ich różne związki. Wszystkie obiekty świata materialnego znajdują się w ciągłym ruchu (zmianie). Istnieją różne formy ruchu materii, w tym chemiczna forma ruchu, która jest również przedmiotem badań chemii. Chemiczna forma ruchu materii obejmuje różne reakcje chemiczne (przemiany substancji). Więc, chemia to nauka o właściwościach pierwiastków chemicznych i ich związków oraz prawach przemian substancji.
Najważniejszym aspektem stosowanym współczesnej chemii jest ukierunkowana synteza związków o niezbędnych i wcześniej przewidywanych właściwościach w celu ich późniejszego zastosowania w różnych dziedzinach nauki i technologii, w szczególności do wytwarzania unikalnych materiałów. Należy zauważyć, że chemia jako nauka przeszła krótką drogę do współczesności - mniej więcej od lat 60. XIX wieku. W ciągu półtora wieku opracowano okresową klasyfikację pierwiastków chemicznych, doktrynę okresowości, stworzono teorię budowy atomu, teorię wiązań chemicznych i budowę związków chemicznych, tak ważne pojawiły się dyscypliny opisujące procesy chemiczne, takie jak termodynamika chemiczna i kinetyka chemiczna, powstała chemia kwantowa, radiochemia, fizyka jądrowa. Badania chemiczne rozszerzyły się tak, że poszczególne gałęzie chemii - chemia nieorganiczna, chemia organiczna, chemia analityczna, chemia fizyczna, chemia polimerów, biochemia, agrochemia itp. – stali się samolubni
wartościowe, niezależne nauki.
Ten podręcznik edukacyjno-metodologiczny obejmuje dwie główne sekcje współczesnej chemii: „Chemia ogólna” i „Chemia nieorganiczna”. Chemia ogólna kładzie teoretyczne podstawy do zrozumienia różnorodnego i złożonego obrazu zjawisk chemicznych. Chemia nieorganiczna wprowadza w konkretny świat substancji powstałych z pierwiastków chemicznych. Autorzy starali się omówić główne zagadnienia kursu chemii ogólnej w możliwie najkrótszej formie. Dużą uwagę przywiązuje się do działów teoretycznych chemii ogólnej: podstawowych praw i pojęć chemii, termodynamiki chemicznej, kinetyki chemicznej, właściwości roztworów, elektrochemii. W dziale „Chemia nieorganiczna” omówiono podstawowe właściwości pierwiastków grup I–VII układu okresowego według D.I. Mendelejew. W załącznikach podano podstawowe właściwości fizyczne i chemiczne substancji nieorganicznych. Niniejsza pomoc dydaktyczna ma na celu pomóc uczniom opanować podstawowe zasady chemii, nabyć umiejętności rozwiązywania typowych problemów oraz przeprowadzania eksperymentów w laboratorium chemicznym.
Podczas prowadzenia prac laboratoryjnych bardzo ważne jest przestrzeganie zasad bezpieczeństwa. Pracę z tą pomocą dydaktyczną należy rozpocząć od zapoznania się z podstawowymi zasadami pracy w laboratorium chemicznym.
ZASADY PRACY W LABORATORIUM CHEMICZNYM
Wymagania bezpieczeństwa przed rozpoczęciem pracy:
1. Przed przystąpieniem do prac laboratoryjnych należy zapoznać się z właściwościami fizycznymi i technicznymi substancji stosowanych i powstających w trakcie reakcji chemicznej, a także z instrukcją i zasadami postępowania z nimi.
2. Utrzymuj miejsce pracy w czystości i porządku. Na biurku powinien znajdować się jedynie niezbędny sprzęt i zeszyt ćwiczeń.
Wymagania bezpieczeństwa podczas pracy:
1. Do przeprowadzenia eksperymentu należy przystąpić dopiero wtedy, gdy jego cel i zadania zostaną jasno zrozumiane, a poszczególne etapy eksperymentu zostaną przemyślane.
2. Prace z substancjami toksycznymi, lotnymi i żrącymi należy wykonywać wyłącznie pod wyciągiem.
3. Podczas wszelkich prac należy zachować maksymalną ostrożność, pamiętając o tej nieostrożności
I nieuwaga może spowodować wypadek.
4. Nie pochylać się nad naczyniem z wrzącym płynem. Ogrzaną probówkę należy trzymać otworem od siebie, ponieważ może wypłynąć ciecz. Ogrzej zawartość w całej probówce, a nie tylko od dołu.
5. Po zużyciu odczynnika należy go natychmiast odłożyć na miejsce, aby nie wywołać chaosu w miejscu pracy i nie pomieszać odczynników podczas ich układania na koniec zajęć.
6. Podczas rozcieńczania stężonego kwasu siarkowego należy wlać kwas małymi porcjami do wody, a nie odwrotnie.
7. Zabrania się pracy z substancjami łatwopalnymi w pobliżu włączonych urządzeń elektrycznych oraz palących się lamp i palników alkoholowych.
8. Substancję należy wąchać kierując parę w swoją stronę ruchem ręki, a nie głęboko ją wdychając.
9. Nie można używać substancji do doświadczeń z puszek, opakowań i zakraplaczy bez etykiet lub z nieczytelnymi napisami.
10. W przypadku kontaktu ze skórą kwasu lub zasady należy przemyć oparzone miejsce dużą ilością wody, a następnie – w przypadku oparzeń kwasem – 3% roztwór sody, a na oparzenia alkaliami - 1% roztwór kwasu borowego.
11. Jeżeli odczynnik dostanie się do oczu, należy je przemyć strumieniem wody, a w przypadku zatrucia gazem zapewnić poszkodowanemu dopływ świeżego powietrza.
12. Aby uniknąć zatrucia, w pomieszczeniach laboratoriów chemicznych surowo zabrania się przechowywania i spożywania żywności oraz palenia tytoniu.
Wymagania bezpieczeństwa po zakończeniu pracy:
Konieczne jest usunięcie ze stołu i podłogi wszystkiego, co rozlane, połamane i porozrzucane. Po zakończeniu eksperymentu należy uporządkować miejsce pracy. Nie wrzucaj granulek i kawałków metalu do zlewu, ale włóż je do specjalnego pojemnika i przekaż pracownikowi laboratorium. Nie należy zabierać żadnych substancji z laboratorium do domu. Po skończonej pracy musisz
Dokładnie umyj ręce. Wszelkie naruszenia zasad bezpieczeństwa i nieprzewidziane sytuacje należy natychmiast zgłaszać nauczycielowi!
Zapoznałem się i wyrażam zgodę na przestrzeganie zasad bezpieczeństwa Podpis studenta:
Przeprowadzono instrukcje, sprawdzono znajomość zasad bezpieczeństwa.Podpis nauczyciela:

Praca laboratoryjna nr 1
KLASY ZWIĄZKÓW NIEORGANICZNYCH
Cel pracy: poznanie klas związków nieorganicznych, metod ich otrzymywania i właściwości chemicznych.
Część teoretyczna
Wszystkie chemikalia dzielą się na dwie grupy: proste i złożone. Proste substancje składają się z atomów jednego pierwiastka (Cl2, O2, C itp.). Związki złożone obejmują dwa lub więcej pierwiastków (K2SO4, NaOH, HNO3 itp.). Najważniejszymi klasami związków nieorganicznych są tlenki, wodorotlenki i sole (rysunek).
Tlenki to związki składające się z dwóch pierwiastków, z których jednym jest tlen. Ze względu na właściwości funkcjonalne tlenki dzielą się na tworzące sól i niesolące (obojętne). Nie tworzący soli nazywane są tlenkami, które nie tworzą związków hydratów i soli (CO, NO, N2 O). Tlenki tworzące sól Ze względu na właściwości chemiczne dzielimy je na zasadowe, kwasowe i amfoteryczne (rysunek). Właściwości chemiczne tlenków przedstawiono w tabeli. 1.
Na2O; MgO; CuO.
Tlenki kwasowe tworzą wszystkie niemetale (z wyjątkiem F) i metale o wysokim stopniu utlenienia (+5, +6, +7), na przykład SO3; P2O5; Mn2O7; CrO3.
Tlenki amfoteryczne tworzą niektóre metale na stopniu utlenienia +2 (Be, Zn, Sn, Pb) i prawie wszystkie metale na stopniu utlenienia +3 i +4 (Al, Ga, Sc, Ge, Sn, Pb, Cr, Mn).
Tabela 1
Właściwości chemiczne tlenków
Zasadowe tlenki |
Tlenki kwasowe |
||
Tlenek zasadowy + H2O → Zasada |
Tlenek kwasowy + H2 O → Kwas |
||
CaO+H2O → Ca(OH)2 |
SO3 +H2O → H2SO4 |
||
Podstawowy tlenek + kwas. tlenek → Sól |
Kwaśny. tlenek + tlenek zasadowy → Sól |
||
CaO+CO2 → CaCO3 |
SO3 + Na2O → Na2SO4 |
||
Podstawowy tlenek + kwas → sól + H2 O |
Kwaśny. tlenek + zasada → sól + H2 O |
||
CaO+H2 SO4 → CaSO4 +H2 O |
SO3 + 2NaOH → Na2 SO4 +H2 O |
Tlenki amfoteryczne
1. Tlenek amfoteryczny + H 2O →
2. Amfa. tlenek + kwas. tlenek → Sól 2. Amfa. tlenek + tlenek zasadowy → Sól
ZnO + N2O5 → Zn(NO3 )2 |
ZnO2 + Na2 O → Na2 ZnO2 (w stopie) |
3. Amfa. tlenek + Kwas → Sól + H2 O 3. Amph. tlenek + zasada → sól + H2 O |
|
ZnO + H2 SO4 → ZnSO4 +H2 O |
ZnO+2NaOH → Na2 ZnO2 +H2 O (w stopie) |
ZnO+2NaOH 2 → Na2 (w roztworze) |
|

ZWIĄZKI NIEORGANICZNE |
||||
Podstawowy |
||||
IA: Li, Na, K, Rb, Cs |
Me2O (Me=Li, Na, K, Rb, Cs) |
|||
IIA: Mg, Ca, Sr, Ba |
MeO (Me=Mg, Ca, Sr, Ba, Cu, Ni) |
|||
AMFOTERYCZNY |
Tworzące sól |
Amfoteryczny |
||
EO (E=Be, Zn, Sn, Pb) |
||||
E2 O3 (E=Al, Ga, Cr) |
||||
EO2 (E=Ge, Pb) |
||||
Kwaśny |
||||
Cl2O |
||||
EO2 (E=S, Se, C, Si) |
||||
SZLACHETNY |
E2 O3 (E=N, As) |
|||
E2 O5 (E=N, P, As, I) |
||||
EO3 (E = S, Se) |
||||
VIIIA: On, Ne, Ar |
||||
Nie tworzący soli |
||||
CO, NO, N2O, SiO, S2O |
||||
NIEMETALE |
||||
Podstawowy (podstawy) |
||||
VA: N2, P, As |
||||
VIA: O2, S, Se |
MeOH (Me=Li, Na, K, Rb, Cs) |
|||
VIIA: F2, Cl2, Br2, I2 |
Me(OH)2 (Me=Mg, Ca, Sr, Ba, Cu, Ni) |
|||
Amfoteryczny |
||||
E(OH)2 (E=Be, Zn, Sn, Pb) |
||||
E(OH)3 (E=Al, Cr) |
||||
WODOROTLENKI |
Kwaśny (kwasy) |
|||
Tlen- |
Nie zawiera kwasu |
|||
HEO2 (E=N, As) |
(E=F, Cl, Br, I) |
|||
H3 AsO3 |
||||
H2 EO3 (E=Se, C) |
||||
HEO3 (E=N, P, I) |
||||
H3 EO4 (E=P, As) |
||||
H2 EO4 (E=S, Se, Cr) |
||||
HEO4 (E=Cl, Mn) |
||||
Sole zasadowe (sole hydroksylowe) |
||||
FeOH(NO3)2, (CaOH)2SO4 |
||||
Sole średnie (normalne) |
||||
Na2 CO3, Mg(NO3)2, Ca3 (PO4)2 |
||||
Sole kwasowe (hydrosale) |
||||
NaHSO4, KHSO4, CaH2 (PO4)2 |
||||
Klasyfikacja związków nieorganicznych |
||||

Wodorotlenki to związki chemiczne tlenków z wodą. Na podstawie właściwości chemicznych rozróżnia się wodorotlenki zasadowe, wodorotlenki kwasowe i wodorotlenki amfoteryczne (patrz rysunek). Główne właściwości chemiczne wodorotlenków podano w tabeli. 2.
Zasadowe wodorotlenki lub zasady to substancje, które podczas dysocjacji elektrolitycznej w roztworach wodnych tworzą ujemnie naładowane jony wodorotlenkowe (OH–) i nie tworzą innych jonów ujemnych. Wodorotlenki metali alkalicznych, które są dobrze rozpuszczalne w wodzie, z wyjątkiem LiOH, nazywane są alkaliami. Nazwy zasadowych wodorotlenków powstają ze słowa „wodorotlenek” i nazwy pierwiastka w dopełniaczu, po czym, jeśli to konieczne, stopień utlenienia pierwiastka wskazano cyframi rzymskimi w nawiasach. Na przykład Fe(OH)2 oznacza wodorotlenek żelaza (II).
Wodorotlenki kwasowe lub kwasy to substancje, które po zdysocjowaniu w roztworach wodnych tworzą dodatnio naładowane jony wodorowe (H+) i nie tworzą innych jonów dodatnich. Nazwy wodorotlenków kwasowych (kwasów) powstają zgodnie z zasadami ustalonymi dla kwasów (patrz dodatek 1)
Wodorotlenki amfoteryczne lub amfolity są utworzone przez pierwiastki o właściwościach amfoterycznych. Wodorotlenki amfoteryczne nazywane są podobnie jak wodorotlenki zasadowe, np. Al(OH)3 – wodorotlenek glinu. Amfolity wykazują zarówno właściwości kwasowe, jak i zasadowe (tab. 2).
Tabela 2
Właściwości chemiczne wodorotlenków
Powody |
|||
do C |
|||
Zasada → Tlenek zasadowy + H2O |
|||
do C |
|||
Ba(OH)2 → BaO + H2O |
|||
Zasada + kwas. tlenek → Sól + H2O |
2. Kwas + zasada. tlenek →Sól+ H2 O |
||
Ba(OH)2 + CO2 → BaCO3 + H2O |
H2 SO4 + Na2 O → Na2 SO4 + H2 O |
||
3. Zasada + Kwas → Sól + H 2 O
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
Wodorotlenki amfoteryczne
1. Amfa. wodorotlenek + kwas. tlenek → sól + H2 O 1. Amph. wodorotlenek + zasada tlenek → Sól+H2O
Sole to substancje, których cząsteczki składają się z kationów metali i reszty kwasowej. Można je uważać za produkty częściowego lub całkowitego zastąpienia wodoru w kwasie metalem lub grupami wodorotlenkowymi w zasadzie resztami kwasowymi.
Istnieją sole średnie, kwaśne i zasadowe (patrz rysunek). Sole średnie lub normalne to produkty całkowitego zastąpienia atomów wodoru w kwasach metalem lub grupami wodorotlenkowymi w zasadach resztą kwasową. Sole kwasów są produktami niepełnego zastąpienia atomów wodoru w cząsteczkach kwasu jonami metali. Sole zasadowe są produktami niepełnego zastąpienia grup wodorotlenkowych w zasadach resztami kwasowymi.

Nazwy soli średnich składają się z nazwy anionu kwasowego w mianowniku (Przym. 1) i nazwy kationu w dopełniaczu, np. CuSO4 - siarczan miedzi. Nazwę soli kwasowych tworzy się w taki sam sposób jak środkowe, ale dodaje się przedrostek hydro-, wskazujący na obecność niepodstawionych atomów wodoru, których liczbę wskazują cyfry greckie, na przykład Ba(H2PO4)2 - diwodorofosforan baru. Nazwy głównych soli również tworzy się podobnie do nazw średnich soli, ale dodaje się przedrostek hydroksy-, wskazujący na obecność niepodstawionych grup hydroksylowych, np. Al(OH)2NO3 - dihydroksonitan glinu.
Porządek pracy
Doświadczenie 1. Ustalenie charakteru tlenków
Eksperyment 1.1. Oddziaływanie tlenku wapnia z wodą (A), kwasem solnym (B) i wodorotlenkiem sodu (C). Sprawdź środowisko powstałego roztworu w doświadczeniu (A) za pomocą wskaźnika
(Załącznik 2).
Obserwacje: A.
Równania reakcji:
Eksperyment 1.2. Oddziaływanie tlenku boru z wodą (A), kwasem solnym (B) i wodorotlenkiem sodu (C). Doświadczenie (A) przeprowadza się z ogrzewaniem. Sprawdź środowisko powstałego roztworu w doświadczeniu (A) za pomocą wskaźnika (Załącznik 2).
Obserwacje: A.
Równania reakcji:
Doświadczenie 2. Otrzymywanie i właściwości wodorotlenku glinu
Eksperyment 2.1. Interakcja chlorku glinu z niedoborem wodorotlenku sodu
NIE.
Sekcje, tematy
Liczba godzin
Program pracy według zajęć
10 stopni
11 Klasa
Wstęp
1. Roztwory i metody ich przygotowania
2. Obliczenia z wykorzystaniem równań chemicznych
3. Oznaczanie składu mieszanin
4. Wyznaczanie wzoru substancji
5. Wzory reakcji chemicznych
6. Zadania łączone
7. Reakcje jakościowe
Wprowadzenie do analizy chemicznej.
Procesy chemiczne.
Chemia pierwiastków.
Korozja metali.
Chemia gastronomiczna.
Farmakologia.
Konferencja końcowa: „Znaczenie eksperymentu w naukach przyrodniczych”.
Całkowity:
Notatka wyjaśniająca
Przedmiot fakultatywny przeznaczony jest dla uczniów klas 10-11 wybierających kierunek przyrodniczy i obejmuje 68 godzin.
Znaczenie kursu polega na tym, że jego nauka pozwoli ci nauczyć się rozwiązywać główne rodzaje problemów obliczeniowych przewidziane na kursie chemii w szkole średniej i programie egzaminów wstępnych na uniwersytety, to znaczy pomyślnie przygotować się do jednolitego egzaminu państwowego z chemii. Ponadto rekompensowany jest brak szkolenia praktycznego. Dzięki temu zajęcia są ciekawe i kształtują umiejętności pracy z odczynnikami i sprzętem chemicznym, rozwijają spostrzegawczość i zdolność logicznego myślenia. W ramach zajęć starano się maksymalnie wykorzystać przejrzystość eksperymentu chemicznego, aby umożliwić studentom nie tylko zobaczenie, jak substancje oddziałują, ale także zmierzenie, w jakich proporcjach wchodzą one w reakcje i powstają w wyniku reakcja.
Cel kursu: poszerzanie wiedzy uczniów na temat eksperymentów chemicznych.
Cele kursu:
· Powtarzanie materiału z lekcji chemii;
· Poszerzenie wiedzy uczniów na temat właściwości substancji;
· Doskonalenie umiejętności praktycznych i umiejętności rozwiązywania problemów obliczeniowych różnego typu;
· Przełamanie formalnego rozumienia procesów chemicznych przez część uczniów.
W trakcie zajęć studenci doskonalą swoje umiejętności rozwiązywania problemów obliczeniowych, wykonują zadania jakościowe mające na celu identyfikację substancji znajdujących się w różnych butelkach bez etykiet, a także eksperymentalnie przeprowadzają łańcuchy przemian.
Podczas eksperymentu w klasie kształtuje się pięć rodzajów umiejętności i zdolności.
1. Umiejętności organizacyjne:
sporządzenie planu doświadczenia zgodnie z instrukcją;
ustalenie listy odczynników i sprzętu zgodnie z instrukcją;
przygotowanie formularza raportu zgodnie z instrukcją;
wykonanie eksperymentu w określonym czasie, z wykorzystaniem znanych w pracy narzędzi, metod i technik;
prowadzenie samokontroli zgodnie z instrukcjami;
znajomość wymagań dotyczących pisemnej dokumentacji wyników eksperymentów.
2. Umiejętności techniczne:
prawidłowe postępowanie ze znanymi odczynnikami i sprzętem;
montaż urządzeń i instalacji z gotowych części zgodnie z instrukcją;
wykonywanie operacji chemicznych zgodnie z instrukcją;
przestrzeganie zasad bezpieczeństwa pracy.
3. Pomiar umiejętności:
praca z przyrządami pomiarowymi zgodnie z instrukcją;
znajomość i wykorzystanie metod pomiarowych;
przetwarzanie wyników pomiarów.
4. Umiejętności i zdolności intelektualne:
wyjaśnienie celu i określenie celów eksperymentu;
wysunięcie hipotezy eksperymentalnej;
selekcja i wykorzystanie wiedzy teoretycznej;
obserwacja i identyfikacja charakterystycznych oznak zjawisk i procesów zgodnie z instrukcją;
porównanie, analiza, ustalenie związków przyczynowo-skutkowych,
uogólnienie uzyskanych wyników oraz - sformułowanie wniosków.
5. Umiejętności projektowe:
korygowanie prostych usterek w sprzęcie, urządzeniach i instalacjach pod okiem nauczyciela;
wykorzystanie gotowego sprzętu, instrumentów i instalacji;
produkcja prostych urządzeń, instrumentów i instalacji pod okiem nauczyciela;
przedstawienie urządzeń, instrumentów i instalacji w formie obrazu.
Kontrola wiedzy odbywa się przy rozwiązywaniu problemów obliczeniowych i eksperymentalnych.
Efektem zajęć fakultatywnych będzie zaliczenie pracy testowej obejmującej przygotowanie, rozwiązanie i eksperymentalną realizację zadania obliczeniowego lub zadania jakościowego: określenie składu substancji lub wykonanie łańcucha przemian.
Wprowadzenie (1 godzina)
Planowanie, przygotowanie i przeprowadzenie eksperymentu chemicznego. Zasady bezpieczeństwa podczas pracy laboratoryjnej i praktycznej. Zasady udzielania pierwszej pomocy w przypadku oparzeń i zatruć chemicznych.
Temat 1. Roztwory i metody ich przygotowania (4 godz.)
Znaczenie roztworów w doświadczeniu chemicznym. Koncepcja prawdziwego rozwiązania. Zasady przygotowywania rozwiązań. Wagi technochemiczne i zasady ważenia ciał stałych.
Udział masowy substancji rozpuszczonej w roztworze. Obliczanie i przygotowanie roztworu o określonym ułamku masowym rozpuszczonej substancji.
Wyznaczanie objętości roztworów za pomocą naczyń miarowych i gęstości roztworów substancji nieorganicznych za pomocą areometru. Tablice gęstości roztworów kwasów i zasad. Obliczenia masy substancji rozpuszczonej na podstawie znanej gęstości, objętości i udziału masowego substancji rozpuszczonej.
Zmiana stężenia substancji rozpuszczonej w roztworze. Mieszanie dwóch roztworów tej samej substancji w celu uzyskania roztworu o nowym stężeniu. Obliczanie stężenia roztworu otrzymanego przez zmieszanie, zasada „krzyża”.
Demonstracje. Szkło chemiczne do sporządzania roztworów (szkła, kolby stożkowe i płaskodenne, cylindry miarowe, kolby miarowe, pręty szklane, lejki szklane itp.). Przygotowanie roztworu chlorku sodu i roztworu kwasu siarkowego. Wagi technochemiczne, odważniki. Oznaczanie objętości roztworów kwasów i zasad za pomocą cylindra miarowego. Areometr. Oznaczanie gęstości roztworów za pomocą areometru. Zwiększanie stężenia roztworu wodorotlenku sodu poprzez częściowe odparowanie wody i dodanie do roztworu dodatkowej zasady, sprawdzenie zmiany stężenia za pomocą areometru. Obniżenie stężenia wodorotlenku sodu w roztworze poprzez jego rozcieńczenie, sprawdzenie zmiany stężenia za pomocą areometru.
Praktyczna praca. Ważenie chlorku sodu na wadze technicznej i chemicznej. Przygotowanie roztworu chlorku sodu o zadanym ułamku masowym soli w roztworze. Wyznaczanie objętości roztworu chlorku sodu za pomocą cylindra miarowego i wyznaczanie jego gęstości za pomocą areometru. Oznaczanie stężenia roztworów kwasów i zasad na podstawie ich gęstości w tabeli „Ułamek masowy substancji rozpuszczonej (w%) i gęstość roztworów kwasów i zasad w temperaturze 20 °C”. Mieszanie roztworów chlorku sodu o różnych stężeniach i obliczanie udziału masowego soli oraz określanie gęstości powstałego roztworu.
Temat 2. Obliczenia z wykorzystaniem równań chemicznych (10 godz.)
Praktyczne określenie masy jednej z reagujących substancji poprzez zważenie lub objętość, gęstość i udział masowy substancji rozpuszczonej w roztworze. Przeprowadzenie reakcji chemicznej i obliczenie, jak tę reakcję zredukować. Zważenie produktu reakcji i wyjaśnienie różnicy pomiędzy otrzymanym wynikiem praktycznym a obliczonym.
Praktyczna praca. Oznaczanie masy tlenku magnezu otrzymanego przez spalenie znanej masy magnezu. Oznaczanie masy chlorku sodu otrzymanego w reakcji roztworu zawierającego znaną masę wodorotlenku sodu z nadmiarem kwasu solnego.
Praktyczne określenie masy jednej z reagujących substancji poprzez ważenie, przeprowadzenie reakcji chemicznej i obliczenia z wykorzystaniem równania chemicznego tej reakcji, określenie masy lub objętości produktu reakcji i jego wydajności w procentach teoretycznie możliwej.
Praktyczna praca. Rozpuszczanie cynku w kwasie solnym i oznaczanie objętości wodoru. Kalcynacja nadmanganianu potasu i oznaczanie objętości tlenu.
Przeprowadzenie reakcji dla substancji zawierających zanieczyszczenia, obserwacja wyników doświadczenia. Obliczenia z określeniem udziału masowego zanieczyszczeń w substancji na podstawie wyników reakcji chemicznej.
Eksperyment demonstracyjny. Rozpuszczenie sodu, wapnia w wodzie i obserwacja wyników doświadczenia w celu wykrycia zanieczyszczeń w tych metalach.
Praktyczna praca. Rozpuszczanie proszku kredowego zanieczyszczonego piaskiem rzecznym w roztworze kwasu azotowego.
Wyznaczanie mas reagujących substancji, przeprowadzanie reakcji chemicznej pomiędzy nimi, badanie produktów reakcji i praktyczne oznaczanie substancji w nadmiarze. Rozwiązywanie zadań w celu wyznaczenia masy jednego z produktów reakcji ze znanych mas substancji reagujących, z których jedna jest podana w nadmiarze.
Eksperyment demonstracyjny. Spalanie siarki i fosforu, oznaczenie substancji występującej w nadmiarze w tych reakcjach.
Praktyczna praca. Przeprowadzenie reakcji pomiędzy roztworami kwasu azotowego i wodorotlenku sodu zawierającymi znane masy reagujących substancji, oznaczenie nadmiaru odczynnika za pomocą wskaźnika.
Temat 3. Oznaczanie składu mieszanin (2 godz.)
Reakcja mieszaniny dwóch substancji z odczynnikiem, który reaguje tylko z jednym składnikiem mieszaniny. Reakcja mieszaniny dwóch substancji z odczynnikiem, który reaguje ze wszystkimi składnikami mieszaniny. Omówienie wyników eksperymentów. Rozwiązywanie problemów w celu określenia składu mieszanin.
Eksperyment demonstracyjny. Oddziaływanie mieszaniny pyłu cynku i opiłków miedzi z kwasem solnym. Oddziaływanie mieszaniny proszku magnezu i pyłu cynku z kwasem solnym.
Temat 4. Ustalanie wzoru substancji (6 godzin)
Pojęcie składu jakościowego i ilościowego substancji. Obliczanie masy cząsteczkowej substancji na podstawie jej gęstości wodoru itp. i udział masowy pierwiastka. Wyznaczanie wzoru substancji na podstawie danych ilościowych produktów reakcji. Wyznaczanie wzoru substancji organicznych na podstawie wzoru ogólnego szeregu homologicznego.
Temat 5. Wzory reakcji chemicznych (5 godz.)
Pojęcie procesów termicznych w reakcjach chemicznych. Reakcje egzo- i endotermiczne. Obliczenia z wykorzystaniem równań termochemicznych.
Demonstracja. Reakcja rozcieńczenia stężonego kwasu siarkowego i przygotowania chlorku amonu.
Pojęcie szybkości reakcji. Czynniki wpływające na szybkość reakcji. Wyznaczanie szybkości reakcji.
Demonstracja. Wpływ warunków reakcji na jej szybkość.
Pojęcie równowagi chemicznej. Metody przesuwania równowagi chemicznej. Zastosowanie tej wiedzy w produkcji chemicznej.
Temat 6. Zadania łączone (3 godz.)
Rozwiązywanie problemów łączonych dla różnych typów bloku C jednolitego egzaminu państwowego z chemii.
Temat 7. Reakcje jakościowe (3 godz.)
Pojęcie reakcji jakościowej. Identyfikacja substancji z wykorzystaniem tabeli rozpuszczalności kwasów, zasad i soli, charakterystyka widocznych zmian w procesach. Oznaczanie substancji nieorganicznych zawartych w różnych butelkach bez etykiet, bez użycia dodatkowych odczynników. Przeprowadzanie przemian substancji nieorganicznych i organicznych.
Eksperyment demonstracyjny. Identyfikacja roztworów siarczanu żelaza (II), siarczanu miedzi (II), chlorku glinu, azotanu srebra za pomocą roztworu wodorotlenku sodu. Identyfikacja roztworów chlorku sodu, jodku potasu, fosforanu sodu, azotanu wapnia za pomocą roztworu azotanu srebra i kwasu azotowego.
Przeprowadzenie łańcucha przekształceń.
Praktyczna praca. Oznaczanie roztworów azotanu srebra, wodorotlenku sodu, chlorku magnezu, azotanu cynku w butelkach numerowanych bez etykiet bez użycia dodatkowych odczynników.
Temat 8. Wprowadzenie do analizy chemicznej (6 godz.)
Wstęp. Chemia, człowiek i współczesne społeczeństwo. Wprowadzenie do analizy chemicznej. Podstawy analizy jakościowej. Podstawy chemii analitycznej. Rozwiązywanie typowych problemów obliczeniowych.
Praktyczna praca. Przeprowadzenie analizy w celu wykrycia śladów krwi i śliny w wydanych próbkach. Analiza chipsów i napojów bezalkoholowych.
Temat 9. Procesy chemiczne (6 godz.)
Charakterystyka procesów chemicznych. Proces chemiczny, jego oznaki. Kryształy w przyrodzie. Krystalizacja substancji i jej zależność od różnych czynników. Procesy chemiczne zachodzące w organizmie człowieka. Biochemia i fizjologia.
Praktyczna praca. Krystalizacja substancji. Uprawa kryształów w laboratorium. Rozkład nadtlenku wodoru przez enzymy krwi.
Temat 10. Chemia pierwiastków (5 godz.)
Istota reakcji chemicznej. Rozwiązywanie problemów z udziałem substancji różnych klas i określanie rodzaju reakcji chemicznej. Reakcje chemiczne zachodzące bez zmiany stopnia utlenienia pierwiastków chemicznych. Reakcje zachodzące wraz ze zmianą stopnia utlenienia pierwiastków chemicznych. Reakcje wymiany jonowej.
Praktyczna praca. Opady soli.
Temat 11. Korozja metali (3 godz.)
Pojęcie korozji. Oznaki korozji powierzchni. Korozja chemiczna i elektrochemiczna. Ochrona przed korozją.
Praktyczna praca. Techniki zabezpieczania powierzchni metalowych przed korozją.
Temat 12. Chemia żywności (7 godz.)
Chemia i żywienie. Znaczenie białek, tłuszczów i węglowodanów w pełnowartościowym żywieniu. Czynniki wpływające na wchłanianie najważniejszych składników żywności. Charakterystyka chemiczna procesów zachodzących w przewodzie pokarmowym. Jedzenie „żywe” i „martwe”. Chemia wegetarianizmu i jedzenia mięsa. Aromaty, konserwanty, barwniki i wzmacniacze smaku.
Praktyczna praca. Oznaczanie sztucznych barwników w żywności. Izolacja białek z obiektów biologicznych.
Temat 13. Farmakologia (4 godz.)
Pojęcie farmakologii. Przepis i wskazówki. Homeopatia, jej podstawy chemiczne. Przeciwwskazania i skutki uboczne, chemia.
Praktyczna praca. Wpływ antybiotyków i azotanów na mikroflorę glebową.
Temat 14. Konferencja końcowa: „Znaczenie eksperymentu w naukach przyrodniczych” (3 godz.)
Od natrochtymii do chemioterapii (chemia medyczna). Chemia biologii żywienia. Rozwiązywanie typowych problemów chemicznych w celu zdania jednolitego egzaminu państwowego.
Wymagania dotyczące efektów uczenia się
Na zajęciach przedmiotu fakultatywnego „Zagadnienia eksperymentalne w chemii” studenci muszą bezwzględnie przestrzegać zasad bezpieczeństwa podczas prowadzenia prac laboratoryjnych i praktycznych oraz znać zasady udzielania pierwszej pomocy w przypadku oparzeń i zatruć odczynnikami chemicznymi.
Po ukończeniu proponowanego przedmiotu studenci powinni:
potrafić dokonywać pomiarów (masa ciała stałego za pomocą wagi technochemicznej, objętość roztworu za pomocą miarki, gęstość roztworu za pomocą areometru); przygotować roztwory o zadanym ułamku masowym rozpuszczonej substancji; określić procentowe stężenie roztworów kwasów i zasad, korzystając z tabelarycznych wartości ich gęstości; planować, przygotowywać i przeprowadzać proste doświadczenia chemiczne związane z rozpuszczaniem, filtrowaniem, odparowywaniem substancji, przemywaniem i suszeniem osadów; produkcja i oddziaływanie substancji należących do głównych klas związków nieorganicznych; oznaczanie substancji nieorganicznych w roztworach indywidualnych; realizacja łańcucha przemian związków nieorganicznych;
rozwiązywać złożone problemy zawierające elementy standardowych problemów obliczeniowych:
oznaczanie masy i udziału masowego substancji rozpuszczonej w roztworze otrzymanym różnymi sposobami (poprzez rozpuszczenie substancji w wodzie, zmieszanie roztworów o różnych stężeniach, rozcieńczenie i zatężenie roztworu);
określenie masy produktu reakcji lub objętości gazu ze znanej masy jednej z substancji reagujących; określenie wydajności produktu reakcji jako procent wydajności teoretycznie możliwej;
określenie masy produktu reakcji lub objętości gazu na podstawie znanej masy jednej z reagujących substancji zawierającej określoną proporcję zanieczyszczeń;
określenie masy jednego z produktów reakcji na podstawie znanych mas substancji reagujących, z których jedna jest podana w nadmiarze.
Bibliografia:
1. Gabrielyan O.S. Chemia ogólna: zadania i ćwiczenia. M.: Edukacja, 2006.
2. Gudkova A.S. 500 problemów z chemii. M.: Edukacja, 2001.
3. Cele Ogólnorosyjskich Olimpiad Chemicznych. M.: Egzamin, 2005.
4. Labiy Yu.M. Rozwiązywanie problemów chemicznych za pomocą równań i nierówności. M.: Edukacja, 2007
5. Magdesieva N.N., Kuzmenko N.E. Naucz się rozwiązywać problemy z chemii. M.: Edukacja, 2006.
6. Nowoszynski I.I. Rodzaje problemów chemicznych i metody ich rozwiązywania. M.: Onyks, 2006.
7. Okaev E.B. Olimpiady Chemiczne. Mn.: TetraSystems, 2005.
8. Ujednolicony egzamin państwowy KIM z chemii dla różnych lat
Numer
lekcja
(sekcje, tematy)
Ilość
godziny
Daktyle
Sprzęt do lekcji
Praca domowa
1. Wstęp.
PSHE D.I.Mendelejew, portrety naukowców
Wstęp.
2. Roztwory i metody ich przygotowania
Lampa alkoholowa, stojak na probówki, probówki, drut płomieniowy, bibuła filtracyjna, parownik, uniwersalna bibułka wskaźnikowa, roztwory kwasu azotowego, chlorku baru, wodorotlenku sodu, wody wapiennej, azotanu srebra
Udział masowy substancji rozpuszczonej.
Stężenie molowe i równoważnik stężenia molowego.
Rozpuszczalność substancji.
Praca praktyczna nr 1: „Przygotowanie roztworu o określonym stężeniu poprzez zmieszanie roztworów o różnych stężeniach.”
3. Obliczenia z wykorzystaniem równań chemicznych
Lampa alkoholowa, stojak, szczypce, szpatułka, szkło, probówki, zakraplacz, cylinder miarowy, lejek filtrujący, bibuła filtracyjna, roztwory kwasu azotowego, azotanu srebra, kwasu solnego, PSHE D.I. Mendelejewa, tabela rozpuszczalności, kalkulator
Wyznaczanie masy produktu reakcji ze znanej masy jednego z reagentów.
Obliczanie stosunków objętościowych gazów.
Zadania związane z wyznaczaniem masy roztworu.
Obliczanie masy, objętości, ilości substancji produktu reakcji, jeżeli którejś z substancji reagujących podano w nadmiarze.
Przeprowadzenie reakcji pomiędzy substancjami zawierającymi znane masy reagujących substancji, określenie nadmiaru za pomocą wskaźnika.
Określenie wydajności produktu reakcji jako procent wydajności teoretycznie możliwej.
Obliczanie zanieczyszczeń w substancjach reagujących.
4. Oznaczanie składu mieszanin
Lampa alkoholowa, statyw, zlewka, cylinder miarowy, naczynie parujące, bibuła filtracyjna, magnez, kwas siarkowy, tlenek miedzi (II), węglan magnezu, wodorotlenek sodu, kwas solny
Określenie składu mieszaniny, której wszystkie składniki oddziałują z określonymi odczynnikami.
Określenie składu mieszaniny, której składniki selektywnie oddziałują z określonymi odczynnikami.
5. Wyznaczanie wzoru substancji
Wyprowadzenie wzoru substancji na podstawie udziału masowego pierwiastków.
Wyprowadzenie wzoru cząsteczkowego substancji na podstawie jej gęstości w wodorze lub powietrzu i udziału masowego pierwiastka.
Wyprowadzenie wzoru cząsteczkowego substancji na podstawie gęstości względnej jej par oraz masy, objętości lub ilości produktów spalania.
Wyprowadzenie wzoru substancji na podstawie wzoru ogólnego szeregu homologicznego związków organicznych.
6. Wzory reakcji chemicznych
PSHE D.I.Mendelejew, tabela rozpuszczalności, karty zadań
Obliczenia z wykorzystaniem równań termochemicznych.
Szybkość reakcji chemicznych.
Bilans chemiczny.
7. Zadania łączone
PSHE D.I.Mendelejew, tabela rozpuszczalności, karty zadań
Połączone zadania.
8. Reakcje jakościowe
Szeroka probówka z rurką wylotową gazu, stojak, stoper, strzykawka gazowa, cylinder miarowy, granulat i proszek cynku, rozcieńczony kwas solny, roztwór nadtlenku wodoru, tlenek manganu (IV), tlenek miedzi (II), tlenek cynku, chlorek sodu, ziemniak plastry, kawałki wątroby.
Metody oznaczania substancji nieorganicznych i organicznych.
Eksperymentalne oznaczanie substancji nieorganicznych.
Eksperymentalne oznaczanie substancji organicznych.
34 godzina