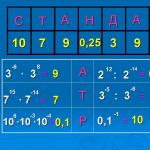
Учебный план курса
| № газеты | Учебный материал |
| 17 | Лекция № 1. Основные цели и задачи олимпиадного движения в контексте современного образования в России. История химического олимпиадного движения в России. Система химических олимпиад и творческих конкурсов в России. Роль химических олимпиад в образовании и науке. (Тюльков И.А., Архангельская О.В.) |
| 18 | Лекция № 2. Методика подготовки и проведения олимпиад различного уровня. Организация химических олимпиад: от простого к сложному. Подготовительная, основная и заключительная стадии организации олимпиад. Система действующих лиц олимпиады, их роль. (Тюльков И.А., Архангельская О.В.) |
| 19 | Лекция № 3.
Концептуальная
основа содержания олимпиадных задач. Примерная
программа содержания различных этапов
химических олимпиад: жесткие границы или
ориентиры для подготовки? Классификация
олимпиадных задач. Задачи химических олимпиад:
от этапа к этапу, от тура к туру.
(Тюльков И.А.,
Архангельская О.В.) Контрольная работа № 1 (срок выполнения – до 25 ноября 2008 г.) |
| 20 | Лекция № 4. Методика решения задач, включающих «цепочку» превращений. Классификация задач со схемами превращений. Тактика и стратегия решения олимпиадных задач с «цепочками». |
| 21 | Лекция № 5. Методика решения задач по физической химии (1). Задачи по термохимии. Задачи с использованием понятий «энтропия» и «энергия Гиббса». (Тюльков И.А., Архангельская О.В., Павлова М.В.) |
| 22 | Лекция № 6.
Методика решения
задач по физической химии (2). Задачи на
химическое равновесие. Задачи по кинетике.
(Тюльков И.А., Архангельская О.В., Павлова М.В.) Контрольная работа № 2 (срок выполнения – до 30 декабря 2008 г.) |
| 23 | Лекция № 7.
Методические
подходы к выполнению экспериментальных задач. Классификация
задач экспериментального тура. Практические
навыки, необходимые для успешного выполнения
экспериментальных задач.
(Тюльков И.А., Архангельская О.В., Павлова М.В.) |
| 24 | Лекция № 8. Методические принципы подготовки школьников к олимпиадам. Использование современных педагогических технологий при подготовке к олимпиадам различного уровня. Тактика и стратегия подготовки и участия в олимпиадах. Организационно-методическая работа учителя-наставника. Методические подходы к составлению олимпиадных задач. Олимпиады как средство повышения квалификации педагогов-наставников. Роль интернет-общения и средств массовой информации в обмене педагогическим опытом. (Тюльков И.А., Архангельская О.В., Павлова М.В.) |
| Итоговая работа.
Краткий отчет о проведении итоговой работы, сопровождаемый справкой из учебного заведения, должен быть направлен в Педагогический университет не позднее 28 февраля 2009 г. (Подробнее об итоговой работе будет напечатано после лекции № 8.) |
|
И.А.ТЮЛЬКОВ,
О.В.АРХАНГЕЛЬСКАЯ,
М.В. ПАВЛОВА
ЛЕКЦИЯ № 4
Методика решения задач,
включающих «цепочку» превращений
Классификация задач со схемами превращений
В заданиях Всероссийской олимпиады школьников по химии на любом этапе и для любой возрастной параллели участников всегда имеются задания со схемами последовательных превращений одних веществ в другие, которые характеризуют связь между основными классами органических и неорганических веществ. Многостадийную схему превращения одних веществ в другие в определенной последовательности часто называют «цепочкой». В «цепочке» часть или все вещества могут быть зашифрованы.
Для выполнения этих заданий необходимо знать основные классы неорганических и органических соединений, номенклатуру, лабораторные и промышленные способы их получения, химические свойства, в том числе продукты термического разложения веществ, механизмы реакций.
«Цепочки» – это оптимальный способ проверить большой объем знаний (практически по всем разделам общей, неорганической и органической химии) в одной задаче.
Схемы превращений веществ можно классифицировать следующим образом.
1) По объектам:
а) неорганические;
б) органические;
в) смешанные.
2) По типам или механизмам реакций (в основном это касается органической химии).
3) По форме «цепочки».
а) Даны все вещества без указаний условий протекания реакций.
б) Все или некоторые вещества зашифрованы буквами. Разные буквы соответствуют разным веществам, условия протекания реакций не указаны.
(В схемах стрелки могут быть направлены в любую сторону, иногда даже в обе стороны. Причем это не знак обратимости! Такие реакции, как правило, содержат разные реагенты.)
в) Вещества в схеме полностью или частично зашифрованы буквами и указаны условия протекания реакций или реагенты.
г) В схемах вместо веществ даны элементы, входящие в состав веществ, в соответствующих степенях окисления.
д) Схемы, в которых органические вещества зашифрованы в виде брутто-формул.
Схемы могут быть линейными, разветвленными, в виде квадрата или другого многоугольника (тетраэдра, куба и т.д.).
Тактика и стратегия решения олимпиадных задач с «цепочками»
В этой лекции мы будем придерживаться классификации заданий по форме представленных в «цепочке» последовательных превращений одних веществ в другие.
Для того чтобы правильно решить любую задачу на составление уравнений реакций согласно схеме, необходимо:
1) проставить цифры под или над стрелками – пронумеровать уравнения реакций, обратить внимание, в какую сторону направлены стрелки в цепочке превращений;
2) расшифровать представленные буквами, свойствами или брутто-формулами вещества (ответ должен быть мотивированным , т.е. необходимо не просто записать формулы расшифрованных соединений, а дать подробные объяснения расшифровки);
3) записать (под соответствующими номерами) все уравнения реакций;
4) внимательно проверить, правильно ли расставлены коэффициенты;
5) написать условия протекания реакций, если это необходимо.
Превратить одно вещество в другое можно различными путями. Например, получить CuO можно из Сu, Cu(OH) 2 , CuSO 4 , Cu(NO 3) 3 и т.д. Принимается любое правильное решение. Для некоторых задач приведены альтернативные решения.
Проиллюстрируем практически все типы «цепочек», которые даются на региональном (III) этапе. Уровень этих заданий близок к программе для поступающих в химические вузы. Поэтому это будут примеры не только из комплектов региональных этапов Всероссийской олимпиады, но и из вступительных экзаменационных билетов по химии в МГУ им. М.В.Ломоносова. Кроме того, используются задания из предшествующих этим экзаменам олимпиад последних лет (например, из конкурса «Покори Воробьевы горы» и олимпиады «Ломоносов»). При решении заданий, в которых имеются зашифрованные вещества, даются подробные объяснения расшифровки того или иного соединения.
Начнем с самых легких заданий.
Даны все вещества без указаний условий протекания реакций
Задача 1.
Fe 2 (SO 4) 3 -> FeI 2 -> Fe(OH) 2 -> Fe(OH) 3 -> Fe 2 O 3 -> Fe -> Fe 2 (SO 4) 3 .
Р е ш е н и е
Пронумеруем цепочку:
Для проведения первой реакции нужны одновременно и восстановитель, и соединение, способное вывести из сферы реакции сульфат ион. Например, йодид бария.
В третьей реакции нужен окислитель. Наиболее подходящим является пероксид водорода, т.е. получается только один продукт реакции. Напишем уравнения реакций.
1) Fe 2 (SO 4) 3 + 3BaI 2 = 2FeI 2 + I 2 + 3BaSO 4 ;
2) FeI 2 + 2NaOH = Fe(OH) 2 + 2NaI;
3) 2Fe(OH) 2 + H 2 O 2 = 2Fe(OH) 3 ;
4) 2Fe(OH) 3 = Fe 2 O 3 + 3H 2 O;
5) Fe 2 O 3 + 2Al = 2Fe + Al 2 O 3 ;
6) 2Fe + 6H 2 SO 4 (50%-я) = Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O.
Задача 2. Напишите уравнения реакций, соответствующие следующей схеме:

Р е ш е н и е
1) CH 3 COONa + HCl = CH 3 COOH + NaCl;
2) 5CH 3 CОCH 3 + 8KMnO 4 + 12H 2 SO 4 = 5CH 3 CОOH +5CO 2 + 8MnSO 4 + 4K 2 SO 4 + 17H 2 O;
3) 2CH 3 COOH + CaСO 3 = (CH 3 COO) 2 Ca + H 2 O + CO 2 ;
4) CH 3 COCH 3 + 8NaMnO 4 + 11NaOH = CH 3 COONa + 8Na 2 MnO 4 + Na 2 CO 3 +7H 2 O;
5) (CH 3 COO) 2 Ca + 2NaOH = 2CH 3 COONa + Ca(OH) 2
(CH 3 COO) 2 Ca + Na 2 СО 3 = 2CH 3 COONa + CaСO 3 ;
6) (СН 3 СOO) 2 Ca(тв.) = СН 3 СOСН 3 + CaCO 3 .
Задача 3.
Напишите уравнения реакций, соответствующие следующей схеме:

Р е ш е н и е
1) 2СuCl + Cl 2 = 2CuCl 2 ;
2) CuCl(тв.) + 3HNO 3 (конц.) = Cu(NO 3) 2 + HCl + NO 2 + H 2 O;
3) Cu + 4HNO 3 (конц.) = Cu(NO 3) 2 + 2NO 2 + 2H 2 O;
4) Cu + Cl 2 = CuCl 2 ;
5) 2Cl + 2NaOH + O 2 = 2CuO + H 2 O + 2NaCl + 4NH 3 ;
6) C 3 H 3 Cu (в реакции 6) может быть только
солью пропина (С 3 Н 4), потому что алкины
с концевой
C=
CH-группой – это СН-кислоты, с которыми
реагируют комплексы меди и серебра.
Cl + CH= C–CH 3 = CuC= C–CH 3 + NH 3 + NH 4 Cl;
7) 2C 3 H 3 Cu + 3H 2 SO 4 (конц.) = 2C 3 H 4 + 2CuSO 4 + SO 2 + 2H 2 O;
8) CuSO 4 CuO + SO 3
CuSO 4 CuO + SO 2 + 0,5O 2 ;
9) CuO + 2HCl = CuCl 2 + H 2 O;
10) CuCl + 2NH 3 (водн. р-р) = Cl;
11) C 3 H 3 Cu + 3HNO 3 (конц.) = Cu(NO 3) 2 + C 3 H 4 + NO 2 + H 2 O (в водном растворе);
12) Cu + 2H 2 SO 4 (конц.) = CuSO 4 + SO 2 + 2H 2 O.
Все или некоторые вещества
зашифрованы буквами.
Условия протекания реакций не указаны
Задача 4. Дана схема превращений:

Напишите уравнения реакций, обозначенных стрелочками. Назовите неизвестные вещества.
Р е ш е н и е
Определение неизвестных веществ. CuSO 4 можно получить растворением Cu, CuO или Cu 2 O в серной кислоте. Сu 2 O не подходит, т.к. это вещество уже имеется в цепочке. Таким образом, первые две реакции могут быть следующие:
1) 2Cu 2 O + O 2 = 4CuO (Х 1 = CuO);
2) СuO + H 2 SO 4 = CuSO 4 + H 2 O.
1) Сu 2 O = Cu + СuO
или Сu 2 O + H 2 = Cu + H 2 O (Х 1 = Cu);
2) Cu + 2H 2 SO 4 (конц.) = СuSO 4 + SO 2 + 2H 2 O.
Известно, что свежеприготовленный гидроксид меди(II) окисляет альдегиды. В результате реакции получается оранжевый осадок Cu 2 O. Следовательно, Х 2 – Сu(OH) 2 .
3) CuSO 4 + 2NaOH = Na 2 SO 4 + Cu(OH) 2 ;
4) 2Cu(OH) 2 + R–CHO = R–COOH + Cu 2 O + 2H 2 O
RCHO + NaOH + 2Cu(OH) 2 = RCOONa + 3H 2 O + Cu 2 O.
Ответ . X 1 – это или медь, или оксид меди(II); X 2 – это гидроксид меди(II) свежеприготовленный.
Задача 5 (химический факультет МГУ, 1998 г.). Напишите уравнения химических реакций, соответствующие следующей последовательности превращений:

Р е ш е н и е
Отправным (ключевым) звеном в данной схеме является вещество Е – альдегид. Рассмотрим реакции 4, 5 и 1. Известно, что качественной реакцией на альдегид является его взаимодействие со свежеприготовленным Cu(OH) 2 . В результате получается соответствующая альдегиду карбоновая кислота и Cu 2 O. Вероятно, что вещество F – Cu 2 O, т.к. из вещества F следует получить вещество В. Поскольку вещество В получается и при термическом разложении Cu(OH) 2 , ясно, что В – CuO. Отсюда следует, что вещество С – Н 2 О. D – спирт, который восстанавливается с помощью CuO в альдегид. И, наконец, реакция 2: спирт (D) получается гидратацией алкена (в схеме спирт получается из воды!), значит, он должен содержать в цепи не менее двух атомов углерода.
A – Cu(OH) 2 ; B – CuO;
C – H 2 О; D – RCH 2 CH 2 OH;
E – RCH 2 CHO; F – Cu 2 O.
Уравнения реакций:
1) Cu(OH) 2 CuO + H 2 O;
2) H 2 O + R–CH=CH 2 = R–CH 2 –CH 2 OH;
3) R–CH 2 –CH 2 OH + CuO = R–CH 2 –CH=О + Cu + H 2 O;
4) R–CH 2 –CH=O + 2Cu(OH) 2 = R–CH 2 –CООH + Cu 2 О + 2H 2 O
RCHO + NaOH + 2Cu(OH) 2 = RCOONa + 3H 2 O + Cu 2 O;
5) 2Cu 2 O + O 2 4CuO
Cu 2 O = Cu + CuO.
Задача 6 (для самостоятельного решения) .
Напишите уравнения реакций, соответствующие следующей схеме последовательных превращений:

Назовите вещества X 1 и X 2 .
Вещества в схеме полностью или
частично зашифрованы буквами
и указаны условия протекания или реагенты
Задача 7. Напишите уравнения химических реакций, соответствующие последовательности превращений:
Определите неизвестные вещества.
Р е ш е н и е
При взаимодействии железа с соляной кислотой получается хлорид железа(II). (Это объясняется тем, что водород в момент выделения не дает окислиться железу до степени окисления +3.) Во 2-й реакции окисляется до , а серная кислота может восстанавливаться до серы или SO 2 . Получившийся раствор солей железа(III) имеет кислую среду, т.к. это соли, образованные слабым основанием и сильными кислотами. При добавлении соды – соли сильного основания и слабой кислоты – происходит совместный гидролиз, который протекает до конца, т.е. образуется осадок (Fe(OH) 3) и газ (CO 2). Гидролиз каждой соли усиливает гидролиз другой.
Х 1 – FeCl 2 ; Х 2 – Fe 2 (SO 4) 3 и FeCl 3 (смесь);
Х 3 – Fe(OH) 3 (или CO 2 , или NaCl и Na 2 SO 4).
Уравнения реакций:
1) Fe + 2HCl = FeCl 2 + H 2 ;
2) 6FeCl 2 + 4H 2 SO 4 = Fe 2 (SO 4) 3 + 4FeCl 3 + S + 4H 2 O
6FeCl 2 + 6H 2 SO 4 = Fe 2 (SO 4) 3 + 4FeCl 3 + 3SO 2 + 6H 2 O;
3) 4FeCl 3 + Fe 2 (SO 4) 3 + 9Na 2 CO 3 + 9H 2 O = 6Fe(OH) 3 + 9CO 2 + 12NaCl + 3Na 2 SO 4 .
Задача 8. Напишите уравнения химических реакций, соответствующие следующей цепочке превращений:
Р е ш е н и е
Пронумеруем уравнения реакций в «цепочке»:
Реакция 1 является тримеризацией ацетилена (типичный способ получения бензола). Далее (реакция 2) идет алкилирование бензола по Фриделю–Крафтсу в присутствии кислоты Льюиса AlBr 3 . Бромирование на свету (реакция 3) протекает в боковой цепи. Спиртовой раствор щелочи в реакции 4 является реактивом для получения алкина из дигалогенпроизводного алкана. Далее идет реакция обмена (реакция 5): водород при тройной связи в алкине и ион серебра в аммиачном растворе оксида серебра. И, наконец (реакция 6) – образующийся фенилацетиленид серебра вступает в обменную реакцию с метилйодидом, в результате которой удлиняется углеродная цепь.
Уравнения реакций:
1) 3C 2 H 2 = C 6 H 6 ;
2) C 6 H 6 + C 2 H 5 Br = C 6 H 5 –C 2 H 5 + HBr;
3) C 6 H 5 –C 2 H 5 + 2Br 2 = C 6 H 5 –CBr 2 –CH 3 + 2HBr;
4) C 6 H 5 –CBr 2 –CH 3 + 2KOH = C 6 H 5 –C= СН + 2KBr + H 2 O;
5) C 6 H 5 –CСН +OH = AgC= C–C 6 H 5 + 2NH 3 + H 2 O;
6) AgC= C–C 6 H 5 + CH 3 I = AgI + CH 3 –C= C–C 6 H 5 .
Итак, зашифрованные вещества:

В схемах вместо веществ даны
элементы,
входящие в состав веществ в соответствующих
степенях окисления
Задача 9. Напишите уравнения реакций, иллюстрирующие схему превращений:
Р е ш е н и е
Пронумеруем уравнения реакций в цепочке:
В реакции 1 идет окисление соединения Fe(II) до соединения Fe(III) (это могут быть соли, гидроксиды, оксиды и т.д.). В качестве окислителя можно взять дихроматы или хроматы, перманганаты, галогены и т.д.
В реакции 4 железо из степени окисления +3 восстанавливается до простого вещества. Обычно металлическое железо получают восстановлением его оксидов (например, хромом или алюминием при высоких температурах – металлотермия).
Оксид железа(III) можно получить в результате термического разложения его солей или гидроксида (реакция 3). Реакция 2 скорее всего обменная. Реакция 5 – взаимодействие металлического железа с кислотой-неокислителем (HCl, HBr, CH 3 COOH и т.д.).
Рассмотрим три из всех возможных вариантов решения этой задачи.
Первый вариант :
1) 2Fe 2+ + Cl 2 = 2Fe 3+ + 2Cl – ;
2) Fe 3+ + 3OH – = Fe(OH) 3 ;
3) 2Fe(OH) 3 = Fe 2 O 3 + 3H 2 O (прокаливание);
5) Fe + 2H + = Fe 2+ + H 2 .
Второй вариант:
1) 2Fe(OH) 2 + H 2 O 2 = 2Fe(OH) 3 ;
2) Fe(OH) 3 + 3HNO 3 = Fe(NO 3) 3 + 3H 2 O;
3) 4Fe(NO 3) 3 = 2Fe 2 O 3 + 12NO 2 + 3O 2 (прокаливание);
4) Fe 2 O 3 + 2Al = Al 2 O 3 + 2Fe;
5) Fe + 2HCl = FeCl 2 + H 2 .
Третий вариант:
1) 4FeO + O 2 = 2Fe 2 O 3 ;
2) Fe 2 O 3 + 3H 2 SO 4 = Fe 2 (SO 4) 3 + 3H 2 O;
3) 2Fe 2 (SO 4) 3 = 2Fe 2 O 3 + 6SO 2 + 3O 2 (прокаливание);
4) Fe 2 O 3 + 2Al = Al 2 O 3 + 2Fe;
5) Fe + 2HCl = FeCl 2 + H 2 .
Схемы, в которых органические
вещества
зашифрованы в виде брутто-формул
Задача 10. Напишите уравнения реакций, соответствующие следующей схеме превращений:

В уравнениях укажите структурные формулы веществ и условия реакций.
Р е ш е н и е
Ключевым звеном в цепочке является вещество с формулой С 3 Н 4 О 2 . По реакции 1 вещество восстанавливается (в брутто-формуле появляются дополнительные четыре атома водорода), а по реакции 3 – окисляется (в формуле появляются дополнительные два атома кислорода). Наиболее вероятно, что С 3 Н 4 О 2 – пропандиаль (CHO–CH 2 –CHO), тогда С 3 Н 4 О 4 – пропандиоловая кислота (COOH–CH 2 –COOH), а С 3 Н 8 О 2 – пропандиол-1,3 (CH 2 OH–CH 2 –CH 2 OH). Рассуждая аналогично (просчитывая изменения в числе атомов в молекуле), делаем вывод о том, что по реакции 4 получается двойной этиловый эфир пропандиоловой кислоты (C 2 H 5 OОС–CH 2 –COOC 2 H 5). Реакция 5 – щелочной гидролиз эфира, в результате которого получается C 3 H 2 O 4 Na 2 – соль (NaOOC–CH 2 –COONa), а по реакции 6 с помощью галогенметана получается двойной метиловый эфир пропандиоловой кислоты (CH 3 OOC–CH 2 –COOCH 3).
Реакция 2 – взаимодействие пропандиола-1,3 с
метаналем с образованием диоксана-1,3
Уравнения реакций:


Задача 11.
Напишите уравнения реакций, соответствующие следующей схеме превращений:

В уравнениях укажите структурные формулы веществ и условия протекания реакций.
(Знак S N обозначает, что реакция протекает по механизму нуклеофильного замещения.)
Р е ш е н и е
Пронумеруем уравнения реакций в цепочке:

В молекуле вещества C 8 H 9 Cl, полученного через одну стадию из бензола, содержится, по-видимому, радикал фенил – это следует из соотношения углерода и водорода в соединении (С 6 Н 5 С 2 H 4 Cl). Тогда Х может быть веществом C 6 H 5 –СH 2 –CH 3 , которое превращается в С 6 Н 5 –С 2 H 4 Cl при действии на него хлора на свету; или Х может быть веществом C 6 H 5 –СH=CH 2 , которое дает С 6 Н 5 С 2 H 4 Cl при действии на него HCl. И в том, и в другом случае хлор идет ко вторичному атому углерода С 6 Н 5 СHCl–СН 3 .
Вещество Y получается по реакции нуклеофильного замещения хлора скорее всего на ОН – группу (реакция 3). Тогда реакция 4 будет реакцией дегидратации. С 8 Н 8 в контексте этой задачи, вероятно, С 6 Н 5 –СH=СН 2 . В этом случае реакция 5 – окисление по двойной связи перманганатом в нейтральной среде – приводит к образованию диола с брутто-формулой С 8 H 10 O 2 . И, наконец, появление в завершающей «цепочку» формуле (по сравнению с веществом Z) еще четырех атомов углерода, четырех атомов водорода и двух атомов кислорода означает реакцию этерификации диола и уксусной кислоты.
Уравнения реакций:
1) C 6 H 6 + CH 2 =CH 2 C 6 H 5 –C 2 H 5 ;
2) C 6 H 5 –C 2 H 5 + Cl 2 C 6 H 5 –CHCl–CH 3 + HCl;
3) C 6 H 5 –CHCl–CH 3 + NaOH + H 2 O = C 6 H 5 CH(OH)–CH 3 + NaCl;
4) C 6 H 5 –CH(OH)–CH 3 C 6 H 5 CH=CH 2 + H 2 O;
5) 3C 6 H 5 CH=CH 2 + 2KMnO 4 + 4H 2 O = 3C 6 H 5 CH(OH)–CH 2 (OH) + 2MnO 2 + 2KOH;
6) C 6 H 5 CH(OH)–CH 2 (OH) + 2CH 3 COOH = ![]()
В заключение приведем примеры заданий, которые были представлены на федеральных окружных * и заключительных этапах Всероссийской олимпиады школьников по химии. На этих этапах цепочки превращений становятся более сложными. Кроме непосредственно цепочки, даются дополнительные сведения о свойствах зашифрованных веществ. Для дешифровки веществ часто необходимо проводить расчеты. В конце текста задания обычно предлагается ответить на несколько вопросов, связанных со свойствами веществ из «цепочки».
Задача 1 (федеральный окружной этап 2008 г., 9-й класс).
«А , Б и В – простые вещества. А быстро реагирует с Б при нагревании до 250 °C, образуя темно-красные кристаллы соединения Г . Реакция Б с В после предварительной инициации протекает очень бурно, приводя к образованию бесцветного вещества Д , газообразного при нормальных условиях. Г , в свою очередь, способно реагировать с В при температуре 300–350 °С, при этом красные кристаллы превращаются в белый порошок Е и образуется соединение Д . Вещество А вступает в реакцию с Д только при температуре около 800 °C, при этом образуются Е и В . Вещество Г легко может быть сублимировано при пониженном давлении и температуре ниже 300 °C, но при нагревании выше 500 °C его пары разлагаются с образованием вещества Б и опять же соединения Е .

1. Определите вещества А –Е .
2. Напишите уравнения всех упомянутых реакций в соответствии с приведенной схемой.
3. Как будут взаимодействовать вещества Г и Е с водными растворами сульфида и йодида натрия, с избытком концентрированного раствора цианида калия? Напишите уравнения реакций.
4. Напишите уравнения реакций, происходящих при взаимодействии веществ Г , Д и Е с концентрированной азотной кислотой».
Р е ш е н и е
1. Обратим внимание на проценты: соединение Д , состоящее из двух элементов Б и В , газообразное и содержит всего 2,74 % В . Такой малый процент свидетельствует о том, что или атомная масса элемента В очень мала, или в формуле Д большой индекс у элемента Б . Учитывая, что Д при н.у. является газом, наиболее вероятно, что В – это водород. Проверим нашу гипотезу. Если состав Д выразить формулой Н х Э у , то
2,74: (97,26/М Э) = х : у .
Заметим, что соединения, где у не равен 1, не получить прямым взаимодействием элемента с водородом в ходе «бурной реакции после предварительной инициации». Перегруппировав уравнение, получаем М Э = 35,5х , которое имеет единственное разумное решение при х = 1. Таким образом, В – водород, Б – хлор.
Определим вещество Е , в состав которого входит 55,94% хлора. Оно образуется в ходе реакции простого вещества А с хлороводородом, и при этом выделяется водород, что позволяет предположить: Е – хлорид элемента, образующего простое вещество А . Для соединения ЭCl x :
(55,94/35,45) : (44,06/М Э) = х .
Отсюда М Э = 27,92х . При х = 1 и 3 получаются соответственно кремний (28) и криптон (84), но это противоречит их валентным возможностям и условию задачи, а вот при х = 2 получается железо (56), которое в реакции с хлороводородом действительно образует FeCl 2 . В ходе прямой реакции железа с хлором образуется другой хлорид – FeCl 3 .
Итак, зашифрованные вещества:
А – Fe; Б – Cl 2 ; В – H 2 ;
Г – FeCl 3 ; Д – HCl; Е – FeCl 2 .
2. Уравнения реакций в цепочке:

3. 2FeCl 3 + 3Na 2 S = 2FeS + S + 6NaCl;
FeCl 2 + Na 2 S = FeS + 2NaCl;
2FeCl 3 + 2NaI = 2FeCl 2 + I 2 + 2NaCl
(возможны реакции:
2FeCl 3 + 6NaI = 2FeI 2 + I 2 + 6NaCl
6FeCl 3 + 18NaI = 2Fe 3 I 8 + I 2 + 18NaCl);
FeCl 3 + 6KCN = K 3 + 3KCl;
FeCl 2 + 6KCN = K 4 + 2KCl.
4. FeCl 3 + 4HNO 3 = Fe(NO 3) 3 + NOCl + Cl 2 + 2H 2 O;
3HCl + HNO 3 = NOCl + Cl 2 + 2H 2 O;
2FeCl 2 + 8HNO 3 = 2Fe(NO 3) 3 + 2NOCl + Cl 2 + 4H 2 O.
Задача 2 (федеральный окружной этап 2007 г., 10-й класс).
«Под А –Е (кроме В ) зашифрованы вещества, содержащие переходные металлы.
Количественный состав веществ А и С :
А: (Cu)=49,3%, (O)=33,1%, (S)=16,6%.
C: (Co)=50,9%, (O)=34,5%, (S)=13,8%.
1. Определите вещества A –E и напишите уравнения реакций.
2. В каком случае в приведенной схеме вещество В получается аморфным и в каком кристаллическим? Предложите по одному альтернативному методу синтеза кристаллического и аморфного вещества В .
3. Какое тривиальное название имеет вещество D ?»
Р е ш е н и е
1. Сложив все приведенные массовые доли (как для вещества А , так и для вещества С ), мы не получим 100%. Значит, в этих веществах содержится как минимум еще по одному элементу!
Вещество А:
Учитывая малую массовую долю неизвестного элемента, можно предположить, что это водород. Тогда брутто-формула соединения А : Cu 3 S 2 O 8 H 4 , или Cu 2 SO 3 CuSO 3 2H 2 O.
Вещество С :
Аналогично предыдущему случаю можно предположить, что и здесь неизвестный элемент – водород. Тогда формула вещества С будет Co 2 (OH) 2 SO 3 .
Вещество В – это Al(OH) 3 . При взаимодействии сульфата алюминия с сульфитом натрия образуется аморфный гидроксид алюминия. Во втором же случае, при взаимодействии хлорида триэтиламмония с Na образуется кристаллический гидроксид алюминия.
При взаимодействии В и С при нагревании образуется алюминат кобальта – Co(AlO 2) 2 .
В щелочной среде восстановление перманганат-иона идет либо до степени окисления +6, либо до +5, соответственно Е – K 2 MnO 4 или K 3 MnO 4 .
А – Cu 2 SO 3 CuSO 3 2H 2 O; B – Al(OH) 3 ; C – Co 2 (OH) 2 SO 3 ; D – CoAl 2 O 4 ; E – K 2 MnO 4 или K 3 MnO 4 .
Уравнения реакций в «цепочке»:
1) 3CuSO 4 + 3Na 2 SO 3 = Cu 2 SO 3 CuSO 3 2H 2 O + 3Na 2 SO 4 + SO 2 ;
2) 3Na 2 SO 3 + Al 2 (SO 4) 3 + 3H 2 O = 2Al(OH) 3 + 3Na 2 SO 4 + 3SO 2
(наряду с гидроксидом алюминия в данной фазе будут присутствовать основные сульфаты различного состава, но традиционно считается, что образуется аморфный гидроксид алюминия);
3) Na + Cl = Al(OH) 3 + NaCl + NEt 3 + H 2 O;
4) 2CoSO 4 + 2Na 2 SO 3 + H 2 O = Co 2 (OH) 2 SO 3 + SO 2 + 2Na 2 SO 4 ;
5) Co 2 (OH) 2 SO 3 + 4Al(OH) 3 2CoAl 2 O 4 + SO 2 + 7H 2 O;
6) 2KMnO 4 + Na 2 SO 3 + 2KOH = 2K 2 MnO 4 + Na 2 SO 4 + H 2 O
KMnO 4 + Na 2 SO 3 + 2KOH = K 3 MnO 4 + Na 2 SO 4 + H 2 O.
2. Растворы солей алюминия имеют кислую среду:
3+ H + + 2+ 2H + + + .
При добавлении щелочи (или водного раствора аммиака), карбонатов или гидрокарбонатов повышение рН раствора приводит к смещению равновесия вправо и полимеризации аквагидроксокомплексов через мостиковые гидроксо- и оксо-группы в многоядерные комплексы. В результате образуется продукт состава Al 2 O 3 x H 2 O (х > 3) (аморфный осадок, не имеющий постоянного состава).
Метод получения аморфного гидроксида алюминия:
Al 2 (SO 4) 3 + 6KOH = 2Al(OH) 3 + 3K 2 SO 4
Al 2 (SO 4) 3 + 6KHCO 3 = 2Al(OH) 3 + 3K 2 SO 4 + 6CO 2 .
Метод получения кристаллического гидроксида алюминия заключается в медленном пропускании CO 2 через раствор тетрагидроксоалюмината натрия:
Na + CO 2 = NaHCO 3 + Al(OH) 3 .
Во втором случае получается продукт определенного состава – Al(OH) 3 .
3. Алюминат кобальта имеет тривиальное название «тенарова синь».
Задача 3 (заключительный этап 2008 г., 10-й класс).
«На приведенной ниже схеме представлены превращения соединений A –К , содержащих в своем составе один и тот же элемент Х .
Дополнительно известно:
Элемент Х
встречается в природе в виде
минерала A
(содержание по массе: Na –
12,06 % ,
X – 11,34 %, H – 5,29 %, остальное – кислород);
Б – бинарное соединение, содержащее 15,94 % (по массе) Х;
В – бесцветный газ с плотностью по воздуху около 1;
Соединение Д используется в медицине в виде спиртового раствора;
d -модификация З схожа с графитом по физическим свойствам;
Вещество И находит широкое применение в органическом синтезе в качестве восстановителя;
Молекула К (почти плоская) имеет ось симметрии третьего порядка (при полном повороте вокруг этой оси симметрии молекула К воспроизводит свое положение в пространстве три раза); в спектре ЯМР 1 Н соединения К наблюдаются два сигнала.
1. Определите элемент Х . Ответ подтвердите расчетом.
2. Приведите формулы соединений A –И . Назовите минерал А .
3. Изобразите структурную формулу К и назовите это соединение.
4. Напишите уравнения всех представленных на схеме реакций.
5. Напишите уравнение реакции Х (аморф.) со смесью концентрированных азотной и плавиковой кислот.
6. Чем объясняется сходство физических свойств -модификации З с графитом?»
Р е ш е н и е
1. Бинарное вещество Б образуется при взаимодействии минерала А с фторидом кальция в присутствии концентрированной серной кислоты. Можно предположить, что Б помимо элемента Х содержит фтор. Учитывая, что валентность фтора в соединениях равна 1, Б можно записать в виде ХF n . Определим элемент Х:
![]()
где М r (Х) – относительная атомная масса элемента Х, n – валентность Х в соединении Б . Из этого уравнения находим
М r (Х) = 3,603n .
Перебираем значения n от 1 до 8. Единственный разумный вариант получаем при n = 3: М r (Х) = 10,81, т.е. элемент Х – бор, (а вещество Б – трифторид бора BF 3).
2. Найдем состав вещества А .
т.е. Na 2 B 4 H 20 O 17 , или Na 2 B 4 O 7 10H 2 O, – минерал «бура» (вещество А ).
При восстановлении трифторида бора гидридом натрия образуется бесцветный газ В , вероятнее всего, представляющий водородное соединение бора. Поскольку плотность В по воздуху около 1, молекулярная масса В близка к 29, следовательно, вещество В – диборан B 2 H 6 (M r = 28).
Дальнейшее взаимодействие диборана с избытком NaH в эфире приводит к образованию комплексного гидрида, широко используемого в органическом синтезе в качестве восстановителя, – тетрагидридобората натрия Na (вещество И ).
При сжигании диборана образуется оксид бора, Г – В 2 О 3 , восстановление которого металлическим алюминием приводит к образованию аморфного бора. Оксид бора реагирует с водой, в результате образуется ортоборная кислота Н 3 ВО 3 (вещество Д , в виде спиртового раствора применяется в медицине под названием «борный спирт»). Борная кислота вступает в реакцию с концентрированной плавиковой кислотой, давая комплексную кислоту, которая после обработки раствором гидроксида натрия превращается в тетрафтороборат натрия Na (соединение Е ).
Рассмотрим взаимодействие трифторида бора с газообразным аммиаком. BF 3 – типичная кислота Льюиса (акцептор электронной пары); в молекуле аммиака имеется неподеленная пара электронов, т.е. NH 3 может выступать в качестве основания Льюиса. При реакции трифторида бора с аммиаком образуется аддукт состава BF 3 NH 3 (соединение Ж ) (ковалентная связь между атомами бора и азота образуется по донорно-акцепторному механизму). Нагревание этого аддукта выше 125 °С приводит к образованию нитрида бора BN (соединение З ).
3. При реакции диборана с газообразным аммиаком при нагревании образуется продукт К , содержащий водород, бор и, вероятно, азот. Молекула К имеет плоское строение, ее высокая симметрия указывает на возможный углеродный аналог этого соединения – бензол. Однако, чтобы в молекуле К было два типа атомов водорода и имелась ось симметрии третьего порядка, необходимо в «бензольном» кольце вместо атомов углерода поочередно разместить атомы азота и бора (рис.). Соединение К называется «неорганическим бензолом» (боразол).

4. Уравнения описанных в задаче реакций:
1) Na 2 B 4 O 7 10Н 2 О + 6CaF 2 + 8H 2 SO 4 (конц.) = 4BF 3 + 2NaHSO 4 + 6CaSO 4 + 17H 2 O;
2) 2BF 3 + 6NaH = B 2 H 6 + 6NaF;
3) B 2 H 6 + 3O 2 = B 2 O 3 + 3H 2 O;
4) B 2 O 3 + 2Al = Al 2 O 3 + 2B;
5) B 2 H 6 + 2NaH 2Na;
6) B 2 O 3 + 3H 2 O = 2H 3 BO 3 ;
7) H 3 BO 3 + 4HF (конц.) = Н + 3H 2 O,
Н + NaOH = Na + H 2 O;
8) BF 3 + NH 3 = BF 3 NH 3 ;
9) 4BF 3 NH 3 BN + 3NH 4 BF 4 ;
10) 3B 2 H 6 + 6NH 3 2B 3 N 3 H 6 + 12H 2 .
5. B (аморф.) + 3HNO 3 (конц.) + 4HF (конц.) = Н + 3NO 2 + 3H 2 O.
6. Заметим, что частица BN изоэлектронна частице C 2 , сумма ковалентных радиусов атомов бора и азота примерно равна сумме двух ковалентных радиусов атома углерода. Кроме того, бор с азотом имеют возможность образовывать четыре ковалентные связи (три по обменному механизму и одну – по донорно-акцепторному). Соответственно, BN тоже образует две структурные модификации – графитоподобную (-модификация) и алмазоподобную (-модификация). Именно поэтому -BN по физическим свойствам очень похож на графит (тугоплавкость, смазочные свойства).
Л и т е р а т у р а
Задачи Всероссийских олимпиад по химии. Под ред. акад. РАН, проф. В.В.Лунина. М.: Экзамен, 2004, 480 с.; Химия: формулы успеха на вступительных экзаменах. Учебное пособие. Под ред. Н.Е.Кузьменко, В.И.Теренина. М.: Изд-во МГУ, Наука, 2006, 377 с.; Химия-2006: Вступительные экзамены в МГУ. Под ред. проф. Н.Е.Кузьменко и проф. В.И.Теренина. М.: Изд-во МГУ, 2006, 84 с.; Вступительные экзамены и олимпиады по химии в Московском университете: 2007. Под ред. проф. Н.Е.Кузьменко и проф. В.И.Теренина. М.: Изд-во МГУ, 2008, 106 с.; Задачи Всероссийской олимпиады по химии федерального окружного и заключительного этапов 2003–2008 гг. Интернет. http://chem.rusolymp.ru ; www.chem.msu.ru .
* До 2008 г. включительно ВОШ(х) проходила в пять этапов: школьный, муниципальный, региональный, федеральный окружной и заключительный. – Прим. авторов.
















 Назад
Вперёд
Назад
Вперёд
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цели урока:
- повторить алгоритм по составлению ОВР методом электронного баланса и раскрыть сущность метода полу реакций МПР.
- показать преимущества в формировании умений прогнозирования направления протекания ОВР в растворах на примере соединений марганца.
- закрепить умения по составлению уравнений ОВР, протекающих в различных средах.
- научить применять полученные знания для решения конкретных задач.
Задачи урока.
- Подготовить учащихся к выполнению задания 36 из ЕГЭ по химии
- Планируемый результат
Предметные:
- знать ОВР, правила составления ОВР;
- уметь Определять характер среды, условия протекания ОВР, исходные и продукты образования, окислителя и восстановителя, составить электронный баланс и пользоваться методом полу реакций, проводить эксперимент и на основе эксперимента сделать вывод.
Метапредметные:
- уметь Организовывать свою деятельность, определять ее цели и задачи, выбирать средства реализации цели и применять их на практике, оценивать результаты; устанавливать причинно-следственные связи, строить логические рассуждения, делать выводы; умение создавать модели и схемы; умение организовывать учебное сотрудничество и совместную деятельность с учителем и сверстниками, работать индивидуально и в группе.
Личностные: Формирование ответственного отношения к учению, готовности и способности обучающихся к саморазвитию и самообразованию на основе мотивации к обучению и познанию; формирование коммуникативной компетентности в общении и сотрудничестве со сверстниками в процессе учебной деятельности.
Оборудование и реактивы:
- персональный компьютер, проектор, презентация
- Раствор перманганата калия, кристаллический перманганат калия, раствор серной кислоты, раствор щелочи, раствор иодида калия, сульфит натрия, 5-10%-ный раствор пероксида водорода
- Большие пробирки, помещенных в демонстрационный штатив с белым фоном, прибор для получения газов, колба-приемник, железный штатив, спиртовка, лучинка, спички, пробирки в универсальном штативе на каждом столе, стеклянная палочка
- Приложение 1 “Соединения элемента марганца: окислители и восстановители, расчет степеней окисления”
- Приложение 2 “Алгоритм составления уравнений ОВР методом электронного баланса”
- Приложение 3 “Алгоритм составления уравнений ОВР ионно-электронным методом”
- Приложение 4 “Окислительные и восстановительные свойства пероксида водорода в зависимости от характера среды. Инструкция по выполнению лабораторного опыта”.
Тип урока: усвоение новых знаний с применением имеющихся знаний и умений с последующим обобщением и систематизацией.
Формы, применяемые на уроке
- Разъяснение (объяснительно-иллюстративный)
- рассуждение (частично-поисковый)
- общая характеристика (проблемный)
Методы, применяемые на уроке
- словесные (беседа, объяснение)
- наглядные (опыты, компьютерная презентация, информационные приложения)
- практические (демонстрация и самостоятельное выполнение опытов).
План урока.
- Актуализация знаний.
- Повторение основных теоретических понятий темы.
- Определение, среды (кислой, нейтральной или щелочной), в которой протекает реакция.
- Электронный и ионно-электронный метод составления уравнений ОВР
- Закрепление полученных знаний
Ход урока
1. Актуализация знаний.
Подготовка к выполнению задания 36 состоит из нескольких элементов:
Изучение теоретического материала, индивидуальные консультации с преподавателем и выполнение заданий, основываясь на данном методическому материале.
Прежде чем приступить к выполнению работы необходимо освоить основные термины, определения, понятия и овладеть техникой химических расчетов.
В задании предложена схема реакции, причем формулы одного-двух веществ заменены многоточиями.
Все задания 36 можно условно разделить на три типа:
Учитель проецирует с помощью видеопроектора схемы на экран Слайд 2
2. Повторение пройденного материала
В программе основной школы вы уже затрагивали основные вопросы, необходимые для выполнения задания 36.
Знаете, какие химические реакции относятся к окислительно -восстановительным и что в ОВР один из участников окисляется. Это восстановитель, т.е. он отдает электроны и повышает свою степень окисления. Другой – восстанавливается. Это окислитель, т.е. он оттягивает на себя валентную пару электронов, понижает свою степень окисления.
Слайд 3 Учитель проецирует с помощью видеопроектора схемы на экран
Выполняем задание. Учащиеся имеют приложение на партах Приложение 1
Выполняем упражнение:
- определение степени окисления элементов по формуле
- строение атома марганца, определяют возможные степени окисления элемента, его окислительную и восстановительную способность.
- заполняют таблицу по типам химических реакций
- формируют вывод
Учащиеся заполняют таблицу. Делают вывод: все реакции замещения и реакции, в которых присутствуют простые вещества относятся к ОВР. Рассматривают строение атома марганца. Делают вывод.
3. Определение, среды (кислой, нейтральной или щелочной), в которой протекает реакция.
Приступая к выполнению данного задания, вы, логически рассуждая, должны определить пропущенные вещества. Для этого необходимо знать основные окислители и восстановители, а также продукты их восстановления или окисления.
Кроме того, для того, чтобы дописать пропущенные вещества, следует учитывать, в какой среде протекает окислительно - восстановительная реакция.
Определить среду можно
А) по продуктам восстановления окислителя (например, марганца)
Перманганаты – сильные окислители, при чём, в зависимости от рН среды:
Учитель проецирует с помощью видеопроектора схемы на экран, проводит опыт
Слайд 4, 5, 6 Демонстрационный опыт “Химический хамелеон”
Восстановление перманганата калия сульфитом натрия в различных средах.
4. Процедуры подбора коэффициентов в уравнениях
Что касается собственно процедуры подбора коэффициентов в уравнениях, то можно использовать метод электронного баланса, а для реакций в растворах удобен так называемый метод полу реакций, или электронно-ионный.
Учитель проецирует с помощью видеопроектора схемы на экран Слайд 7,8,9
Составление уравнений ОВР методом электронного баланса
Метод электронного баланса основан на сравнении степеней окисления в исходных и конечных веществах, когда известны все исходные вещества и продукты реакции. Этим методом вы уже пользовались при работе на уроках в 8-9 классах.
Приложение 2.
Работа у доски: Уровнять реакции, используя метод электронного баланса, определить окислитель и восстановитель. Слайд 7,8,9
Делают вывод: Методом электронного баланса расставлять коэффициенты удобно, если известны исходные вещества и продукты реакции, т.е. даны полные схемы реакций.
Метод полу реакций, или электронно-ионный.
При использовании метода полу реакций (электронно-ионный баланс) следует иметь в виду, что в водных растворах связывание избыточного кислорода и присоединение кислорода восстановителем происходит по-разному в кислой, нейтральной и щелочной средах.
Учитель проецирует с помощью видеопроектора схемы на экран. Выполняет опыты.
Учащиеся имеют приложения на партах. Приложение 3. Слайд 10,11
Демонстрационный опыт. Восстановление перманганата калия йодидом калия в различных средах. “Химический хамелеон”
Учитель проецирует с помощью видеопроектора схемы на экран, учащиеся для удобства имеют схемы на партах
Работа у доски: Уровнять реакции, используя МПР, определить окислитель и восстановитель.
Одну реакцию выполняет учитель, две оставляет на самостоятельную работу учащихся.
Слайд 12,13,14
Делаем вывод:
Рассмотрев метод электронно-ионного баланса
или метод полу реакций можно выделить следующие
достоинства данного метода:
5. Закрепление полученных знаний
Реакции – диспропорционирования.
Учитель проецирует с помощью видеопроектора схемы на экран. Выполняет опыт.
Демонстрационный опыт “Химический хамелеон” Слайд 15, 16
Описание:
Для опыта нужна пробирка с газоотводной трубкой. В пробирку насыпали кристаллический перманганат калия (марганцовку). При нагревании перманганат калия разлагается, выделяющийся кислород поступает по газоотводной трубке в колбу-приемник. Кислород тяжелее воздуха, поэтому не покидает колбу и постепенно заполняет ее. Если опустить тлеющую лучину в колбу с собранным кислородом, то она ярко вспыхнет, т.к. кислород поддерживает горение.
Уравнение проведенной реакции:
2KMnO 4 = K 2 MnO 4 + MnO 2 + O 2
После окончания опыта и охлаждения пробирки в нее наливают несколько миллилитров воды, тщательно взбалтывают содержимое и наблюдают цвет образовавшихся веществ (К 2 МnO 4 - зеленого цвета и МnO 2 темно-бурого).
K 2 Mn +6 O 4 + H 2 O -> KMn +7 O 4 + Mn +4 O 2 + KOH
При сильном разбавлении водой происходит реакция самоокисления-самовосстановления. Окраска изменится с зеленой на красно-фиолетовую и выпадет бурый осадок.
Самостоятельная работа в тетрадях: Уровнять реакции, используя МПР, определить окислитель и восстановитель. Слайд 15,16
Формируют вывод: Это реакции, где окислитель и восстановитель – один и тот же элемент, входящий в состав одной молекулы.
Самостоятельно проводим опыт и пишем уравнение методом полуреакций
Учитель объясняет, что пероксид водорода может проявлять окислительные и восстановительные свойства, как в кислотной, так и в щелочной среде.
(перекиси могут быть как окислителями, так и восстановителями, электроны перекисей могут переходить от одной молекулы к другой:
Н 2 O 2 + Н 2 O 2 = O 2 + 2Н 2 O.)
Учащиеся выполняют лабораторный опыт и делают вывод о проявлении перекиси водорода окислительных и восстановительных свойств в зависимости от среды.
Примечание. Для эксперимента используют 3%-й раствор перекиси водорода, который можно приобрести в аптеке, как и раствор марганцовки.
Техника эксперимента проста и не требует большой затраты времени.
Учитель проецирует с помощью видеопроектора схемы на экран. Для удобства учащиеся имеют приложение на партах. Приложение 4. Слайд 17
Лабораторная работа: “Восстановление перманганата пероксидом водорода” “Химический хамелеон” - Превращение малинового раствора в бесцветный”
Делают вывод: В этом случае пероксид водорода проявляет восстановительные свойства, а перманганат калия - окислительные.
6. Домашнее задание: Слайд 18
Принесли мне маску сварщика автоматическую etaltech et8f с жалобой – работает нестабильно. К сожалению я ее не сфотографировал, она вот такая, только наклеечка другая:
Смотрим инструкцию:

Черным по белому написано, что работает от солнечных батарей. Вскрываю и….

Две литиевые батарейки, наглухо запаянные в плату. Вот тебе и солнечные батареи…. В интернете к сожалению нет схем масок. На плате написано artotic s777f – Это китайский производитель этих масок, как обычно, крупный китайский завод клепает продукцию, а у нас только навешивают бренд – корвет, etalon, кратон, калибр…

Литиевые батарейки соединены последовательно, и через диод идут на шину VCC. На плате имеется операционный усилитель 27L2C , два счетверенных двухканальных аналоговых мультиплексора BU4551BF , один мультивибратор HCF4047 . Я немножко пореверсинжинирил схему, часто у меня было вот такое выражение лица: О.о но кое что понять удалось.
Питание на мультиплексоры от VCC поступает всегда. Так как они КМОП то потребляют ток только во время переключения. Солнечная батарея подключена на базу транзистора так, что при наличии освещенности открывает транзистор и через транзистор с VCC через фильтр подается питание на операционный усилитель. У маски два переменных резистора настройки – степень затемнения и чувствительность. Внутри два переключателя – режим сварка-заточка, и скорость растенения стекла после прекращения дуги. В качестве датчиков используются два параллельно соединенных фотодиода. Причем в режиме “заточка” они закорачиваются, садясь на землю. Выходит солнечная батарея используется только как датчик. Через 2-3-5 лет батарейки скиснут и маску выкинут, покупая новую. Так хитро китайцы обеспечивают постоянный поток заказов. Никаких ионисторов и цепей зарядки не предусмотрено.

Что еще удалось узнать. Стекло – двойной бутерброд из ЖК фильтров, то есть два стекла используется для гарантированного затенения. Правда качество стекол невысокое и я явно видел разницу в затенении между центром и краями. Стекло включено между выходами Q и!Q мультивибратора 4047. При этом на стекле меандр, амплитуда которого – и есть степень затенения. При изменении степени затенения от минимума до максимума меняется амплитуда меандра с 4,2В до 6В. Для реализации этого хитрого фокуса изменяется напряжение на входе питания мультивибратора. Зачем питать стекло напряжением прямоугольной формы – не знаю, то ли для уменьшения явления поляризации, то ли еще для чего. Я пробовал поиграться со стеклом просто так, если на него подать напряжение – оно как емкость заряжается и при снятии напряжения растеняется довольно долго – должно пройти секунд 5-7 прежде чем оно станет прозрачным.
UPD. Переменный ток для питания ЖК светофильтра используется для устранения явления электролиза, если запитать стекло постоянным током, то со временем растворится один из прозрачных электродов. Напряжение питания разное – у fubag optima 11 напряжение питания стекла – 24В переменки с частотой 0,5 Гц.
Сами датчики – фотодиоды в тонированном пластиковом корпусе, заточены на ИК излучение, поэтому маска упорно не хотела срабатывать на энергосберегающую лампу. Но остро реагировала на ЖК монитор, и хорошо срабатывала на лампу накаливания.
Вот такие дела. Учитывая отсутствие схем управления маской в интернете вообще, кажется интересной задачей склепать опенсорсную схему управления маской на микроконтроллере. С нормальной зарядкой от солнечной батареи, умной обработкой сигнала с датчиков и какими-нибудь дополнительными функциями. Например автоматическим затенением наглухо если температура ниже пороговой, все равно на морозе быстро сработать не получится – так затенимся полностью и станем просто сварочной маской.
Было оговорено, что на мощности свыше 600 Вт лучше использовать двухуровневое питание, которое позволяет довольно серьезно разгрузить выходной каскад и на меньшем количестве оконечных транзисторов получить большую мощность. Для начала стоит пояснить что же есть такое - двухуровневое питание.
Надеемся не надо пояснять что такое двуполярный источник питания, этот же вариант можно назвать "четырехполярным", поскольку относительно общего провода имеется 4 различных напряжения. Принципиальная схема такого источника приведена на рисунке 1.
Рисунок 1.
Однако напряжение питания необходимо подавать на оконечный каскад усилителя, а как быть, если этих напряжений 2? Правильно - необходима дополнительная схема управления этим самым питанием. По принципу управления различают 2 основных класса - G и H. Отличаютс они между собой прежде всего тем, что класс G изменяет напряжение питания на оконечном каскаде плавно, т.е. силовые транзисторы системы управления питания работают в усилительном режиме, а в классе H силовые ключи системы управления питанием подают ступечато, т.е. они либо полностью закрыты, либо полностью открыты...
Временные диаграммы приведены на рисунке 2 и 3, на рис.2 - класс G, на рис.3 - класс H. Синяя линия - выходной сигнал, красная и зеленая - напряжение питания оконечного каскада усилителя мощности.

Рисунок 2.
Рисунок 3.
Как должно подаваться питание на оконечный каскад вроде разобрались, осталось выяснить каким набором элементов это сделать...
Для начала рассмотрим класс H. На рисунке 5 приведена принципиальная схема усилителя мощности работающег в класе H.

Рисунок 4 УВЕЛИЧИТЬ .
Синим прописано напряжение и мощностьна нагрузку 4 Ома, красны для нагрузки 8 Ом, на рисунке так же показан рекомендуемый источник питания. Как видно из схемы ее костяк состоит из типовго класаа AB, однако питание на усилитель напряжение подается уже с более высоковольной "ветки" питания, причем влияние выходного сигнала на напряжение питания усилителя напряжение снижено (уменьшено сопротивление R36, R37, иногда номинал этих резисторов приходится снижать вплоть до 68 Ом, особенно на мощностях выше 1 кВт), поскольку при подключении "второго этажа" питания на выходном сигнале наблюдается небольшой всплеск, которй ухом уловит не каждый, а вот на устойчивость схемы он влияет довольно серьезно...
Управление питанием, подаваемым на оконечные каскады осуществляется компораторами LM311, порог срабатывания которых регулируется подстроечными резисторами R73 и R77. Для правильной настройки потребуется или ОЧЕНЬ хороший слух или, что предпочтительней - осцилограф.
После компораторов стоят транзисторные драйвера, которые работают уже непосредственно на затворы мосфитов разной структуры. Поскольку силовые мосфиты управления питанием работаю к лючевом режиме, то выделяемое на них тепло довльно низкое, для них гораздо важнее максимальный ток, протекающий по открытому переход сток-исток. Мы используем для этих целей транзисторы IRFP240-IRFP9240 для усилителей до 700 Вт, их же, но уже по 2 в параллель для мощностей до 1 кВт и IRF3710-IRF5210 для мощностей свыше 1 кВт.
На рисунке 5 приведена принципиальная схема усилителя мощности на 1400 Вт класса H. Отличается схема от предыдущего варианта тем, что в оконечном каскаде используется уже 6 пар транзисторов (для усилителя на 1000 Вт необходимо 4 пары), а силовые ключи управления питания IRF3710-IRF5210.

Рисунок 5. УВЕЛИЧИТЬ
На рисунке 6 приведена принципиальная схема усилителя "Хамелеон 600 G", работающий в классе G ну и с выходной мощность до 600 Вт, причем как на нагрузку как 4 Ома, так и 8 Ом. По сути управление "вторым этажом" питания осуществляется повторителями напряжения выходного сигнала, только на них предварительно подается дополнительное опорное напряжени в 18 вольт и как только напряжение на выходе приближается к величине напряжения "первого этажа" более чем на 18 вольт повторители начинаю подавать напряжение со "второго этажа". Плюсом данной схемотехники является то, что остутствуют коммутационные помехи, характерные для класса H, однако улучшение качества звука требует довольно серьезных жертв - количество транзисторов в упрвлении напряжением питания оконечного каскада должно быть равно количеству самих оконечных транзисторов и это будет практически на предел ОБР, т.е. требуется довольно хорошее охлаждение.

Рисунок 6 УВЕЛИЧИТЬ
На рисунке 7 приведена схему усилителя на мощность до 1400 Вт касса G, в которой используется 6 пар как оконечных, так и управляющих транзисторов (для мощностей до 1000 Вт используетс по 4 пары)

Рисунок 7 УВЕЛИЧИТЬ
Чертежи печатных плат - полная версия - лежат . Чертежи в формате lay, в jpg будут несколько позже...
Технические характеристики усилетелей сведены в таблицу:
| Наименование параметра | Значение |
| Напряжение питания, В, двухуровневое не более | |
| Максимальна выходная мощность на нагрузку 4 Ома: УМ ХАМЕЛЕОН 600 H УМ ХАМЕЛЕОН 1000 H УМ ХАМЕЛЕОН 1400 H УМ ХАМЕЛЕОН 600 G УМ ХАМЕЛЕОН 1000 G | |
| Входное напряжение регулируется подбором резистора R22 и может быть уложено в стандартные 1 В. Однако следует заметить, что чем выше собственный коф усиления, тем выше уровень THD и вероятность возбуждения. | |
| THD для класса H и выходной мощности 1400 Вт не более THD для класса G и выходной мощности 1400 Вт не более При выходной мощности до включения "второго этажа" питания уровень THD для обоих усилителей не превышает | 0,1 % |
| Рекомендуемый ток покоя препоследнего каскада на резисторе R32 или R35 устанавливается напряжение в 0,2 В резистором R8 | |
| Рекомендуемый ток покоя оконечных транзисторов на любом из резисторов 0,33 Ома устанавливается напряжение в 0, 25 В резистором R29 | |
| Регулировку защиты рекомендуется производить на реальной АС подключив параллельно АС сопротивление 6 Ом и добиваясь устойчивого свечения светодиода VD7 при 75 % от максимальной мощности |
К сожалению у данного усилителя выявился один недостаок - при высоких напряжениях питания дифкаскад начинает смопроизвольно греться из за слишком большого протекающего тока через него. Снизить ток - увеличить искажения, что весьма не желательно. Поэтому было применено использование теплоотводов на транзисторы диф каскада:


ПРОЧИТАТЬ ПОЛНОСТЬЮ ВЕСЬ МАТЕРИАЛ О СЕММЕТРИЧНОМ УСИЛИТЕЛЕСТРОЕНИИ
Пантелеев Павел Александрович
В работе даются объяснения возникновения цвета у различных соединений, а также исследуются свойства веществ-хамелеонов.
Скачать:
Предварительный просмотр:
Химия цвета. Вещества-хамелеоны
Секция: естествознание
Выполнил: Пантелеев Павел Николаевич,
Ученик 11 «А» класса
Средней общеобразовательной школы №1148
им. Ф. М. Достоевского
Преподаватель: Кармацкая Любовь Александровна
1. Введение. Стр.2
2. Природа цвета:
2.1. органических веществ; Стр.3
2.2. неорганических веществ. Стр.4
3. Воздействие среды на цвет. Стр.5
4. Вещества-хамелеоны. Стр.7
5. Экспериментальная часть:
5.1. Переход хромата в бихромат и обратно; Стр.8
5.2. Окислительные свойства солей хрома (VI); Стр.9
5.3. Окисление этанола хромовой смесью. Стр.10
6. Фотохромизм. Стр.10
7. Выводы. Стр.13
8.Список использованных источников. Стр.14
1. Введение.
На первый взгляд, может показаться трудным дать объяснение природы цвета. Почему вещества имеют разные цвета? Каким образом цвет вообще возникает?
Интересно, что в глубинах океана обитают существа, в теле которых течёт кровь голубого цвета. Одни из таких представителей – голотурии. При этом кровь рыб, выловленных в море, красная, подобно крови многих других крупных существ.
От чего же зависит цвет различных веществ?
Прежде всего, цвет зависит не только от того, как окрашено вещество, но и от того, как оно освещено. Ведь в темноте всё кажется чёрным. Цвет также определяют химические структуры, преобладающие в веществе: например, цвет листьев растений бывает не только зелёным, но и синим, фиолетовым и др. Это объясняется тем, что в таких растениях помимо хлорофилла, придающего зелёный окрас, преобладают и другие соединения.
Голубая кровь у голотурий объясняется тем, что у них в пигменте, обеспечивающим цвет крови, вместо железа содержится ванадий. Именно его соединения придают голубую окраску жидкости, содержащейся в голотуриях. В глубинах, где они обитают, содержание кислорода в воде очень мало и им приходится приспосабливаться к этим условиям, поэтому в организмах возникли соединения, совершенно иные, чем у обитателей воздушного окружения.
Но мы ещё не ответили на поставленные выше вопросы. В данной работе мы постараемся дать полные, развёрнутые ответы на них. Для этого следует провести ряд исследований.
Целью данной работы и будет дать объяснение возникновения цвета у различных соединений, а также исследовать свойства веществ-хамелеонов.
В соответствии с целью поставлены задачи
Вообще, цвет является результатом взаимодействия света с молекулами вещества. Этот результат объясняется несколькими процессами:
* взаимодействием магнитных колебаний светового луча с молекулами вещества;
* избирательным поглощением тех или иных световых волн молекулами с разными структурами;
* воздействием лучей, отражённых или прошедших через вещество, на сетчатку глаза или на оптический прибор.
Основой для объяснения цвета является состояние электронов в молекуле: их подвижность, способность переходить с одного энергетического уровня на другой, перемещаться от одного атома к другому.
Цвет связан с подвижностью электронов в молекуле вещества и с возможностью перехода электронов на ещё свободные уровни при поглощении энергии кванта света (элементарная частица светового излучения ).
Цвет возникает в результате взаимодействия квантов света с электронами в молекулах вещества. Однако, из-за того, что состояние электронов в атомах металлов и неметаллов, органических и неорганических соединениях различно, механизм появления цвета у веществ также отличается .
2.1 Цвет органических соединений.
У органических веществ , обладающих цветом (а далеко не все они имеют это свойство), молекулы схожи по своей структуре: они, как правило, большие, состоят из десятков атомов. Для возникновения цвета в этом случае значение имеют не электроны отдельных атомов, а состояние системы электронов всей молекулы .
Обычный солнечный свет - это поток электромагнитных волн. Световая волна характеризуется длиной – расстоянием между соседними максимумами или двумя соседними впадинами. Она измеряется в нанометрах (нм). Чем короче волна, тем больше её энергия, и наоборот.
Окраска вещества зависит от того, какие волны (лучи) видимого света оно поглощает. Если солнечный свет веществом совсем не поглощается, а отражается и рассеивается, то вещество будет казаться белым (бесцветным). Если же вещество поглощает все лучи, то оно кажется чёрным.
Процесс поглощения или отражения определённых лучей света связан с особенностями строения молекулы вещества. Поглощение светового потока всегда связано с передачей энергии электронам молекулы вещества. Если в молекуле содержатся s-электроны (образующие сферическое облако ), то для возбуждения их и перевода на другой энергетический уровень требуется большая энергия. Поэтому соединения, имеющие s-электроны, всегда кажутся бесцветными. В то же время p-электроны (образующие облако в форме восьмёрки ) возбуждаются легко, так как связь, осуществляемая ими менее прочная. Такие электроны содержатся в молекулах, имеющих сопряжённые двойные связи. Чем длиннее цепь сопряжения, тем больше p-электронов и тем меньше требуется энергии для их возбуждения. Если энергия волн видимого света (длины волн от 400 до 760 нм) будет достаточной для возбуждения электронов, то появляется окраска, которую мы видим. Лучи, затраченные на возбуждение молекулы, будут ей поглощаться, а непоглощённые будут восприниматься нами как окраска вещества .
2.2 Цвет неорганических веществ.
У неорганических веществ цвет обусловлен электронными переходами и переносом заряда от атома одного элемента к атому другого. Решающую роль здесь играет внешняя электронная оболочка элемента.
Как и в органических веществах, возникновение цвета здесь связано с поглощением и отражением света.
Вообще, окраска вещества складывается из суммы отражённых волн (или прошедших через вещество без задержки). При этом цвет вещества означает, что из всего диапазона длин волн видимого света им поглощаются определённые кванты. В молекулах окрашенных веществ энергетические уровни электронов расположены близко друг к другу. Например, вещества: водород, фтор, азот – кажутся нам бесцветными. Это происходит из-за того, что кванты видимого света не поглощаются ими, так как не могут перенести электроны на более высокий уровень. То есть, через эти вещества проходят ультрафиолетовые лучи, не воспринимаемые человеческим глазом, поэтому и сами вещества для нас не имеют цвета. У цветных веществ, например, хлора, брома, йода, электронные уровни расположены теснее друг к другу, поэтому кванты света в них способны перевести электроны из одного состояния в другое .
Опыт. Влияние иона металла на окраску соединений.
Приборы и реактивы: четыре пробирки, вода, соли железа(II), кобальта(II), никеля (II), меди (II).
Выполнение опыта. В пробирки наливаем 20-30 мл воды, вносим по 0,2 г солей железа, кобальта, никеля и меди и перемешиваем до растворения. Окраска раствора железа стала жёлтой, кобальта – розовой, никеля - зелёной, а меди – синей.
Вывод: Как известно из химии, структура этих соединений одинакова, однако они имеют различное число d-электронов: у железа – 6, у кобальта – 7, у никеля – 8, у меди – 9. Это число влияет на окраску соединений. Поэтому и видно различие в цвете.
3. Воздействие среды на цвет.
Ионы в растворе окружены оболочкой растворителя. Слой таких молекул, непосредственно примыкающих к иону, называют сольватной оболочкой .
В растворах ионы могут воздействовать не только друг на друга, но и на окружающие их молекулы растворителя, а те в свою очередь на ионы. При растворении и в результате сольватации возникает цвет у иона ранее бесцветного. Замена воды на аммиак углубляет цвет. Аммиачные молекулы деформируются легче и интенсивность окраски усиливается.
Теперь сравним интенсивность окраски соединений меди.
Опыт №3.1. Сравнение интенсивности окраски соединений меди.
Приборы и реактивы: четыре пробирки, 1-процентный раствор CuSO 4, вода, НCl, раствор аммиака NH 3, 10-процентный раствор гексацианоферрата(II) калия.
Выполнение опыта. В одну пробирку помещаем 4 мл CuSO 4 и 30 мл H 2 O, в другие две – 3 мл CuSO 4 и 40 мл H 2 O. Добавляем в первую пробирку 15 мл концентрированной НCl – появляется жёлто-зелёная окраска, во вторую – 5 мл 25-процентного раствора аммиака – появляется синяя окраска, в третью – 2 мл 10-процентного раствора гексацианоферрата(II) калия – наблюдаем красно-бурый осадок. В последнюю пробирку добавляем раствор CuSO 4 и оставляем для контроля.
2+ + 4Cl - ⇌ 2- + 6H 2 O
2+ + 4NH 3 ⇌ 2+ + 6H 2 O
2 2 + 4- ⇌ Cu 2 + 12 H 2 O
Вывод: При уменьшении количества реагента (вещества, участвующего в химической реакции ), необходимого для образования соединения, происходит увеличение интенсивности окраски. При образовании новых соединений меди происходит перенос заряда и изменение цвета.
4. Вещества-хамелеоны.
Понятие «хамелеон» известно, прежде всего, как биологический, зоологический термин, обозначающий пресмыкающееся, обладающее способностью менять окраску своего кожного покрова при раздражении, перемене цвета окружающей среды и т. п.
Однако «хамелеонов» можно встретить и в химии. Так в чём же связь?
Обратимся к химическому понятию:
Вещества-хамелеоны - это вещества, меняющие свою окраску в химических реакциях и свидетельствующие об изменениях в исследуемой среде. Выделяем общее – изменение цвета (окраски). Именно это и связывает данные понятия. Вещества-хамелеоны известны с давних времён. В старинных руководствах по химическому анализу рекомендуется использовать «раствор хамелеона» для определения в образцах неизвестного состава содержания сульфита натрия Na
2
SO
3
, пероксида водорода Н
2
O
2
или щавелевой кислоты Н
2
С
2
O
4
. «Раствор хамелеона» - это раствор перманганата калия КМnO
4
, который при химических реакциях, в зависимости от среды, меняет свою окраску по-разному. Например, в кислотной среде ярко-фиолетовый раствор перманганата калия обесцвечивается из-за того, что из перманганат-иона МnO
4
-
образуется катион, т.е.
положительно заряженный ион
Мn
2+
; в сильнощелочной среде из ярко-фиолетового МnO
4
- получается зелёный манганат-ион МnO
4
2-
. А в нейтральной, слабокислой или слабощелочной среде конечным продуктом реакции будет нерастворимый чёрно-бурый осадок диоксида марганца МnO
2
.
Добавим, что благодаря своим окислительным свойствам, т.е. способности отдавать электроны или забирать их у атомов других элементов, и наглядному изменению окраски в химических реакциях перманганат калия нашел широкое применение в химическом анализе.
Значит, в данном случае «раствор хамелеона» (перманганата калия) используется в качестве индикатора, т.е.
вещества, показывающего наличие химической реакции или изменения, произошедшие в исследуемой среде.
Существуют и другие вещества, называемые «хамелеонами». Мы рассмотрим вещества, содержащие элемент хром Cr.
Хромат калия - неорганическое соединение, соль металла калия и хромовой кислоты с формулой K 2 CrO 4 , жёлтые кристаллы, растворимые в воде.
Бихрома́т ка́лия (двухромовокислый калий, ка́лиевый хро́мпик) - K 2 Cr 2 O 7 . Неорганическое соединение, оранжевые кристаллы, растворимые в воде. Высокотоксичен.
5. Экспериментальная часть.
Опыт №5.1. Переход хромата в бихромат и обратно.
Приборы и реактивы: раствор хромата калия К 2 СrO 4 , раствор бихромата калия К 2 Cr 2 O 7 , серная кислота, гидроксид натрия.
Выполнение опыта. К раствору хромата калия добавляем серную кислоту, в результате происходит изменение окраски раствора из жёлтого в оранжевый цвет.
2К 2 CrO 4 + Н 2 SO 4 = К 2 Cr 2 O 7 + К 2 SO 4 + Н 2 О
К раствору бихромата калия добавляю щёлочь, в результате происходит изменение окраски раствора из оранжевой в жёлтую.
К 2 Cr 2 O 7 + 4NaOH = 2Na 2 CrO 4 + 2КOH + Н 2 О
Вывод: В кислой среде хроматы неустойчивы, ион жёлтого цвета превращается в ион Cr
2
O
7
2-
оранжевого цвета, а в щелочной среде реакция протекает в обратном направлении:
2 Cr
2
O
4
2-
+ 2Н
+
кислая среда
-
щелочная
среда
Cr
2
O
7
2-
+ Н
2
О.
Окислительные свойства солей хрома (VI).
Приборы и реактивы: раствор бихромата калия К 2 Cr 2 O 7 , раствор сульфита натрия Na 2 SO 3 , серная кислота H 2 SO 4 .
Выполнение опыта. К раствору К 2 Cr 2 O 7 , подкисленному серной кислотой, добавляем раствор Na 2 SO 3. Наблюдаем изменение окраски: оранжевый раствор стал зелёно-синим.
Вывод: В кислой среде хром восстанавливается сульфитом натрия от хрома (VI) до хрома (III): К 2 Cr 2 O 7 + 3Na 2 SO 3 + 4H 2 SO 4 = К 2 SO 4 + Cr 2 (SO 4 ) 3 + 3Na 2 SO 4 + 4H 2 O.
Опыт №5.4. Окисление этанола хромовой смесью.
Приборы и реактивы: 5%-ный раствор бихромата калия К 2 Cr 2 O 7 , 20%-ный раствор серной кислоты H 2 SO 4 , этиловый спирт (этанол).
Выполнение опыта: К 2 мл 5%-ного раствора бихромата калия приливаем 1 мл 20%-ного раствора серной кислоты и 0,5 мл этанола. Наблюдаем сильное потемнение раствора. Разбавляем раствор водой, чтобы лучше увидеть его оттенок. Получаем раствор жёлто-зелёного цвета.
К
2
Cr
2
O
7
+ 3C
2
H
5
OH+ H
2
SO
4
→
3CH
3
-CОН + Cr
2
О
3
+ K
2
SO
4
+ 4H
2
O
Вывод: В кислотной среде этиловый спирт окисляется бихроматом калия. При этом образуется альдегид. Этот опыт показывает взаимодействие химических хамелеонов с органическими веществами.
Опыт 5.4. наглядно иллюстрирует принцип, по которому действуют индикаторы для обнаружения алкоголя в организме. Принцип основан на специфическом ферментативном окислении этанола, сопровождающегося образованием пероксида водорода (Н 2 О 2 ), вызывающего образование окрашенного хромогена, т.е. органического вещества, содержащего хромофорную группу (хим. группа, состоящая из атомов углерода, кислорода, азота).
Таким образом, эти индикаторы визуально (по цветовой шкале) показывают содержание алкоголя в слюне человека. Они применяются в медицинских учреждениях, при установлении фактов употребления алкоголя и алкогольного опьянения. Область применения индикаторов – любая ситуация, когда необходимо установить факт употребления алкоголя: проведение предрейсовых осмотров водителей транспортных средств, выявление нетрезвых водителей на автодорогах автоинспекцией, использование при экстренной диагностике, как средство самоконтроля и др.
6. Фотохромизм.
Познакомимся с интересным явлением, где также происходит изменение цвета веществ, фотохромизмом.
Сегодня очками со стеклами-хамелеонами вряд ли кого-то удивишь. Но история открытия необычных веществ, меняющих свой цвет в зависимости от освещенности, очень интересна. В 1881 году английский химик Фипсон получил от своего друга Томаса Гриффита письмо, в котором тот описывал свои необычные наблюдения. Гриффит писал, что входная дверь почты, расположенной напротив его окон, в течение дня меняет свой цвет - темнеет, когда солнце в зените, и светлеет в сумерках. Заинтересовавшись сообщением, Фипсон исследовал литопон - краску, которой была окрашена дверь почты. Наблюдение его друга подтвердилось. Фипсон не смог объяснить причину явления. Однако обратимой цветной реакцией не на шутку заинтересовались многие исследователи. И в начале ХХ века им удалось синтезировать несколько органических веществ, названных "фотохромами", то есть "светочувствительными красками". Со времен Фипсона ученые многое узнали о фотохромах – веществах, меняющих окраску под действием света.
Фотохромизм, или тенебресценция - явление обратимого изменения окраски вещества под действием видимого света, ультрафиолета.
Воздействие света вызывает в фотохромном веществе , атомарные перестройки, изменение заселённости электронных уровней. Параллельно с изменением цвета вещество может менять показатель преломления, растворимость, реакционную способность, электропроводимость, другие химико-физические характеристики. Фотохромизм присущ ограниченному числу органических и неорганических, природных и синтетических соединений.
Различают химический и физический фотохромизм:
- химический фотохромизм: внутримолекулярные и межмолекулярные обратимые фотохимические реакциями (таутомеризация (обратимая изомерия), диссоциация (расщепление), цис-транс-изомеризация и др.);
- физический фотохромизм: результат перехода атомов или молекул в разные состояния. Изменение окраски в этом случае обусловлено изменением заселённости электронных уровней. Такой фотохромизм наблюдается при воздействии на вещество только мощных световых потоков.
Фотохромы в природе:
- Минерал тугтупит способен менять цвет от белого или бледно-розового до ярко-розового.
Фотохромные материалы
Существуют следующие типы фотохромных материалов: жидкие растворы и полимерные плёнки (высокомолекулярные соединения ), содержащие фотохромные органические соединения, стекла с равномерно распределёнными в их объёме микрокристаллами галогенидов серебра (соединения серебра с галогенами ), фотолиз (распад под действием света ) которых обусловливает фотохромизм; кристаллы галогенидов щелочных и щёлочно-земельных металлов, активированные различными добавками (например, CaF 2 /La,Ce; SrTiO 3 /Ni,Mo).
Эти материалы применяются в качестве светофильтров переменной оптической плотности (т. е. регулируют поток света) в средствах защиты глаз и приборов от светового излучения, в лазерной технике и т.д.
Фотохромные линзы
Фотохромная линза на свету, частично прикрытая бумагой. Между светлой и темной частями виден второй уровень цвета, так как фотохромные молекулы расположены на обеих поверхностях линзы поликарбоната и других пластмасс . Фотохромные линзы обычно темнеют в присутствии ультрафиолета и светлеют при его отсутствии меньше чем за минуту, но полный переход из одного состояния в другое происходит от 5 до 15 минут.
Выводы.
Итак, цвет различных соединений зависит:
*от взаимодействия света с молекулами вещества;
*у органических веществ цвет возникает в результате возбуждения электронов элемента и их перехода на другие уровни. Важно состояние системы электронов всей большой молекулы;
*у неорганических веществ цвет обусловлен электронными переходами и переносом заряда от атома одного элемента к атому другого. Большую роль играет внешняя электронная оболочка элемента;
*на окраску соединения влияет внешняя среда;
*важную роль играет число электронов в соединении.
Список использованных источников
1. Артеменко А. И. «Органическая химия и человек» (теоретические основы, углублённый курс). Москва, «Просвещение», 2000.
2. Фадеев Г. Н. «Химия и цвет» (книга для внеклассного чтения). Москва, «Просвещение», 1977.