Размер: px
Начинать показ со страницы:
Транскрипт
1 Государственное образовательное учреждение лицей 1547 Национальный исследовательский ядерный университет «МИФИ» Физическая лаборатория описание лабораторных работ для 8, 9,10 и 11 классов лицея. Раздел Молекулярная Физика. Тепловые явления. Москва 2010г. Под редакцией Г.С. Богданова
2 Оглавление 3 НАБЛЮДЕНИЕ ЗА ОТВЕРДЕВАНИЕМ АМОРФНОГО ВЕЩЕСТВА. ИЗМЕРЕНИЕ ТЕМПЕРАТУРЫ КРИСТАЛЛИЗАЦИИ ВЕЩЕСТВА. 4 ИССЛЕДОВАНИЕ СВОЙСТВ ПЕРЕОХЛАЖДЕННОЙ ЖИДКОСТИ 5 ИССЛЕДОВАНИЕ ИЗОХОРНОГО ПРОЦЕССА 7 ИССЛЕДОВАНИЕ ИЗОТЕРМИЧЕСКОГО ПРОЦЕССА. 9 ИЗУЧЕНИЕ ИЗОБАРНОГО ПРОЦЕССА 10 2
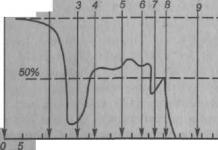
3 1.НАБЛЮДЕНИЕ ЗА ОТВЕРДЕВАНИЕМ АМОРФНОГО ВЕЩЕСТВА. Оборудование: пробирка с желтым веществом, лабораторный термометр, штатив лабораторный с муфтой и лапкой, сосуд с горячей водой (один на класс), наручные часы. Содержание и метод выполнения работы. Аморфные вещества не имеют определенной температуры плавления. По мере нагревания они постепенно размягчаются, превращаясь в жидкость все менее и менее вязкую. При охлаждении эта жидкость непрерывно увеличивает свою вязкость, пока не застынет в аморфно-твердое тело. Объясняется это особенностями строения таких веществ. В аморфных веществах молекулы расположены также беспорядочно, как и в жидкостях, и поэтому их переход в жидкое состояние и обратно не сопровождается изменением молекулярного строения вещества, а заключается только в непрерывном изменении подвижности молекул. Таким образом, аморфно-твердое состояние и жидкое состояние не представляют собой двух различных состояний вещества. Тело из аморфного вещества может формально соответствовать признакам, характерным для твердых тел- сохранять свою форму и объем, но являться при этом жидкостью, в которой подвижность молекул значительно снизилась из-за охлаждения. В том, что аморфные вещества, в отличие от кристаллических, не имеют определенной температуры плавления и кристаллизации, можно убедиться, сравнивая графики изменения температуры со временем, полушечные при наблюдении за охлаждением кристаллического и аморфного веществ. Пробирку с аморфным веществом желтого цвета в присутствии учителя погружают наполовину в сосуд с горячей водой с температурой С. После того, как вещество достаточно прогреется, убеждаются в том, что в пробирке жидкость. В нее погружают термометр и с интервалом времени в одну минуту записывают его показания. Когда температура уменьшится до 40 С, рассматривают вещество в пробирке и убеждаются в том, что оно затвердело. Опыт прекращают. Строят график зависимости температуры вещества от времени и сравнивают его с графиком, построенным при выполнении работы «Измерение температуры кристаллизации вещества». Убеждаются в отсутствии процесса кристаллизации при переходе аморфного тела из жидкого состояния в твердое. Порядок выполнения работы. 1. Подготовьте таблицу для записи результатов измерений: Время, мин t, C 2. Определите цену деления шкалы термометра. 3. Пробирку с желтым веществом опустите в горячую воду и растопите его. 4. Убедитесь, что в пробирке находится жидкость. При наклоне пробирки в разные стороны видно, что форма вещества в ней меняется в зависимости от наклона, то есть не сохраняется, что и является одним из отличий жидкостей от твердых тел. 5. Поместите в пробирку термометр и закрепите ее в лапке штатива. 6. После того, как показания термометра установятся, начинайте регистрировать температуру с интервалом в одну минуту. 7. Когда температура опустится до 40 С, освободите пробирку из лапки штатива и, наклоняя ее в разные стороны, убедитесь, что вещество застыло. 8. По данным измерений постройте график зависимости температуры вещества в пробирке от времени. При возможности сравните его с графиком, построенным при выполнении работы "Измерение температуры кристаллизации вещества". 9. С помощью графика докажите, что в пробирке находилось аморфное вещество. Контрольные вопросы. 1.Чем отличаются графики отвердевания кристаллического и аморфного веществ? 2.В чем внешнее отличие твердых тел от жидкостей? 3
4 2. ИЗМЕРЕНИЕ ТЕМПЕРАТУРЫ КРИСТАЛЛИЗАЦИИ ВЕЩЕСТВА. Оборудование: пробирка с зеленым веществом, лабораторный термометр, стакан с горячей водой, наручные часы. Содержание и метод выполнения работы. В кристаллическом веществе атомы и молекулы образуют упорядоченную упаковку и совершают малые колебания около своих положений равновесия. По мере нагревания тела скорость колеблющихся частиц возрастает вместе с размахом колебаний. Увеличение скорости движения частиц с возрастанием температуры составляет один из основных законов природы, который относится к веществу в любом состоянии - твердом, жидком или газообразном. При определенной температуре колебания становятся столь энергичными, что упорядоченное расположение частиц становится невозможным -кристалл плавится. С началом плавления подводимое тепло идет уже не на увеличение скорости частиц, а на разрушение кристаллической решетки. Поэтому подъем температуры приостанавливается. Последующее нагревание -это увеличение скорости частиц жидкости. В случае кристаллизации из расплава вышеописанные явления наблюдаются в обратном порядке: по мере охлаждения жидкости ее частицы замедляют свое хаотическое движение; с понижением температуры до определенного значения, частицы движутся уже столь медленно, что некоторые из них под действием сил притяжения начинают пристраиваться одна к другой, образуя кристаллические зародыши. Пока все вещество не закристаллизуется, температура останется постоянной. Эта температура, как правило, та же, что и температура плавления. После того, как все вещество перейдет в твердое состояние, температура опять начинает понижаться, что соответствует процессу охлаждения твердого тела. Таким образом, температуру кристаллизации вещества можно определить, построив график зависимости температуры от времени. Из изложенного выше следует, что этот график будет иметь характерный участок в виде отрезка, параллельного оси времени. Температура, соответствующая этому участку, и будет температурой кристаллизации данного вещества. Порядок выполнения работы. 1. Подготовьте таблицу для записи результатов измерений: Время, мин t, C 2. Опустите пробирку с исследуемым веществом в присутствии учителя в сосуд с водой при температуре С и наблюдайте за тем, как вещество плавится. 3. После того, как все вещество расплавится, перенесите пробирку в стакан, куда налито около 150 мл горячей воды, и поместите в расплавленное вещество термометр. 4. С момента, когда температура вещества начнет понижаться, записывайте показания термометра с интервалом в 1 минуту. 5. Продолжая записывать показания термометра, пронаблюдайте этап перехода вещества в твердое состояние. 6. При охлаждении до 45 С прекратите измерения. По полученным данным постройте график зависимости температуры от времени. 7. По графику определите температуру кристаллизации вещества и время, в течение которого продолжалась кристаллизация вещества. Контрольные вопросы. 1. Чем отличаются графики зависимости температуры от времени при отвердевании кристаллических и аморфных веществ? 2. Как по графику изменения температуры вещества при нагревании от времени определить температуру плавления кристаллического тела? Дополнительное задание. 1. Налейте в сосуд около 400 мл горячей воды и погрузите в нее пробирку с затвердевшим кристаллическим веществом, куда ранее был вплавлен термометр. 2. Записывая показания термометра с интервалом в 1 минуту, пронаблюдайте за изменением состояния вещества при его нагревании до 70 С. 3. По данным измерений постройте график зависимости температуры вещества от времени и определите по нему температуру плавления. 4. Сопоставьте полученные значения температур плавления и кристаллизации вещества. 4
5 3. ИССЛЕДОВАНИЕ СВОЙСТВ ПЕРЕОХЛАЖДЕННОЙ ЖИДКОСТИ. Оборудование: пробирка, розовое вещество в пакете, лабораторный термометр, сосуд с горячей водой (один на класс), стеклянный стакан, наручные часы. Содержание и метод выполнения работы. Если кристаллическое вещество, находящееся в жидком состоянии, охлаждать, то в момент, когда его температура опустится до температуры плавления, должна начаться кристаллизация. Однако при достаточно быстром охлаждении жидкости кристаллизация не всегда успевает произойти и вещество оказывается при температуре, которая ниже температуры плавления, сохраняя свое жидкое состояние. Это явление называют переохлаждением жидкости. В различных жидкостях переохлаждение достигается неодинаково легко. Некоторые жидкости могут переохлаждаться на десятки градусов ниже своей температуры кристаллизации, другие кристаллизуются уже при самом незначительном переохлаждении. Состояние переохлажденной жидкости неустойчиво, также как состояние пересыщенного пара или перегретой жидкости. Некоторые жидкости в переохлажденном состоянии достаточно встряхнуть, чтобы вызвать быструю кристаллизацию. Переохлажденная жидкость может закристаллизоваться и при внесении в нее кристалла того же вещества. Из веществ, легко сохраняющихся в переохлажденном состоянии, можно назвать гипосульфит, салол, ванилин. Если переохлажденная жидкость начинает кристаллизоваться, имея незначительный теплообмен с окружающими телами, то выделяющаяся при этом энергия нагревает образующуюся смесь из кристаллов и жидкости. При не слишком сильном переохлаждении, то есть когда температура жидкости на момент кристаллизации оказалась не на много ниже температуры плавления, выделяющаяся теплота может разогреть всю систему до температуры плавления, после чего темп кристаллизации замедлится и будет зависеть от того, с какой скоростью выделяющееся тепло станет поглощаться окружающими телами. Целью работы является построение графика зависимости температуры вещества от времени, определение по нему температуры кристаллизации, наблюдение за ростом кристаллов в переохлажденной жидкости. Объектом изучения является розовое вещество в пробирке. В присутствии учителя пробирку погружают наполовину в горячую воду с температурой С. Вещество быстро расплавится. Пробирку переносят в стеклянный стакан без воды или зажимают в лапке штатива, вставляют в нее лабораторный термометр и с интервалом в одну минуту записывают его показания. Чтобы не вызвать преждевременной кристаллизации, стакан с пробиркой надо предохранять от толчков. Термометр в жидкости тоже должен находиться неподвижно. Когда температура опустится до 35 С, термометр несколько раз поднимают и опускают внутри жидкости. Этого воздействия оказывается достаточно, чтобы начался процесс кристаллизации. Продолжая измерять температуру, наблюдают за образованием кристаллов. Опыт заканчивают после того, как вещество, закристаллизовавшись, начнет остывать уже как твердое тело. Порядок выполнения работы. 1.Подготовьте таблицу для записи результатов измерений: Время, мин t, C 2.Определите цену деления шкалы термометра. 3.Разомните вещество в пакетике и пересыпьте его в пробирку. 4.Пробирку с веществом поместите в сосуд с горячей водой. Когда вещество полностью расплавится, перенесите пробирку в стеклянный стакан без воды и поместите в нее термометр. 5. После того, как показания термометра установятся, начинайте записывать его показания с интервалом в одну минуту. 6. Когда температура опустится до 35 С, помешайте термометром жидкость в пробирке, стараясь не повредить его кончик. 7.При образовании первых кристаллов обратите внимание на их форму и скорость роста. 8.Постройте график зависимости температуры вещества от времени. 9. По графику определите: а) температуру кристаллизации вещества, б) продолжительность времени пребывания вещества в состоянии переохлажденной жидкости, 5
6 в) продолжительность времени кристаллизации вещества. 10. Окончив работу, вещество вновь расплавьте, охладите и перелейте в пакетик. Внимание! Вещество, оставленное в пробирке, при длительном хранении может привести к ее растрескиванию. Контрольные вопросы. 1. Какое состояние вещества называют переохлажденной жидкостью? 2. Как вещество можно вывести из состояния переохлажденной жидкости? 6
7 4.ИССЛЕДОВАНИЕ ИЗОХОРНОГО ПРОЦЕССА Оборудование: прозрачная трубка с кранами, манометрическая трубка, измерительная лента, штатив с лапкой, внешний стакан калориметра, термометр лабораторный, мерный цилиндр, сосуд с теплой водой. Содержание и метод выполнения работы Целью работы является исследование зависимости давления газа от температуры при его изохорном охлаждении. Из закона Шарля следует, что если объем определенного количества газа не изменяется, то изменение его давления и температуры удовлетворяет условию: Р 1 /Т 2 = Р2/Т2 (1), где P 1 и Р 2 - давление газа в исходном и конечном состояниях, a T 1 и Т 2 - температура в этих состояниях. В начале эксперимента определяют давление и температуру газа в нагретом состоянии. Затем его охлаждают при неизменном объеме и вновь определяют давление и температуру. После этого проверяют, насколько изменение этих параметров соответствует равенству (1). Исследуемым газом является воздух, находящийся внутри прозрачной трубки. Чтобы его нагреть трубку укладывают плотно виток к витку в стакан калориметра. Перед этим один из кранов закрывают. Укладку начинают с того конца, на котором находится закрытый кран, и проводят так, чтобы конец с открытым краном оказался сверху. Затем в стакан наливают теплой воды. Уровень воды должен быть выше открытого крана не более чем на 5-10 мм. Воздух в шланге при нагревании станет расширяться и из крана начнут выходить пузырьки. Когда температуры воздуха и воды сравняются, расширение прекратится и пузырьки перестанут образовываться. После отделения последнего пузырька кран закрывают. Состояние воздуха в шланге в этот момент принимают за исходное и приступают к определению его параметров - температуры и давления. Температуру определяют термометром по температуре воды, а давление по показанию классного барометра - анероида. Такой способ измерения давления возможен по следующим соображениям. Пузырьки образуются до тех пор, пока давление воздуха в трубке не станет равным сумме давления атмосферы и столба воды над краном. Но так как уровень воды над краном по условию проведения опыта составляет всего несколько миллиметров, давлением водяного столба можно пренебречь по сравнению с давлением атмосферы. Исходя из этого, можно считать, что в исходном состоянии давление воздуха в трубке равно атмосферному давлению. Измерив исходные параметры воздуха, его переводят в другое состояние путем охлаждения до комнатной температуры. Трубку извлекают из калориметра и в виде бухты вешают на лапку штатива. Лапка штатива предварительно закрепляется на стержне на высоте около 35 см от поверхности стола. Под лапку ставят мерный цилиндр, в который налито мл воды. Термометр также вынимают из калориметра. Затем один из кранов соединяют с манометрической трубкой. Делается это в следующей последовательности. Свободный конец трубки погружают до дна в мерный цилиндр. Верхнюю часть трубки слегка зажимают в лапке штатива, но так чтобы внутренний канал не оказался полностью перекрытым. Еще раз проверяют, чтобы нижний конец трубки был бы погружен в воду. Только после этих операций трубку с помощью соединительного патрубка соединяют с краном. При контакте с более холодным воздухом классного помещения воздух в большой трубке охлаждается, его давление падает, но объем остается постоянным. Если открыть кран, то на концах манометрической трубки возникнет разность давлений и вода из сосуда начнет втягиваться вверх по трубке до тех пор, пока давление столба воды в ней и давление воздуха в большой трубке не уравновесят атмосферного давления. то есть пока не нас тупит равенство: Р ат = Р 2 + Р в, где Р В - давление в трубке, а Р В - давление столба воды в манометрической трубке. Отсюда Р 2 = Р ат - Р в. По высоте водяного столба определяют его давление и, зная давление атмосферы, вычисляют давление в большой трубке после охлаждения P 2. Температура в трубке в этот момент равна температуре воздуха в классе и определяется термометром. Получив значения P 1, Р 2, Т 1 и Т 2 находят отношения давления воздуха к его температуре в нагретом и охлажденном состоянии и проверяют насколько выполняется равенство (1) в условиях проведенного эксперимента. 7
8 Порядок выполнения работы 1. Подготовьте таблицу для записи результатов измерений и вычислений: t 1, С Т 1, К Р 2, Па t 2, С Т 2, К h, мм Р В, Па Р 2, Па Р 1 /T 1 Р 2 /Т 2 2.По показанию термометра определите температуру воздуха в классе t 2. 3.Уложите трубку во внешний стакан калориметра. 4.Заполните стакан теплой водой так, чтобы открытый кран оказался бы погруженным не более чем на 5-10 мм. 5.По выделению пузырьков определите момент выравнивания температур воды и воздуха в трубке. 6.По температуре воды определите температуру в трубке t 1. 7.С помощью барометра - анероида определите давление воздуха в трубке Р 1 = Р ат. 8.Закройте кран, извлеките трубку из стакана и поместите ее на штатив как сказано выше. 9.Присоедините к крану манометрическую трубку, выполняя последовательность действий, изложенную в предыдущем разделе. 9. Плавно откройте кран и наблюдайте за поднятием уровня воды в манометрической трубке. В момент, когда температуры воздуха в большой трубке и в комнате станут одинаковыми, поднятие уровня воды прекратится. Измерьте после этого разность уровней воды в трубке и в мерном цилиндре - h. 11.Вычислите величину давления водяного столба: Р В = ρgh, где ρ - плотность воды, g - ускорение свободного падения, h - разность уровней. 12.Вычислите давление воздуха в трубке после охлаждения Р 2 = P ат - Р В 13.Переведите полученные значения температуры в градусы шкалы Кельвина Т = t Вычислите отношения P 1 /T 1 и Р 2 /Т Сделайте вывод о том, насколько полученный результат соответствует формуле (1). Укажите возможные причины расхождения экспериментальных данных с теорией. Контрольные вопросы 1.Почему охлаждение воздуха в проведенном опыте можно считать изохорным? 2.Какие условия должны выполняться, чтобы изменения параметров газа соответствовали закону Шарля 8
9 5. ИССЛЕДОВАНИЕ ИЗОТЕРМИЧЕСКОГО ПРОЦЕССА. Оборудование: прозрачная трубка с кранами на концах, мерный цилиндр, измерительная лента. Содержание и метод выполнения работы. Целью работы является проверка соотношения между объемом и давлением определенного количества газа при его изотермическом сжатии. В соответствии с законом Бойля-Мариотта это соотношение должно иметь вид: V 1 P 1 = V 2 P 2 (1), где V 1 и V 2 - объемы, занимаемые газом соответственно до и после сжатия, а P 1 и Р 2 - его давления. Объектом изучения в работе является воздух, находящийся внутри прозрачной трубки. До сжатия он имеет следующие параметры. Давление равно атмосферному. Объем равен объему внутренней полости трубки. Температура соответствует температуре воздуха в помещении класса. Для сжатия воздуха в трубке один из кранов закрывают. Второй кран оставляют открытым. Конец трубки с открытым краном погружают до дна мерного цилиндра, который предварительно заполняют водой комнатной температуры, недолив до края мм. Через открытый кран в трубку заходит вода и сжимает воздух до тех пор, пока его давление не сравняется с внешним давлением. Таким образом, после сжатия параметры воздуха окажутся следующими. Объем будет равен объему внутренней полости за вычетом объема воды, вошедшей в трубку. Давление возрастет на величину гидростатического давления столба воды в цилиндре. Температура не изменится. Объем внутренней полости трубки определяется произведением площади ее поперечного сечения на длину. Поскольку поперечное сечение трубки одинаково по всей длине, объем воздуха удобно измерять в условных единицах. За условную единицу принимают единицу длины воздушного столба. Итак, в исходном состоянии давление определяется по показаниям барометра - анероида, а объем измерительной лентой по длине внутренней полости. Для измерения давления во втором состоянии измеряют разницу уровней воды в мерном цилиндре и в трубке - h. По формуле для расчета гидростатического давления жидкости вычисляют давление столба воды: Р в = ρgh, где ρ - плотность воды. Давление воздуха во втором состоянии будет равно сумме атмосферного и гидростатического давлений. Для определения объема воздуха во втором состоянии измеряют длину столба воды, вошедшей в трубку. Из измеренной ранее длины трубки вычитают длину столба воды. Завершив измерения, находят произведения давления на объем воздуха в первом и втором состояниях. Сравнивая полученные числа, делают вывод о справедливости закона Бойля - Мариотта. Порядок выполнения работы. 1. Подготовьте таблицу для записи результатов измерений и вычислений: l 1, мм Р 1, Па Δl, мм l 2, мм h, мм Р В, Па Р 2, Па l 1 P 1 l 2 P 2 2. Измерьте длину воздушного столба в трубке l Закройте один кран и погрузите конец трубки с открытым краном в мерный цилиндр до дна. 4. Измерьте длину столба воды, вошедшей в трубку - Δl. 5. Измерьте разницу уровней воды в мерном цилиндре и в трубке - h. 6. Вычислите длину воздушного столба в трубке после сжатия 1 2 = Δl. 7. Вычислите гидростатической давление воды Р = ρgh. 8. Вычислите давление воздуха в трубке после сжатия Р 2 = P 1 + Р в. 9. Вычислите произведения l 1 P 1 и 1 2 Р 2 и сделайте вывод о том, насколько точно изменение параметров газа в проделанном опыте соответствует закону Бойля-Мариотта. 10. Укажите причины, повлиявшие на точность полученных результатов. Контрольные вопросы. 1. Почему процесс сжатия воздуха в данной работе можно считать изобарным? 2. Какие условия должны выполняться, чтобы, изменения параметров газа соответствовали закону Бойля-Мариотта? 9
10 6.ИЗУЧЕНИЕ ИЗОБАРНОГО ПРОЦЕССА Оборудование: прозрачная трубка с двумя кранами на концах, лабораторный термометр, измерительная лента, внешний стакан калориметра, сосуд с теплой водой, сосуд с холодной водой. Содержание и метод выполнения работы Целью работы является проверка соотношения между изменением объема и температуры определенного количества газа при его изобарном охлаждении. В соответствии с законом Гей-Люссака это соотношение должно иметь вид: V 1 /T 1 = V 2 /T 2 (1), где V 1 и V 2 -объемы, занимаемые данной массой газа соответственно до и после охлаждения, а T 1 и Т 2 - его температуры. Исследуемым газом в данной работе является воздух, находящийся внутри прозрачной трубки. Для изоляции внутренней полости трубки от внешней среды на концах закреплены специальные краны. Измерения объема и температуры теплого и холодного воздуха внутри трубки проводят в следующем порядке. Трубку плотно, виток к витку, укладывают внутрь стакана калориметра. Кран, который расположится при этом вблизи дна, предварительно закрывают. Верхний кран оставляют открытым. Затем в калориметр наливают нагретую до С воду. Воду заливают так, чтобы открытый кран оказался бы погруженным в нее не более чем на 5-10мм. По мере прогрева объем воздуха в трубке будет возрастать и из открытого крана станут выходить пузырьки. В момент, когда температура воздуха сравняется с температурой теплой воды, выделение пузырьков прекратится. Это состояние воздуха в трубке принимают за исходное. Температуру воздуха в исходном состоянии Т 1 можно определить, если измерить температуру воды в стакане. Его объем V 1 равен объему внутренней полости трубки. После измерения температуры теплой воды воздух переводят в состояние с другими параметрами. Для этого закрывают кран, теплую воду сливают и заполняют стакан холодной водой, следя за тем, чтобы ее уровень над верхним краном оказался таким же, как в первой части опыта. После этого кран опять открывают. При охлаждении объем воздуха уменьшится, и через открытый кран в трубку поступит некоторое количество воды. Когда температуры воды и воздуха опять станут одинаковыми (через 1-2 минуты), приступают к определению параметров газа в новом состоянии. Температуру воздуха вновь определяют по температуре воды. Чтобы определить его объем после охлаждения, закрывают верхний кран, трубку извлекают из калориметра и, удерживая вертикально, резко встряхивают несколько раз. При этом капли воды, попавшие внутрь, сольются и образуют неразрывный столбик. Измерив объем этого водяного столба и вычтя его из внутреннего объема трубки, узнают объем воздуха в конечном состоянии. Измерение объемов в этой работе удобно проводить в условных единицах по длине воздушного или водяного столба: внутренняя полость трубки имеет форму цилиндра и ее объем V = S l, но площадь поперечного сечения S в ходе опыта не меняется, и, чтобы не измерять эту величину, которая после подстановки в равенство (1) все равно сократится, объем выражают в единицах длины (см. рисунки 1 и 2). Давление воздуха в трубке в первой и второй части опыта равнялось сумме атмосферного давления и давления небольшого столба воды над открытым краном. Поскольку уровень теплой и холодной воды не менялся, то эта сумма в ходе опыта не менялась, а значит и давление воздуха в трубке при его охлаждении оставалось постоянным, то есть процесс протекал изобарически. В завершении работы сравнивают отношения объема воздуха к его температуре до и после охлаждения. 10
11 Порядок выполнения работы 1.Подготовьте таблицу для записи результатов измерений и вычислений: l 1, см t 1, C T 1, K Δl, см l 2, см t 2, C T 2, K l 1 /T 1 l 2 /T 2 2.Измерьте длину воздушного столба в трубке l 1 (рис. 1). 3.Закройте один кран и уложите трубку виток к витку в стакан калориметра. Кран на верхнем конце оставьте открытым. 4.Заполните стакан теплой водой и поместите в него термометр. 5.Наблюдайте за выделением пузырьков воздуха из открытого крана. Как только оно прекратится, определите и запишите показание термометра t 1 (С). 6.Закройте кран, слейте теплую воду, заполните стакан холодной водой до прежнего уровня и снова откройте кран. 7.Выждав полторы - две минуты, определите и запишите показание термометра t 2 (С). 8.Закройте кран, слейте воду, извлеките шланг из стакана, встряхните его и измерьте длину столба воды в нем Δl (рис. 2). 9.Вычислите длину столба охлажденного воздуха: l 2 = l 1 - Δl. 10.Переведите записанные показания термометра в градусы Кельвина: Т = t Вычислите отношения l 1 /T 1 и l 2 /T 1 и сделайте вывод о том, насколько точно изменение параметров газа в проделанном опыте соответствует закону Гей-Люссака. 12.Укажите причины, повлиявшие на точность полученных результатов. Контрольные вопросы 1. Почему процесс охлаждения воздуха в данной работе можно считать изобарным? 2. Какие условия должны выполняться, чтобы, определяя параметры газа, можно было воспользоваться законом Гей-Люссака? 11
Термодинамика и молекулярная физика 1. При температуре 250 K и давлении плотность газа равна Какова молярная масса этого газа? Ответ приведите в кг/моль с точностью до десятитысячных. 2. Воздух охлаждали
Занятие 12 Молекулярно-кинетическая теория Задача 1 Из контейнера с твёрдым литием изъяли 4 моль этого вещества. Определите на сколько примерно уменьшилось число атомов лития в контейнере и впишите недостающие
4-1 IV.С.1 Средняя квадратичная скорость некоторого газа при нормальных условиях равна 480 м/с. Сколько молекул содержит 1 г этого газа? IV.С.2 Два одинаковых сосуда, содержащих углекислый газ при 320
«МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ». Основные положения МКТ (молекулярно-кинетической теории): Все тела состоят из молекул; Молекулы движутся (беспорядочно, хаотически броуновское движение); Молекулы взаимодействуют
Задание 1 (5 минут) В сосуде с водой плавает опрокинутая вверх дном кастрюля Будет ли изменяться уровень воды в кастрюле с изменением температуры окружающего воздуха? (Тепловым расширением воды, кастрюли
Ярославский государственный педагогический университет им. К. Д. Ушинского Кафедра общей физики Лаборатория молекулярной физики Лабораторная работа 6 Определение отношения C p /C методом V Клемана-Дезорма
Работа. 0 ИССЛЕДОВАНИЕ ПЛАВЛЕНИЯ И КРИСТАЛЛИЗАЦИИ МЕТАЛЛА Задача. Получить диаграмму охлаждения и кристаллизации металла.. По результатам п. найти температуру и удельную теплоту плавления (кристаллизации)
Отложенные задания (86) График зависимости давления от объема для циклического процесса изображен на рисунке. В этом процессе газ 1) совершает положительную работу 2) совершает отрицательную работу 3)
Методические указания к выполнению лабораторной работы.. ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРНОГО КОЭФФИЦИЕНТА ДАВЛЕНИЯ ВОЗДУХА ПРИ ПОМОЩИ ГАЗОВОГО ТЕРМОМЕТРА * * Аникин А.И. Свойства газов. Свойства конденсированных
ЛАБОРАТОРНАЯ РАБОТА 1.31 Исследование изохорического процесса. Закон Шарля. ЦЕЛЬ РАБОТЫ Исследование зависимости давления воздуха от температуры в замкнутом объеме. Оценить положение абсолютного нуля температур
БЛОК 4 «МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ». Основные положения МКТ (молекулярно-кинетической теории): Все тела состоят из молекул; Молекулы движутся (беспорядочно, хаотически броуновское движение); Молекулы
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ КАЗАНСКАЯ ГОСУДАРСТВЕННАЯ АРХИТЕКТУРНО-СТРОИТЕЛЬНАЯ АКАДЕМИЯ Кафедра физики МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ЛАБОРАТОРНЫМ РАБОТАМ ПО ФИЗИКЕ для студентов специальностей
Лабораторная работа 6 Определение отношения удельных теплоемкостей газов методом адиабатного расширения Приборы и материалы:) закрытый стеклянный баллон с краном; 3) манометр;4) поршневой насос Цель работы:
Задание 5 для 8 класса (2017-2018 учебный год) Влажность. Кипение. Фазовые переходы. Часть 1. Теория и примеры решения задач Насыщенные и ненасыщенные пары. Влажность. Как отмечалось в задании «Газовые
ПОДГОТОВК к ОГЭ ЧСТЬ 1 ТЕПЛОВЫЕ ЯВЛЕНИЯ 1.В твёрдых телах теплопередача может осуществляться путём 1.конвекции 2.излучения и конвекции 3.теплопроводности 4.конвекции и теплопроводности 2.Внутренняя энергия
Вариант 1 1. Одноатомный идеальный газ получил от нагревателя 2 кдж тепловой энергии. Какую. Работу он при этом совершил? (Процесс изобарический). 2. Для нагревания 1 кг неизвестного газа на 1 K при постоянном
С1.1. В опыте, иллюстрирующем зависимость температуры кипения от давления воздуха (рис. 1 а), кипение воды под колоколом воздушного насоса происходит уже при комнатной температуре, если давление достаточно
РАБОТА 2 ИЗУЧЕНИЕ ИЗОТЕРМИЧЕСКИХ ПРОЦЕССОВ СЖАТИЯ И РАСШИРЕНИЯ ВОЗДУХА Цель работы: проверить выполнение закона Бойля-Мариотта при изотермических процессах. Введение Термодинамика имеет дело с термодинамической
Банк заданий. Изменение агрегатных состояний вещества. Газовые законы. Тепловые машины. 2.1. Испарение и конденсация. Насыщенный пар. Влажность воздуха. К каждому из заданий даны 4 варианта ответа, из
МАТЕРИАЛ для подготовки к тестированию 8 класс по теме: «Тепловые явления» ПРИМЕРНЫЕ ЗАДАНИЯ: 1. Какое движение молекул и атомов в газообразном состоянии вещества называется тепловым движением? 2. Чем
1 вариант A1. «Расстояние между соседними частицами вещества мало (они практически соприкасаются)». Это утверждение соответствует модели 1) только твердых тел 3) твердых тел и жидкостей 2) только жидкостей
Понятие температуры одно из важнейших в молекулярной физике. Температура - это физическая величина, которая характеризует степень нагретости тел. Беспорядочное хаотическое движение молекул называется тепловым
Лабораторная работа 151 Определение показателя адиабаты воздуха и расчет изменения энтропии в процессе теплообмена Приборы и принадлежности: стеклянный баллон с двухходовым краном, насос, манометр, барометр,
РАБОТА 3 ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ ВОДЫ МЕТОДОМ КАПИЛЛЯРНЫХ ТРУБОК Цель работы: Измерить коэффициент поверхностного натяжения воды методом капиллярных трубок и исследовать зависимость
ЛАБОРАТОРНАЯ РАБОТА 5.11 ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ ТЕПЛОТЫ ИСПАРЕНИЯ ВОДЫ ПРИ ТЕМПЕРАТУРЕ КИПЕНИЯ Цель работы: экспериментальное определение молярной теплоты испарения воды при атмосферном давлении и температуре
Федеральное агентство по образованию Государственное образовательное учреждение высшего профессионального образования Ухтинский государственный технический университет (УГТУ) Тестовые задания по молекулярной
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ УДЕЛЬНЫХ ТЕПЛОЁМКОСТЕЙ ВОЗДУХА МЕТОДОМ КЛЕМАНА-ДЕЗОРМА -- Страница 1 из 6 Лабораторная работа ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ УДЕЛЬНЫХ ТЕПЛОЁМКОСТЕЙ ВОЗДУХА МЕТОДОМ КЛЕМАНА- ДЕЗОРМА Теплоёмкостью
Работа 2.2 ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ ГАЗА МЕТОДОМ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ Цель работы:) изучение первого начала термодинамики в различных изопроцессах; 2) экспериментальное определение показателя
Раздел 1. ТЕПЛОВЫЕ ЯВЛЕНИЯ 1. ТЕМПЕРАТУРА. ИЗМЕРЕНИЕ ТЕМПЕРАТУРЫ 1-й уровень сложности? 1.1. В ведро с холодной водой бросили кирпич, который перед этим некоторое время находился в костре. Как будут изменяться
Примерный банк заданий по физике 8 класс базовый уровень. 1.1Агрегатные состояния. Плавление и отвердевание 1. Агрегатное состояние вещества определяется 1)размерами частиц и расстоянием между ними 2)расстоянием
Задание 4. Влажность. Кипение. Фазовые переходы. (2014-2015 учебный год). Насыщенные и ненасыщенные пары. Влажность. Как отмечалось в первом задании, в жидкости (или твердом теле) при любой температуре
ЛАБОРАТОРНАЯ РАБОТА 5.6 ОПРЕДЕЛЕНИЕ С P /C V ВОЗДУХА МЕТОДОМ КЛЕМАНА ДЕЗОРМА И РАСЧЕТ ИЗМЕНЕНИЯ ЭНТРОПИИ ПРИ РАЗЛИЧНЫХ ПРОЦЕССАХ Цель работы: экспериментальное определение отношения теплоемкостей С р /С
ЛЕТНЯЯ ШКОЛА 10 класс физико-математический профиль физико-технический профиль 3 июля 2018 года ИТОГОВАЯ КОНТРОЛЬНАЯ РАБОТА ПО ФИЗИКЕ РАЗБОР, КРИТЕРИИ ОЦЕНИВАНИЯ 1.Нагревание комнаты (4 балла) Комната
3 сессия: Основы термодинамики Тема 1: Внутренняя энергия. Тепловые явления можно описать с помощью макроскопических величин (Р,Т, V), которые можно регистрировать такими приборами как манометр и термометр.
ИЗМЕРЕНИЕ КОЭФФИЦИЕНТА ТЕПЛОПРОВОДНОСТИ МЕТАЛЛА Задачи 1. Создать в металлическом стержне стационарный градиент температуры с помощью нагревателя и калориметра с холодной водой. 2. Измерить зависимость
ЛАБОРАТОРНАЯ РАБОТА 5.9 ИЗМЕНЕНИЕ ЭНТРОПИИ В ИЗОЛИРОВАННОЙ СИСТЕМЕ Цель работы: исследование приращения энтропии в необратимых адиабатных процессах. Литература: гл. 6 6.1 6.11; гл. 3 3.1, 3.4;
Условие задачи Решение 2.Молекулярная физика и термодинамика 7. Распределение Максвелла и Больцмана. Формула Больцмана характеризует распределение частиц, находящихся в состоянии хаотического теплового
Основные понятия: Тепловые явления Обязательный минимум по предмету физика 8 класс «а», «с», «н» 1 триместр Тепловое движение. Внутренняя энергия. Два способа изменения внутренней энергии: работа и теплопередача.
Воздушный шар объемом 2500 м 3 с массой оболочки 400 кг имеет внизу отверстие, через которое воздух в шаре нагревается горелкой. Какова максимальная масса груза, который может поднять шар, если воздух
1 Относительная влажность воздуха в закрытом сосуде 30%. Какой станет относительная влажность, если объѐм сосуда при неизменной температуре уменьшить в 3 раза? 1) 60% 2) 90% 3) 100% 4) 120% 2 В результате
Мастер-класс 3 декабря 2016 года. Термодинамика, часть 2. Задачи. 1. В сосуде неизменного объема находится идеальный газ. Если часть газа выпустить из сосуда при постоянной температуре, то как изменятся
ЛАБОРАТОРНАЯ РАБОТА 5.13 ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ ЖИДКОСТИ Цель работы: экспериментальное определение коэффициента поверхностного натяжения жидкости и его зависимости от температуры.
Лабораторная работа 8 Определение отношения теплоемкости газа при постоянном давлении к теплоемкости газа при постоянном объеме Цель работы: изучение законов идеального газа и определение опытным путем
Урок по теме: «Тепловое движение. Температура» ТЕПЛОВОЕ ДВИЖЕНИЕ. ТЕМПЕРАТУРА Этот учебный год мы начинаем с изучения нового раздела физики, посвящённого тепловым явлениям. К тепловым явлениям относятся
Насыщенные и ненасыщенные пары. Влажность. Как отмечалось в первом задании, в жидкости (или твердом теле) при любой температуре существует некоторое количество «быстрых» молекул, кинетическая энергия которых
Итоговый тест, Машиноведение (Теплотехника) 1. Идеальный газ отдал количество теплоты 300 Дж и при этом внутренняя энергия газа уменьшилась на 100 Дж. Работа, совершенная газом, равна 1) 400 Дж 2) 200
МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА Кириллов А.М., учитель гимназии 44 г. Сочи (http://kirillandrey72.narod.ru/) Данная подборка тестов сделана на основе учебного пособия «Веретельник В.И., Сивов Ю.А.,
Министерство образования и науки Российской Федерации Государственное образовательное учреждение Высшего профессионального образования «УФИМСКИЙ ГОСУДАРСТВЕННЫЙ НЕФТЯНОЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ» Кафедра
Изменение физических величин в процессах, часть 1 1. Температуру холодильника идеальной тепловой машины уменьшили, оставив температуру нагревателя прежней. Количество теплоты, полученное газом от нагревателя
Работа 2.16 Исследование зависимости вязкости аморфного вещества от температуры и определение энергии активации его молекул вода. Оборудование: консистометр, секундомер, исследуемое аморфное тело, Введение
18.2 Диаграмма состояния. Тройная точка. Фазовые превращения определяются изменениями температуры и давления. Для наглядного изображения фазовых превращений используется диаграмма состояния, на которой
Задания к контрольной работе 2 Контрольная работа проводится по главам: «Тепловые машины», «Молекулярно-кинетическая теория идеального газа» и «Агрегатные состояния вещества». Если ученик выполнил все
КАЛМЫЦКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Кафедра общей физики Лабораторная работа 9 «Определение теплоты перехода воды в пар при температуре кипения» Лаборатория 211 Лабораторная работа 9 «Определение теплоты
Тренировочные задания по МКТ (А) Какое явление наиболее убедительно доказывает, что между молекулами существуют силы отталкивания?) диффузия) броуновское движение) беспорядочное движение молекул 4)
Индивидуальное задание N 7 1.1. Два сосуда одинакового объема содержат кислород. В одном сосуде давление Р 1 =2 МПа и температура Т 1 =800 К, в другом Р 2 =2,5 МПа, Т 2 =200 К. Сосуды соединили трубкой
Экспериментальное задание. Наблюдение остывания воды в сосуде, если вода чистая, если на поверхность воды налит тонкий слой подсолнечного масла, молока. Цель работы: научиться измерять скорость остывания
Министерство образования и науки, молодежи и спорта Украины Государственное высшее учебное заведение «Национальный горный университет» Методические указания к лабораторной работе.3 ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА
2.3. ОСНОВЫ ТЕРМОДИНАМИКИ Основные законы и формулы Термодинамика исследует тепловые свойства газов, жидкостей и твёрдых тел. Физическая система в термодинамике (её обычно называют термодинамической) представляет
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ C P /C V ДЛЯ ВОЗДУХА МЕТОДОМ КЛЕМАНА-ДЕЗОРМА Принадлежности: экспериментальная установка в сборе. Введение. Согласно первому закону термодинамики тепло, подведенное к термодинамической
ЛАБОРАТОРНАЯ РАБОТА 21 ОПРЕДЕЛЕНИЕ ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ ЖИДКОСТЕЙ Цель работы: измерение поверхностного натяжения жидкостей методом отрыва капель при комнатной температуре. Оборудование: капельница,
Составитель: Яргаева В. А. РАБОТА. ПОСТРОЕНИЕ ДИАГРАММЫ ПЛАВКОСТИ ДВУХКОМПОНЕНТНОЙ СИСТЕМЫ Цель работы: освоить термический анализ: снять кривые охлаждения чистых компонентов и бинарных смесей различного
ИЗМЕРЕНИЕ КОЭФФИЦИЕНТА ВЯЗКОСТИ ЖИДКОСТИ МЕТОДОМ СТОКСА Методические указания для проведения лабораторных работ МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТОМСКИЙ ГОСУДАРСТВЕННЫЙ
ЗАДАЧИ К ИНДИВИДУАЛЬНОМУ ДОМАШНЕМУ ЗАДАНИЮ 5 (график в конце файла) 1. Воздушный пузырек на дне озера глубиной 16 м имеет объем 1,1 см 3 Температура на дне равна 5 С, а на поверхности 16 С. Определите
Работа 22 Определение плотности сыпучих и пористых тел Оборудование: два одинаковых сосуда, жидкостный манометр, сыпучее или пористое тело Введение Как известно, плотность вещества m ρ =, (1) V где m масса
Виртуальная лабораторная работа 6 ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ МОЛЯРНЫХ ТЕПЛОЕМКОСТЕЙ C /C v ДЛЯ ВОЗДУХА (компьютерное моделирование) В.В.Монахов, А.В.Кожедуб, А.В.Смирнов Цель работы - экспериментальное определение
Лабораторная работа «Измерение ускорения свободного падения» Цель работы: определить ускорение свободного падения с помощью нитяного маятника. Приборы и материалы: штатив с муфтой и лапкой; груз массой
17.3 Эффект Джоуля - Томсона Если газ адиабатически расширяется и совершает работу, то он должен охлаждаться, поскольку производимая им работа совершается за счет его внутренней энергии. Это наблюдали
ФИЗИКА 8 класс Тема урока: «Плавления и отвердевания тел» Цели урока: Предметные: обеспечить закрепление основных понятий и применение знаний и способов действий по теме; организовать деятельность по самостоятельному
ВРЕМЯ КОМПОЗИЦИЙ
– шоу, джаз, модерн, народный танец, фэнтази, стрит шоу, танцевальная шоу
· Соло, дуэт/пара –максимум1.45- 2.15 мин.
· Малая группа – максимум 2.00 - 3.00 мин.
· Формейшн – максимум 3.00-4.00 мин.
· Формейшен дети -2.00-3.00 мин.
· Мини продакшн - минимум 3.00 мин, максимум 8.00 мин.
· Продакшн – минимум 4.00 мин, максимум 8.00 мин.
Примечание : Используется своя музыка. Носители: MD-диски и CD-диски (не более одной мелодии на одном носителе с указанием города и названия коллектива). Иметь дубликат записи.
Молекулярная физика. Тепловые явления.
Опытное обоснование основных положений МКТ:
Молекулярно-кинетическая теория – учение о строении и свойствах вещества, использующее представление о существовании атомов и молекул как наименьших частиц химического вещества. В основе МКТ лежат три строго доказанных с помощью опытов утверждения:
- Вещество состоит из частиц – атомов и молекул, между которыми существуют промежутки;
- Эти частицы находятся в хаотическом движении, на скорость которого влияет температура;
- Частицы взаимодействуют друг с другом.
То, что вещество действительно состоит из молекул, можно доказать, определив их размеры.: Капля масла расплывается по поверхности воды, образуя слой, толщина которого равна диаметру молекулы. Капля объемом 1 мм 3 не может расплыться больше, чем на 0,6 м 2:
Существуют также другие способы доказательства существования молекул, но перечислять их нет необходимости: современные приборы (электронный микроскоп, ионный проектор) позволяют видеть отдельные атомы и молекулы.
Силы взаимодействия молекул
. а) взаимодействие имеет электромагнитный характер; б) силы короткодействующие, обнаруживаются на расстояниях, сопоставимых с размерами молекул; в) существует такое расстояние, когда силы притяжения и отталкивания равны (R 0), если R>R 0 , тогда преобладают силы притяжения, если R Действие сил молекулярного притяжения обнаруживается в опыте со свинцовыми цилиндрами, слипающимися после очистки их поверхностей. Молекулы и атомы в твердом теле
совершают беспорядочные колебания относительно положений, в которых силы притяжения и отталкивания со стороны соседних атомов уравновешены. В жидкости
молекулы не только колеблются около положения равновесия, но и совершают перескоки из одного положения равновесия в соседнее, эти перескоки молекул являются причиной текучести жидкости, ее способности принимать форму сосуда. В газах
обычно расстояния между атомами и молекулами в среднем значительно больше размеров молекул; силы отталкивания на больших расстояниях не действуют, поэтому газы легко сжимаются; практически отсутствуют между молекулами газа и силы притяжения, поэтому газы обладают свойством неограниченно расширяться. Масса и размер молекул. Постоянная Авогадро:
Любое вещество состоит из частиц, поэтому количество вещества
принято считать пропорциональным числу частиц. Единицей количества вещества является моль
. Моль
равен количеству вещества системы, содержащей столько же частиц, сколько содержится атомов в 0,012 кг углерода. Отношение числа молекул к количеству вещества называется постоянной Авогадро:
Постоянная Авогадро равна . Она показывает, сколько атомов или молекул содержится в одном моле вещества. Количество вещества можно найти как отношение числа атомов или молекул вещества к постоянной Авогадро: Молярной массой
называется величина, равная отношению массы вещества к количеству вещества: Молярную массу можно выразить через массу молекулы: Для определения массы молекул
нужно разделить массу вещества на число молекул в нем: Броуновское движение:
Броуновское движение
– тепловое движение взвешенных в газе или жидкости частиц. Английский ботаник Роберт Броун (1773 – 1858) в 1827 году обнаружил беспорядочное движение видимых в микроскоп твердых частиц, находящихся в жидкости. Это явление было названо броуновским движением. Это движение не прекращается; с увеличением температуры его интенсивность растет. Броуновское движение – результат флуктуации давления (заметного отклонения от средней величины). Причина броуновского движения частицы заключается в том, что удары молекул жидкости о частицу не компенсируют друг друга. Идеальный газ:
У разреженного газа расстояние между молекулами во много раз превышает их размеры. В этом случае взаимодействие между молекулами пренебрежимо мало и кинетическая энергия молекул много больше потенциальной энергии их взаимодействия. Для объяснения свойств вещества в газообразном состоянии вместо реального газа используется его физическая модель - идеальный газ. В модели предполагается: Расстояние между молекулами чуть больше их диаметра; Молекулы – упругие шарики; Между молекулами не действуют силы притяжения; При соударении молекул друг с другом и со стенками сосуда действуют силы отталкивают; Движения молекул подчиняется законам механики. Основное уравнение МКТ идеального газа:
Основное уравнение МКТ позволяет вычислить давление газа, если известны масса молекулы, среднее значение квадрата скорости и концентрация молекул. Давление идеального газа
заключается в том, что молекулы при столкновениях со стенками сосуда взаимодействуют с ними по законам механики как упругие тела. При столкновении молекулы со стенкой сосуда проекция скорости v x вектора скорости на ось OX, перпендикулярную стенке, изменяет свой знак на противоположный, но остается постоянной по модулю. Поэтому в результате столкновений молекулы со стенкой проекция ее импульса на ось OX изменяется от mv 1x =-mv x до mv 2x =mv x . Изменение импульса молекулы при столкновении со стенкой вызывает сила F 1 , действующая на нее со стороны стенки. Изменение импульса молекулы равно импульсу этой силы: Во время столкновения, согласно третьему закону Ньютона, молекула действует на стенку с силой F 2 , равной по модулю силе F 1 и направленной противоположно. Молекул много, и каждая передает стенке при столкновении такой же импульс. За секунду они передают импульс , где z – число столкновений всех молекул со стенкой, которое пропорционально концентрации молекул в газе, скорости молекул и площади поверхности стенки: . К стенке движется только половина молекул, остальные движутся в обратную сторону: . Тогда полный импульс, переданный стенке за 1 секунду: . Согласно второму закону Ньютона изменение импульса тела за единицу времени равно действующей на него силе: Учитывая, что не все молекулы имеют одинаковую скорость, сила, действующая на стенку будет пропорциональна среднему квадрату скорости. Так как молекулы движутся во всех направлениях, средние значения квадратов проекций скорости равны. Следовательно, средний квадрат проекции скорости: ; . Тогда давление газа на стенку сосуда равно: Основное уравнение МКТ. Обозначив среднее значение кинетической энергии поступательного движения молекул идеального газа: Получим Температура и ее измерение:
Основное уравнение МКТ для идеального газа устанавливает связь легко измеряемого макроскопического параметра – давления – с такими микроскопическими параметрами газа, как средняя кинетическая энергия и концентрация молекул. Но, измерив только давление, мы не можем узнать ни среднее значение кинетической энергии молекул в отдельности, ни их концентрацию. Следовательно, для нахождения микроскопических параметров газа нужны измерения еще какой-то физической величины, связанной со средней кинетической энергией молекул. Такой величиной является температура
. Любое макроскопическое тело или группа макроскопических тел при неизменных внешних условиях самопроизвольно переходит в состояние теплового равновесия. Тепловое равновесие –
это такое состояние, при котором все макроскопические параметры сколь угодно долго остаются неизменными. Температура характеризует состояние теплового равновесия системы тел: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру
. Для измерения температуры можно воспользоваться изменением любой макроскопической величины в зависимости от температуры: объема, давления, электрического сопротивления и т.д. Чаще всего на практике используют зависимость объема жидкости (ртути или спирта) от температуры. При градуировке термометра обычно за начало отсчета (0) принимают температуру тающего льда; второй постоянной точкой (100) считают температуру кипения воды при нормальном атмосферном давлении (шкала Цельсия). Так как различные жидкости расширяются при нагревании неодинаково, то установленная таким образом шкала будет до некоторой степени зависеть от свойств данной жидкости. Конечно, 0 и 100°С будут совпадать у всех термометров, но 50°С совпадать не будут. В отличие от жидкостей все разреженные газы расширяются при нагревании одинаково и одинаково меняют свое давление при изменении температуры. Поэтому в физике для установления рациональной температурной шкалы используют изменение давления определенного количества разреженного газа при постоянном объеме или изменение объема газа при постоянном давлении. Такую шкалу иногда называют идеальной газовой шкалой температур
. При тепловом равновесии средняя кинетическая энергия поступательного движения молекул всех газов одинакова. Давление прямо пропорционально средней кинетической энергии поступательного движения молекул: . При тепловом равновесии, если давление газа данной массы и его объем фиксированы, средняя кинетическая энергия молекул газа должна иметь строго определенное значение, как и температура. Т.к. , то , или . Обозначим . Величина растет с повышением температуры и ни от чего, кроме температуры не зависит. Следовательно, ее можно считать естественной мерой температуры. Абсолютная температурная шкала:
Будем считать величину , измеряемую в энергетических единицах, прямо пропорциональной температуре , выражаемой в градусах: , где - коэффициент пропорциональности. Коэффициент , в честь австрийского физика Л. Больцмана называется постоянной Больцмана.
Следовательно, . Температура, определяемая этой формулой, не может быть отрицательной. Следовательно, наименьшим возможным значением температуры является 0, если давление или объем равны нулю. Предельную температуру, при которой давление идеального газа обращается в нуль при фиксированном объеме или объем идеального газа стремится к нулю при неизменном давлении, называют абсолютным нулем температуры
. Английский ученый У. Кельвин ввел абсолютную шкалу температур. Нулевая температура по шкале Кельвина соответствует абсолютному нулю, а каждая единица температуры по этой шкале равна градусу по шкале Цельсия. Единица абсолютной температуры в СИ называется Кельвином.
Следовательно, абсолютная температура есть мера средней кинетической энергии движения молекул.
Скорость молекул газа:
Зная абсолютную температуру, можно найти среднюю кинетическую энергию молекул газа, а, следовательно, и средний квадрат их скорости. Квадратный корень из этой величины называется средней квадратичной скоростью
: Опыты по определению скоростей молекул доказали справедливость этой формулы. Одни из опытов был предложен О. Штерном в 1920 году. Уравнение состояния идеального газа (уравнение Менделеева – Клапейрона). Универсальная газовая постоянная:
На основе зависимости давления газа от концентрации его молекул и температуры можно получить уравнение, связывающее все три макроскопических параметра: давление, объем и температуру - характеризующие состояние данной массы достаточно разреженного газа. Это уравнение называют уравнением состояния идеального газа. Где - универсальная газовая постоянная Для данной массы газа, следовательно Уравнение Клапейрона. Изотермический, изохорный и изобарный процессы:
Количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра называют газовыми законами. А процессы, протекающие при неизменном значении одного из параметров, - изопроцессами. Изотермический процесс
– процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре. Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется.
– закон Бойля - Мариотта. Изохорный процесс
- процесс изменения состояния термодинамической системы макроскопических тел при постоянном объеме. Для газа данной массы отношение давления к температуре постоянно, если объем газа не меняется
. – закон Шарля. Изобарный процесс
- процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении. Для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется
. – закон Гей-Люссака. Внутренняя энергия:
Внутренняя энергия макроскопического тела равна сумме кинетических энергий беспорядочного движения всех молекул (или атомов) относительно центров масс тела и потенциальных энергий взаимодействия всех молекул друг с другом (но не с молекулами других тел).
При любых процессах в изолированной термодинамической системе внутренняя энергия остается неизменной. 145.
Молекулярная физика
-
раздел физики, изучающий строение и
свойства вещества, исходя из
молекулярно-кинетических представлений
о его строении. 146.
Основные положения молекулярно-кинетической
теории:
1)
Все тела состоят из атомов, молекул и
ионов, имеющих в свою очередь сложное
строение. 2)
Атомы, молекулы и ионы находятся в
непрерывном хаотическом движении,
называемом тепловым. Скорость этого
движения зависит от температуры. 3)
Между атомами и молекулами существуют
силы взаимного притяжения и отталкивания. 147.
Экспериментальным
подтверждением
справедливости
первых двух положений являются диффузия,
броуновское движение, растворимость
и др. Подтверждением справедливости
третьего
положения
служит явление возникновения сил
упругости при деформации тел. 148.
Диффузия
-
это явление самопроизвольного
проникновения молекул одного вещества
в промежутки между молекулами другого
вещества, происходящее в результате
теплового движения. 149.
Броуновское
движение
-
это движение мельчайших макроскопических
тел (пылинок, цветочной пыльцы, частичек
туши и т.д.) под действием ударов со
стороны молекул жидкости или газа. 150.
Диаметр
молекул имеет порядок 10 -10
м, а масса - 10 -26
кг. 151.
Количество
вещества
-
величина, равная числу структурных
элементов (атомов, молекул, ионов),
составляющих систему. где
N - число частиц, N A
- постоянная Авогадро, m
– масса вещества, - молярная масса
вещества. Единицей количества вещества
является 1 моль. 152.
1
моль
- это порция молекул, равная числу
Авогадро. Более
точное определение 1 моля:
это порция молекул или других структурных
единиц вещества, в которой содержится
столько же молекул или других структурных
единиц, сколько их содержится в 0,012 кг
углерода. 153.
Молярная
масса
-
это масса одного моля данного вещества.
Единицей молярной массы является
кг/моль. 154.
Относительная
молекулярная масса –
это
величина численно равная отношению
массы молекулы данного вещества к 1/12
массы изотопа атома углерода 6 С 12 .
Измеряется в углеродных единицах (у.
ед) или атомных единицах (а.е.м.) 155.
Число N молекул в теле массой m
можно подсчитать по формуле: где
- количество вещества, N А
- число Авогадро, - молярная масса
вещества, из которого состоит тело. 156.
Идеальным
называется газ, потенциальная энергия
взаимодействия, между молекулами
которого равна нулю. 157.
Основное уравнение МКТ:
где
n
- число молекул в единице объёма
(концентрация), m
- масса молекулы,-
средний квадрат скорости. 158.
Другой
вид основного уравнения МКТ
где
p
- давление,
- средняя кинетическая энергия молекул. 159.
Средняя квадратичная скорость молекул
где
– молярная масса вещества, m 0
– масса молекулы, T
– абсолютная температура. 160.
Средняя кинетическая энергия
поступательного движения молекулы
идеального газа
161.
Зависимость давления газа от концентрации
молекул и температуры:
162.
Температура
-
величина, характеризующая состояние
термодинамического (теплового) равновесия
макроскопической системы. 163.
Абсолютный
нуль температуры
- это предельная температура, при которой
давление идеального газа обращается в
нуль при фиксированном объёме или объём
идеального газа стремится к нулю при
неизменном давлении. Можно
сформулировать иначе: Абсолютный
нуль температуры
-
это предельная температура, при которой
прекращается поступательное движение
молекул. 164.
Абсолютная
(термодинамическая) шкала
-
это шкала температур, в которой за начало
отсчета принят абсолютный нуль. Единица
температуры в этой шкале - кельвин (К),
величина которого совпадает с градусом
Цельсия. В шкале Цельсия абсолютный
нуль равен -273,15С. Связь между абсолютной
температурной шкалой и шкалой Цельсия
выражается формулой 165.
Уравнение
состояния идеального газа
(уравнение
Менделеева-Клапейрона)
: где
р - давление, V - объём, R=8,31 Дж/(мольК) -
универсальная газовая постоянная, T -
абсолютная температура, - молярная
масса газа. Или где
- плотность газа. 166.
Уравнение
Клапейрона
или объединённый газовый закон: 167.
Изотермическим
называется
процесс, протекающий при постоянной
температуре. Если при этом масса газа
не изменяется, то процесс подчиняется
закону
Бойля-Мариотта. Формулировка закона:
Для данной массы газа произведение
давления на объём при постоянной
температуре есть величина постоянная. 168.
Изобарным
называется
процесс, протекающий при постоянном
давлении. Если масса газа не меняется,
то процесс подчиняется закону Гей-Люссака
:
Для данной массы газа при постоянном
давлении отношение объёма к абсолютной
температуре есть величина постоянная. 169.
Изохорным
называется
процесс, протекающий при постоянном
объёме. Если масса газа постоянна, то
процесс подчиняется закону
Шарля
:
Для данной массы газа при постоянном
объёме отношение давления к абсолютной
температуре есть величина постоянная. 170.
Давление смеси газов равно сумме
парциальных давлений, созданных каждым
газом.
Этот
закон известен под названием "закон
Дальтона"
. 171.
Термодинамика
- это раздел физики, в котором рассматриваются
тепловые явления с точки зрения
происходящих в них преобразований
энергии. 172.
Внутренняя энергия
- это сумма кинетической энергии
хаотического движения молекул,
потенциальной энергии их взаимодействия
и внутримолекулярной энергии молекул,
из которых состоит тело. 173.
Внутреннюю энергию
тел можно изменить двумя способами:
теплообмен
и совершение работы.
Признаком изменения внутренней энергии
тела является изменение его температуры
и (или) агрегатного состояния. 174.
Внутренняя
энергия одноатомного, идеального газа
определяется по формуле: 175.
Изменение
внутренней энергии
одноатомного газа можно подсчитать по
формуле: где
m - масса газа, - молярная масса газа. 176.
Теплообмен
бывает трёх видов:
лучеиспускание, конвекция, теплопередача.
Лучеиспускание
-
это теплообмен с помощью электромагнитных
волн теплового диапазона. Конвекция
- это теплообмен, осуществляемый при
перемешивании жидкостей или газов,
имеющих разную температуру, Теплопередача
-это
форма передачи энергии, при которой
осуществляется непосредственный обмен
энергией между хаотически движущимися
молекулами тел при их тепловом контакте. 177.
Количество теплоты
-
это энергия, которую тело получает или
отдаёт при теплообмене. 178.
Теплоёмкость тела
-
это величина равная количеству теплоты,
которое надо передать телу для изменения
его температуры на 1 кельвин. Теплоёмкость
тела измеряется в Дж/К. Количество
теплоты, которое надо сообщить телу с
теплоёмкостью С вычисляется по формуле 179.
Удельная теплоёмкость
-
это величина численно равная количеству
теплоты, которую надо сообщить веществу
массой 1 кг для изменения его температуры
на 1 кельвин. Удельная
теплоёмкость измеряется в Дж/(кгК).
Теплоёмкость
тела связана с удельной теплоёмкостью
вещества, из которого оно изготовлено,
формулой 180.
Закон
сохранения энергии в тепловых процессах
(первый закон термодинамики):
количество теплоты, переданное телу,
идёт на увеличение его внутренней
энергии и на совершение работы против
внешних сил. 181.
Применение
первого закона термодинамики к
изопроцессам.
1)
Изотермический (Т=const)
т.к.U=0,
т.е. количество теплоты, переданное
системе, идёт на совершение работы
против внешних сил; 2)
Изобарный (p=const)
т.е.
количество теплоты, переданное системе,
идёт на совершение работы против внешних
сил и на изменение её внутренней энергии; 3)
Изохорный
(V=const)
т.е.
количество теплоты, переданное системе,
идёт на изменение её внутренней энергии. 4)
Адиабатным
называется
процесс, протекающий без теплообмена
с окружающей средой (Q=0). Закон сохранения
энергии для него имеет вид: т.е.
работа против внешних сил совершается
за счёт убыли внутренней энергии. 182.
Работа расширения газа
при
постоянном давлении вычисляется по
формуле: где
V 2
и V 1
-
конечный и начальный объёмы газа, р -
давление. Т.к. где
T 2
-
температура газа в конечном состоянии,
T 1
-
температура газа в начальном состоянии,
- молярная масса, R - универсальная
газовая постоянная. 183.
Тепловой
двигатель (тепловая машина)
-
это устройство, совершающее работу за
счёт уменьшения внутренней энергии
рабочего тела. 184.
Любая тепловая
машина
состоит из трёх частей: нагревателя,
холодильника и рабочего тела. 185.
Тепловой
коэффициент полезного действия
тепловой
машины равен: где
Q 1
-
количество теплоты, полученной от
нагревателя, Q 2
-
количество теплоты, отданной холодильнику,
A ‑ механическая работа. 186.
Формула Карно
для
идеальной тепловой машины: где
Т 1
-
температура нагревателя, Т 2
-
температура холодильника, - КПД. 187.
Плавление
-
это процесс перехода вещества из твёрдого
состояния в жидкое при температуре
плавления. 188.
Процесс превращения жидкости в твёрдое
кристаллическое состояние называется
кристаллизацией
. 189.
Удельная теплота плавления
-
это количество теплоты, необходимое
для превращения 1 кг твёрдого
кристаллического вещества из твёрдого
состояния в жидкое, при температуре
плавления. Удельная
теплота плавления измеряется в Дж/кг. 190.
Парообразование
-
это процесс перехода вещества из твёрдого
или жидкого состояния в газообразное. 191.
Испарение
- это процесс парообразования, происходящий
с открытой поверхности жидкости или
твёрдого тела. 192.
Сублимация
(возгонка)
– это переход твёрдого вещества в
газообразное, минуя жидкое состояние. 193.
Кипение
- это процесс парообразования, происходящий
не только с открытой поверхности
жидкости, но и по всему её объёму внутрь
пузырьков газа, растворённого в жидкости.
Для каждой жидкости существует своя
температура кипения. Жидкость кипит
при такой температуре, при которой
давление её насыщенных паров равно
атмосферному давлению. 194.
Пар, находящийся в динамическом равновесии
со своей жидкостью, называется насыщенным
. 195.Точка
росы
- температура, при которой пар переходит
в состояние насыщения. 196.
Процесс перехода вещества из газообразного
состояния в жидкое, называется
конденсацией. 197.
Количество теплоты, которое необходимо
для превращения единицы массы жидкости
в пар, называется удельной
теплотой парообразования и конденсации
Удельная
теплота парообразования измеряется в
Дж/кг. 198.
Абсолютная
влажность
- это парциальное давление (плотность)
водяных паров в атмосфере. 199.
Относительная
влажность
-
это величина равная отношению абсолютной
влажности к давлению (плотности)
насыщенного пара при данной температуре. Молекулярная
физика. Тепловые явления.
Знать/понимать:
-
план, руководствуясь которым они должны
характеризовать физическую теорию, а
именно:
*
теоретическое и экспериментальное
обоснование теории (опытное обоснование,
модели, величины, методы описания);
*
формулировки основных положений (законы,
постулаты, принципы, основные положения,
фундаментальные постоянные);
*
следствия теории и факты их экспериментальной
проверки (частные законы, применение к
решению задач, техническое
применение);
*границы
применимости теории;
*
примеры практического значения теории
и её применений.
Уметь:
*приводить
примеры, показывающие, что
-
наблюдения и эксперимент являются
основой для выдвижения гипотез и теорий;
-
эксперимент позволяет проверить
истинность теоретических выводов;
-
физическая теория даёт возможность
объяснить известные явления природы и
научные факты;
-
физическая теория позволяет предсказывать
ещё неизвестные явления, их особенности;
-
один и тот же природный объект или
процесс можно описать (исследовать) на
основе разных моделей;
-
законы физики и физические теории имеют
определённые границы применимости;
*
раскрывать влияние научных идей и теорий
на формирование современного мировоззрения;
называть значимые черты современной
физической картины мира; приводить
примеры физических явлений и процессов,
изучаемых в теории; иллюстрировать роль
физики в создании и (или) совершенствовании
важнейших технологических объектов;
*
воспринимать, перерабатывать и предъявлять
учебную информацию в различных формах
(словесной, образной, символической):
излагать суть содержания текста учебника
по физике; выделять в тексте учебника
важнейшие категории научной информации
(описание явления или опыта; постановка
проблемы; выдвижение гипотезы;
моделирование объектов и процессов;
формулировка теоретического вывода и
его интерпретация; экспериментальная
проверка гипотезы или теоретического
предсказания); выдвигать гипотезы для
объяснения предъявленной системы
научных фактов; делать выводы на основе
экспериментальных данных, представленных
таблицей, графиком или диаграммой.
Учащимся
необходимо владеть:
Основными
понятиями и законами физики: соотносить
изучаемые понятия с теми свойствами
(особенностями) тел и процессов, для
характеристики которых эти понятия
введены в физику; описывать опыты,
оказавшие существенное влияние на
развитие физики; раскрывать смысл
изучаемых законов и принципов; описывать
преобразования энергии в процессах;
Понятиями
и представлениями физики, связанными
с жизнедеятельностью человека.
Блок
- Основы молекулярно-кинетической
теории.
При
изучении на уровне А (базовый уровень
Стандарта, 2 ч/неделю)
В
учебнике Мякишева Г.Я., Буховцева Б.Б.
теме посвящено 8 параграфов: §56. Основные
положения молекулярно-кинетической
теории. Размеры молекул. § 57. Масса
молекул. Количество вещества. §58.
Броуновское движение. §59. Силы
взаимодействия молекул. §60. Строение
газообразных, жидких и твердых тел. §61.
Идеальный газ в молекулярно-кинетической
теории. §62. Среднее значение квадрата
скорости молекул. §63. Основное уравнение
молекулярно-кинетической теории газов.
На
изучение темы отводится не более 5 часов.
ДЦМ:
ознакомить обучающихся с основными
положениями молекулярно-кинетической
теории.
Блок
состоит из четырех модулей: М1 «Основные
положения МКТ. Размеры молекул. Масса
молекул. Количество вещества.
Броуновское движение. Силы
взаимодействия молекул» (2 урока)
М2
«Строение газообразных, жидких и твердых
тел. Идеальный газ в МКТ. Скорость
молекул.
Основное уравнение МКТ газов»(2
урока)
М3
«Обобщение и контроль знаний по теме»(1
урок)
Обязательный
минимум знаний/ умений/навыков.
Знать:
Делимость
вещества, парообразование, сублимация,
растворимость доказывают, что тело
состоит из частиц.(все уровни)
Сжимаемость
веществ, диффузия свидетельствует, что
между частицами вещества есть промежутки.
(все уровни)
Диффузия
и броуновское движение доказывают, что
частицы движутся. (все уровни)
Зависимость
скорости испарений и диффузии от
температуры говорит о том, что скорость
движения частиц зависит от температуры.
(все уровни)
Модель
идеального газа, кристаллическая
решетка твердых тел, модель строения
жидкости. (все уровни)
Макропараметры:
давление, объем, температура. (все
уровни)
Микропараметры:
средний квадрат скорости, концентрация,
масса одной молекулы. (все уровни)
Основные
положения МКТ: (для всех уровней)
все
тела состоят из молекул, между которыми
есть промежутки;
масса
тел может меняться дискретно; молекулы
непрерывно хаотически движутся;
молекулы
взаимодействуют (притягиваются или
отталкиваются в зависимости от расстояния
между частицами)
Фундаментальные
постоянные: (для всех уровней)
Уметь
определять: (все уровни)
молярную
массу вещества;
относительную
молекулярную массу;
количество
вещества;
число
молекул вещества в данном количестве
вещества;
среднее
значение квадрата скорости;
средний
квадрат проекции скорости на оси
координат;
выводить:
основное
уравнение молекулярно-кинетической
теории газов.
m
0
Определять
(вычислять
):
а) размеры молекул, относительную
молекулярную массу по формуле М
r
=
1/ 12
m
0
C
, молярную
массу
M
=
m
0
N
A
(все уровни); количество вещества по
формуле (все уровни); число
молекул
вещества по формуле
(все уровни);
б) среднее значение
квадрата скорости по формуле
(все уровни);
в) средний квадрат
проекции скорости по формуле
(все уровни);
г) давление газа
на стенку сосуда по формуле
(все уровни);
д) давление
идеального газа через концентрацию
молекул и среднюю кинетическую энергию
поступательного
движения
(все уровни)
Описывать:
опыт
Броуна (все уровни
);
опыт
Перрена (2,3 уровень); вклад Френкеля (3
уровень)
Раскрывать:
суть МКТ,
Объяснять
:
причину
броуновского движения, диффузии; (2,3
уровни); условия возникновения сил
отталкивания и сил притяжения, природу
этих сил (2,3 уровни); строение газообразных
тел, скорость молекул в газообразных
телах, свойства газообразных тел (все
уровни); строение жидкостей, скорость
молекул, свойства жидких веществ (все
уровни); строение твердых тел, скорость
молекул в твердых телах, свойства твердых
тел (все уровни);
Литература.
Мякишев
Г.Я., Буховцев Б.Б. Физика-10, 18-е изд., М.,
Просвещение, 2009г.
Тарасов
Л.В. Современная физика в средней школе.
М., Просвещение, 1990г.
Рымкевич
А.П. Сборник задач по физике. М.,
Просвещение, 1998г.
Лишевский
В.П. Ученые - популяризаторы науки. М.,
«Знание», 1987г.
Модульная
программа «Молекулярно-кинетическая
теория»
Модуль
Осмыслить
основные понятия МКТ, конкретизировать
понятие о размерах и массе молекул,
углубить и систематизировать знания
о количестве вещества. Осознание
существования сил взаимодействия
молекул.
Осмысление
строения газообразных, жидких и твердых
тел. Освоение понятия «идеальный газ».
Определение скорости молекул. Знакомство
с основным уравнением МКТ газов.
Самоконтроль
учебных достижений, выявление ошибок,
их коррекция
Входной
контроль по теме «Основные положения
молекулярно-кинетической теории.
Размеры и масса молекул. Количество
вещества. Броуновское движение».
Строение
газообразных тел.
Выполнение
дифференцированных заданий для
выявления уровня усвоения содержания
всех элементов модулей М1-М2.
Представление
о строении вещества
Возникновение
атомистической теории строения
вещества.
Строение
жидких тел.
Вклад
Я.И. Френкеля.
Подведение
итогов.
Строение
твердых тел.
Размеры
и масса молекул Относительная
молекулярная масса, молярная масса
и количество вещества
Сложность
изучения теории газов и свойств
молекул. Модель идеального газа.
Беспорядочное
движение частиц. Опыты Перрена. Силы
взаимодействия молекул.
Давление
газа в МКТ.
Выходной
контроль
Связь
давления со средней кинетической
энергией молекул.
Подведение
итогов
Вывод
основного уравнения МКТ газов
Выходной контроль
Подведение итогов.
Модуль
М1. 1 уровень сложности.
Руководство
по усвоению учебного материала
ЧДЦ.
Составить план изучения модуля и
определить основные учебные задачи.
(ИТ,
ИД, ИЭ, ДТ, ДД, ДЭ)
1.
Просмотрите §56-58. Обратите внимание
на выделенные заголовки текста.
Отметьте для себя, какие пункты вы
знаете хорошо, о чем вы только частично
помните, что вам встречается впервые.
На основании этого определите ваш
собственный путь изучения М1. Для
работы воспользуйтесь учебником, если
необходимо обращайтесь к учителю за
консультацией.
2.
Внимательно ознакомьтесь с вопросами,
которые вам предстоит рассмотреть
при изучении М1.
1.Ознакомьтесь
с Приложением 1, проследите этапы
становления атомистической теории.
Запишите основные этапы с указание
дат.
(1
балл)
2Т.Приведите
примеры физических явлений, доказывающих
основные положения МКТ.
(1
балл)
(2
балла)
2Д.
Рассмотрите при помощи микроскопа
движение частиц краски. Опишите
увиденное.
(1 балл)
(ИТ,ИД,ИЭ)
(см.
Приложение 1)
(ДД,ДТ,ДЭ)
История
атомистической теории
Приложение
1)
1.
.Ознакомьтесь с Приложением 1, проследите
этапы становления атомистической
теории. Запишите основные этапы с
указание дат.
(1
балл)
2Т.
Приведите примеры физических явлений,
доказывающих:
-строение
веществ,
- движение
частиц
- наличие
сил притяжения (отталкивания) между
частицами.
(1
балл)
2Э.
Прочитайте стихотворение Лукреция
Кара «О природе вещей». Какие физические
явления описываются в нем? Что
доказывается этими строками?
(2
балла)
2Д.
Составьте план действий по определению
размера молекулы оливкового масла.
(1
балл)
«О
природе вещей»
Выслушай
то, что скажу, и ты сам, несомненно,
признаешь,
Что
существуют тела, которых мы видеть
не можем…
Стало
быть, ветры-тела, но только незримые
нами.
Хоть
и не видим совсем, как в ноздри они
проникают…
И
наконец, на морском берегу, развивающем
волны,
Платье
сыреет всегда, а на солнце, вися, оно
сохнет,
Видеть,
однако, нельзя, как влага на нем оседает,
Как
и не видно того, как она исчезает от
зноя.
Значит,
дробится вода на такие мельчайшие
части,
Что
недоступны они совершенно для нашего
глаза.
УЭ3.
Основные положения молекулярно-кинетической
теории.
ЧДЦ:
сформулировать и проанализировать
основные положения МКТ
(1
балл)
2. Ответьте
на вопросы:
(1
балл)
Основные
положения МКТ
Цель
МКТ
Прочитайте
§56,58. Запишите в таблицу 1 основные
положения МКТ, цель МКТ и доказательства
основных положений МКТ.
(1
балл)
2. Ответьте
на вопросы:
-
доказательны ли основные положения
МКТ?
- достаточно
ли убедительны эти доказательства?
(1балл)
УЭ4.
2.
Решите задачи, используя обобщённый
алгоритм решения задачи.
(За
решение каждой – 1балл)
ИТ,ИД,ИЭ
1.Какое
количество вещества содержится в
алюминиевой отливке массой 5,4кг?
ДТ,ДД,ДЭ
1.Какова
масса 500 моль углекислого газа?
1.Найдите
формулы для расчета диаметра молекул,
массы молекул., относительной
молекулярной массы, количества
вещества. (1балл)
2.
Решите задачи, используя обобщённый
алгоритм решения задачи
(За
решение каждой – 1балл)
2.Сколько
молекул содержится в углекислом газе
(СО
2
)
массой 1г?
2.Найти
число атомов в алюминиевом предмете
массой 135 г.
Обобщённый
алгоритм решения задачи
Переведите
все физические величины в международную
СИ
Количество
вещества определяется по формуле
=
N
/
N
A
(1)
Молярная
масса М
=
m
0
N
A
Заменив
N
и
N
A
в (1), получим =
m
/М
(расчётная формула для задачи 1), где
М - молярная масса (масса вещества в
количестве 1 моль)
Число
молекул определяется по формуле
N
=
N
A
m
/М
(расчетная формула для задачи 2)
Молярная
масса сложного вещества определяется
М = М
r
(1)
+ М
r
(2)
УЭ5.
ЧДЦ:
Усвоить сущность броуновского движения,
знать отличия от диффузии. Объяснять
природу сил взаимодействия молекул,
выяснить зависимость от расстояния
между молекулами.
УЭ6.
Выходной контроль
УЭ7.Подведение
итогов.
Модуль
М1. 2 уровень сложности.
Основные
положения молекулярно-кинетической
теории. Размеры и масса молекул.
Количество вещества. Броуновское
движение. Силы взаимодействия молекул.
УЭ0.Определение
цели и задач модуля.
ДЦМ:
усвоить основные положения МКТ,
конкретизировать понятие о размерах
и массе молекул, повторить, углубить
и систематизировать знания о количестве
вещества. Осмыслить суть беспорядочного
движения частиц.
Интегральные
когнитивные стили
Дифференцированные
когнитивные стили
Руководство
по усвоению учебного материала
Руководство
по усвоению учебного материала
УЭ1.
Входной контроль по теме «Основные
положения МКТ. Размеры и масса молекул.
Количество вещества. Броуновское
движение»
ЧДЦ.
Составить план изучения модуля и
определить основные учебные задачи.
Вклад М.В. Ломоносова в развитие МКТ.
1.
Просмотрите §56-58. Обратите внимание
на выделенные заголовки текста.
Отметьте для себя, какие пункты вы
знаете хорошо, о чем вы только частично
помните, что вам встречается впервые.
На основании этого определите ваш
собственный путь изучения М1. Для
работы воспользуйтесь учебником, если
необходимо обращайтесь к учителю за
консультацией.
2.
Внимательно ознакомьтесь с вопросами,
которые вам предстоит рассмотреть
при изучении М1.
(ИТ,
ИД, ИЭ, ДТ, ДД, ДЭ)
1.
Возникновение атомистической теории
строения вещества.
2.
Основные положения МКТ. Размеры
молекул. Масса молекул.
3.
Количество вещества. Число Авогадро.
4.
Относительная молекулярная масса.
Молекулярная масса.
5.
Беспорядочное движение частиц.
1.
Просмотрите §56-58. Обратите внимание
на выделенные заголовки текста.
Отметьте для себя, какие пункты вы
знаете хорошо, о чем вы только частично
помните, что вам встречается впервые.
На основании этого определите ваш
собственный путь изучения М1. Для
работы воспользуйтесь учебником, если
необходимо обращайтесь к учителю за
консультацией.
2.
Внимательно ознакомьтесь с вопросами,
которые вам предстоит рассмотреть
при изучении М1.
УЭ2.
Представление о строении вещества
ЧДЦ:
Повторить сведения о строении вещества
и истории возникновения атомистической
теории строения вещества.
1.Ознакомьтесь
с Приложением 1, проследите этапы
становления атомистической теории.
Сделайте вывод о становлении МКТ как
теории.Запишите основные этапы с
указание дат.
(1балл)
(ИТ,ИД,ИЭ,ДД,ДТ,ДЭ)
История
атомистической теории (см. Приложение
1)
1.Ознакомьтесь
с Приложением 1, проследите этапы
становления атомистической теории.
Запишите основные этапы с указание
дат. Сделайте вывод о становлении МКТ
как теории.
(1балл)
2Т. Ответьте
на вопрос.
(2балла)
2Д.
Рассмотрите по микроскопом каплю
молока. Объясните поведение мелких
капелек масла.
(1балл)
(2балла)
Почему
на Земле пыль долго удерживается над
её поверхностью, а на Луне она быстро
оседает, несмотря на то, что сила
тяжести на Луне меньше, чем на Земле?
Почему
из осколков разбитого стакана невозможно
собрать целый стакан, а хорошо
отшлифованные мерительные плитки
плотно прилипают друг к другу.
2Т. Ответьте
на вопрос.
(2балла)
2Д.
Рассмотрите по микроскопом каплю
молока. Чем объясняется поведение
мелких капелек масла.
(1балл)
2Э. Прочтите
стихотворение В.Я. Брюсова. Согласны
ли вы, что «в малом можно увидеть то
же, что и в большом»?
(2балла)
ИЭ,ДЭ
Быть
может, эти электроны –
Миры,
где пять материков,
Искусства,
знанья, войны, троны
И
память сорока веков!
Ещё,
быть может, каждый атом –
Вселенная,
где сто планет;
Там
все, что здесь, в объеме сжатом,
Но
также то, чего здесь нет.
Их
бесконечность, как и здесь;
Там
скорбь и страсть, как здесь, и даже
Там
та же мировая спесь.
УЭ3.
Основные
положения молекулярно-кинетической
теории. Вклад М.В. Ломоносова в развитие
МКТ.
ЧДЦ:
сформулировать и проанализировать
основные положения МКТ. Ознакомиться
с атомно-молекулярной теорией
М.В.Ломоносова.
1.Прочитайте
§56,58. Запишите в таблицу 1 основные
положения МКТ, цель МКТ и доказательства
основных положений МКТ.
(1
балл)
2.
Ознакомьтесь с материалом Приложения
2. Все ли положения МКТ отражены в
данном тексте.
(1
балл)
Основные
положения МКТ
Цель
МКТ
Основные
положения МКТ, их доказательства
(ИТ,ИД,ИЭ,ДТ,ДД,ДЭ)
1.Прочитайте
§56,58. Запишите в таблицу 1 основные
положения МКТ, цель МКТ и доказательства
основных положений МКТ.
(1
балл)
2.
Ознакомьтесь с материалом Приложения
2.Найдите в тексте основные положения
МКТ. Все ли положения отражены в данном
тексте?
(1
балл)
Приложение
2
УЭ4.
Размеры и масса молекул.
Относительная молекулярная масса и
количество вещества.
ЧДЦ:
Воспроизводить формулы для расчета
размеров, массы молекул. Решать
стандартные задачи на расчет массы,
количества вещества.
УЭ5.
Беспорядочное движение частиц.
Силы взаимодействия молекул.
ЧДЦ:
Опыты Перрена. Объяснять природу сил
взаимодействия молекул, выяснить
зависимость от расстояния между
молекулами.
УЭ6.
Выходной контроль
ЧДЦ:
Проверить усвоение учебных элементов
УЭ7.Подведение
итогов.
ЧДЦ:
заполнить лист контроля, оценить свои
знания.
Документ
Веществ, делают теорию
растворов труднейшей проблемой молекулярной
физики
и учения... Она
является пограничной областью знания, которая
объединяет физическую
химию, физику
поверхностных явлений
... вещества. Именно
они
в первую очередь понимаются
под термином... ... теории
и на практике" - не столько руководство
... , которой
они
не понимают
, ... должно
совпасть с произнесением самого возвышенного и тайного имени
Бога, к которому
он
... физически
возможные явления
в пределах пропорций момента инерции предмета, к которому
оно
... ... тепловые
явления
обусловлены механическим движением материальных частиц. В труде «Опыт теории
упругости воздуха» он
... о работе сил разной физической
природы. Для вечеров на темы «Молекулярная
физика
» и «Основы электродинамики... Опытное обоснование основных положений МКТ: Молекулярно-кинетическая теория
- учение о строении и свойствах вещества, использующее представление о существовании атомов и молекул как наименьших частиц химического вещества. В основе МКТ лежат три строго доказанных с помощью опытов утверждения: Вещество состоит из частиц - атомов и молекул, между которыми существуют промежутки;
Эти частицы находятся в хаотическом движении, на скорость которого влияет температура;
Частицы взаимодействуют друг с другом.
То, что вещество действительно состоит из молекул, можно доказать, определив их размеры. Капля масла расплывается по поверхности воды, образуя слой, толщина которого равна диаметру молекулы. Капля объемом 1 мм 3 не может расплыться больше, чем на 0,6 м 2: Существуют также другие способы доказательства существования молекул, но перечислять их нет необходимости: современные приборы (электронный микроскоп, ионный проектор) позволяют видеть отдельные атомы и молекулы. Силы взаимодействия молекул
. а) взаимодействие имеет электромагнитный характер; б) силы короткодействующие, обнаруживаются на расстояниях, сопоставимых с размерами молекул; в) существует такое расстояние, когда силы притяжения и отталкивания равны (R 0), если R>R 0 , тогда преобладают силы притяжения, если R Действие сил молекулярного притяжения обнаруживается в опыте со свинцовыми цилиндрами, слипающимися после очистки их поверхностей. Молекулы и атомы в твердом теле
совершают беспорядочные колебания относительно положений, в которых силы притяжения и отталкивания со стороны соседних атомов уравновешены. В жидкости
молекулы не только колеблются около положения равновесия, но и совершают перескоки из одного положения равновесия в соседнее, эти перескоки молекул являются причиной текучести жидкости, ее способности принимать форму сосуда. В газах
обычно расстояния между атомами и молекулами в среднем значительно больше размеров молекул; силы отталкивания на больших расстояниях не действуют, поэтому газы легко сжимаются; практически отсутствуют между молекулами газа и силы притяжения, поэтому газы обладают свойством неограниченно расширяться. Масса и размер молекул. Постоянная Авогадро: Любое вещество состоит из частиц, поэтому количество вещества
принято считать пропорциональным числу частиц. Единицей количества вещества является моль
. Моль
равен количеству вещества системы, содержащей столько же частиц, сколько содержится атомов в 0,012 кг углерода. Отношение числа молекул к количеству вещества называется постоянной Авогадро:
Постоянная Авогадро равна. Она показывает, сколько атомов или молекул содержится в одном моле вещества. Количество вещества можно найти как отношение числа атомов или молекул вещества к постоянной Авогадро: Молярной массой
называется величина, равная отношению массы вещества к количеству вещества: Молярную массу можно выразить через массу молекулы: Для определения массы молекул
нужно разделить массу вещества на число молекул в нем: Броуновское движение: Броуновское движение
- тепловое движение взвешенных в газе или жидкости частиц. Английский ботаник Роберт Броун (1773 - 1858) в 1827 году обнаружил беспорядочное движение видимых в микроскоп твердых частиц, находящихся в жидкости. Это явление было названо броуновским движением. Это движение не прекращается; с увеличением температуры его интенсивность растет. Броуновское движение - результат флуктуации давления (заметного отклонения от средней величины). Причина броуновского движения частицы заключается в том, что удары молекул жидкости о частицу не компенсируют друг друга. Идеальный газ: У разреженного газа расстояние между молекулами во много раз превышает их размеры. В этом случае взаимодействие между молекулами пренебрежимо мало и кинетическая энергия молекул много больше потенциальной энергии их взаимодействия. Для объяснения свойств вещества в газообразном состоянии вместо реального газа используется его физическая модель - идеальный газ. В модели предполагается: расстояние между молекулами чуть больше их диаметра; молекулы - упругие шарики; между молекулами не действуют силы притяжения; при соударении молекул друг с другом и со стенками сосуда действуют силы отталкивают; движения молекул подчиняется законам механики. Основное уравнение МКТ идеального газа: Основное уравнение МКТ позволяет вычислить давление газа, если известны масса молекулы, среднее значение квадрата скорости и концентрация молекул. Давление идеального газа
заключается в том, что молекулы при столкновениях со стенками сосуда взаимодействуют с ними по законам механики как упругие тела. При столкновении молекулы со стенкой сосуда проекция скорости v x вектора скорости на ось OX, перпендикулярную стенке, изменяет свой знак на противоположный, но остается постоянной по модулю. Поэтому в результате столкновений молекулы со стенкой проекция ее импульса на ось OX изменяется от mv 1x =-mv x до mv 2x =mv x . Изменение импульса молекулы при столкновении со стенкой вызывает сила F 1 , действующая на нее со стороны стенки. Изменение импульса молекулы равно импульсу этой силы: Во время столкновения, согласно третьему закону Ньютона, молекула действует на стенку с силой F 2 , равной по модулю силе F 1 и направленной противоположно. Молекул много, и каждая передает стенке при столкновении такой же импульс. За секунду они передают импульс, где z - число столкновений всех молекул со стенкой, которое пропорционально концентрации молекул в газе, скорости молекул и площади поверхности стенки: . К стенке движется только половина молекул, остальные движутся в обратную сторону: . Тогда полный импульс, переданный стенке за 1 секунду: . Согласно второму закону Ньютона изменение импульса тела за единицу времени равно действующей на него силе: Учитывая, что не все молекулы имеют одинаковую скорость, сила, действующая на стенку будет пропорциональна среднему квадрату скорости. Так как молекулы движутся во всех направлениях, средние значения квадратов проекций скорости равны. Следовательно, средний квадрат проекции скорости: ; . Тогда давление газа на стенку сосуда равно: Основное уравнение МКТ. Обозначив среднее значение кинетической энергии поступательного движения молекул идеального газа: Получим Температура и ее измерение: Основное уравнение МКТ для идеального газа устанавливает связь легко измеряемого макроскопического параметра - давления - с такими микроскопическими параметрами газа, как средняя кинетическая энергия и концентрация молекул. Но, измерив только давление, мы не можем узнать ни среднее значение кинетической энергии молекул в отдельности, ни их концентрацию. Следовательно, для нахождения микроскопических параметров газа нужны измерения еще какой-то физической величины, связанной со средней кинетической энергией молекул. Такой величиной является температура
. Любое макроскопическое тело или группа макроскопических тел при неизменных внешних условиях самопроизвольно переходит в состояние теплового равновесия. Тепловое равновесие -
это такое состояние, при котором все макроскопические параметры сколь угодно долго остаются неизменными. Температура характеризует состояние теплового равновесия системы тел: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру
. Для измерения температуры можно воспользоваться изменением любой макроскопической величины в зависимости от температуры: объема, давления, электрического сопротивления и т.д. Чаще всего на практике используют зависимость объема жидкости (ртути или спирта) от температуры. При градуировке термометра обычно за начало отсчета (0) принимают температуру тающего льда; второй постоянной точкой (100) считают температуру кипения воды при нормальном атмосферном давлении (шкала Цельсия). Так как различные жидкости расширяются при нагревании неодинаково, то установленная таким образом шкала будет до некоторой степени зависеть от свойств данной жидкости. Конечно, 0 и 100?С будут совпадать у всех термометров, но 50?С совпадать не будут. В отличие от жидкостей все разреженные газы расширяются при нагревании одинаково и одинаково меняют свое давление при изменении температуры. Поэтому в физике для установления рациональной температурной шкалы используют изменение давления определенного количества разреженного газа при постоянном объеме или изменение объема газа при постоянном давлении. Такую шкалу иногда называют идеальной газовой шкалой температур
. При тепловом равновесии средняя кинетическая энергия поступательного движения молекул всех газов одинакова. Давление прямо пропорционально средней кинетической энергии поступательного движения молекул: . При тепловом равновесии, если давление газа данной массы и его объем фиксированы, средняя кинетическая энергия молекул газа должна иметь строго определенное значение, как и температура.Т. к. , то, или. Обозначим. Величина растет с повышением температуры и ни от чего, кроме температуры не зависит. Следовательно, ее можно считать естественной мерой температуры. Абсолютная температурная шкала: Будем считать величину, измеряемую в энергетических единицах, прямо пропорциональной температуре, выражаемой в градусах: , где - коэффициент пропорциональности. Коэффициент, в честь австрийского физика Л. Больцмана называется постоянной Больцмана.
Следовательно, . Температура, определяемая этой формулой, не может быть отрицательной. Следовательно, наименьшим возможным значением температуры является 0, если давление или объем равны нулю. Предельную температуру, при которой давление идеального газа обращается в нуль при фиксированном объеме или объем идеального газа стремится к нулю при неизменном давлении, называют абсолютным нулем температуры
. Английский ученый У. Кельвин ввел абсолютную шкалу температур. Нулевая температура по шкале Кельвина соответствует абсолютному нулю, а каждая единица температуры по этой шкале равна градусу по шкале Цельсия. Единица абсолютной температуры в СИ называется Кельвином:
. Следовательно, абсолютная температура есть мера средней кинетической энергии движения молекул.
Скорость молекул газа: Зная абсолютную температуру, можно найти среднюю кинетическую энергию молекул газа, а, следовательно, и средний квадрат их скорости. Квадратный корень из этой величины называется средней квадратичной скоростью
: Опыты по определению скоростей молекул доказали справедливость этой формулы. Одни из опытов был предложен О. Штерном в 1920 году. Уравнение состояния идеального газа (уравнение Менделеева - Клапейрона). Универсальная газовая постоянная: На основе зависимости давления газа от концентрации его молекул и температуры можно получить уравнение, связывающее все три макроскопических параметра: давление, объем и температуру - характеризующие состояние данной массы достаточно разреженного газа. Это уравнение называют уравнением состояния идеального газа. Где - универсальная газовая постоянная для данной массы газа, следовательно Уравнение Клапейрона. Изотермический, изохорный и изобарный процессы: Количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра называют газовыми законами. А процессы, протекающие при неизменном значении одного из параметров, - изопроцессами. Изотермический процесс
- процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре. Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется.
- закон Бойля - Мариотта. Изохорный процесс
- процесс изменения состояния термодинамической системы макроскопических тел при постоянном объеме. Для газа данной массы отношение давления к температуре постоянно, если объем газа не меняется
. - закон Шарля. Изобарный процесс
- процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении. Для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется
. - закон Гей-Люссака. Внутренняя энергия: Внутренняя энергия макроскопического тела равна сумме кинетических энергий беспорядочного движения всех молекул (или атомов) относительно центров масс тела и потенциальных энергий взаимодействия всех молекул друг с другом (но не с молекулами других тел).
При любых процессах в изолированной термодинамической системе внутренняя энергия остается неизменной.

![]()
Алистер кроули. Магия в теории и на практике
Документ
Название программы: Образовательная программа кружка: «Юный физик» п Возраст учащихся: с 10 лет Срок реализации: 1 год Казаков Владимир Геннадьевич
Образовательная программа
![]()
![]()
![]()
![]()
![]()