Електролити Не само металите и полупроводниците са проводници на електрически ток. Електрическият ток се осъществява от разтвори на много вещества във вода. Опитът показва, че чистата вода не води електрически ток, тоест в него няма свободни носители на електрически заряди. Кристалите на трапезната сол и натриевия хлорид не провеждат електричество. Не само металите и полупроводниците са проводници на електрически ток. Електрическият ток се осъществява от разтвори на много вещества във вода. Както показва опитът, чистата вода не провежда електрически ток, тоест в нея няма свободни носители на електрически заряди. Кристалите на трапезната сол и натриевия хлорид не провеждат електричество. Разтворът на натриев хлорид обаче е добър проводник на електрически ток. Разтворът на натриев хлорид обаче е добър проводник на електрически ток. Разтвори на соли, киселини и основи, които могат да провеждат електрически ток, се наричат електролити. Разтвори на соли, киселини и основи, които могат да провеждат електрически ток, се наричат електролити.

Електролиза Преминаването на електрически ток през електролит е задължително придружено от отделяне на вещество в твърдо или газообразно състояние върху повърхността на електродите. Освобождаването на веществото върху електродите показва, че в електролитите електрически зарядитранспортират заредени атоми на материята - йони. Този процес се нарича електролиза. Преминаването на електрически ток през електролит е задължително придружено от отделяне на вещество в твърдо или газообразно състояние върху повърхността на електродите. Освобождаването на вещество върху електродите показва, че в електролитите електрическите заряди се носят от заредени атоми на веществото - йони. Този процес се нарича електролиза.

Законът за електролизата Майкъл Фарадей, въз основа на експерименти с различни електролити, установи, че по време на електролиза масата m на веществото, освободено върху електрода, е пропорционална на заряда q, преминал през електролита, или силата на тока I и времето t на преминаване на тока : Майкъл Фарадей, въз основа на експерименти с различни електролити, установи, че по време на електролиза масата m на веществото, освободено върху електрода, е пропорционална на заряда q, преминал през електролита, или силата на тока I и времето t на преминаване на тока : m=kq= kIt. Това уравнение се нарича закон на електролизата. Коефициентът k, в зависимост от отделеното вещество, се нарича електрохимичен еквивалент на веществото. Това уравнение се нарича закон на електролизата. Коефициентът k, в зависимост от отделеното вещество, се нарича електрохимичен еквивалент на веществото.

Проводимост на електролитите Проводимостта на течните електролити се обяснява с факта, че когато се разтворят във вода, неутралните молекули на соли, киселини и основи се разпадат на отрицателни и положителни йони. Проводимостта на течните електролити се обяснява с факта, че при разтваряне във вода неутралните молекули на соли, киселини и основи се разпадат на отрицателни и положителни йони. В електрическо поле йоните се движат и създават електрически ток. В електрическо поле йоните се движат и създават електрически ток.



Физическо състояниеелектролити Има не само течни, но и твърди електролити. Пример за твърд електролит е стъклото. Стъклото съдържа положителни и отрицателни йони. В твърдото си състояние стъклото не провежда електричество, тъй като йоните не могат да се придвижват твърдо тяло. Има не само течни, но и твърди електролити. Пример за твърд електролит е стъклото. Стъклото съдържа положителни и отрицателни йони. В твърдо състояние стъклото не провежда електричество, тъй като йоните не могат да се движат в твърдото вещество. Когато стъклото се нагрява, йоните могат да се движат под въздействието на електрическо полеи стъклото става проводник. Когато стъклото се нагрява, йоните могат да се движат под въздействието на електрическо поле и стъклото става проводник.

Приложение на електролизата Явлението електролиза се използва на практика за получаване на много метали от разтвор на сол. Явлението електролиза се използва на практика за получаване на много метали от разтвор на сол. Електролизата се използва за защита срещу окисление или за декорация. различни предметии машинни части с тънки слоеве от метали като хром, никел, сребро, злато. Използвайки електролиза за защита срещу окисление или за декорация, различни предмети и машинни части се покриват с тънки слоеве метали като хром, никел, сребро и злато.

Назад Напред
внимание! Визуализациите на слайдовете са само за информационни цели и може да не представят всички функции на презентацията. Ако се интересувате тази работа, моля, изтеглете пълната версия.
Цел на урокас помощта на презентацията е формирането на понятията „електролити, електрическа дисоциация, степен на дисоциация“; разглеждане на явлението електролиза, извеждане на закона на Фарадей; приложение на електролизата в технологиите.
Тема на урока: „Електрически ток в течности“.
Цел на урока:
1. А) Въведете дефиниции на понятията:
Електролити;
Електрическа дисоциация;
Степен на дисоциация.
Б) Помислете за явлението електролиза. Закон на Фарадей.
2. Развитие на умения за наблюдение, разширяване на кръгозора.
3. Възпитаване на интерес към изучавания предмет.
Оборудване: мултимедиен проектор, компютър, интерактивна дъска, презентация (Приложение 1).
Тип урок: урок за изучаване на нов материал.
Напредък на урока
I. Актуализиране на знанията (съобщаване на темата, целта и задачите на урока). (Слайд 2, 3)
II. Учене на нов материал.
а)Въпроси:
1) Кои тела са проводници на електрически ток?
2) Каква проводимост имат течните метали?
В разтвори и стопилки на електролити (соли, киселини и основи) преносът на заряд под въздействието на електрическо поле се извършва от йони „+“ и „-“, които се движат в противоположни посоки.
Електролитите са вещества, чиито разтвори и стопилки имат йонна проводимост. (Слайд 4)
Въпрос: Защо, когато се разтвори във вода, твърдият полярен диелектрик става проводник на електрически ток? (Слайд 5)
За да отговорите на този въпрос, разгледайте процеса на разтваряне на CuCl 2 във вода.
(Обяснение: В такъв кристал + Cu йони и – Cl йони са разположени в местата на проста кубична решетка.
Когато кристал CuCl 2 се потопи във вода, отрицателните ОН полюси на водните молекули започват да се привличат от силите на Кулон към положителните Cu йони и водните молекули се обръщат към отрицателните Cl йони с техния положителен Н полюс.
Преодолявайки силите на привличане между Cu + и Cl - йони, електрическото поле на полярните водни молекули премахва йони от повърхността на кристала)
Заключение: в разтвора се появяват свободни носители - Cu + и Cl -, които са заобиколени от полярни водни молекули.
Това явление се нарича електрическа дисоциация (от латинската дума - разделяне). (Слайд 6)
Електрическа дисоциация– разделяне на електролитните молекули на положителни и отрицателни йони под въздействието на разтворител.
Въпрос: От какви параметри зависи разтворимостта на дадено вещество? (В зависимост от температурата)
Степен на дисоциация– отношението на броя на дисоциираните на йони молекули към общия брой молекули на дадено вещество.
Рекомбинация– процесът на комбиниране на йони с различни знаци в неутрални молекули.
Б)При йонната проводимост преминаването на ток е свързано с преноса на материя. При електродите се отделят вещества, които изграждат електролитите. (Слайд 7)
Когато в електролита се създаде външно електрическо поле, възниква насочено движение на йони. Медният хлорид във воден разтвор се разпада на медни и хлорни йони.
“+” медните йони (катиони) се привличат към “-” електрода (катода), а “-” хлорните йони (аниони) се привличат към “+” електрода (анода).
Достигайки катода, медните йони се неутрализират от излишните електрони, които се намират на катода - в резултат се образуват неутрални медни атоми, които се отлагат върху катода.
Хлорните йони отдават един излишен електрон на анода, превръщайки се в неутрални хлорни атоми, комбинирайки се по двойки, хлорните атоми образуват хлорна молекула, която се освобождава на анода под формата на газови мехурчета.
Процесът на освобождаване на вещество върху електродите, свързан с редокс реакцията - наречена електролиза. (Слайд 8)
(Феноменът електролиза е открит през 1800 г. от английските физици У. Никълс и А. Карлайл)
Какво определя масата на веществото, освободено върху електродите за определено време?
Закон за електролизата (закон на Фарадей). (Слайд 9 (Съобщение на ученика)
Изследвания в областта на електричеството, магнетизма, магнитооптиката, електрохимията. открива явлението електромагнитна индукция и установява нейните закони. Експериментите за преминаване на ток през разтвори на киселини, соли и основи са резултат от откриването на законите на електролизата (законите на Фарадей). Той въвежда понятието поле и използва термина „магнитно поле“. За първи път получава хлор в течно състояние, след това сероводород, въглероден диоксид, амоняк и азотен диоксид. . Положи началото на изследването на естествения каучук. Показа възможността за фотохимично хлориране на етилен. Въвежда понятието диелектрична константа. Името на Фарадей влезе в системата от електрически единици като единица за електрически капацитет.
Въпроси (Слайд 10)
1. Как да намерите масата на веществото, освободено върху електродите?

2. Как да намерим масата на един йон?

3. Как да намерим броя на йоните?

4. Как да намерим заряда на един йон? (n – валентност)


Масата на веществото, освободено върху електрода по време на преминаването на електрически ток, е право пропорционална на силата на тока и времето. (Това твърдение е получено през 1833 г. от английския физик Майкъл Фарадей и се нарича Закон на Фарадей).
K – електрохимичен еквивалент на веществото (в зависимост от моларна масавещество "M" и валентност "n")
Phys. значението на k е числено равно на масата на веществото, освободено върху електрода, когато заряд от 1 C преминава през електролита.
N a *e=F – Константата на Фарадей. (Слайд 12)
Физическото значение на F е числено равно на заряда, който трябва да премине през разтвора на електролита, за да се освободи 1 мол едновалентно вещество върху електрода.
IN)Приложение на електролизата в технологиите (съобщение на ученика). (Слайд 13)
- Галванопластиката е декоративно или антикорозионно покритие на метални изделия с тънък слой от друг метал (никелиране, хромиране, медно покритие, позлатяване).
- Галванопластиката е електролитно производство на метални копия и релефни предмети. По този метод са направени фигури за Исакиевския събор в Санкт Петербург.
- Електрометалургия - производство на чисти метали чрез електролиза на разтопени руди (Al, Na, Mg, Be).
- Рафиниране на метали - пречистване на металите от примеси. (Слайд 14–17)
G)Поведение за обобщение на урока.
1. Какви вещества се наричат електролити?
2. Дефинирайте:
електрическа дисоциация;
степен на дисоциация;
рекомбинация.
3. Какъв процес се нарича електролиза? Кой го отвори и кога?
4. Формулирайте закона на Фарадей?
5. Физическо значениеелектрохимичен еквивалент на веществото и константа на Фарадей.
Домашна работа: §§ 122-123, пр. 20 (4, 5). (Слайд 18)
Референции
1. Учебно електронно издание „Интерактивен курс по физика за 7-11 клас”, „Физикон”, 2004г.
2. “Open Physics 1.1”, LLC “Physikon”, 1996-2001, редактиран от професора на MIPT S.M. Козела.
3. „Библиотека с електронни нагледни помагала. Физика 7-11 клас”, ДУ РЦ ЕМТО, „Кирил и Методий”, 2003г.
Слайд 1
Слайд 2

Слайд 3
 Методи на урока Проблемно-диалогичен с използване на информационни и комуникационни технологии, елементи на мозъчна атака, демонстрационни експерименти и подготовка на референтно резюме
Методи на урока Проблемно-диалогичен с използване на информационни и комуникационни технологии, елементи на мозъчна атака, демонстрационни експерименти и подготовка на референтно резюме
Слайд 4
 Математика - построяване на графики, конвертиране на формули, изчисления. Междупредметна комуникация Химия - електролитна дисоциация, електролиза
Математика - построяване на графики, конвертиране на формули, изчисления. Междупредметна комуникация Химия - електролитна дисоциация, електролиза
Слайд 5
 Основни етапи на урока Организационен моментАктуализиране на знанията. Мозъчна атакаМотивация. Демонстрационен опит Постановка на проблема Провокативен диалог. Намиране и решаване на задачата Демонстрационен опит. Интеграция в областта на химията. Водещ диалог Систематизиране и обобщаване на знанията Търсене на информация в Интернет Затвърдяване на знанията Домашна работа
Основни етапи на урока Организационен моментАктуализиране на знанията. Мозъчна атакаМотивация. Демонстрационен опит Постановка на проблема Провокативен диалог. Намиране и решаване на задачата Демонстрационен опит. Интеграция в областта на химията. Водещ диалог Систематизиране и обобщаване на знанията Търсене на информация в Интернет Затвърдяване на знанията Домашна работа
Слайд 6
 Отговорете на въпросите: На какви групи се делят всички вещества според проводимостта на електрическия ток? Дайте примери за най-добрите проводници на електрически ток. Какви частици причиняват ток в металите? Ще се промени ли електрическата проводимост на метала, ако се нагрее? Ще се промени ли електрическата проводимост на метал, ако се разтопи? Какви течности знаете, че провеждат електрически ток, освен разтопените метали?
Отговорете на въпросите: На какви групи се делят всички вещества според проводимостта на електрическия ток? Дайте примери за най-добрите проводници на електрически ток. Какви частици причиняват ток в металите? Ще се промени ли електрическата проводимост на метала, ако се нагрее? Ще се промени ли електрическата проводимост на метал, ако се разтопи? Какви течности знаете, че провеждат електрически ток, освен разтопените метали?
Слайд 7

Слайд 8
 Въпроси за изследване Как съпротивлението на електролита зависи от температурата и геометричните параметри на електролита? Защо чистата вода не провежда, а солевият разтвор провежда електрически ток? Какво причинява електрически ток в солен разтвор?
Въпроси за изследване Как съпротивлението на електролита зависи от температурата и геометричните параметри на електролита? Защо чистата вода не провежда, а солевият разтвор провежда електрически ток? Какво причинява електрически ток в солен разтвор?
Слайд 9
 Течности, които провеждат добре електричество Електролити Солни разтвори Алкални разтвори Киселинни разтвори
Течности, които провеждат добре електричество Електролити Солни разтвори Алкални разтвори Киселинни разтвори
Слайд 10
 Когато противоположно заредените електроди се спускат в разтвор на меден сулфат, възниква насочено движение на йони. Медният сулфат във воден разтвор се разпада на медни йони и киселинен остатък.
Когато противоположно заредените електроди се спускат в разтвор на меден сулфат, възниква насочено движение на йони. Медният сулфат във воден разтвор се разпада на медни йони и киселинен остатък.
Слайд 11

Слайд 12
 Процесът на освобождаване на вещества, които изграждат електролита върху електродите, когато електрически ток протича през неговия разтвор (или стопилка), се нарича електролиза и има широк спектър от приложения. техническо приложение. Къде се използва електролизата? Трябва да подготвите отговор на този въпрос, като използвате Интернет.
Процесът на освобождаване на вещества, които изграждат електролита върху електродите, когато електрически ток протича през неговия разтвор (или стопилка), се нарича електролиза и има широк спектър от приложения. техническо приложение. Къде се използва електролизата? Трябва да подготвите отговор на този въпрос, като използвате Интернет.
Слайд 13
 Какво определя масата на веществото, отложено върху електрода? Електролитната дисоциация е разделянето на молекулите на положителни и отрицателни йони под действието на разтворител. Когато йони с различни знаци се съберат, е възможна тяхната рекомбинация (комбинация) в една молекула
Какво определя масата на веществото, отложено върху електрода? Електролитната дисоциация е разделянето на молекулите на положителни и отрицателни йони под действието на разтворител. Когато йони с различни знаци се съберат, е възможна тяхната рекомбинация (комбинация) в една молекула
Слайд 14
 Майкъл Фарадей - велик английски учен, творец общо обучениеза електромагнитните явления Майкъл Фарадей експериментално установява закона за електролизата през 1833 г. Той въвежда вече общоприетите термини: електрод, катод, анод, електролит, електролиза.
Майкъл Фарадей - велик английски учен, творец общо обучениеза електромагнитните явления Майкъл Фарадей експериментално установява закона за електролизата през 1833 г. Той въвежда вече общоприетите термини: електрод, катод, анод, електролит, електролиза.
Слайд 15
 Изпълнение тестови задачи I. Посочете грешния отговор 1. Течностите могат да бъдат диелектрици, проводници, полупроводници. 2. Всички течности са електролити. 3. Разтвори на соли, основи, киселини и стопени соли, които имат електрическа проводимост, се наричат електролити. II. Електролитна дисоциациянаречен... III. Рекомбинацията се нарича... IV. Електролизата се нарича... 1. процес на отделяне на вещества, които изграждат електролита върху електродите. 2. комбиниране на йони с различни знаци в неутрални молекули. 3. образуването на положителни и отрицателни йони, когато веществата се разтварят в течност. V. С повишаване на температурата на електролита неговата електропроводимост... 1. нараства. 2. намалява. 3. не се променя.
Изпълнение тестови задачи I. Посочете грешния отговор 1. Течностите могат да бъдат диелектрици, проводници, полупроводници. 2. Всички течности са електролити. 3. Разтвори на соли, основи, киселини и стопени соли, които имат електрическа проводимост, се наричат електролити. II. Електролитна дисоциациянаречен... III. Рекомбинацията се нарича... IV. Електролизата се нарича... 1. процес на отделяне на вещества, които изграждат електролита върху електродите. 2. комбиниране на йони с различни знаци в неутрални молекули. 3. образуването на положителни и отрицателни йони, когато веществата се разтварят в течност. V. С повишаване на температурата на електролита неговата електропроводимост... 1. нараства. 2. намалява. 3. не се променя.

Въз основа на техните електрически свойства всички течности могат да бъдат разделени на 2 групи:
ТЕЧНОСТИ
ПРОВОДЯЩ
НЕПРОВОДИМ
Те включват дестилирана вода, алкохол, минерално масло
Те включват разтвори (най-често водни) и стопилки на соли, киселини и основи

Електролитна дисоциация
Електролитната дисоциация е разграждането на електролитните молекули на положителни и отрицателни йони.
Степента на дисоциация е делът на молекулите в разтворено вещество, които са се разпаднали на йони. Зависи от:
- температура
- концентрация на разтвора
- електрически свойства на разтворителя
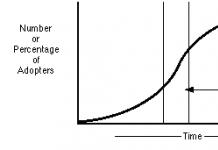
С повишаване на температурата степента на дисоциация се увеличава и следователно се увеличава концентрацията на положително и отрицателно заредени йони.

Йонна рекомбинация
Заедно с дисоциацията в електролита, процесът на редукция на йони в неутрални молекули може едновременно да възникне. Когато йони с различни знаци се срещнат, те отново могат да се комбинират в неутрални молекули - рекомбинирайте .
При постоянни условия се установява в разтвора динамично равновесие, при което броят на молекулите, които се разпадат на йони за секунда, е равен на броя на двойките йони, които се рекомбинират в неутрални молекули по едно и също време.

Йонна проводимост
Носители на заряд във водни разтвори или стопилки на електролити са положително и отрицателно заредени йони.
Ако се включи съд с електролитен разтвор електрическа верига, тогава отрицателните йони ще започнат да се движат към положителния електрод - анода, а положителните йони - към отрицателния - катод. В резултат на това ще се установи електрически ток. Тъй като преносът на заряд във водни разтвори или електролитни стопилки се извършва от йони, такава проводимост се нарича йонни .

Електролиза
При йонната проводимост преминаването на ток е свързано с преноса на материя. При електродите се отделят веществата, които изграждат електролитите. На анода отрицателно заредените йони се отказват от допълнителните си електрони (в химията това се нарича реакция на окисление), а на катода положителните йони получават липсващите електрони ( реакция на възстановяване). Процесът на освобождаване на вещество в електрода, свързан с редокс реакции, се нарича електролиза .

Приложения на електролизата
Електролизата се използва широко в технологиите за различни цели. Електролитно покрийте повърхността на един метал с тънък слой от друг ( никелиране, хромиране, медно покритиеи т.н.). Това трайно покритие предпазва повърхността от корозия.
Ако осигурите добро отлепване на електролитното покритие от повърхността, върху която е отложен металът (това се постига например чрез нанасяне на графит върху повърхността), тогава можете да получите копие от релефната повърхност.
Процесът на получаване на отлепващи се покрития - електротипия- е разработен от руския учен Б. С. Якоби (1801-1874), който през 1836 г. използва този метод, за да направи кухи фигури за Исакиевския събор в Санкт Петербург.
Друг начин за използване на електролиза е получаването на чист метал от примеси. Електролизата се използва за направата на печатни платки за различни цифрови устройства.

- (снимка) (снимка) (снимка)
- Физика. 10. клас: учебник. за общо образование институции: основни и профилни. нива / Г. Я. Мякишев, Б. Б. Буховцев, Н. Н. Соцки
- http://class-fizika.narod.ru/10_12.htm
- http://www.nado5.ru/e-book/ehlektricheskii-tok-v-zhidkostyakh
- http://rza.org.ua/glossary/image-246.html(снимка)
- http://www.electrofaq.com/ETMbook/CONDUCT/CON5A.HTM(снимка)
- http://lib.convdocs.org/docs/index-280240.html(снимка)