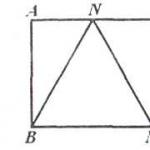
За да изпълните задачи 1–3, използвайте следните серии от химични елементи. Отговорът в задачи 1–3 е поредица от числа, под които са посочени химичните елементи на даден ред.
- 1. С
- 2. На
- 3. Ал
- 4. Си
- 5. Mg
Задача No1
Определете кои атоми от елементите, посочени в серията, съдържат един несдвоен електрон в основно състояние.
Отговор: 23
Обяснение:
Нека запишем електронната формула за всеки от посочените химични елементи и изобразим електронно-графичната формула на последното електронно ниво:
1) S: 1s 2 2s 2 2p 6 3s 2 3p 4
2) Na: 1s 2 2s 2 2p 6 3s 1
3) Al: 1s 2 2s 2 2p 6 3s 2 3p 1
4) Si: 1s 2 2s 2 2p 6 3s 2 3p 2
5) Mg: 1s 2 2s 2 2p 6 3s 2
Задача No2
От химичните елементи, посочени в поредицата, изберете три метални елемента. Подредете избраните елементи в ред на увеличаване на редуциращите свойства.
Запишете номерата на избраните елементи в необходимата последователност в полето за отговор.
Отговор: 352
Обяснение:
В основните подгрупи на периодичната таблица металите са разположени под диагонала бор-астат, както и във второстепенни подгрупи. Така металите от този списък включват Na, Al и Mg.
Металните и следователно редуциращите свойства на елементите се увеличават, когато се движат наляво по периода и надолу по подгрупата. Така металните свойства на изброените по-горе метали нарастват в реда на Al, Mg, Na
Задача No3
Измежду елементите, посочени в серията, изберете два елемента, които, когато се комбинират с кислород, проявяват степен на окисление +4.
Запишете номерата на избраните елементи в полето за отговор.
Отговор: 14
Обяснение:
Основните степени на окисление на елементите от представения списък в сложни вещества:
Сяра - "-2", "+4" и "+6"
Натрий Na – „+1“ (единичен)
Алуминий Al – “+3” (единичен)
Silicon Si – “-4”, “+4”
Магнезий Mg – “+2” (единичен)
Задача No4
От предложения списък с вещества изберете две вещества, в които има йонна химична връзка.
- 1. KCl
- 2. КНО 3
- 3. H 3 BO 3
- 4.H2SO4
- 5.PCl 3
Отговор: 12
Обяснение:
В по-голямата част от случаите наличието на йонен тип връзка в съединение може да се определи от факта, че неговите структурни единици включват едновременно атоми на типичен метал и атоми на неметал.
Въз основа на този критерий йонният тип връзка се среща в съединенията KCl и KNO 3.
В допълнение към горната характеристика, наличието на йонна връзка в съединение може да се каже, ако неговата структурна единица съдържа амониев катион (NH 4 +) или неговите органични аналози - алкиламониеви катиони RNH 3 +, диалкиламониев R 2 NH 2 +, триалкиламониеви катиони R 3 NH + и тетраалкиламониев R 4 N +, където R е някакъв въглеводороден радикал. Например, йонният тип връзка възниква в съединението (CH 3) 4 NCl между катиона (CH 3) 4 + и хлоридния йон Cl −.
Задача No5
Установете съответствие между формулата на дадено вещество и класа/групата, към която принадлежи това вещество: за всяка позиция, обозначена с буква, изберете съответната позиция, обозначена с цифра.
| А | б | IN |
Отговор: 241
Обяснение:
N 2 O 3 е неметален оксид. Всички неметални оксиди с изключение на N 2 O, NO, SiO и CO са киселинни.
Al 2 O 3 е метален оксид в степен на окисление +3. Металните оксиди в степен на окисление +3, +4, както и BeO, ZnO, SnO и PbO са амфотерни.
HClO 4 е типичен представител на киселините, т.к при дисоциация във воден разтвор от катиони се образуват само H + катиони:
HClO 4 = H + + ClO 4 -
Задача No6
От предложения списък с вещества изберете две вещества, с всяко от които взаимодейства цинкът.
1) азотна киселина (разтвор)
2) железен (II) хидроксид
3) магнезиев сулфат (разтвор)
4) натриев хидроксид (разтвор)
5) алуминиев хлорид (разтвор)
Запишете номерата на избраните вещества в полето за отговор.
Отговор: 14
Обяснение:
1) Азотната киселина е силен окислител и реагира с всички метали с изключение на платината и златото.
2) Железният хидроксид (II) е неразтворима основа. Металите изобщо не реагират с неразтворими хидроксиди, а само три метала реагират с разтворими (алкали) - Be, Zn, Al.
3) Магнезиевият сулфат е сол на по-активен метал от цинка и следователно реакцията не протича.
4) Натриев хидроксид - алкален (разтворим метален хидроксид). Само Be, Zn, Al работят с метални основи.
5) AlCl 3 – сол на метал, по-активен от цинка, т.е. реакцията е невъзможна.
Задача No7
От предложения списък с вещества изберете два оксида, които реагират с вода.
- 1.BaO
- 2. CuO
- 3.НЕ
- 4. SO 3
- 5. PbO2
Запишете номерата на избраните вещества в полето за отговор.
Отговор: 14
Обяснение:
От оксидите само оксиди на алкални и алкалоземни метали, както и всички киселинни оксиди, с изключение на SiO 2, реагират с вода.
Следователно варианти на отговор 1 и 4 са подходящи:
BaO + H 2 O = Ba(OH) 2
SO 3 + H 2 O = H 2 SO 4
Задача No8
1) бромоводород
3) натриев нитрат
4) серен оксид (IV)
5) алуминиев хлорид
Запишете избраните числа в таблицата под съответните букви.
Отговор: 52
Обяснение:
Единствените соли сред тези вещества са натриев нитрат и алуминиев хлорид. Всички нитрати, както и натриевите соли, са разтворими и следователно натриевият нитрат не може да образува утайка по принцип с нито един от реагентите. Следователно солта X може да бъде само алуминиев хлорид.
Често срещана грешка сред полагащите Единния държавен изпит по химия е неразбирането, че във воден разтвор амонякът образува слаба основа - амониев хидроксид поради реакцията:
NH3 + H2O<=>NH4OH
В тази връзка воден разтвор на амоняк дава утайка, когато се смеси с разтвори на метални соли, които образуват неразтворими хидроксиди:
3NH3 + 3H2O + AlCl3 = Al(OH)3 + 3NH4Cl
Задача No9
В дадена трансформационна схема
Cu х> CuCl 2 Y> CuI
веществата X и Y са:
- 1. AgI
- 2. аз 2
- 3.Cl2
- 4.HCl
- 5.КИ
Отговор: 35
Обяснение:
Медта е метал, разположен в серията активност вдясно от водорода, т.е. не реагира с киселини (с изключение на H 2 SO 4 (конц.) и HNO 3). По този начин, образуването на меден (II) хлорид е възможно в нашия случай само чрез реакция с хлор:
Cu + Cl 2 = CuCl 2
Йодидните йони (I -) не могат да съществуват съвместно в един и същи разтвор с двувалентни медни йони, т.к се окисляват от тях:
Cu 2+ + 3I - = CuI + I 2
Задача No10
Установете съответствие между уравнението на реакцията и окисляващото вещество в тази реакция: за всяка позиция, обозначена с буква, изберете съответната позиция, обозначена с цифра.
Отговор: 1433
Обяснение:
Окислителят в реакцията е вещество, което съдържа елемент, който понижава степента на окисление
Задача No11
Установете съответствие между формулата на веществото и реагентите, с всеки от които това вещество може да взаимодейства: за всяка позиция, обозначена с буква, изберете съответната позиция, обозначена с цифра.
Отговор: 1215
Обяснение:
A) Cu(NO 3) 2 + NaOH и Cu(NO 3) 2 + Ba(OH) 2 – подобни взаимодействия. Солта реагира с метален хидроксид, ако изходните вещества са разтворими и продуктите съдържат утайка, газ или леко дисоцииращо вещество. Както за първата, така и за втората реакция са изпълнени и двете изисквания:
Cu(NO 3) 2 + 2NaOH = 2NaNO 3 + Cu(OH) 2 ↓
Cu(NO 3) 2 + Ba(OH) 2 = Na(NO 3) 2 + Cu(OH) 2 ↓
Cu(NO 3) 2 + Mg - солта реагира с метал, ако свободният метал е по-активен от това, което е включено в солта. Магнезият в серията активност се намира вляво от медта, което показва неговата по-голяма активност, следователно реакцията протича:
Cu(NO 3) 2 + Mg = Mg(NO 3) 2 + Cu
B) Al(OH) 3 – метален хидроксид в степен на окисление +3. Металните хидроксиди в степен на окисление +3, +4, както и хидроксидите Be(OH) 2 и Zn(OH) 2 като изключение, се класифицират като амфотерни.
По дефиниция амфотерните хидроксиди са тези, които реагират с основи и почти всички разтворими киселини. Поради тази причина веднага можем да заключим, че вариант на отговор 2 е подходящ:
Al(OH) 3 + 3HCl = AlCl 3 + 3H 2 O
Al(OH) 3 + LiOH (разтвор) = Li или Al(OH) 3 + LiOH (разтвор.) =to=> LiAlO 2 + 2H 2 O
2Al(OH) 3 + 3H 2 SO 4 = Al 2 (SO 4) 3 + 6H 2 O
В) ZnCl 2 + NaOH и ZnCl 2 + Ba(OH) 2 – взаимодействие от типа „сол + метален хидроксид“. Обяснението е дадено в параграф А.
ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
ZnCl 2 + Ba(OH) 2 = Zn(OH) 2 + BaCl 2
Трябва да се отбележи, че с излишък от NaOH и Ba (OH) 2:
ZnCl2 + 4NaOH = Na2 + 2NaCl
ZnCl 2 + 2Ba(OH) 2 = Ba + BaCl 2
D) Br 2, O 2 са силни окислители. Единствените метали, които не реагират, са среброто, платината и златото:
Cu + Br 2 t° > CuBr 2
2Cu + O2 t° >2CuO
HNO 3 е киселина със силни окислителни свойства, т.к окислява не с водородни катиони, а с киселинообразуващ елемент - азот N +5. Реагира с всички метали с изключение на платина и злато:
4HNO 3(конц.) + Cu = Cu(NO 3)2 + 2NO 2 + 2H 2 O
8HNO 3(разр.) + 3Cu = 3Cu(NO 3) 2 + 2NO + 4H 2 O
Задача No12
Установете съответствие между общата формула на хомоложна серия и името на вещество, принадлежащо към тази серия: за всяка позиция, обозначена с буква, изберете съответната позиция, обозначена с цифра.
Запишете избраните числа в таблицата под съответните букви.
| А | б | IN | |
Отговор: 231
Обяснение:
Задача No13
От предложения списък с вещества изберете две вещества, които са изомери на циклопентан.
1) 2-метилбутан
2) 1,2-диметилциклопропан
3) пентен-2
4) хексен-2
5) циклопентен
Запишете номерата на избраните вещества в полето за отговор.
Отговор: 23
Обяснение:
Циклопентанът има молекулна формула C5H10. Нека напишем структурните и молекулните формули на веществата, посочени в условието
Име на веществото |
Структурна формула |
Молекулярна формула |
циклопентан |
C5H10 |
|
2-метилбутан |
||
1,2-диметилциклопропан |
C5H10 |
|
C5H10 |
||
циклопентен |
Задача No14
От предложения списък с вещества изберете две вещества, всяко от които реагира с разтвор на калиев перманганат.
1) метилбензен
2) циклохексан
3) метилпропан
Запишете номерата на избраните вещества в полето за отговор.
Отговор: 15
Обяснение:
От въглеводородите, които реагират с воден разтвор на калиев перманганат, са тези, които съдържат C=C или C≡C връзки в структурната си формула, както и хомолози на бензена (с изключение на самия бензен).
Метилбензенът и стиренът са подходящи за този начин.
Задача No15
От предложения списък с вещества изберете две вещества, с които взаимодейства фенолът.
1) солна киселина
2) натриев хидроксид
4) азотна киселина
5) натриев сулфат
Запишете номерата на избраните вещества в полето за отговор.
Отговор: 24
Обяснение:
Фенолът има слаби киселинни свойства, по-изразени от алкохолите. Поради тази причина фенолите, за разлика от алкохолите, реагират с алкали:
C6H5OH + NaOH = C6H5ONa + H2O
Фенолът съдържа в своята молекула хидроксилна група, директно свързана с бензеновия пръстен. Хидрокси групата е ориентиращ агент от първи вид, т.е. улеснява реакциите на заместване в орто и пара позиции:
Задача No16
От предложения списък с вещества изберете две вещества, които се подлагат на хидролиза.
1) глюкоза
2) захароза
3) фруктоза
5) нишесте
Запишете номерата на избраните вещества в полето за отговор.
Отговор: 25
Обяснение:
Всички изброени вещества са въглехидрати. От въглехидратите монозахаридите не се подлагат на хидролиза. Глюкозата, фруктозата и рибозата са монозахариди, захарозата е дизахарид, а нишестето е полизахарид. Следователно захарозата и нишестето от горния списък са обект на хидролиза.
Задача No17
Посочена е следната схема на трансформации на веществото:
1,2-дибромоетан → X → бромоетан → Y → етилформиат
Определете кои от посочените вещества са веществата X и Y.
2) етанал
4) хлороетан
5) ацетилен
Запишете номерата на избраните вещества под съответните букви в таблицата.
Задача No18
Установете съответствие между името на изходното вещество и продукта, който се образува главно, когато това вещество реагира с бром: за всяка позиция, обозначена с буква, изберете съответната позиция, обозначена с цифра.
Запишете избраните числа в таблицата под съответните букви.
| А | б | IN | Ж |
Отговор: 2134
Обяснение:
Заместването при вторичния въглероден атом се извършва в по-голяма степен, отколкото при първичния. По този начин основният продукт от бромирането на пропан е 2-бромопропан, а не 1-бромопропан:
Циклохексанът е циклоалкан с размер на пръстена повече от 4 въглеродни атома. Циклоалканите с размер на пръстена над 4 въглеродни атома, когато взаимодействат с халогени, влизат в реакция на заместване със запазване на цикъла:
Циклопропан и циклобутан - циклоалканите с минимален размер на пръстена за предпочитане претърпяват реакции на присъединяване, придружени от разкъсване на пръстена:
Заместването на водородните атоми при третичния въглероден атом се извършва в по-голяма степен, отколкото при вторичния и първичния. По този начин бромирането на изобутан протича главно както следва:
Задача No19
Установете съответствие между реакционната схема и органичното вещество, което е продукт на тази реакция: за всяка позиция, обозначена с буква, изберете съответната позиция, обозначена с цифра.
Запишете избраните числа в таблицата под съответните букви.
| А | б | IN | Ж |
Отговор: 6134
Обяснение:
Нагряването на алдехиди с прясно утаен меден хидроксид води до окисление на алдехидната група до карбоксилна група:
Алдехидите и кетоните се редуцират от водород в присъствието на никел, платина или паладий до алкохоли:
Първичните и вторичните алкохоли се окисляват от горещ CuO съответно до алдехиди и кетони:
Когато концентрираната сярна киселина реагира с етанол при нагряване, могат да се образуват два различни продукта. При нагряване до температура под 140 °C протича предимно междумолекулна дехидратация с образуването на диетилов етер, а при нагряване над 140 °C настъпва вътрешномолекулна дехидратация, в резултат на което се образува етилен:
Задача No20
От предложения списък с вещества изберете две вещества, чиято реакция на термично разлагане е редокс.
1) алуминиев нитрат
2) калиев бикарбонат
3) алуминиев хидроксид
4) амониев карбонат
5) амониев нитрат
Запишете номерата на избраните вещества в полето за отговор.
Отговор: 15
Обяснение:
Редокс реакциите са тези реакции, при които един или повече химични елементи променят степента си на окисление.
Реакциите на разлагане на абсолютно всички нитрати са окислително-възстановителни реакции. Металните нитрати от Mg до Cu включително се разлагат до метален оксид, азотен диоксид и молекулярен кислород:
Всички метални бикарбонати се разлагат дори при леко нагряване (60 o C) до метален карбонат, въглероден диоксид и вода. В този случай не настъпва промяна в степента на окисление:
Неразтворимите оксиди се разлагат при нагряване. Реакцията не е редокс, защото Нито един химичен елемент не променя степента си на окисление в резултат на това:
Амониевият карбонат се разлага при нагряване на въглероден диоксид, вода и амоняк. Реакцията не е редокс:
Амониевият нитрат се разлага на азотен оксид (I) и вода. Реакцията се отнася до OVR:
Задача No21
От предложения списък изберете две външни влияния, които водят до увеличаване на скоростта на реакция на азот с водород.
1) понижаване на температурата
2) повишаване на налягането в системата
5) използване на инхибитор
Запишете номерата на избраните външни влияния в полето за отговор.
Отговор: 24
Обяснение:
1) понижаване на температурата:
Скоростта на всяка реакция намалява с понижаване на температурата
2) повишаване на налягането в системата:
Повишаването на налягането увеличава скоростта на всяка реакция, в която участва поне едно газообразно вещество.
3) намаляване на концентрацията на водород
Намаляването на концентрацията винаги намалява скоростта на реакцията
4) повишаване на концентрацията на азот
Увеличаването на концентрацията на реагентите винаги увеличава скоростта на реакцията
5) използване на инхибитор
Инхибиторите са вещества, които забавят скоростта на реакцията.
Задача No22
Установете съответствие между формулата на веществото и продуктите от електролизата на воден разтвор на това вещество върху инертни електроди: за всяка позиция, обозначена с буква, изберете съответната позиция, обозначена с цифра.
Запишете избраните числа в таблицата под съответните букви.
| А | б | IN | Ж |
Отговор: 5251
Обяснение:
A) NaBr → Na + + Br -
Na+ катиони и водни молекули се конкурират помежду си за катода.
2H 2 O + 2e - → H 2 + 2OH -
2Cl - -2e → Cl 2
B) Mg(NO 3) 2 → Mg 2+ + 2NO 3 -
Mg 2+ катиони и водни молекули се конкурират помежду си за катода.
Катионите на алкалните метали, както и магнезият и алуминият, не могат да бъдат редуцирани във воден разтвор поради тяхната висока активност. Поради тази причина водните молекули вместо това се редуцират съгласно уравнението:
2H 2 O + 2e - → H 2 + 2OH -
NO 3 - аниони и водни молекули се конкурират помежду си за анода.
2H 2 O - 4e - → O 2 + 4H +
Така че отговор 2 (водород и кислород) е подходящ.
B) AlCl 3 → Al 3+ + 3Cl -
Катионите на алкалните метали, както и магнезият и алуминият, не могат да бъдат редуцирани във воден разтвор поради тяхната висока активност. Поради тази причина водните молекули вместо това се редуцират съгласно уравнението:
2H 2 O + 2e - → H 2 + 2OH -
Cl - аниони и водни молекули се конкурират помежду си за анода.
Анионите, състоящи се от един химичен елемент (с изключение на F -), превъзхождат водните молекули за окисление в анода:
2Cl - -2e → Cl 2
Следователно вариант на отговор 5 (водород и халоген) е подходящ.
D) CuSO 4 → Cu 2+ + SO 4 2-
Металните катиони вдясно от водорода в серията активност се редуцират лесно при условия на воден разтвор:
Cu 2+ + 2e → Cu 0
Киселинните остатъци, съдържащи киселинообразуващ елемент в най-високо състояние на окисление, губят конкуренцията с водните молекули за окисляване на анода:
2H 2 O - 4e - → O 2 + 4H +
Следователно вариант на отговор 1 (кислород и метал) е подходящ.
Задача No23
Установете съответствие между името на солта и средата на водния разтвор на тази сол: за всяка позиция, обозначена с буква, изберете съответната позиция, обозначена с цифра.
Запишете избраните числа в таблицата под съответните букви.
| А | б | IN | Ж |
Отговор: 3312
Обяснение:
А) железен (III) сулфат - Fe 2 (SO 4) 3
образуван от слаба „основа“ Fe(OH) 3 и силна киселина H 2 SO 4. Извод - средата е кисела
B) хром (III) хлорид - CrCl 3
образуван от слабата „основа” Cr(OH) 3 и силната киселина HCl. Извод - средата е кисела
Б) натриев сулфат - Na 2 SO 4
Образува се от силната основа NaOH и силната киселина H 2 SO 4. Извод - средата е неутрална
Г) натриев сулфид - Na 2 S
Образува се от силната основа NaOH и слабата киселина H2S. Извод - средата е алкална.
Задача No24
Установете съответствие между метода за въздействие върху равновесната система
CO (g) + Cl 2 (g) COCl 2 (g) + Q
и посоката на изместване на химическото равновесие в резултат на този ефект: за всяка позиция, обозначена с буква, изберете съответната позиция, обозначена с число.
Запишете избраните числа в таблицата под съответните букви.
| А | б | IN | Ж |
Отговор: 3113
Обяснение:
Изместването на равновесието при външно въздействие върху системата става по такъв начин, че да се минимизира ефектът от това външно въздействие (принцип на Le Chatelier).
А) Увеличаването на концентрацията на CO води до изместване на равновесието към предната реакция, тъй като води до намаляване на количеството CO.
B) Повишаването на температурата ще измести равновесието към ендотермична реакция. Тъй като правата реакция е екзотермична (+Q), равновесието ще се измести към обратната реакция.
В) Намаляването на налягането ще измести равновесието към реакцията, която води до увеличаване на количеството на газовете. В резултат на обратната реакция се образуват повече газове, отколкото в резултат на директната реакция. Така равновесието ще се измести към обратната реакция.
Г) Увеличаването на концентрацията на хлор води до изместване на равновесието към директната реакция, тъй като в резултат на това намалява количеството на хлора.
Задача No25
Установете съответствие между две вещества и реактив, който може да се използва за разграничаване на тези вещества: за всяка позиция, обозначена с буква, изберете съответната позиция, обозначена с цифра.
Отговор: 3454
Обяснение:
Възможно е да се разграничат две вещества с помощта на трето само ако тези две вещества взаимодействат с него по различен начин и най-важното е, че тези разлики са външно различими.
А) Разтворите на FeSO 4 и FeCl 2 могат да бъдат разграничени с помощта на разтвор на бариев нитрат. В случай на FeSO 4 се образува бяла утайка от бариев сулфат:
FeSO 4 + BaCl 2 = BaSO 4 ↓ + FeCl 2
В случая на FeCl 2 няма видими признаци на взаимодействие, тъй като реакцията не протича.
B) Разтворите на Na 3 PO 4 и Na 2 SO 4 могат да бъдат разграничени с помощта на разтвор на MgCl 2. Разтворът на Na 2 SO 4 не реагира, а в случай на Na 3 PO 4 се утаява бяла утайка от магнезиев фосфат:
2Na 3 PO 4 + 3MgCl 2 = Mg 3 (PO 4) 2 ↓ + 6NaCl
В) Разтворите на KOH и Ca(OH) 2 могат да бъдат разграничени с помощта на разтвор на Na 2 CO 3. KOH не реагира с Na 2 CO 3, но Ca (OH) 2 дава бяла утайка от калциев карбонат с Na 2 CO 3:
Ca(OH) 2 + Na 2 CO 3 = CaCO 3 ↓ + 2NaOH
D) Разтворите на KOH и KCl могат да бъдат разграничени с помощта на разтвор на MgCl 2. KCl не реагира с MgCl 2 и смесването на разтвори на KOH и MgCl 2 води до образуването на бяла утайка от магнезиев хидроксид:
MgCl 2 + 2KOH = Mg(OH) 2 ↓ + 2KCl
Задача No26
Установете съответствие между веществото и неговата област на приложение: за всяка позиция, обозначена с буква, изберете съответната позиция, обозначена с цифра.
Запишете избраните числа в таблицата под съответните букви.
| А | б | IN | Ж |
Отговор: 2331
Обяснение:
Амоняк – използва се при производството на азотни торове. По-специално, амонякът е суровина за производството на азотна киселина, от която от своя страна се произвеждат торове - натриев, калиев и амониев нитрат (NaNO 3, KNO 3, NH 4 NO 3).
Като разтворители се използват четирихлорметан и ацетон.
Етиленът се използва за производството на високомолекулни съединения (полимери), а именно полиетилен.
Отговорът на задачи 27–29 е число. Напишете това число в полето за отговор в текста на работата, като същевременно спазвате определената степен на точност. След това прехвърлете този номер във ФОРМА ЗА ОТГОВОРИ № 1 вдясно от номера на съответната задача, като започнете от първата клетка. Запишете всеки знак в отделно поле според примерите, дадени във формуляра. Не е необходимо да се записват мерни единици на физическите величини.
Задача No27
Каква маса калиев хидроксид трябва да се разтвори в 150 g вода, за да се получи разтвор с масова част на основата 25%? (Напишете числото до най-близкото цяло число.)
Отговор: 50
Обяснение:
Нека масата на калиев хидроксид, която трябва да се разтвори в 150 g вода, е равна на x g. Тогава масата на получения разтвор ще бъде (150 + x) g, а масовата част на алкалите в такъв разтвор може да бъде изразено като x/(150+x). От условието знаем, че масовата част на калиевия хидроксид е 0,25 (или 25%). Следователно уравнението е валидно:
х/(150+х) = 0,25
По този начин масата, която трябва да се разтвори в 150 g вода, за да се получи разтвор с масова част от алкали 25%, е 50 g.
Задача No28
В реакция, чието термохимично уравнение е
MgO (тв.) + CO 2 (g) → MgCO 3 (тв.) + 102 kJ,
Влизат 88 g въглероден диоксид. Колко топлина ще се отдели в този случай? (Напишете числото до най-близкото цяло число.)
Отговор: ___________________________ kJ.
Отговор: 204
Обяснение:
Нека изчислим количеството въглероден диоксид:
n(CO 2) = n(CO 2)/ M(CO 2) = 88/44 = 2 mol,
Според уравнението на реакцията, когато 1 мол CO 2 реагира с магнезиев оксид, се отделят 102 kJ. В нашия случай количеството въглероден диоксид е 2 mol. Означавайки количеството отделена топлина като x kJ, можем да запишем следната пропорция:
1 mol CO 2 – 102 kJ
2 mol CO 2 – x kJ
Следователно уравнението е валидно:
1 ∙ x = 2 ∙ 102
Така количеството топлина, което ще се отдели, когато 88 g въглероден диоксид участва в реакцията с магнезиев оксид, е 204 kJ.
Задача No29
Определете масата на цинка, който реагира със солна киселина, за да произведе 2,24 L (N.S.) водород. (Напишете числото до най-близката десета.)
Отговор: ___________________________ g.
Отговор: 6.5
Обяснение:
Нека напишем уравнението на реакцията:
Zn + 2HCl = ZnCl 2 + H 2
Нека изчислим количеството водородно вещество:
n(H2) = V(H2)/Vm = 2,24/22,4 = 0,1 mol.
Тъй като в уравнението на реакцията има равни коефициенти пред цинка и водорода, това означава, че количествата цинкови вещества, влезли в реакцията, и образуваният в резултат на нея водород също са равни, т.е.
n(Zn) = n(H 2) = 0,1 mol, следователно:
m(Zn) = n(Zn) ∙ M(Zn) = 0,1 ∙ 65 = 6,5 g.
Не забравяйте да прехвърлите всички отговори във формуляр за отговори № 1 в съответствие с инструкциите за изпълнение на работата.
Задача No33
Натриевият бикарбонат с тегло 43,34 g се калцинира до постоянно тегло. Остатъкът се разтваря в излишък от солна киселина. Полученият газ се пропуска през 100 g 10% разтвор на натриев хидроксид. Определете състава и масата на образуваната сол, нейната масова част в разтвора. В отговора си запишете уравненията на реакцията, които са посочени в изложението на задачата, и предоставете всички необходими изчисления (посочете мерните единици на необходимите физически величини).
Отговор:
Обяснение:
Натриевият бикарбонат се разлага при нагряване съгласно уравнението:
2NaHCO 3 → Na 2 CO 3 + CO 2 + H 2 O (I)
Полученият твърд остатък очевидно се състои само от натриев карбонат. Когато натриевият карбонат се разтвори в солна киселина, протича следната реакция:
Na 2 CO 3 + 2HCl → 2NaCl + CO 2 + H 2 O (II)
Изчислете количеството на натриев бикарбонат и натриев карбонат:
n(NaHCO3) = m(NaHCO3)/M(NaHCO3) = 43,34 g/84 g/mol ≈ 0,516 mol,
следователно,
n(Na2CO3) = 0,516 mol/2 = 0,258 mol.
Нека изчислим количеството въглероден диоксид, образуван при реакция (II):
n(CO 2) = n(Na 2CO 3) = 0,258 mol.
Нека изчислим масата на чистия натриев хидроксид и неговото количество вещество:
m(NaOH) = m разтвор (NaOH) ∙ ω(NaOH)/100% = 100 g ∙ 10%/100% = 10 g;
n(NaOH) = m(NaOH)/ M(NaOH) = 10/40 = 0,25 mol.
Взаимодействието на въглероден диоксид с натриев хидроксид, в зависимост от техните пропорции, може да протече в съответствие с две различни уравнения:
2NaOH + CO 2 = Na 2 CO 3 + H 2 O (с излишък на алкали)
NaOH + CO 2 = NaHCO 3 (с излишък на въглероден диоксид)
От представените уравнения следва, че се получава само средна сол при съотношение n(NaOH)/n(CO 2) ≥2, а само кисела сол при съотношение n(NaOH)/n(CO 2) ≤ 1.
Според изчисленията ν(CO 2) > ν(NaOH), следователно:
n(NaOH)/n(CO2) ≤ 1
Тези. взаимодействието на въглероден диоксид с натриев хидроксид се осъществява изключително с образуването на кисела сол, т.е. според уравнението:
NaOH + CO 2 = NaHCO 3 (III)
Ние извършваме изчислението въз основа на липсата на алкали. Съгласно уравнението на реакцията (III):
n(NaHCO3) = n(NaOH) = 0,25 mol, следователно:
m(NaHCO3) = 0,25 mol ∙ 84 g/mol = 21 g.
Масата на получения разтвор ще бъде сумата от масата на алкалния разтвор и масата на въглеродния диоксид, абсорбиран от него.
От уравнението на реакцията следва, че е реагирала, т.е. само 0,25 mol CO 2 се абсорбират от 0,258 mol. Тогава масата на абсорбирания CO 2 е:
m(CO 2) = 0,25 mol ∙ 44 g/mol = 11 g.
Тогава масата на разтвора е равна на:
m(разтвор) = m(разтвор на NaOH) + m(CO 2) = 100 g + 11 g = 111 g,
и масовата част на натриев бикарбонат в разтвора ще бъде равна на:
ω(NaHCO3) = 21 g/111 g ∙ 100% ≈ 18,92%.
Задача No34
При изгаряне на 16,2 g органично вещество с нециклична структура се получават 26,88 l (n.s.) въглероден диоксид и 16,2 g вода. Известно е, че 1 мол от това органично вещество в присъствието на катализатор добавя само 1 мол вода и това вещество не реагира с амонячен разтвор на сребърен оксид.
Въз основа на данните за условията на проблема:
1) направете изчисленията, необходими за установяване на молекулната формула на органично вещество;
2) запишете молекулната формула на органично вещество;
3) съставете структурна формула на органично вещество, което недвусмислено отразява реда на връзките на атомите в неговата молекула;
4) напишете уравнението за реакцията на хидратация на органичната материя.
Отговор:
Обяснение:
1) За да определим елементния състав, нека изчислим количествата вещества въглероден диоксид, вода и след това масите на елементите, включени в тях:
n(CO 2) = 26,88 l/22,4 l/mol = 1,2 mol;
n(CO 2) = n(C) = 1.2 mol; m(C) = 1,2 mol ∙ 12 g/mol = 14,4 g.
n(H2O) = 16,2 g/18 g/mol = 0,9 mol; n(H) = 0,9 mol ∙ 2 = 1,8 mol; m(H) = 1.8 g.
m(орган. вещества) = m(C) + m(H) = 16,2 g, следователно в органичната материя няма кислород.
Общата формула на органично съединение е C x H y.
x: y = ν(C) : ν(H) = 1,2: 1,8 = 1: 1,5 = 2: 3 = 4: 6
Така най-простата формула на веществото е C 4 H 6. Истинската формула на веществото може да съвпада с най-простата или да се различава от нея с цял брой пъти. Тези. бъде, например, C8H12, C12H18 и т.н.
Условието гласи, че въглеводородът е нецикличен и една негова молекула може да прикрепи само една молекула вода. Това е възможно, ако в структурната формула на веществото има само една кратна връзка (двойна или тройна). Тъй като желаният въглеводород е нецикличен, очевидно е, че една множествена връзка може да съществува само за вещество с формула C 4 H 6. В случай на други въглеводороди с по-високо молекулно тегло, броят на множествените връзки винаги е повече от една. По този начин молекулната формула на веществото C 4 H 6 съвпада с най-простата.
2) Молекулната формула на органично вещество е C 4 H 6.
3) От въглеводородите алкините, в които тройната връзка е разположена в края на молекулата, взаимодействат с амонячен разтвор на сребърен оксид. За да се избегне взаимодействие с амонячен разтвор на сребърен оксид, алкиновият състав C 4 H 6 трябва да има следната структура:
CH3 -C≡C-CH3
4) Хидратацията на алкините се извършва в присъствието на двувалентни живачни соли.
Спецификация
контролни измервателни материали
за провеждане на единния държавен изпит през 2017 г
по химия
1. Цел на единния държавен изпит KIM
Единният държавен изпит (наричан по-нататък Единен държавен изпит) е форма на обективна оценка на качеството на обучение на лица, усвоили образователни програми за средно общо образование, като се използват стандартизирани задачи (материали за контролни измервания).
Единният държавен изпит се провежда в съответствие с Федералния закон от 29 декември 2012 г. № 273-FZ „За образованието в Руската федерация“.
Контролно-измервателните материали позволяват да се установи нивото на овладяване на завършилите федералния компонент на държавния стандарт за средно (пълно) общо образование по химия, основно и специализирано ниво.
Резултатите от единния държавен изпит по химия се признават от образователните организации на средното професионално образование и образователните организации на висшето професионално образование като резултати от приемните тестове по химия.
2. Документи, определящи съдържанието на Единния държавен изпит KIM
3. Подходи за избор на съдържание и разработване на структурата на Единния държавен изпит KIM
Основата за подходите за разработване на Единния държавен изпит KIM за 2017 г. по химия бяха онези общи методически насоки, които бяха определени по време на формирането на изпитни модели от предишни години. Същността на тези настройки е следната.
- KIM са фокусирани върху тестване на усвояването на система от знания, която се счита за инвариантно ядро на съдържанието на съществуващите програми по химия за общообразователни организации. В стандарта тази система от знания е представена под формата на изисквания към обучението на завършилите. Тези изисквания съответстват на нивото на представяне на тестваните елементи на съдържание в CMM.
- За да се осигури възможност за диференцирана оценка на образователните постижения на завършилите Единен държавен изпит KIM, овладяването на основните образователни програми по химия се проверява на три нива на сложност: основно, напреднало и високо. Учебният материал, върху който се базират задачите, е подбран въз основа на значението му за общообразователната подготовка на зрелостниците.
- Изпълнението на задачите на изпитната работа включва изпълнението на определен набор от действия. Сред тях най-показателни са например: идентифициране на класификационни характеристики на вещества и реакции; определят степента на окисление на химичните елементи, като използват формулите на техните съединения; обясняват същността на конкретен процес, връзката между състава, структурата и свойствата на веществата. Способността на изпитвания да извършва различни действия по време на работа се счита за показател за усвояване на изучавания материал с необходимата дълбочина на разбиране.
- Еквивалентността на всички варианти на изпитната работа се осигурява чрез поддържане на същото съотношение на броя на задачите, които проверяват овладяването на основните елементи от съдържанието на ключови раздели от курса по химия.
4. Структура на единния държавен изпит KIM
Всяка версия на изпитната работа е изградена по единен план: работата се състои от две части, включващи 40 задачи. Част 1 съдържа 35 задачи с кратък отговор, включително 26 задачи с основно ниво на сложност (поредните номера на тези задачи: 1, 2, 3, 4, ... 26) и 9 задачи с повишено ниво на сложност ( поредните номера на тези задачи: 27, 28, 29, …35).
Част 2 съдържа 5 задачи с високо ниво на сложност с подробен отговор (поредните номера на тези задачи: 36, 37, 38, 39, 40).
Резултатът от единния държавен изпит по химия не по-нисък от минималния установен брой точки дава право на прием в университети по специалност, където списъкът на приемните тестове включва предмета химия.
Университетите нямат право да определят минималния праг по химия под 36 точки. Престижните университети са склонни да определят минималния си праг много по-висок. Защото за да учат там първолаците трябва да имат много добри познания.
На официалния уебсайт на FIPI всяка година се публикуват версии на Единния държавен изпит по химия: демонстрация, ранен период. Именно тези опции дават представа за структурата на бъдещия изпит и нивото на трудност на задачите и са източници на надеждна информация при подготовката за Единния държавен изпит.
Ранна версия на единния държавен изпит по химия 2017 г
| година | Изтеглете ранна версия |
| 2017 | вариант по химии |
| 2016 | Изтегли |
Демо версия на Единния държавен изпит по химия 2017 от FIPI
| Вариант на задачи + отговори | Изтеглете демо версия |
| Спецификация | демо вариант химия еге |
| Кодификатор | кодификатор |
Има промени във версиите от 2017 г. на Единния държавен изпит по химия в сравнение с предишния KIM от 2016 г., така че е препоръчително да се подготвите според текущата версия и да използвате версиите от предишни години за разнообразно развитие на завършилите.
Допълнителни материали и оборудване
Следните материали са приложени към всяка версия на единния държавен изпит по химия:
− периодична таблица на химичните елементи D.I. Менделеев;
− таблица за разтворимост на соли, киселини и основи във вода;
− електрохимични серии от метални напрежения.
Имате право да използвате непрограмируем калкулатор по време на изпита. Списъкът на допълнителните устройства и материали, чието използване е разрешено за Единния държавен изпит, е одобрен със заповед на Министерството на образованието и науката на Руската федерация.
За тези, които искат да продължат образованието си в университет, изборът на предмети трябва да зависи от списъка с приемни тестове за избраната специалност
(направление на обучение).
Списъкът на приемните изпити в университетите за всички специалности (области на обучение) се определя със заповед на Министерството на образованието и науката на Руската федерация. Всеки университет избира от този списък определени предмети, които посочва в правилата си за прием. Необходимо е да се запознаете с тази информация на уебсайтовете на избраните университети, преди да кандидатствате за участие в Единния държавен изпит със списък от избрани предмети.
За да изпълните задачи 1–3, използвайте следните серии от химични елементи. Отговорът в задачи 1–3 е поредица от числа, под които са посочени химичните елементи на даден ред.
1) Na 2) K 3) Si 4) Mg 5) C
Задача No1
Определете кои атоми от елементите, посочени в серията, имат четири електрона на външно енергийно ниво.
Отговор: 3; 5
Броят на електроните във външното енергийно ниво (електронен слой) на елементите от основните подгрупи е равен на номера на групата.
По този начин от представените опции за отговор са подходящи силиций и въглерод, т.к те са в основната подгрупа на четвъртата група на таблицата D.I. Менделеев (IVA група), т.е. Отговор 3 и 5 са верни.
Задача No2
От химичните елементи, посочени в поредицата, изберете три елемента, които са в Периодичната таблица на химичните елементи D.I. Менделеев са в същия период. Подредете избраните елементи във възходящ ред на техните метални свойства.
Запишете номерата на избраните елементи в необходимата последователност в полето за отговор.
Отговор: 3; 4; 1
От представените елементи в един период се срещат три - натрий Na, силиций Si и магнезий Mg.
При движение в рамките на един период от периодичната таблица, D.I. Менделеев (хоризонтални линии) отдясно наляво се улеснява преносът на електрони, разположени на външния слой, т.е. Металните свойства на елементите са подобрени. По този начин металните свойства на натрия, силиция и магнезия се увеличават в серията Si Задача No3 Измежду елементите, посочени в серията, изберете два елемента, които показват най-ниска степен на окисление, равна на –4. Запишете номерата на избраните елементи в полето за отговор. Отговор: 3; 5 Според правилото на октета, атомите на химичните елементи са склонни да имат 8 електрона във външното си електронно ниво, като благородните газове. Това може да се постигне или чрез даряване на електрони от последното ниво, тогава предишното, съдържащо 8 електрона, става външно, или, обратно, чрез добавяне на допълнителни електрони до осем. Натрият и калият се отнасят към алкалните метали и са в основната подгрупа на първа група (IA). Това означава, че във външния електронен слой на техните атоми има по един електрон. В това отношение енергийно по-изгодно е да загубите един електрон, отколкото да спечелите още седем. Ситуацията с магнезия е подобна, само че той е в основната подгрупа на втората група, тоест има два електрона на външно електронно ниво. Трябва да се отбележи, че натрият, калият и магнезият са метали и отрицателното състояние на окисление е принципно невъзможно за металите. Минималната степен на окисление на всеки метал е нула и се наблюдава при прости вещества. Химичните елементи въглерод С и силиций Si са неметали и са в главната подгрупа на четвърта група (IVA). Това означава, че техният външен електронен слой съдържа 4 електрона. Поради тази причина за тези елементи е възможно както да се откажат от тези електрони, така и да се добавят още четири към общо 8. Силициевите и въглеродните атоми не могат да добавят повече от 4 електрона, така че минималната степен на окисление за тях е -4. Задача No4 От предоставения списък изберете две съединения, които съдържат йонна химична връзка. Отговор: 1; 3 В по-голямата част от случаите наличието на йонен тип връзка в съединение може да се определи от факта, че неговите структурни единици включват едновременно атоми на типичен метал и атоми на неметал. Въз основа на тази характеристика установяваме, че има йонна връзка в съединение номер 1 - Ca(ClO 2) 2, т.к. във формулата му можете да видите атоми на типичния метал калций и атоми на неметали - кислород и хлор. В този списък обаче няма повече съединения, съдържащи метални и неметални атоми. В допълнение към горната характеристика, наличието на йонна връзка в съединение може да се каже, ако неговата структурна единица съдържа амониев катион (NH 4 +) или неговите органични аналози - алкиламониеви катиони RNH 3 +, диалкиламониев R 2 NH 2 +, триалкиламониеви катиони R 3 NH + и тетраалкиламониев R 4 N +, където R е някакъв въглеводороден радикал. Например, йонният тип връзка възниква в съединението (CH 3) 4 NCl между катиона (CH 3) 4 + и хлоридния йон Cl −. Сред посочените в задачата съединения е амониевият хлорид, при който йонната връзка се осъществява между амониевия катион NH 4 + и хлоридния йон Cl − . Задача No5 Установете съответствие между формулата на дадено вещество и класа/групата, към която принадлежи това вещество: за всяка позиция, обозначена с буква, изберете съответната позиция от втората колона, обозначена с цифра. Запишете номерата на избраните връзки в полето за отговор. Отговор: А-4; B-1; НА 3 Обяснение: Киселинните соли са соли, получени в резултат на непълно заместване на подвижни водородни атоми с метален катион, амониев или алкиламониев катион. В неорганичните киселини, които се изучават като част от училищната програма, всички водородни атоми са подвижни, тоест те могат да бъдат заменени с метал. Примери за киселинни неорганични соли сред представения списък са амониевият бикарбонат NH 4 HCO 3 - продуктът от заместването на един от двата водородни атома във въглеродната киселина с амониев катион. По същество киселинната сол е кръстоска между нормална (средна) сол и киселина. В случай на NH 4 HCO 3 - средната стойност между нормалната сол (NH 4) 2 CO 3 и въглеродната киселина H 2 CO 3. В органичните вещества само водородни атоми, които са част от карбоксилни групи (-COOH) или хидроксилни групи на феноли (Ar-OH), могат да бъдат заменени с метални атоми. Това е, например, натриевият ацетат CH 3 COONa, въпреки факта, че в неговата молекула не всички водородни атоми са заменени с метални катиони, е средна, а не кисела сол (!). Водородните атоми в органичните вещества, прикрепени директно към въглероден атом, почти никога не могат да бъдат заменени от метални атоми, с изключение на водородните атоми при тройна C≡C връзка. Несолеобразуващите оксиди са оксиди на неметали, които не образуват соли с основни оксиди или основи, тоест или изобщо не реагират с тях (най-често), или дават различен продукт (не сол) в реакция с тях. Често се казва, че несолеобразуващите оксиди са оксиди на неметали, които не реагират с основи и основни оксиди. Този подход обаче не винаги работи за идентифициране на необразуващи соли оксиди. Например CO, като необразуващ сол оксид, реагира с основен железен (II) оксид, но не за образуване на сол, а свободен метал: CO + FeO = CO 2 + Fe Несолеобразуващите оксиди от училищния курс по химия включват оксиди на неметали в степен на окисление +1 и +2. Общо те се намират в Единния държавен изпит 4 - това са CO, NO, N 2 O и SiO (аз лично никога не съм срещал последния SiO в задачи). Задача No6 От предложения списък с вещества изберете две вещества, с всяко от които желязото реагира без нагряване. Отговор: 2; 4 Цинковият хлорид е сол, а желязото е метал. Металът реагира със сол само ако е по-реактивен от този в солта. Относителната активност на металите се определя от серията от метални активности (с други думи, серията от метални напрежения). Желязото е разположено вдясно от цинка в серията активност на металите, което означава, че е по-малко активно и не е в състояние да измести цинка от солта. Тоест реакцията на желязото с вещество №1 не се случва. Медният (II) сулфат CuSO 4 ще реагира с желязото, тъй като желязото е отляво на медта в серията активности, тоест е по-активен метал. Концентрираната азотна и концентрирана сярна киселина не могат да реагират с желязо, алуминий и хром без нагряване поради явление, наречено пасивация: на повърхността на тези метали под въздействието на тези киселини се образува сол, неразтворима без нагряване, която действа като защитна обвивка. При нагряване обаче това защитно покритие се разтваря и реакцията става възможна. Тези. тъй като е посочено, че няма нагряване, реакцията на желязото с конц. HNO 3 не изтича. Солната киселина, независимо от концентрацията, е неокисляваща киселина. Металите, които са отляво на водорода в серията активност, реагират с неокисляващи киселини и освобождават водород. Желязото е един от тези метали. Заключение: възниква реакцията на желязото със солна киселина. В случай на метал и метален оксид, реакция, както в случая на сол, е възможна, ако свободният метал е по-активен от този, който е част от оксида. Fe, според серията активност на металите, е по-малко активен от Al. Това означава, че Fe не реагира с Al 2 O 3. Задача No7 От предложения списък изберете два оксида, които реагират с разтвор на солна киселина, но не реагирайте
с разтвор на натриев хидроксид. Запишете номерата на избраните вещества в полето за отговор. Отговор: 3; 4 CO е несолеобразуващ оксид, не реагира с воден разтвор на алкали. (Трябва да се помни, че въпреки това при тежки условия - високо налягане и температура - той все още реагира с твърди основи, образувайки формиати - соли на мравчена киселина.) SO 3 - серен оксид (VI) е киселинен оксид, който съответства на сярна киселина. Киселинните оксиди не реагират с киселини и други киселинни оксиди. Тоест SO 3 не реагира със солна киселина и реагира с основа - натриев хидроксид. Не става. CuO - меден (II) оксид - се класифицира като оксид с предимно основни свойства. Реагира с HCl и не реагира с разтвор на натриев хидроксид. Пасва MgO - магнезиевият оксид - се класифицира като типичен основен оксид. Реагира с HCl и не реагира с разтвор на натриев хидроксид. Пасва ZnO, оксид с изразени амфотерни свойства, лесно реагира както със силни основи, така и с киселини (както и с киселинни и основни оксиди). Не става. Задача No8 Отговор: 4; 2 При реакцията между две соли на неорганични киселини се образува газ само при смесване на горещи разтвори на нитрити и амониеви соли поради образуването на термично нестабилен амониев нитрит. Например, NH 4 Cl + KNO 2 =t o => N 2 + 2H 2 O + KCl Списъкът обаче не включва нито нитрити, нито амониеви соли. Това означава, че една от трите соли (Cu(NO 3) 2, K 2 SO 3 и Na 2 SiO 3) реагира или с киселина (HCl), или с основа (NaOH). Сред солите на неорганичните киселини само амониеви соли отделят газ при взаимодействие с основи: NH 4 + + OH = NH 3 + H 2 O Амониеви соли, както вече казахме, не са в списъка. Единственият останал вариант е взаимодействието на сол с киселина. Солите сред тези вещества включват Cu (NO 3) 2, K 2 SO 3 и Na 2 SiO 3. Реакцията на меден нитрат със солна киселина не се случва, т.к. не се образува газ, не се образува утайка, не се образува слабо дисоцииращо вещество (вода или слаба киселина). Натриевият силикат реагира със солна киселина, но поради освобождаването на бяла желатинова утайка от силициева киселина, а не на газ: Na 2 SiO 3 + 2HCl = 2NaCl + H 2 SiO 3 ↓ Остава последният вариант - взаимодействието на калиев сулфит и солна киселина. Всъщност в резултат на йонообменната реакция между сулфит и почти всяка киселина се образува нестабилна сярна киселина, която моментално се разлага на безцветен газообразен серен оксид (IV) и вода. Задача No9 Запишете номерата на избраните вещества под съответните букви в таблицата. Отговор: 2; 5 CO 2 е киселинен оксид и трябва да се третира или с основен оксид, или с основа, за да се превърне в сол. Тези. За да се получи калиев карбонат от CO 2, той трябва да се третира или с калиев оксид, или с калиев хидроксид. Така веществото X е калиев оксид: K 2 O + CO 2 = K 2 CO 3 Калиевият бикарбонат KHCO 3, подобно на калиевия карбонат, е сол на въглеродната киселина, с единствената разлика, че бикарбонатът е продукт на непълно заместване на водородните атоми във въглеродната киселина. За да получите кисела сол от нормална (средна) сол, трябва или да я обработите със същата киселина, която е образувала тази сол, или да я обработите с киселинен оксид, съответстващ на тази киселина в присъствието на вода. Така реагентът Y е въглероден диоксид. При преминаване през воден разтвор на калиев карбонат, последният се превръща в калиев бикарбонат: K 2 CO 3 + H 2 O + CO 2 = 2KHCO 3 Задача No10 Установете съответствие между уравнението на реакцията и свойството на азотния елемент, което проявява в тази реакция: за всяка позиция, обозначена с буква, изберете съответната позиция, обозначена с цифра. Запишете номерата на избраните вещества под съответните букви в таблицата. Отговор: А-4; Б-2; В 2; G-1 А) NH 4 HCO 3 е сол, която съдържа амониев катион NH 4 +. В амониевия катион азотът винаги има степен на окисление -3. В резултат на реакцията се превръща в амоняк NH3. Водородът почти винаги (с изключение на съединенията му с метали) има степен на окисление +1. Следователно, за да бъде молекулата на амоняк електрически неутрална, азотът трябва да има степен на окисление -3. По този начин няма промяна в степента на окисление на азота, т.е. не проявява редокс свойства. B) Както е показано по-горе, азотът в амоняка NH 3 има степен на окисление -3. В резултат на реакцията с CuO амонякът се превръща в просто вещество N 2. Във всяко просто вещество степента на окисление на елемента, от който се образува, е нула. Така азотният атом губи своя отрицателен заряд и тъй като електроните са отговорни за отрицателния заряд, това означава, че азотният атом ги губи в резултат на реакцията. Елемент, който губи част от своите електрони в резултат на реакция, се нарича редуциращ агент. В) В резултат на реакцията на NH 3 със степен на окисление на азота, равна на -3, той се превръща в азотен оксид NO. Кислородът почти винаги има степен на окисление -2. Следователно, за да бъде молекулата на азотния оксид електрически неутрална, азотният атом трябва да има степен на окисление +2. Това означава, че азотният атом в резултат на реакцията променя степента си на окисление от -3 на +2. Това показва, че азотният атом е загубил 5 електрона. Тоест азотът, какъвто е случаят с B, е редуциращ агент. Г) N 2 е просто вещество. Във всички прости вещества елементът, който ги образува, има степен на окисление 0. В резултат на реакцията азотът се превръща в литиев нитрид Li3N. Единственото състояние на окисление на алкален метал, различно от нула (степен на окисление 0 възниква за всеки елемент) е +1. По този начин, за да бъде структурната единица Li3N електрически неутрална, азотът трябва да има степен на окисление -3. Оказва се, че в резултат на реакцията азотът е придобил отрицателен заряд, което означава добавяне на електрони. Азотът е окислител в тази реакция. Задача No11 Установете съответствие между формулата на веществото и реагентите, с всеки от които това вещество може да взаимодейства: за всяка позиция, обозначена с буква, изберете съответната позиция, обозначена с цифра. D) ZnBr 2 (разтвор) 1) AgNO 3, Na 3 PO 4, Cl 2 2) BaO, H2O, KOH 3) H2, Cl2, O2 4) HBr, LiOH, CH3COOH 5) H3PO4, BaCl2, CuO Запишете номерата на избраните вещества под съответните букви в таблицата. Отговор: А-3; Б-2; AT 4; G-1 А) Когато водородният газ преминава през разтопена сяра, се образува сероводород H 2 S: H 2 + S =t o => H 2 S Когато хлорът се прекара върху натрошена сяра при стайна температура, се образува серен дихлорид: S + Cl 2 = SCl 2 За да преминете единния държавен изпит, не е необходимо да знаете точно как сярата реагира с хлора и съответно да можете да напишете това уравнение. Основното нещо е да запомните на основно ниво, че сярата реагира с хлора. Хлорът е силен окислител, сярата често проявява двойна функция - както окислителна, така и редуцираща. Тоест, ако сярата е изложена на силен окислител, който е молекулярен хлор Cl2, тя ще се окисли. Сярата гори със син пламък в кислород и образува газ с остра миризма - серен диоксид SO2: B) SO 3 - серен оксид (VI) има изразени киселинни свойства. За такива оксиди най-характерните реакции са реакциите с вода, както и с основни и амфотерни оксиди и хидроксиди. В списъка под номер 2 виждаме вода, основния оксид BaO и хидроксида KOH. Когато киселинен оксид взаимодейства с основен оксид, се образува сол на съответната киселина и метала, който е част от основния оксид. Киселинният оксид съответства на киселина, в която образуващият киселина елемент има същото състояние на окисление като в оксида. Оксидът SO 3 съответства на сярна киселина H 2 SO 4 (и в двата случая степента на окисление на сярата е +6). По този начин, когато SO 3 взаимодейства с метални оксиди, ще се получат соли на сярна киселина - сулфати, съдържащи сулфатен йон SO 4 2-: SO 3 + BaO = BaSO 4 При реакция с вода киселинният оксид се превръща в съответната киселина: SO 3 + H 2 O = H 2 SO 4 И когато киселинните оксиди взаимодействат с металните хидроксиди, се образува сол на съответната киселина и вода: SO 3 + 2KOH = K 2 SO 4 + H 2 O В) Цинковият хидроксид Zn(OH) 2 има типични амфотерни свойства, т.е. той реагира както с киселинни оксиди и киселини, така и с основни оксиди и основи. В списък 4 виждаме както киселини - бромоводородна HBr и оцетна киселина, така и алкални - LiOH. Нека си припомним, че алкалите са метални хидроксиди, разтворими във вода: Zn(OH) 2 + 2HBr = ZnBr 2 + 2H 2 O Zn(OH) 2 + 2CH 3 COOH = Zn(CH 3 COO) 2 + 2H 2 O Zn(OH) 2 + 2LiOH = Li 2 D) Цинковият бромид ZnBr 2 е сол, разтворима във вода. За разтворимите соли йонообменните реакции са най-често срещаните. Една сол може да реагира с друга сол, при условие че и двете соли са разтворими и се образува утайка. ZnBr 2 също съдържа бромиден йон Br-. Характерно за металните халогениди е, че те могат да реагират с Hal 2 халогени, които са по-високи в периодичната таблица. По този начин? описаните видове реакции възникват с всички вещества в списък 1: ZnBr 2 + 2AgNO 3 = 2AgBr + Zn(NO 3) 2 3ZnBr 2 + 2Na 3 PO 4 = Zn 3 (PO 4) 2 + 6NaBr ZnBr 2 + Cl 2 = ZnCl 2 + Br 2 Задача No12 Установете съответствие между името на веществото и класа/групата, към която принадлежи това вещество: за всяка позиция, обозначена с буква, изберете съответната позиция, обозначена с цифра. Запишете номерата на избраните вещества под съответните букви в таблицата. Отговор: А-4; Б-2; В 1 Обяснение: А) Метилбензенът, известен още като толуен, има структурната формула: Както можете да видите, молекулите на това вещество се състоят само от въглерод и водород, следователно метилбензенът (толуен) е въглеводород B) Структурната формула на анилин (аминобензен) е следната: Както може да се види от структурната формула, анилиновата молекула се състои от ароматен въглеводороден радикал (C 6 H 5 -) и аминогрупа (-NH 2), следователно анилинът принадлежи към ароматните амини, т.е. верен отговор 2. B) 3-метилбутанал. Окончанието "al" показва, че веществото е алдехид. Структурна формула на това вещество: Задача No13 От предложения списък изберете две вещества, които са структурни изомери на 1-бутен. Запишете номерата на избраните вещества в полето за отговор. Отговор: 2; 5 Обяснение: Изомерите са вещества, които имат еднаква молекулна формула и различна структура, т.е. вещества, които се различават по реда на свързване на атомите, но с еднакъв състав на молекулите. Задача No14 От предложения списък изберете две вещества, които при взаимодействие с разтвор на калиев перманганат ще причинят промяна в цвета на разтвора. Запишете номерата на избраните вещества в полето за отговор. Отговор: 3; 5 Обяснение: Алканите, както и циклоалканите с размер на пръстена от 5 или повече въглеродни атома, са много инертни и не реагират с водни разтвори на дори силни окислители, като например калиев перманганат KMnO 4 и калиев дихромат K 2 Cr 2 О 7 . Така варианти 1 и 4 отпадат - при добавяне на циклохексан или пропан към воден разтвор на калиев перманганат няма да настъпи промяна на цвета. Сред въглеводородите от хомоложната серия на бензола само бензенът е пасивен към действието на водни разтвори на окислители; всички останали хомолози се окисляват, в зависимост от околната среда, до карбоксилни киселини или до съответните им соли. Така вариант 2 (бензен) отпада. Верните отговори са 3 (толуен) и 5 (пропилен). И двете вещества обезцветяват лилавия разтвор на калиев перманганат поради следните реакции: CH 3 -CH=CH 2 + 2KMnO 4 + 2H 2 O → CH 3 -CH(OH)–CH 2 OH + 2MnO 2 + 2KOH Задача No15 От предоставения списък изберете две вещества, с които формалдехидът реагира. Запишете номерата на избраните вещества в полето за отговор. Отговор: 3; 4 Обяснение: Формалдехидът принадлежи към класа на алдехидите - кислородсъдържащи органични съединения, които имат алдехидна група в края на молекулата: Типичните реакции на алдехидите са реакции на окисление и редукция, протичащи по протежение на функционалната група. Сред списъка с отговори за формалдехид са характерни реакциите на редукция, при които водородът се използва като редуциращ агент (кат. – Pt, Pd, Ni), и окислението – в този случай реакцията на сребърно огледало. Когато се редуцира с водород върху никелов катализатор, формалдехидът се превръща в метанол: Реакцията на сребърно огледало е реакция на редукция на сребро от амонячен разтвор на сребърен оксид. Когато се разтвори във воден разтвор на амоняк, сребърният оксид се превръща в комплексно съединение - диамин сребърен хидроксид (I) OH. След добавяне на формалдехид възниква редокс реакция, при която среброто се редуцира: Задача No16 От предоставения списък изберете две вещества, с които реагира метиламинът. Запишете номерата на избраните вещества в полето за отговор. Отговор: 2; 5 Обяснение: Метиламинът е най-простото органично съединение от класа на амините. Характерна особеност на амините е наличието на несподелена електронна двойка на азотния атом, в резултат на което амините проявяват свойствата на основи и действат като нуклеофили в реакциите. Така, в това отношение, от предложените отговори, метиламинът като основа и нуклеофил реагира с хлорометан и солна киселина: CH 3 NH 2 + CH 3 Cl → (CH 3) 2 NH 2 + Cl − CH 3 NH 2 + HCl → CH 3 NH 3 + Cl − Задача No17 Посочена е следната схема на трансформации на веществото: Определете кои от посочените вещества са веществата X и Y. Запишете номерата на избраните вещества под съответните букви в таблицата. Отговор: 4; 2 Обяснение: Една от реакциите за получаване на алкохоли е реакцията на хидролиза на халоалкани. Така етанолът може да се получи от хлороетан чрез третиране на последния с воден разтвор на основа - в този случай NaOH. CH 3 CH 2 Cl + NaOH (воден) → CH 3 CH 2 OH + NaCl Следващата реакция е реакцията на окисление на етилов алкохол. Окисляването на алкохоли се извършва върху меден катализатор или с помощта на CuO: Задача No18 Установете съответствие между името на веществото и продукта, което се образува главно, когато това вещество реагира с бром: за всяка позиция, обозначена с буква, изберете съответната позиция, обозначена с цифра. Отговор: 5; 2; 3; 6 Обяснение: За алканите най-характерните реакции са реакциите на заместване на свободните радикали, по време на които водородният атом се замества с халогенен атом. Така, чрез бромиране на етан можете да получите бромоетан, а чрез бромиране на изобутан можете да получите 2-бромоизобутан: Тъй като малките пръстени на молекулите на циклопропан и циклобутан са нестабилни, по време на бромиране пръстените на тези молекули се отварят, като по този начин възниква реакция на добавяне: За разлика от циклите на циклопропан и циклобутан, цикълът на циклохексан е голям, което води до заместване на водороден атом с бромен атом: Задача No19 Установете съответствие между реагиращите вещества и въглеродсъдържащия продукт, който се образува по време на взаимодействието на тези вещества: за всяка позиция, обозначена с буква, изберете съответната позиция, обозначена с цифра. Запишете избраните числа в таблицата под съответните букви. Отговор: 5; 4; 6; 2 Задача No20 От предложения списък с типове реакции изберете два типа реакции, които включват взаимодействието на алкални метали с вода. Запишете числата на избраните типове реакции в полето за отговор. Отговор: 3; 4 Алкалните метали (Li, Na, K, Rb, Cs, Fr) се намират в основната подгрупа на група I на таблицата D.I. Менделеев и са редуциращи агенти, които лесно отдават електрон, разположен на външното ниво. Ако обозначим алкалния метал с буквата М, тогава реакцията на алкалния метал с вода ще изглежда така: 2M + 2H 2 O → 2MOH + H 2 Алкалните метали са много реактивни спрямо водата. Реакцията протича бързо с отделяне на голямо количество топлина, необратима е и не изисква използването на катализатор (некаталитичен) - вещество, което ускорява реакцията и не е част от продуктите на реакцията. Трябва да се отбележи, че всички силно екзотермични реакции не изискват използването на катализатор и протичат необратимо. Тъй като металът и водата са вещества в различни агрегатни състояния, тази реакция протича на фазовата граница и следователно е хетерогенна. Типът на тази реакция е заместване. Реакциите между неорганични вещества се класифицират като реакции на заместване, ако просто вещество взаимодейства със сложно и в резултат на това се образуват други прости и сложни вещества. (Между киселина и основа протича реакция на неутрализация, в резултат на която тези вещества обменят съставните си части и се образуват сол и слабо дисоциирано вещество). Както бе споменато по-горе, алкалните метали са редуциращи агенти, даряващи електрон от външния слой, следователно реакцията е редокс. Задача No21 От предложения списък с външни влияния изберете две влияния, които водят до намаляване на скоростта на реакция на етилен с водород. Запишете номерата на избраните външни влияния в полето за отговор. Отговор: 1; 4 Скоростта на химичната реакция се влияе от следните фактори: промени в температурата и концентрацията на реагентите, както и използването на катализатор. Според основното правило на Вант Хоф, с всяко 10 градуса повишаване на температурата, константата на скоростта на хомогенна реакция се увеличава 2-4 пъти. Следователно понижаването на температурата също води до намаляване на скоростта на реакцията. Първият отговор е правилен. Както беше отбелязано по-горе, скоростта на реакцията също се влияе от промените в концентрацията на реагентите: ако концентрацията на етилен се увеличи, скоростта на реакцията също ще се увеличи, което не отговаря на изискванията на задачата. Намаляването на концентрацията на водород, изходният компонент, напротив, намалява скоростта на реакцията. Следователно вторият вариант не е подходящ, но четвъртият е подходящ. Катализаторът е вещество, което ускорява скоростта на химическата реакция, но не е част от продукта. Използването на катализатор ускорява реакцията на хидрогениране на етилен, което също не отговаря на условията на задачата и следователно не е правилният отговор. Когато етиленът реагира с водород (на Ni, Pd, Pt катализатори), се образува етан: CH 2 =CH 2(g) + H 2(g) → CH 3 -CH 3(g) Всички компоненти, участващи в реакцията, и продуктът са газообразни вещества, следователно налягането в системата също ще повлияе на скоростта на реакцията. От два обема етилен и водород се образува един обем етан, следователно реакцията е да се намали налягането в системата. Като увеличим натиска, ще ускорим реакцията. Петият отговор не е верен. Задача No22 Установете съответствие между формулата на солта и продуктите на електролизата на воден разтвор на тази сол, които се отделят върху инертните електроди: към всяка позиция, ФОРМУЛА СОЛ ПРОДУКТИ ЗА ЕЛЕКТРОЛИЗА Запишете избраните числа в таблицата под съответните букви. Отговор: 1; 4; 3; 2 Електролизата е окислително-редукционен процес, който протича върху електродите, когато постоянен електрически ток преминава през разтвор или разтопен електролит. На катода се извършва предимно редукцията на онези катиони, които имат най-голяма окислителна активност. На анода тези аниони, които имат най-голяма редукционна способност, се окисляват първи. Електролиза на воден разтвор 1) Процесът на електролиза на водни разтвори на катода не зависи от материала на катода, а зависи от позицията на металния катион в електрохимичната серия на напрежение. За катиони в серия Процес на редукция на Li + - Al 3+: 2H 2 O + 2e → H 2 + 2OH − (H 2 се освобождава на катода) Процес на редукция на Zn 2+ - Pb 2+: Me n + + ne → Me 0 и 2H 2 O + 2e → H 2 + 2OH − (H 2 и Me ще бъдат освободени на катода) Процес на редукция на Cu 2+ - Au 3+ Me n + + ne → Me 0 (Me се освобождава на катода) 2) Процесът на електролиза на водни разтвори на анода зависи от материала на анода и природата на аниона. Ако анодът е неразтворим, т.е. инертни (платина, злато, въглища, графит), тогава процесът ще зависи само от природата на анионите. За аниони F − , SO 4 2- , NO 3 − , PO 4 3- , OH − процес на окисление: 4OH − - 4e → O 2 + 2H 2 O или 2H 2 O – 4e → O 2 + 4H + (кислородът се отделя на анода) халидни йони (с изключение на F-) процес на окисление 2Hal − - 2e → Hal 2 (свободни халогени се освобождават) процес на окисляване на органични киселини: 2RCOO − - 2e → R-R + 2CO 2 Общото уравнение на електролизата е: А) Разтвор на Na3PO4 2H 2 O → 2H 2 (на катода) + O 2 (на анода) Б) Разтвор на KCl 2KCl + 2H 2 O → H 2 (на катода) + 2KOH + Cl 2 (на анода) B) Разтвор на CuBr2 CuBr 2 → Cu (на катода) + Br 2 (на анода) Г) Разтвор на Cu(NO3)2 2Cu(NO 3) 2 + 2H 2 O → 2Cu (на катода) + 4HNO 3 + O 2 (на анода) Задача No23 Установете съответствие между името на солта и връзката на тази сол с хидролизата: за всяка позиция, обозначена с буква, изберете съответната позиция, обозначена с цифра. Запишете избраните числа в таблицата под съответните букви. Отговор: 1; 3; 2; 4 Хидролизата на соли е взаимодействието на соли с вода, което води до добавяне на водороден катион Н + водна молекула към аниона на киселинния остатък и (или) хидроксилната група ОН - водна молекула към металния катион. Солите, образувани от катиони, съответстващи на слаби основи, и аниони, съответстващи на слаби киселини, се подлагат на хидролиза. А) Амониев хлорид (NH 4 Cl) - сол, образувана от силна солна киселина и амоняк (слаба основа), претърпява хидролиза в катиона. NH 4 Cl → NH 4 + + Cl - NH 4 + + H 2 O → NH 3 H 2 O + H + (образуване на амоняк, разтворен във вода) Средата на разтвора е кисела (pH< 7). B) Калиев сулфат (K 2 SO 4) - сол, образувана от силна сярна киселина и калиев хидроксид (алкал, т.е. силна основа), не се подлага на хидролиза. K 2 SO 4 → 2K + + SO 4 2- В) Натриев карбонат (Na 2 CO 3) - сол, образувана от слаба въглена киселина и натриев хидроксид (алкал, т.е. силна основа), претърпява хидролиза при аниона. CO 3 2- + H 2 O → HCO 3 - + OH - (образуване на слабо дисоцииращ бикарбонатен йон) Средата на разтвора е алкална (рН > 7). D) Алуминиев сулфид (Al 2 S 3) - сол, образувана от слаба хидросулфидна киселина и алуминиев хидроксид (слаба основа), претърпява пълна хидролиза до образуване на алуминиев хидроксид и сероводород: Al 2 S 3 + 6H 2 O → 2Al(OH) 3 + 3H 2 S Средата на разтвора е близка до неутрална (pH ~ 7). Задача No24 Установете съответствие между уравнението на химическата реакция и посоката на изместване на химичното равновесие с увеличаване на налягането в системата: за всяка позиция, обозначена с буква, изберете съответната позиция, обозначена с цифра. УРАВНЕНИЕ НА РЕАКЦИЯТА A) N 2 (g) + 3H 2 (g) ↔ 2NH 3 (g) B) 2H 2 (g) + O 2 (g) ↔ 2H 2 O (g) B) H 2 (g) + Cl 2 (g) ↔ 2HCl (g) D) SO 2 (g) + Cl 2 (g) ↔ SO 2 Cl 2 (g) ПОСОКА НА ИЗМЕСТВАНЕ НА ХИМИЧНОТО РАВНОВЕСИЕ 1) се измества към директната реакция 2) се измества към обратната реакция 3) няма промяна в равновесието Запишете избраните числа в таблицата под съответните букви. Отговор: А-1; B-1; AT 3; G-1 Една реакция е в химично равновесие, когато скоростта на правата реакция е равна на скоростта на обратната реакция. Изместването на равновесието в желаната посока се постига чрез промяна на условията на реакцията. Фактори, определящи равновесното положение: - налягане: увеличаването на налягането измества равновесието към реакция, водеща до намаляване на обема (обратно, намаляването на налягането измества равновесието към реакция, водеща до увеличаване на обема) - температура: повишаването на температурата измества равновесието към ендотермична реакция (обратно, понижаването на температурата измества равновесието към екзотермична реакция) - концентрации на изходните вещества и реакционните продукти: увеличаването на концентрацията на изходните вещества и отстраняването на продуктите от реакционната сфера измества равновесието към предната реакция (обратно, намаляването на концентрацията на изходните вещества и увеличаването на реакционните продукти измества равновесието към обратна реакция) - катализаторите не влияят на изместването на равновесието, а само ускоряват постигането му А) В първия случай реакцията протича с намаляване на обема, тъй като V (N 2) + 3V (H 2) > 2V (NH 3). Чрез увеличаване на налягането в системата равновесието ще се измести към страната с по-малък обем вещества, следователно в посока напред (към директната реакция). B) Във втория случай реакцията протича и с намаляване на обема, тъй като 2V(H 2) + V(O 2) > 2V(H 2 O). Чрез увеличаване на налягането в системата равновесието също ще се измести към директната реакция (към продукта). В) В третия случай налягането не се променя по време на реакцията, т.к V(H2) + V(Cl2) = 2V(HCl), така че равновесието не се измества. D) В четвъртия случай реакцията протича и с намаляване на обема, тъй като V (SO 2) + V (Cl 2) > V (SO 2 Cl 2). Чрез увеличаване на налягането в системата равновесието ще се измести към образуването на продукта (директна реакция). Задача No25 Установете съответствие между формулите на веществата и реактива, с който можете да различите техните водни разтвори: за всяка позиция, обозначена с буква, изберете съответната позиция, обозначена с цифра. ФОРМУЛИ НА ВЕЩЕСТВАТА А) HNO3 и H2O B) NaCl и BaCl 2 D) AlCl3 и MgCl2 Запишете избраните числа в таблицата под съответните букви. Отговор: А-1; Б-3; AT 3; G-2 А) Азотната киселина и водата могат да бъдат разграничени с помощта на сол - калциев карбонат CaCO 3. Калциевият карбонат не се разтваря във вода и при взаимодействие с азотна киселина образува разтворима сол - калциев нитрат Ca (NO 3) 2 и реакцията е придружена от освобождаване на безцветен въглероден диоксид: CaCO 3 + 2HNO 3 → Ca(NO 3) 2 + CO 2 + H 2 O B) Калиев хлорид KCl и алкален NaOH могат да бъдат разграничени чрез разтвор на меден (II) сулфат. Когато меден (II) сулфат взаимодейства с KCl, реакцията на обмен не настъпва; разтворът съдържа йони K +, Cl -, Cu 2+ и SO 4 2-, които не образуват ниско дисоцииращи вещества помежду си. Когато меден (II) сулфат реагира с NaOH, възниква обменна реакция, в резултат на която се утаява меден (II) хидроксид (синя основа). В) Натриевият хлорид NaCl и бариевият хлорид BaCl2 са разтворими соли, които също могат да бъдат разграничени от разтвор на меден (II) сулфат. Когато медният (II) сулфат взаимодейства с NaCl, реакцията на обмен не възниква; разтворът съдържа Na +, Cl -, Cu 2+ и SO 4 2- йони, които не образуват ниско дисоцииращи вещества помежду си. Когато меден (II) сулфат взаимодейства с BaCl 2, възниква обменна реакция, в резултат на която се утаява бариев сулфат BaSO 4. D) Алуминиевите хлориди AlCl 3 и магнезиевите хлориди MgCl 2 се разтварят във вода и се държат по различен начин при взаимодействие с калиев хидроксид. Магнезиевият хлорид с алкали образува утайка: MgCl 2 + 2KOH → Mg(OH) 2 ↓ + 2KCl Когато алкалът реагира с алуминиев хлорид, първо се образува утайка, която след това се разтваря, за да образува сложна сол - калиев тетрахидроксоалуминат: AlCl 3 + 4KOH → K + 3KCl Задача No26 Установете съответствие между веществото и неговата област на приложение: за всяка позиция, обозначена с буква, изберете съответната позиция, обозначена с цифра. Запишете избраните числа в таблицата под съответните букви. Отговор: А-4; Б-2; AT 3; G-5 А) Амонякът е най-важният продукт на химическата промишленост, производството му е повече от 130 милиона тона годишно. Амонякът се използва главно в производството на азотни торове (амониев нитрат и сулфат, урея), лекарства, експлозиви, азотна киселина и сода. Сред предложените варианти за отговор областта на приложение на амоняка е производството на торове (Четвърти вариант за отговор). Б) Метанът е най-простият въглеводород, най-термично стабилният представител на редица наситени съединения. Използва се широко като битово и промишлено гориво, както и като суровина за промишлеността (Втори отговор). Метанът е 90-98% компонент на природния газ. В) Каучуците са материали, получени чрез полимеризация на съединения със спрегнати двойни връзки. Изопренът е един от тези видове съединения и се използва за производството на един от видовете каучук: D) Алкените с ниско молекулно тегло се използват за производството на пластмаси, по-специално етиленът се използва за производството на пластмаса, наречена полиетилен: н CH 2 =CH 2 → (-CH 2 -CH 2 -) n Задача No27 Изчислете масата на калиев нитрат (в грамове), която трябва да се разтвори в 150 g разтвор с масова част на тази сол 10%, за да се получи разтвор с масова част 12%. (Напишете числото до най-близката десета.) Отговор: 3,4 g Обяснение: Нека x g е масата на калиев нитрат, който е разтворен в 150 g разтвор. Нека изчислим масата на калиев нитрат, разтворен в 150 g разтвор: m(KNO 3) = 150 g 0,1 = 15 g За да бъде масовата част на солта 12%, се добавят x g калиев нитрат. Масата на разтвора е (150 + x) g. Записваме уравнението във формата: (Напишете числото до най-близката десета.) Отговор: 14,4 g Обяснение: В резултат на пълното изгаряне на сероводород се образуват серен диоксид и вода: 2H 2 S + 3O 2 → 2SO 2 + 2H 2 O Следствие от закона на Авогадро е, че обемите на газовете при едни и същи условия са свързани помежду си по същия начин като броя на моловете на тези газове. Така според уравнението на реакцията: ν(O 2) = 3/2ν(H 2 S), следователно, обемите на сероводород и кислород се отнасят един към друг по абсолютно същия начин: V(O 2) = 3/2V(H 2 S), V(O 2) = 3/2 · 6,72 l = 10,08 l, следователно V(O 2) = 10,08 l/22,4 l/mol = 0,45 mol Нека изчислим масата на кислорода, необходима за пълно изгаряне на сероводород: m(O 2) = 0,45 mol 32 g/mol = 14,4 g Задача No30 Използвайки метода на електронния баланс, създайте уравнение за реакцията: Na 2 SO 3 + … + KOH → K 2 MnO 4 + … + H 2 O Идентифицирайте окислителя и редуциращия агент. Mn +7 + 1e → Mn +6 │2 реакция на редукция S +4 − 2e → S +6 │1 реакция на окисление Mn +7 (KMnO 4) – окислител, S +4 (Na 2 SO 3) – редуциращ агент Na 2 SO 3 + 2KMnO 4 + 2KOH → 2K 2 MnO 4 + Na 2 SO 4 + H 2 O Задача No31 Желязото се разтваря в гореща концентрирана сярна киселина. Получената сол се третира с излишък от разтвор на натриев хидроксид. Образуваната кафява утайка се филтрира и калцинира. Полученото вещество се нагрява с желязо. Напишете уравнения за четирите описани реакции. 1) Желязото, подобно на алуминия и хрома, не реагира с концентрирана сярна киселина, като се покрива със защитен оксиден филм. Реакцията протича само при нагряване, освобождавайки серен диоксид: 2Fe + 6H 2 SO 4 → Fe 2 (SO 4) 2 + 3SO 2 + 6H 2 O (при нагряване) 2) Железен (III) сулфат е водоразтворима сол, която влиза в обменна реакция с алкали, в резултат на което се утаява железен (III) хидроксид (кафяво съединение): Fe 2 (SO 4) 3 + 3NaOH → 2Fe(OH) 3 ↓ + 3Na 2 SO 4 3) Неразтворимите метални хидроксиди се разлагат при калциниране до съответните оксиди и вода: 2Fe(OH) 3 → Fe 2 O 3 + 3H 2 O 4) Когато железен (III) оксид се нагрява с метално желязо, се образува железен (II) оксид (желязото в съединението FeO има междинно състояние на окисление): Fe 2 O 3 + Fe → 3FeO (при нагряване) Задача No32 Напишете уравненията на реакцията, които могат да се използват за извършване на следните трансформации: Когато пишете уравнения на реакцията, използвайте структурните формули на органичните вещества. 1) Вътремолекулна дехидратация настъпва при температури над 140 o C. Това се случва в резултат на отделянето на водороден атом от въглеродния атом на алкохола, разположени един след друг към алкохолния хидроксил (в β-позиция). CH 3 -CH 2 -CH 2 -OH → CH 2 =CH-CH 3 + H 2 O (условия - H 2 SO 4, 180 o C) Междумолекулната дехидратация настъпва при температури под 140 o C под действието на сярна киселина и в крайна сметка се свежда до разделянето на една водна молекула от две алкохолни молекули. 2) Пропиленът е несиметричен алкен. При добавяне на водородни халиди и вода, водороден атом се добавя към въглероден атом при множествена връзка, свързана с голям брой водородни атоми: CH 2 =CH-CH 3 + HCl → CH 3 -CHCl-CH 3 3) Чрез третиране на 2-хлоропропан с воден разтвор на NaOH, халогенният атом се замества с хидроксилна група: CH 3 -CHCl-CH 3 + NaOH (воден) → CH 3 -CHOH-CH 3 + NaCl 4) Пропиленът може да се получи не само от пропанол-1, но и от пропанол-2 чрез реакция на вътрешномолекулна дехидратация при температури над 140 o C: CH 3 -CH(OH)-CH 3 → CH 2 =CH-CH 3 + H 2 O (условия H 2 SO 4, 180 o C) 5) В алкална среда, действайки с разреден воден разтвор на калиев перманганат, настъпва хидроксилиране на алкени с образуването на диоли: 3CH 2 =CH-CH 3 + 2KMnO 4 + 4H 2 O → 3HOCH 2 -CH(OH)-CH 3 + 2MnO 2 + 2KOH Задача No33 Определете масовите фракции (в%) на железен (II) сулфат и алуминиев сулфид в сместа, ако при третиране на 25 g от тази смес с вода се отдели газ, който напълно реагира с 960 g 5% разтвор на мед ( II) сулфат. В отговор запишете уравненията на реакцията, които са посочени в формулировката на проблема, и предоставете всички необходими изчисления (посочете мерните единици на необходимите физически величини). Отговор: ω(Al 2 S 3) = 40%; ω(CuSO 4) = 60% Когато смес от железен (II) сулфат и алуминиев сулфид се третира с вода, сулфидът просто се разтваря и сулфидът се хидролизира, за да образува алуминиев (III) хидроксид и сероводород: Al 2 S 3 + 6H 2 O → 2Al(OH) 3 ↓ + 3H 2 S (I) Когато сероводородът преминава през разтвор на меден (II) сулфат, медният (II) сулфид се утаява: CuSO 4 + H 2 S → CuS↓ + H 2 SO 4 (II) Нека изчислим масата и количеството на разтворения меден (II) сулфат: m(CuSO 4) = m(разтвор) ω(CuSO 4) = 960 g 0,05 = 48 g; ν(CuSO 4) = m(CuSO 4)/M(CuSO 4) = 48 g/160 g = 0,3 mol Съгласно уравнението на реакцията (II) ν(CuSO 4) = ν(H 2 S) = 0,3 mol, а според уравнението на реакцията (III) ν(Al 2 S 3) = 1/3ν(H 2 S) = 0,1 мол Нека изчислим масите на алуминиев сулфид и меден (II) сулфат: m(Al2S3) = 0,1 mol · 150 g/mol = 15 g; m(CuSO4) = 25 g – 15 g = 10 g ω(Al2S3) = 15 g/25 g 100% = 60%; ω(CuSO 4) = 10 g/25 g 100% = 40% Задача No34 При изгаряне на проба от някакво органично съединение с тегло 14,8 g се получават 35,2 g въглероден диоксид и 18,0 g вода. Известно е, че относителната плътност на парите на това вещество по отношение на водорода е 37. По време на изследването на химичните свойства на това вещество беше установено, че когато това вещество взаимодейства с меден (II) оксид, се образува кетон. Въз основа на данните от условията на задачата: 1) направете изчисленията, необходими за установяване на молекулната формула на органично вещество (посочете единиците за измерване на необходимите физически количества); 2) запишете молекулната формула на оригиналното органично вещество; 3) съставете структурна формула на това вещество, което недвусмислено отразява реда на връзките на атомите в неговата молекула; 4) напишете уравнението за реакцията на това вещество с меден (II) оксид, като използвате структурната формула на веществото.ФОРМУЛА НА ВЕЩЕСТВОТО
РЕАКТИВИ