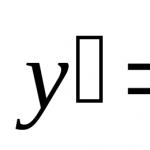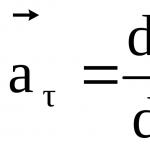Електронът има собствен механичен ъглов момент L s, наречен спин. Спинът е интегрално свойство на електрона, като неговия заряд и маса. Спинът на електрона съответства на неговия собствен магнитен момент P s, пропорционален на L s и насочен в обратна посока: P s = g s L s, g s е жиромагнитното съотношение на спиновите моменти. Проекция на собствения магнитен момент върху посоката на вектор B: P sB =eh/2m= B , където h=h/2, B =магнетон на Бор. Общият магнитен момент на атома p a = векторната сума на магнитните моменти на електрона, влизащ в атома: P a =p m +p ms. Опитът на Щерн и Герлах. Чрез измерване на магнитни моменти те откриха, че тесен лъч от водородни атоми в нееднородно магнитно поле се разделя на 2 лъча. Въпреки че в това състояние (атомите са били в състояние S), ъгловият момент на електрона е 0, както и магнитният момент на атома е 0, така че магнитното поле не влияе на движението на водородния атом, това е, не трябва да има разделяне. По-нататъшни изследвания обаче показаха, че спектралните линии на водородните атоми показват такава структура дори в отсъствието на магнитно поле. Впоследствие беше установено, че тази структура на спектралните линии се обяснява с факта, че електронът има свой собствен неразрушим механичен момент, наречен спин.
21. Орбитален, спинов и пълен ъглов и магнитен момент на електрона.
Електронът има собствен ъглов импулс M S, който се нарича спин. Стойността му се определя според общите закони на квантовата механика: M S = h= h[(1/2)*(3/2)]=(1/2) h3, M l = h – орбитален момент. Проекцията може да приеме квантови стойности, които се различават една от друга с h. M Sz =m S h, (m s =S), M lz =m l h. За да намерите стойността на собствения магнитен момент, умножете M s по съотношението s към M s, s – собствен магнитен момент:
s =-eM s /m e c=-(e h/m e c)=- B 3, B – Магнетон на Бор.
Знакът (-), защото M s и s са насочени в различни посоки. Електронният момент се състои от 2: орбитален M l и спин M s. Това събиране се извършва по същите квантови закони, по които се събират орбиталните моменти на различните електрони: Мj= h, j е квантовото число на общия ъглов момент.
22. Атом във външно магнитно поле. ефект на Зееман .
Ефектът на Zeeman е разделянето на енергийните нива, когато атомите са изложени на магнитно поле. Разделянето на нивата води до разделяне на спектралните линии на няколко компонента. Разделянето на спектралните линии, когато излъчващите атоми са изложени на магнитно поле, се нарича също ефект на Зееман. Зеемановото разделяне на нивата се обяснява с факта, че атом с магнитен момент j придобива допълнителна енергия E=- jB B в магнитно поле, jB е проекцията на магнитния момент върху посоката на полето. jB =- B gm j , E= B gm j , ( j =0, 1,…, J). Енергийното ниво се разделя на поднива, а големината на разделянето зависи от квантовите числа L, S, J на дадено ниво.
Собствени механични и магнитни моменти (завъртане)
ОБОСНОВКА ЗА СЪЩЕСТВУВАНЕТО НА СПИН. Уравнението на Шрьодингер позволява да се изчисли енергийният спектър на водорода и по-сложните атоми. Експерименталното определяне на нивата на атомната енергия обаче показа, че няма пълно съгласие между теорията и експеримента. Прецизните измервания разкриха фината структура на нивата. Всички нива, с изключение на основното, са разделени на няколко много близки поднива. По-специално, първото възбудено ниво на водородния атом ( н= 2) се разделят на две поднива с енергийна разлика от само 4,5 10 -5 eV. За тежките атоми степента на фино разделяне е много по-голяма, отколкото за леките атоми.
Възможно е да се обясни това несъответствие между теорията и експеримента, като се използва предположението (Uhlenbeck, Goudsmit, 1925), че електронът има друга вътрешна степен на свобода - спин. Според това предположение електронът и повечето други елементарни частици, наред с орбиталния ъглов импулс, имат и собствен механичен ъглов момент. Този присъщ момент се нарича спин.
Наличието на въртене върху микрочастица означава, че в някои отношения тя е като малък въртящ се връх. Тази аналогия обаче е чисто формална, тъй като квантовите закони значително променят свойствата на ъгловия момент. Според квантовата теория една точкова микрочастица може да има свой собствен момент. Важно и нетривиално квантово свойство на спина е, че само той може да зададе предпочитана ориентация в частица.
Наличието на присъщ механичен момент в електрически заредените частици води до появата на техния собствен (спинов) магнитен момент, насочен в зависимост от знака на заряда, паралелен (положителен заряд) или антипаралелен (отрицателен заряд) на спиновия вектор. Неутрална частица, например неутрон, също може да има свой собствен магнитен момент.
Съществуването на спин в електрона е показано от експериментите на Стърн и Герлах (1922) чрез наблюдение на разделянето на тесен сноп от сребърни атоми под въздействието на нехомогенно магнитно поле (в хомогенно поле моментът само променя ориентацията; само в нееднородно поле се движи постъпателно или покрай полето или срещу него).в зависимост от посоката спрямо полето). Невъзбудените сребърни атоми са в сферично симетрично s-състояние, тоест с орбитален импулс, равен на нула. Магнитният момент на системата, свързан с орбиталното движение на електрона (както в класическата теория), е право пропорционален на механичния момент. Ако последното е нула, тогава магнитният момент също трябва да е нула. Това означава, че външното магнитно поле не трябва да влияе върху движението на сребърните атоми в основно състояние. Опитът показва, че такова влияние съществува.
В експеримента лъч от сребърни, алкални метални и водородни атоми беше разделен, но Винагисамо наблюдавани два пакета, еднакво отклонени в противоположни посоки и разположени симетрично спрямо лъча при липса на магнитно поле. Това може да се обясни само с факта, че магнитният момент на валентния електрон в присъствието на поле може да приеме две стойности, еднакви по големина и противоположни по знак.
Експерименталните резултати водят до заключението, че че разделянето в магнитно поле на сноп от атоми от първата група на периодичната система, които очевидно са в s-състояние, на две компоненти се обяснява с две възможни състояния на спиновия магнитен момент на валентния електрон.Големината на проекцията на магнитния момент върху посоката на магнитното поле (именно тя определя ефекта на отклонение), установена от експериментите на Щерн и Герлах, се оказа равна на т.нар. Магнетон на Бор
Фината структура на енергийните нива на атомите, които имат един валентен електрон, се обяснява с наличието на спин в електрона, както следва. В атоми (с изключение на с-състояние) поради орбитално движение има електрически токове, чието магнитно поле влияе върху спиновия магнитен момент (така нареченото спин-орбитално взаимодействие). Магнитният момент на електрона може да бъде ориентиран или по протежение на полето, или срещу полето. Състоянията с различна ориентация на спина се различават леко по енергия, което води до разделянето на всяко ниво на две. Атомите с няколко електрона във външната обвивка ще имат по-сложна фина структура. Така в хелий, който има два електрона, има единични линии (синглети) в случай на антипаралелни електронни завъртания (общият спин е нула - парахелий) и тройни линии (триплети) в случай на паралелни завъртания (общият спин е ч- ортохелий), които съответстват на три възможни проекции върху посоката на магнитното поле на орбиталните токове на общия спин на два електрона (+h, 0, -h).
Така редица факти доведоха до необходимостта да се припише нова вътрешна степен на свобода на електроните. За да се опише напълно състоянието, заедно с три координати или всяка друга тройка от количества, които съставляват квантовомеханичния набор, е необходимо също да се посочи стойността на проекцията на въртене върху избраната посока (модулът на въртене не е необходимо да се посочва , защото както показва опитът, не се променя за никоя частица при какви обстоятелства).
Спиновата проекция, подобно на проекцията на орбиталния импулс, може да се промени с кратно ч. Тъй като бяха наблюдавани само две ориентации на спина на електрони, Уленбек и Гудсмит предположиха, че проекцията на спина на електрона С zза всяка посока може да приеме две стойности: С z = ±h/2.
През 1928 г. Дирак получава релативистично квантово уравнение за електрона, от което следва съществуването и въртенето на електрона з/2без специални хипотези.
Протонът и неутронът имат същия спин 1/2 като електрона. Спинът на фотона е равен на 1. Но тъй като масата на фотона е нула, тогава са възможни две, а не три от неговите проекции +1 и -1. Тези две проекции в електродинамиката на Максуел съответстват на две възможни кръгови поляризации на електромагнитна вълна, по часовниковата стрелка и обратно на часовниковата стрелка спрямо посоката на разпространение.
СВОЙСТВА НА ОБЩИЯ ИМПУЛС НА ИМПУЛСА.Както орбиталният импулс M, така и спиновият импулс S са величини, които приемат само квантови дискретни стойности. Нека сега разгледаме общия ъглов момент, който е векторната сума на споменатите моменти.
Дефинираме оператора на общия ъглов момент като сбор от операторите и
Операторите и пътуват, тъй като операторът действа върху координатите, но операторът не действа върху тях. Може да се покаже, че
това означава, че проекциите на общия ъглов импулс не комутират една с друга по същия начин като проекциите на орбиталния импулс. Операторът комутира с всяка проекция, от което следва, че операторът и операторът на всяка (с изключение на една) проекция съответстват на физически величини и са сред едновременно измеримите. Операторът също пътува с оператори и.
Определихме състоянието на електрона в полето на централната сила с три квантови числа: n, l, m.Квантови нива д нобикновено се определят от две квантови числа n, l.В този случай спинът на електрона не беше взет под внимание. Ако вземем предвид и спина, тогава всяко състояние се оказва по същество двойно, тъй като са възможни две ориентации на спина С z = хм с ; м с = ±1/2. Така към трите квантови числа се добавя четвърто м с, т.е. трябва да се означи вълновата функция, отчитаща спина.
За всеки срок д n,lимаме (2 л+ 1) състояния, различни по ориентацията на орбиталния импулс (брой м), всяко от които на свой ред се разлага на две състояния, които се различават по спин. Следователно има 2 (2 л+ 1) -кратна дегенерация.
Ако сега вземем предвид слабото взаимодействие на спина с магнитното поле на орбиталните токове, тогава енергията на състоянието също ще зависи от ориентацията на спина спрямо орбиталния момент. Енергийната промяна по време на такова взаимодействие е малка в сравнение с енергийната разлика между нивата с различни n,lи следователно новите линии, които възникват, са близо една до друга.
По този начин разликата в ориентациите на спиновия момент по отношение на вътрешното магнитно поле на атома може да обясни произхода на множеството спектрални линии. От горното следва, че за атоми с един оптичен електрон са възможни само дублети (двойни линии) поради две ориентации на спина на електрона. Това заключение се потвърждава от експериментални данни. Нека сега се обърнем към номерирането на атомните нива, като вземем предвид мултиплетната структура. Когато се вземе предвид спин-орбиталното взаимодействие, нито орбиталният импулс, нито спиновият импулс имат специфична стойност в състояние със специфична енергия (операторите не комутират с оператора). Според класическата механика ще имаме прецесия на векторите и около вектора на общия въртящ момент, както е показано на фиг. 20. Общият момент остава постоянен. Подобна ситуация се случва в квантовата механика. При отчитане на спиновото взаимодействие само общият момент има определена стойност в състояние с дадена енергия (операторът комутира с оператора). Следователно, когато се взема предвид спин-орбиталното взаимодействие, състоянието трябва да се класифицира според стойността на общия момент. Общият момент се квантува според същите правила като орбиталния момент. А именно, ако въведем квантовото число й, което задава момента Дж, Че
И проекцията в някаква посока е 0 zима значението Дж z = хм й, при което й= l + л с (л с= S), ако спинът е успореден на орбиталния момент, и й= | аз - л с| ако са антипаралелни. По подобен начин м й = m + m с (м с= ±1/2). Тъй като l,m са цели числа и л с , л м- тогава половинки
й = 1/2, 3/2, 5/2, … ; м й= ±1/2, ±3/2, … , ± й.

В зависимост от ориентацията на спина, енергията на термина ще бъде различна, а именно ще бъде за й = л+ ½ и й = |л- S|. Следователно в този случай енергийните нива трябва да се характеризират с числата n,l и числото j, което определя общия момент, тоест E = E nlj.
Вълновите функции ще зависят от спиновата променлива S z и ще бъдат различни за различните j: .
Квантови нива при дадена л, различни по значение й, са близки един до друг (те се различават по енергията на спин-орбиталното взаимодействие). Четворка на числата n, l, j, m йможе да приема следните стойности:
н= 1, 2, 3,…; л= 0, 1, 2,…, н- 1; й = l + l сили | л - л с |; л с= ±1/2;
-j ? м й ? й.
Стойността на орбиталния момент l се обозначава в спектроскопията с буквите s, p, d, f и т.н. Основното квантово число се поставя пред буквата. Номерът е посочен долу вдясно й.Следователно, например, нивото (термата) с н= 3, l = 1, й= 3/2 се обозначава като 3 Р 3/2. Фигура 21 показва диаграма на нивата на водородоподобен атом, като се вземе предвид мултиплетната структура. Редове 5890? и 5896? форма

известен натриев дублет: жълти линии D2 и D1. 2 с-терминът е далеч от 2 Р-термини, както трябва да бъде във водородоподобни атоми ( л-отстранена дегенерация).
Всяко от разглежданите нива д nlпринадлежи на (2 й+ 1) състояния, различни по брой м й, тоест ориентацията на общия момент J в пространството. Само когато се приложи външно поле, тези нива на сливане могат да се разделят. При липса на такова поле имаме (2 й+ 1)-кратна дегенерация. Така че термин 2 с 1/2 има израждане 2: две състояния, които се различават по ориентация на спина. Срок 2 Р 3/2 има четирикратно израждане според ориентациите на момента Дж, м й= ±1/2, ±3/2.
ЗЕЕМАН ЕФЕКТ.П. Зееман, изучавайки емисионния спектър на натриевите пари, поставени във външно магнитно поле, открива разделянето на спектралните линии на няколко компонента. Впоследствие, въз основа на квантово-механичните концепции, това явление беше обяснено с разделянето на атомните енергийни нива в магнитно поле.
Електроните в атома могат да бъдат само в определени дискретни състояния, при промяна на които се излъчва или абсорбира квант светлина. Енергията на атомното ниво зависи от общия орбитален момент, характеризиращ се с орбиталното квантово число Л, и общия спин на неговите електрони, характеризиращ се със спиновото квантово число С. Номер Лможе да приема само цели числа и число С- цели и полуцели числа (в единици ч). В посоката, която могат да поемат съответно (2 Л+ 1) и (2 С+ 1) позиции в пространството. Следователно нивото на данните ЛИ Сизроден: състои се от (2 Л+ 1)(2S +1) поднива, енергиите на които (ако не се вземе предвид спин-орбиталното взаимодействие) съвпадат.
Спин-орбиталното взаимодействие обаче води до факта, че енергията на нивата зависи не само от количествата ЛИ С,но също и върху относителната позиция на векторите на орбиталния импулс и спина. Следователно енергията се оказва зависима от общия въртящ момент М = М Л + М С, определено от квантовото число Дж, а нивото с даденото ЛИ Ссе разделя на няколко поднива (образувайки мултиплет) с различни Дж. Това разделяне се нарича структура на фино ниво. Благодарение на фината структура, спектралните линии също се разделят. Например, д-натриевата линия съответства на прехода от нивото Л = 1 , С= ½ на ниво c Л = 0, С= S. Първото от тях (нива) е дублет, съответстващ на възможните стойности Дж= 3/2 и Дж= Ѕ ( Дж =Л + С; С= ±1/2), а вторият няма фина структура. Ето защо д-линията се състои от две много близки линии с дължини на вълните 5896? и 5890?.
Всяко ниво на мултиплета все още остава изродено поради възможността за ориентация на общия механичен момент в пространството по (2 й+ 1) упътвания. В магнитно поле това израждане се премахва. Магнитният момент на атома взаимодейства с полето, а енергията на такова взаимодействие зависи от посоката. Следователно, в зависимост от посоката, атомът придобива различна допълнителна енергия в магнитното поле и зеемановото разделяне на нивото на (2 й+ 1) поднива.
Разграничете нормалният (прост) ефект на Zeeman, когато всяка линия е разделена на три компонента и аномалния (сложен) ефект, когато всяка линия е разделена на повече от три компонента.
За да разберем общите принципи на ефекта на Зееман, нека разгледаме най-простия атом - водородния атом. Ако водороден атом се постави във външно еднородно магнитно поле с индукция IN,то поради взаимодействието на магнитния момент Р мс външно поле атомът ще придобие допълнителна стойност в зависимост от модулите и взаимната ориентация INИ следобеденергия
UB= -pmB = -pmBB,
Където pmB- проекция на магнитния момент на електрона върху посоката на полето.
Като се има предвид това Р mB = - хм л /(2м)(магнитно квантово число м л= 0, ±1, ±2, …, ±l), получаваме
Магнетон на Бор.
Обща енергия на водороден атом в магнитно поле
където първият член е енергията на кулоновото взаимодействие между електрон и протон.
От последната формула следва, че при липса на магнитно поле (B = 0), енергийното ниво се определя само от първия член. Кога е B? 0, трябва да се вземат предвид различни допустими стойности на m l. Тъй като за даденост нИ лчислото m l може да приеме 2 л+ 1 възможни стойности, тогава първоначалното ниво ще се раздели на 2 л+ 1 поднива.
На фиг. 22а показва възможни преходи във водородния атом между състояния Р(л= 1) и с (л= 0). В магнитно поле p-състоянието се разделя на три поднива (при l = 1 m = 0, ±1), от всяко от които могат да възникнат преходи към s ниво и всеки преход се характеризира със собствена честота: Следователно, в спектъра се появява триплет (нормален ефект на Зееман). Имайте предвид, че по време на преходите се спазват правилата за избор на квантови числа:
На фиг. Фигура 22b показва разделянето на енергийните нива и спектралните линии за прехода между състоянията д(л= 2) и стр(л= 1). състояние дв магнитно поле

се разделя на пет поднива, състояние p на три. Когато се вземат предвид правилата за преход, са възможни само преходите, посочени на фигурата. Както се вижда, в спектъра се появява триплет (нормален ефект на Зееман).
Нормалният ефект на Zeeman се наблюдава, ако оригиналните линии нямат фина структура (те са синглети). Ако първоначалните нива имат фина структура, тогава в спектъра се появяват по-голям брой компоненти и се наблюдава аномален ефект на Zeeman.
МЕХАНИЧНИ И МАГНИТНИ МОМЕНТИ НА ЕЛЕКТРОНА
Орбитален магнитен момент на електрон
Всеки ток, както е известно, генерира магнитно поле. Следователно електрон, чийто орбитален механичен момент е различен от нула, също трябва да има магнитен момент.
От класическите концепции ъгловият момент има формата
където е скоростта и е радиусът на кривината на траекторията.
Магнитният момент на затворен ток с площ създава магнитен момент
е единицата, нормална към равнината, и са зарядът и масата на електрона.
Сравнявайки (3.1) и (3.2), получаваме
Магнитният момент е свързан с механичния момент чрез множител
което се нарича магнитомеханично (жиромагнитно) отношение за електрона.
За моментните проекции имаме същата връзка
Преходът към квантовата механика се осъществява чрез замяна на числените уравнения с операторни уравнения
Формули (3.5) и (3.6) са валидни не само за електрон в атом, но и за всички заредени частици, които имат механичен момент.
Собствената стойност на оператора е равна на
където е магнитното квантово число (вижте раздел 2.1)
Константата се нарича магнетон на Бор
В единици SI това е J/T.
По същия начин можете да получите собствените стойности на магнитния момент
където е орбиталното квантово число.
Често се използва запис
Където . Знакът минус понякога се пропуска.
Собствени механични и магнитни моменти на електрон (спин)
Електронът има четвърта степен на свобода, която е свързана със собствения механичен (и следователно магнитен) момент на електрона - спин. Наличието на спин следва от релативисткото уравнение на Дирак
където е векторна матрица и са четириредови матрици.
Тъй като количествата са четириредови матрици, вълновата функция трябва да има четири компонента, които могат да бъдат удобно записани като колона. Ние няма да прилагаме решения (3.12), но ще постулираме наличието на спин (собствен момент) на електрона като някакво емпирично изискване, без да се опитваме да обясним неговия произход.
Нека се спрем накратко на онези експериментални факти, от които следва съществуването на спин на електрони. Едно такова пряко доказателство са резултатите от опита на немските физици Щерн и Герлах (1922) върху пространственото квантуване. В тези експерименти лъчи от неутрални атоми бяха прекарани през област, в която беше създадено нееднородно магнитно поле (фиг. 3.1). В такова поле частица с магнитен момент придобива енергия и върху нея ще действа сила
който може да раздели лъча на отделни компоненти.
Първите експерименти изследват снопове от сребърни атоми. Лъчът беше прекаран по оста и се наблюдава разцепване по оста. Главният компонент на силата е равен на
Ако сребърните атоми не са възбудени и са на по-ниско ниво, тоест в състояние (), тогава лъчът изобщо не трябва да се разделя, тъй като орбиталният магнитен момент на такива атоми е нула. За възбудени атоми (), лъчът ще трябва да се раздели на нечетен брой компоненти в съответствие с броя на възможните стойности на магнитното квантово число ().
Всъщност беше наблюдавано разделяне на лъча на два компонента. Това означава, че магнитният момент, който причинява разделянето, има две проекции върху посоката на магнитното поле и съответното квантово число приема две стойности. Резултатите от експеримента подтикват холандските физици Uhlenbeek и Goudsmit (1925) да изложат хипотеза за електронът има свои собствени механични и свързани с тях магнитни моменти.
По аналогия с орбиталното число въвеждаме квантовото число, което характеризира собствения механичен импулс на електрона. Нека определим по броя на разделянията. следователно
Квантовото число се нарича спиново квантово число и характеризира собствения или спиновия ъглов момент (или просто „въртене“). Магнитното квантово число, което определя проекциите на спиновия механичен момент и спиновия магнитен момент на спина, има две значения. Тъй като , a , тогава не съществуват други стойности и следователно
Срок завъртанеидва от английската дума завъртане, което означава да въртя.
Спиновият ъглов момент на електрона и неговата проекция се квантуват съгласно обичайните правила:
Както винаги, при измерване на количество се получава една от двете възможни стойности. Преди измерването е възможно всяко тяхно наслагване.
Съществуването на спин не може да се обясни с въртенето на електрона около собствената му ос. Максималната стойност на механичния въртящ момент може да се получи, ако масата на електрона е разпределена по екватора. Тогава, за да се получи величината на момента на подреждане, линейната скорост на екваториалните точки трябва да бъде m/s (m е класическият радиус на електрона), тоест значително по-голяма от скоростта на светлината. Следователно нерелативистичното третиране на спина е невъзможно.
Да се върнем към експериментите на Щерн и Герлах. Познавайки големината на разделянето (по величината), можем да изчислим големината на проекцията на спиновия магнитен момент върху посоката на магнитното поле. Той представлява един магнетон на Бор.
Получаваме връзката между и:
величина
се нарича спиново магнитомеханично съотношение и е два пъти орбиталното магнитомеханично съотношение.
Същата връзка съществува между магнитните и механичните моменти на въртене:
Нека сега намерим стойността:
Обаче е обичайно да се казва, че спиновият магнитен момент на един електрон е равен на един магнетон на Бор. Тази терминология се е развила исторически и се дължи на факта, че когато измерваме магнитен момент, обикновено измерваме неговата проекция и тя е точно равна на 1.