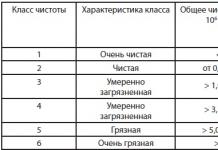
Практическата работа включва четири експеримента.
Опит 1
Калциниране на медна тел и взаимодействие на меден (II) оксид със сярна киселина
Запалете спиртната лампа (газова горелка). Вземете медната жица с щипки за тигел и я поставете в пламъка. След известно време извадете жицата от пламъка и почистете всички черни отлагания, които са се образували върху нея, върху лист хартия. Повторете опита няколко пъти. Поставете получения черен налеп в епруветка и налейте в нея разтвор на сярна киселина. Загрейте сместа. какво наблюдаваш
Образувало ли се е ново вещество при нагряване на медта? Запишете уравнението на химичната реакция и определете нейния тип въз основа на броя и състава на първоначалния
вещества и продукти на реакцията. Какви признаци на химична реакция забелязахте? Образувано ли е ново вещество, когато меден (II) оксид реагира със сярна киселина? Определете вида на реакцията въз основа на броя и състава на изходните материали и продуктите на реакцията и напишете нейното уравнение.
1. При калциниране на медна тел, медта ще се окисли:

и се образува черен меден (II) оксид. Това е сложна реакция.
2. Полученият меден (II) оксид се разтваря в сярна киселина, разтворът става син и се образува меден (II) сулфат:
Това е реакция на обмен.
Взаимодействие на мрамор с киселина
Поставете 1-2 парчета мрамор в малка чаша. Изсипете достатъчно солна киселина в чашата, за да покрие парчетата. Запалете треска и я донесете в чашата.
Образуват ли се нови вещества, когато мраморът реагира с киселина? Какви са знаците химична реакциягледа ли? Напишете уравнението на химичната реакция и посочете вида й въз основа на броя и състава на изходните вещества и продуктите на реакцията.
1. Мрамор, разтворен в солна киселина, възниква химическа реакция:

Опит 3
Взаимодействие на железен (III) хлорид с калиев тиоцианат
Изсипете 2 ml разтвор на железен (III) хлорид в епруветка и след това няколко капки разтвор на калиев тиоцианат KSCN - сол на киселината HSCN, с киселинен остатък SCN -.
Какви признаци придружават тази реакция? Запишете неговото уравнение и типа на реакцията въз основа на броя и състава на изходните материали и реакционните продукти.
О.С.ГАБРИЕЛЯН,
И. Г. ОСТРУМОВ,
А.К.АХЛЕБИНИН
ЗАПОЧНЕТЕ С ХИМИЯ
7 клас
Продължение. За начало вижте № 1, 2, 3, 4, 5, 6, 7, 8, 9, 10/2006 г.
Глава 3.
Явления, възникващи с вещества
(край)
§18. Химична реакция.
Поток и условия за прекратяване
химична реакция
Всички разгледани по-горе методи за разделяне на смеси се основават на разликите във физичните свойства на веществата, образуващи смесите, и се отнасят до физични явления. Има обаче и химични явления. Такива явления са придружени от трансформация на вещества, те се наричат химична реакция.
Нека сравним физични явления, лежащи в основата на разделянето на смеси и химични реакции, водещи до производството на нови химични съединения, използвайки примера на смес от желязо и сяра на прах.
Смесете старателно железни стружки и сяра на прах (тегловно съотношение 7:4). Оказа се смесица от две прости вещества, при което всеки запазва свойствата си (предложете начини за разделяне на получената смес).
Сместа се прехвърля в епруветка и се нагрява на пламъка на спиртна лампа. Започва химическа реакция на желязото със сярата, в резултат на което се образува ново вещество - железен сулфид. Реакционен продукт – съединение, чиито свойства се различават както от свойствата на желязото, така и на сярата. Например, не се привлича от магнит, потъва във вода, не ръждясва и не гори (фиг. 78).
Нека опишем проведената химична реакция с думи:
желязо + сяра = железен сулфид
и химични формули:
За да се осъществи този химичен процес, бяха необходими две условия: контакт на реагиращите вещества и първоначално подаване на топлина (нагряване).
Първото условие е задължително за всички химични процеси, в които участват две или повече вещества. Второто не винаги е задължително.
Демонстрационен експеримент. Поставете малко мраморно парче в епруветка и добавете разтвор на солна киселина. Получава се бързо отделяне на газ (фиг. 79).
Епруветката се затваря със запушалка с газоотвеждаща тръба и върхът й се спуска в друга епруветка с варна вода. Фактът, че протича химична реакция, може да се съди по появата на бяла утайка - помътняване на варовита вода (фиг. 80).
Какъв газ е бил отделен при първия експеримент? Какъв е реагентът за този газ във втория опит?
Не е необходимо нагряване и за двете реакции.
Можете да опишете протичащите реакции, като използвате имената на веществата:
мрамор + солна киселина калциев хлорид + въглероден диоксид + вода,
въглероден диоксид + варова вода калциев карбонат + вода.
Химиците обаче използват вместо думи химични формули:
CaCO 3 + HCl CaCl 2 + CO 2 + H 2 O,
CO 2 + Ca(OH) 2 CaCO 3 + H 2 O.
За протичането на някои реакции контактът на веществата или тяхното нагряване не е достатъчен. Ако възникнат такива реакции, те протичат много бавно. За да се ускори този процес, се използват специални вещества, наречени катализатори.
Катализаторите са вещества, които ускоряват химичните реакции, но в края на реакцията остават непроменени качествено и количествено.
Наричат се биологични катализатори от протеинова природа ензими, или ензими.
Нека демонстрираме ефекта на катализаторите, като използваме следния експеримент.
Демонстрационен експеримент. Малък обем разтвор на водороден прекис (по-точно пероксид) се излива в голяма епруветка. Към разтвора се добавят няколко зърна прах от манганов диоксид, който действа като катализатор. Започва бързо отделяне на газ - кислород, което се вижда от проблясването на тлееща треска, поставена в горната част на епруветката (фиг. 81).
Нека повторим подобен експеримент, само че вместо манганов диоксид, поставяме малко каша от прясно нарязани картофи, съдържаща ензима, в епруветка с водороден прекис. Наблюдаваме бързо освобождаване на кислород.
Протичащата химическа реакция може да бъде представена с имената на веществата:
или техните формули:
![]()
По този начин, необходимо условиеза протичане на химични реакции е контактът на реагиращите вещества. В някои случаи е необходимо нагряване или използване на катализатори.
Познаването на условията за възникване на реакции ви позволява да ги контролирате: да ускорите, забавите или спрете напълно. Последното обстоятелство е много важно, например, за спиране на реакциите на горене при гасене на пожари.
Както знаете, горенето е взаимодействието на веществата с кислорода във въздуха. Следователно, за да се потуши пожар, е необходимо да се спре достъпът на кислород до горящите предмети. Това се постига чрез напълването им с вода, различни пени, пясък, хвърляне на дебел плат или използване на специални устройства - пожарогасители (фиг. 82).
1. Какви условия са необходими за протичане на химични реакции?
2. Дайте примери за реакции от Ежедневието, които не изискват първоначално нагряване.
3. Какво представляват катализаторите? Какво представляват ензимите?
4. Назовете методите за гасене на пожари, които знаете.
5. С помощта на учител или специална литература прегледайте дизайна на пожарогасител с въглероден диоксид. Какъв е принципът на неговото действие?
6. Прочетете инструкциите за използване на висококачествени прахове за пране - синтетични перилни препарати (SDC) с добавени ензими. Какви са предимствата на SMS, съдържащи ензими, пред обикновените SMS?
7. Защо гасите пожари или горящи дървени сгради с вода? Каква е ролята на водата в този процес?
8. Защо не можете да загасите горящо масло с вода?
9. Защо не можете да гасите горящи електрически уреди или електрическа инсталация с вода?
§19. Признаци на химични реакции
Вече знаете, че същността на химичните реакции е превръщането на едно вещество в друго. Често такива трансформации са придружени от външни ефекти, които се възприемат от сетивата. Така викат признаци на химични реакции.
Могат да се вземат предвид външни признаци на химични реакции: образуване на утайка (фиг. 83, А, см.
с. 10), изпускане на газ (фиг. 83, b), миризма, промяна на цвета (фиг. 83, V), отделяне или поглъщане на топлина.
В предишния параграф вече се запознахте с някои признаци на реакции. По този начин, когато железните стружки взаимодействат със сяра на прах, цветът на сместа се променя и се отделя топлина (вижте.
ориз. 78, b). Когато мраморът взаимодейства с солна киселинасе наблюдава отделяне на газ (виж фиг. 79). При взаимодействие въглероден двуокисс варовита вода се появи утайка (виж фиг. 80). Проблясването на тлееща треска в присъствието на кислород също е признак за протичаща реакция (виж фиг. 81).
Нека илюстрираме тези признаци на химични реакции с помощта на демонстрация и ученически експерименти.
Демонстрационен експеримент. Бехерова чаша съдържа безцветен алкален разтвор. Може да се открие с помощта на специални вещества - индикатори (от лат. индико- посочвам). Индикатор за алкали е безцветен алкохолен разтвор на фенолфталеин.
Ако добавите няколко капки разтвор на фенолфталеин към съдържанието на чашата, течността ще стане пурпурна, "сигнализирайки" наличието на алкален разтвор в чашата.
След това към съдържанието на чашата се добавя киселинен разтвор, докато пурпурният цвят изчезне. Какъв признак на химическа реакция наблюдавате?
Вижте някои други реакции, включващи промени в цвета на разтворите.
Демонстрационен експеримент. В две чаши има многоцветни разтвори: виолетово-розов (калиев перманганат в алкална среда) и оранжев ( подкислен разтворкалиев дихромат). Към двете чаши се добавя безцветен разтвор на натриев сулфит. Какво показва протичането на химични реакции в стъклата (фиг. 84)?
Студентски експеримент. Разтворете няколко кристала калиев перманганат (буквално два или три!) В чаша вода (изчакайте, докато веществото се разтвори напълно). Потопете таблетката в получения разтвор аскорбинова киселина. Какви промени показват, че протича химична реакция?
Студентски експеримент. В газова запалка с прозрачно тяло виждате безцветна течност. Това е смес от два газа, чиито имена можете да прочетете в бензиностанции или битови бутилки - пропан и бутан. Какъв вид газове са те, ако имат течност? агрегатно състояние? Факт е, че има повишено налягане вътре в резервоара. Натиснете вентила, без да запалвате газта. Чуваш ли съскане? Пропанът и бутанът избухнаха, приемайки газообразното състояние, познато на нормалното налягане.
Запалете си запалката. Протича химическа реакция на горене на пропан и бутан (фиг. 85). Доближете пламъка за кратко до стъклото на прозореца. Обяснете наблюдаваното явление.
Сравнете цвета на пламъка на запалката с пламъка на газовата печка и свещта. Какъв пламък пуши? Проследете връзката между блясъка на пламъка и неговите димни свойства.
Преминаването на пропан и бутан от течно състояние вътре в запалка в газообразно състояние извън нея е физическо явление. И изгарянето на тези газове е химическа реакция.
Някои реакции са придружени от образуването на трудно разтворими вещества, които се утаяват.
Демонстрационен експеримент. Разтвор на железен хлорид се добавя към две чаши, съдържащи безцветен разтвор на натриев хидроксид и жълтеникав разтвор на жълта кръвна сол (фиг. 86). Какво показва химични явления?
Не само образуването на утайка, но и нейното разтваряне е признак за протичане на химична реакция.
Демонстрационен експеримент. Към стъклото с кафявата утайка, получена в предишния опит, се добавя солна киселина. Какво показва, че протича химическа реакция?
Благодарение на образуването на неразтворимо вещество - калциев карбонат (запомнете: това е и креда, и мрамор) в резултат на естествени химични реакции, каменните "ледени висулки" - сталактити и сталагмити - "растят" в пещерите.
Формирането на сталактитни колони отнема хиляди години. Можете да симулирате фрагмент от този процес у дома (задача 9 в края на този параграф). Ясно е, че вместо сталактит ще получите просто утайка от калциев карбонат.
1. Каква е разликата химични явленияот физическите?
2. Към какви явления бихте класифицирали горенето на свещ и „горенето“ на електрическа крушка?
3. Дайте примери за известни от ежедневието реакции, които са придружени от промяна на цвета, отделяне на газ или образуване на утайка.
4. Какъв процес се случва, когато лекарства като UPSA аспирин ефервесцентни таблетки или витамин С се разтварят във вода?
5. Какви качествени реакции се използват за разграничаване на кислорода от въглеродния диоксид?
6. Мраморните скулптури се унищожават от така наречения киселинен дъжд. Какво явление се случва в този случай?
7. Изсипете купчина сух речен пясък в дълбока чиния. Накиснете пясъка в алкохол. Направете малка вдлъбнатина на върха на конуса и поставете в нея смес от добре смесени 2 г сода за хляб и 13 г пудра захар. Остава само да запалите сместа и да наблюдавате протичането на няколко химични реакции наведнъж: изгаряне на алкохол, овъгляване на захар, разлагане на сода при нагряване.
8. Налейте половин чаша вода в литров стъклен буркан и пуснете една ефервесцентна таблетка аспирин с размер на грахово зърно. Какво се наблюдава в този случай? За да определите какъв газ се отделя в резултат на химическа реакция, спуснете тлееща треска в буркана (без да докосвате течността).
9. Залейте с половин чаша преварена вода и разбъркайте половин чаена лъжичка гасена вар (има в железарските магазини). Целият прах няма да се разтвори, но това не е проблем. Оставете сместа да се утаи и изсипете бистрия разтвор от утайката в чиста чаша.
Използвайки сламка за сок (внимавайте да не напръскате!), издухайте издишания въздух през разтвора. Скоро ще стане облачно: ще се образува бяла утайка. Направете заключение за протичането на химична реакция в стъклото.
ПРАКТИЧЕСКА РАБОТА № 6.
Изследване на процеса на корозия на желязото
(домашен експеримент)
Вероятно знаете процеса на корозия (ръжда) на желязото. Под въздействието на външни условия върху метала се образува ръжда. В тази работа ще разберете как външни условиявърху скоростта на корозия на желязото.
За провеждане на експеримента ще ви трябва:
Три пластмасови бутилки с капачки от 250–500 ml;
Три големи гвоздея с дължина 5–10 см;
Шкурка за оголване на нокти;
Сварена вода;
Вода от чешмата;
Сол.
Ноктите трябва да се измият със сапун, за да се отстрани слоят масло, който ги предпазва от ръжда. Когато ноктите изсъхнат, шлайфайте повърхността им с шкурка и изплакнете с преварена вода.
Първата бутилка се напълва напълно със студена преварена вода, поставя се пирон и се затваря плътно с капака.
Напълнете втората бутилка до половината със студена чешмяна вода и поставете пирон в нея. Не е необходимо да затваряте бутилката с капак.
Първо добавете две супени лъжици готварска сол към третата бутилка. Напълнете го до половината със студена чешмяна вода, затворете капака и разбъркайте добре. Когато цялата сол се разтвори, поставете третия и последен пирон в бутилката. Не е необходимо да затваряте бутилката с капак.
За да избегнете объркване, номерирайте всяка бутилка с флумастер.
Поставете бутилките на уединено място. Ако водата от втората и третата бутилка се изпари, просто добавете към тях чешмяна вода.
След една седмица върху ноктите ще се образува ръжда. Вижте къде има повече и къде по-малко.
Запишете вашите наблюдения, като поставите номерата на бутилките до съответните описания, например:
Малко или почти никаква ръжда не се е образувала -...;
Ръждата се вижда ясно, залепва здраво за гвоздея -...;
Има толкова много ръжда, че не залепва за пирона, пада от него и образува кафява утайка на дъното на бутилката - ....
Направете заключения за това как съставът на разтвора и достъпът на въздух влияят на процеса на корозия.
Практическа работа №4. Химия 8 клас (към учебника на Габриелян О.С.)
Признаци на химични реакции
Мишена: изучавайте признаците на химичните реакции, консолидирайте знанията за видовете химични реакции.Оборудване : епруветки, поставка за епруветки, нагревател, кибрит, държач за епруветки, чаша 50 ml, щипка за тигел, медна жица, треска, лист хартия, шпатула.
Реактиви: разтвори на сярна киселина, железен (III) хлорид, калиев тиоцианат, калиев карбонат, калциев хлорид; мрамор, солна киселина.
Опит 1.
Калциниране на медна тел и взаимодействие на меден (II) оксид със сярна киселина.
Работен ред:
1) Запалете нагревателя
Използвайки щипки за тигел, вземете медната жица и я поставете в пламъка.
След известно време извадете жицата от пламъка и почистете всички черни отлагания, които са се образували върху нея, върху лист хартия.
Повтаряме опита няколко пъти.
Наблюдавани явления:
По време на процеса на нагряване червеният меден проводник се покрива с черно покритие, т.е. образува се ново вещество.
Уравнение на реакцията:
2Cu + O 2 = 2CuO
Това е сложна реакция.
Заключение:
2) Поставете полученото черно покритие в епруветка.
Добавете към него разтвор на сярна киселина и го загрейте внимателно.
Наблюдавани явления:
Черният прах се разтваря, разтворът става зеленикаво-син, т.е. образуват се нови вещества.
Уравнение на реакцията:
2CuO + H 2 SO 4 = CuSO 4 + H 2 O
Това е реакция на обмен.
Заключение:
промяната в цвета е знак за химическа реакция.
Опит 2.
Взаимодействие на мрамор с киселина.
Поставете 1-2 парчета мрамор в чаша.
Добавете солна киселина към чашата, така че парчетата да бъдат покрити с нея.
Наблюдавани явления:
има бързо отделяне на безцветен газ, "кипене" на разтвора.
Запалваме факла и я внасяме в чашата.
Наблюдавани явления:
светлината изгасва.
Това означава, че образуваното ново вещество е въглероден диоксид.
Уравнение на реакцията:
Това е реакция на обмен.
Заключение:
Отделянето на газ е признак на химическа реакция.
Опит 3.
Изсипете 2 ml разтвор на железен (III) хлорид FeCl3 в епруветка и след това няколко капки разтвор на калиев тиоцианат KSCN.
Наблюдавани явления:
разтворът става кървавочервен.
Уравнение на реакцията:
Това е реакция на обмен.
Заключение:
промяната в цвета е знак за химическа реакция.
Опит 4.
Взаимодействие на натриев карбонат с калциев хлорид.
Работен ред:
Изсипете 2 ml разтвор на натриев карбонат Na 2 CO 3 в епруветка.
Добавете няколко капки разтвор на калциев хлорид CaCl2.
Наблюдавани явления:
образува се бяла утайка.
Уравнение на реакцията:
Това е реакция на обмен.
Заключение:
Валежите са признак на химическа реакция.
Общо заключение за работата: чрез правене практическа работабяха изучени признаци на химични реакции, консолидирани бяха знанията за видовете химични реакции.
"Химия. 8 клас." ОПЕРАЦИОННА СИСТЕМА. Габриелян (ГДЗ)
Практическа работа № 4 (4) | Признаци на химични реакции. Обменни реакции
Експеримент 1. „Калциниране на медна жица и взаимодействие на меден (II) оксид със сярна киселина“
Завършване на работата:
Въвеждаме медна тел в пламъка на горелката, медта се нагрява и окислява във въздуха:
Протича химическа реакция (образува се утайка), в резултат на което се образува черно покритие - меден (II) оксид.
Почистете всякакви отлагания, които са се образували върху лист хартия. Нека повторим опита няколко пъти. Поставете получената плака в епруветка и изсипете разтвор на сярна киселина в нея, загрейте сместа. Целият прах ще се разтвори, разтворът ще стане син:
Протича химическа реакция (утайката се разтваря, цветът на системата се променя) и се образува меден (II) сулфат.
Експеримент 2. „Взаимодействие на мрамор с киселина“
Завършване на работата:
Те поставиха парче мрамор в чаша и наляха солна киселина в чашата, колкото да покрие парчето; Наблюдаваме отделянето на газови мехурчета:
Протича химическа реакция (отделя се газ), мраморът се разтваря и се отделя CO 2 . Те донесоха запалена треска в стъклото и тя изгасна, защото CO 2 не поддържа горенето.
Експеримент 3. „Взаимодействие на железен (III) хлорид с калиев тиоцианат.“
Завършване на работата:
2 ml разтвор на железен хлорид се изсипват в епруветка и след това няколко капки разтвор на калиев тиоцианат, разтворът става яркочервен:
Възникнала е химическа реакция (цветът се е променилсистеми).
Експеримент 4. „Взаимодействие на натриев сулфат с бариев хлорид.“
Завършване на работата:
В епруветка се изсипват 2 ml разтвор на натриев сулфат, след което се добавят няколко капки бариев хлорид. Наблюдаваме утаяването на бяла финокристална утайка:
Възникнала е химическа реакция (образува се утайка).
Заключение: Признаци на обменни реакции: 1) промяна в цвета на реакционната система; 2) утаяване в реакционната система; 3) изпускане на газ вреакционна система.
Авак Авакян

Съобщавам химически „новини“. Моите опоненти, опитвайки се да създадат „унищожителни опровержения“ на моите геоложки открития в Дрокино, заявиха в своите опуси, че концентрирани сярна киселина, уж не реагира с варовици и мрамори и затова съм толкова „необразован“ и „като цяло луд“, че „направо“ не знам тази „всеизвестна Истина“. Като оправдание те цитират идеята, че уж сярната киселина образува гипс, който, като неразтворимо съединение, покрива варовика или мрамора с филм, който го предпазва от по-нататъшно действие на киселината и следователно „мигновено блокира“ тази реакция. Този „бисер“ за първи път беше изразен от Дмитрий Лвович Бръзгалов (възпитател в детска градина; в интернет ми пише анонимно „помия“); след това същата идея беше публикувана от Борис Михайлович Лобастов (студент по геология в Красноярск), формулирайки я с особен патос: „в геологията изследванията за наличие на карбонати се извършват с помощта на солна киселина, чиято концентрация не надвишава 10%. Защо не използваме сярна киселина, особено във висока концентрация, след като е по-силна? Работата е там, че реакцията на сярна киселина и калцит (калциев карбонат) произвежда много слабо разтворимо съединение - калциев сулфат (известен още като гипс), който моментално напълно покрива повърхността на карбонатите и спираоттам и реакцията." (дума " спира“ той подчерта с удебелен шрифт).
Целият шум се дължи на факта, че използвах сярна киселина с концентрация 93% („акумулаторна киселина“), за да тествам скалите Дрокино за наличие на карбонати (предимно калцит), въпреки че „според инструкциите“ официалните геолози са „предписани » Използвайте 10% солна киселина за този тест. Виждайки, че правя тестове с грешна киселина, моите критици ме нападнаха, опитвайки се да докажат, че киселината, която използвах, уж не реагира с калцита и че следователно съм невеж и всичките ми геоложки резултати в околностите на Дрокино са глупости на шарлатанин.
По правило просто ме мързи да отговарям на този вид „бисери“: все пак не говорим за сложна химическа екзотика, а за банални основи от училищен учебник. Но тъй като моите нещастни критици започнаха пламенно да умножават този „бисер“ и страстно да го „препостват“ с цел дискредитиране на цялата ми работа във всички области, намерих време, ПЛЕНЕНО тази химическа реакция към ВИДЕО и публикува това ВИДЕО на няколко сървъра; тук, щракнете върху избора (на първата връзка - ИЗТЕГЛИ ):
Продължителност - малко повече три минути. Първо, вариант на тази реакция е показан чрез пипетиране на киселина върху полирана мраморна повърхност; след това същата реакция се показва в епруветка (парче от този мрамор се поставя в епруветка с киселина). За мрамора - БЛАГОДАРЯ на Игор Юриевич Табакаев (това е битка, тоест фрагмент от гробището Бадалък; не се страхувайте: никой не е извършил вандализъм в гробището, това е точно битка). Мраморът (истински, гробищен) е най-инертната форма на калцита (при тебешира тази реакция протича още по-бързо). И така - ето видео факт: тази реакция ПРЕДСТАВЯ (въпреки Бризгалов и Лобастов)! Просто моите уж „високо образовани“ опоненти „от упор“ не знаят, че, първо, гипсът е, макар и слабо, забележимо разтворим в чиста вода; и второ, той може да реагира със сярна киселина, първо за да образува калциев ХИДРОСУЛФАТ Ca(HSO 4) 2 и след това асоциираното CaSO 4 × 3H 2 SO 4, като и двете от тези съединения са РАЗТВОРИМИ (вижте например „Аналитична химия на калций; страница 11"; или "Курс аналитична химия. Том първи. Качествен анализ; Ф.П. Тредуел, У.Т. Гол; 1946 г.; стр. 292") и се образуват толкова по-лесно, колкото по-висока е концентрацията на киселината. По този начин, в излишък от концентрирана сярна киселина, НЯМА да видите CaSO 4: ще получите прозрачен разтвор на Ca (HSO 4) 2 и CaSO 4 × 3H 2 SO 4.
P.S. Изненадваща е „свестността” както на тези критици, така и на читателите, които са съгласни с тях. Е, наистина ли е толкова трудно да го вземеш и провериш? В края на краищата нито мраморът, нито сярната киселина 93% са нито дефицит, нито забранени продукти.