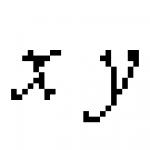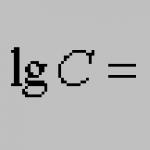На 1 март 1869 г. Менделеев завършва работата си „Експеримент върху система от елементи, основана на тяхното атомно тегло и химическо сходство“. Този ден се счита за деня на откриването на периодичния закон на елементите от D.M. Менделеев. „Откритието на Д. И. Менделеев е свързано с фундаменталните закони на Вселената, като закона на Нютон за всеобщото привличане или теорията на относителността на Айнщайн, а Д. М. Менделеев е наравно с имената на тези велики физици.“ Академик А.И. Русанов.
"Периодичната таблицатъй като беше и си остава главната пътеводна звезда в най-новите решения на проблема за материята." Проф. А. Н. Реформатски.
„Когато подхождате към оценката на личности като Д. И. Менделеев, анализът на техните научно творчество, неволно се иска да се намерят в това произведение най-белязаните с печата на гениалността елементи. От всички признаци, които отличават гения и неговото проявление, два изглеждат най-показателни: първо, способността да се обхващат и интегрират широки области на знанието и, второ, способността за резки скокове на мисълта, за неочаквано сближаване на факти и концепции , които за обикновения смъртен изглеждат далеч един от друг и несвързани по никакъв начин, поне докато такава връзка не бъде открита и доказана." Л. А. Чугаев, професор по химия.
И самият Менделеев разбираше огромното значение на открития от него закон за науката. И вярваше в по-нататъшното му развитие. „Според периодичния закон бъдещето не заплашва унищожение, а само обещава надстройки и развитие.“ DI. Менделеев.
Оригиналният изглед на таблицата, написан на ръка от D.I. Менделеев.
Ако всичко научно познаниесвят би изчезнал поради някакъв катаклизъм, тогава за възраждането на цивилизацията един от основните закони ще бъде периодичният закон на D.I. Менделеев. Напредъкът в атомната физика, включително ядрена енергияа синтезът на изкуствени елементи стана възможен само благодарение на Периодичния закон. От своя страна те разшириха и задълбочиха същността на закона на Менделеев.
Периодичният закон играе огромна роляв развитието на химията и други природни науки. Открита е взаимната връзка между всички елементи и техните физични и химични свойства. Това постави естествената наука пред научен и философски проблем от огромно значение: тази взаимна връзка трябва да бъде обяснена.
Откриването на периодичния закон е предшествано от 15 години упорит труд. По времето, когато е открит периодичният закон, са били известни 63 химични елемента и е имало около 50 различни класификации. Повечето учени сравняват само елементи с подобни свойства, така че не успяха да открият закона. Менделеев сравнява всичко едно с друго, включително различни елементи. Менделеев записва на карти цялата известна информация за откритите и изучавани по това време химични елементи и техните съединения, подрежда ги в нарастващ ред на техните относителни атомни маси и анализира изчерпателно целия този набор, опитвайки се да намери определени закономерности в него. В резултат на интензивна творческа работа той открива сегменти в тази верига, в които имотите химически елементии образуваните от тях вещества се променят по подобен начин - периодично - периоди. С развитието на изследването на структурата на електронната обвивка на атомите стана ясно защо свойствата на атомите показват периодичност с увеличаване на атомната маса. Атомите с една и съща външна сфера образуват една група. Атомите с еднакъв брой външни сфери образуват един ред. Атомите с ядра, които имат еднакви заряди, но различни маси, имат еднакви химични свойства, но различни атомни тегла и са изотопи на един и същ химичен елемент. По същество свойствата на атомите отразяват свойствата на външните електронни обвивки, които са тясно свързани със законите на квантовата физика.
Самата периодична таблица е трансформирана многократно, показвайки различна информация за свойствата на атомите. Има и любопитни маси. 
Така наречената краткосрочна или кратка форма на ТМ 

Дълъг период или дълга форма на ТМ 
Изключително дълъг. 
Знамена на държави, указващи страната, в която елементът е открит за първи път. 
Имената на елементи, които са били отменени или са се оказали погрешни, като историята на дидимия Di - по-късно се оказва смес от два новооткрити елемента празеодим и неодим. 
Тук елементите, образувани по време на Голям взрив, синьо - синтезирано по време на първичната нуклеосинтеза, жълтият и зеленият цвят показват елементи, синтезирани съответно в дълбините на „малки“ и „големи“ звезди. Розов цвят - вещества (ядра), синтезирани по време на експлозия на свръхнова. Между другото, златото (Au) все още се синтезира при сблъсъци на неутронни звезди. Виолетово – изкуствено създадено в лаборатории. Но това не е цялата история... 
Тук различните цветове показват органични, неорганични и основни елементи, необходими за изграждането на телата на живите същества, включително и нас. 








Кула маса
Предложен през 2006 г. от Виталий Цимерман въз основа на идеите на Чарлз Джанет. Той изучава орбиталното запълване на атомите - начина, по който електроните са разположени спрямо ядрото. И въз основа на това той раздели всички елементи на четири групи, сортирайки ги според конфигурациите на техните електронни позиции. Масата е изключително семпла и функционална. 



Масата е спирала.
През 1964 г. Теодор Бенфей предложи поставянето на водород (Н) в центъра на масата и поставянето на другите елементи около него в спирала, която се развива по посока на часовниковата стрелка. Още на втория завой спиралата се разтяга на бримки, които съответстват на преходни метали и лантаниди с актиниди, предвидено е място за все още неизвестни суперактиноиди. Това придава на масата вид на екстравагантно дизайнерско решение. 
Маса - дъгова спирала.
Изобретен през 1975 г. от химика Джеймс Хайд. Той се интересуваше от органосилициеви съединения, така че кремъкът беше включен в основата на масата, тъй като имаше голямо числовръзки с други елементи. Различни категории елементи също са групирани в сектори и маркирани с желания цвят. Масата е по-красива от аналозите си, но поради криволинейната си форма не е лесна за използване. 






Тези таблици показват последователността на запълване на електронни обвивки. Поне някои от тях. Всички тези маси изглеждат много екзотични.
Таблица на изотопите. Тук се показват "времето на живот" на различни изотопи и тяхната стабилност в зависимост от масата на ядрото. Това обаче вече не е периодичната таблица, това е съвсем различно ( ядрена физика) история... 
Световният етер е субстанцията на ВСЕКИ химичен елемент и следователно ВСЯКА субстанция; той е Абсолютната истинска материя като Вселенската елементообразуваща Същност.Световният етер е източникът и венецът на цялата истинска периодична таблица, нейното начало и край - алфата и омегата на периодичната таблица на елементите на Дмитрий Иванович Менделеев.
В античната философия етерът (aithér-гръцки), заедно със земята, водата, въздуха и огъня, е един от петте елемента на битието (според Аристотел) - петата същност (quinta essentia - латински), разбирана като най-фината всепроникваща материя. IN края на XIXвек, хипотезата за световния етер (МЕ), изпълващ всичко, е широко разпространена в научните среди световно пространство. Той се разбира като безтегловна и еластична течност, която прониква във всички тела. Мнозина са се опитвали да обяснят съществуването на етера физични явленияи имоти.
Предговор.
Менделеев има две фундаментални научни открития:
1 - Откриване на периодичния закон в същността на химията,
2 - Откриване на връзката между субстанцията на химията и субстанцията на етера, а именно: частиците на етера образуват молекули, ядра, електрони и т.н., но не участват в химични реакции.
Етерът е частици материя с размер ~ 10-100 метра (всъщност те са „първите тухли” на материята).
Данни. Етерът беше в оригиналната периодична таблица. Клетката за Етер се намираше в нулевата група с инертни газове и в нулевия ред като основен системообразуващ фактор за изграждане на Системата от химични елементи. След смъртта на Менделеев таблицата е изкривена чрез премахване на Етер от нея и елиминиране на нулевата група, като по този начин се крие фундаменталното откритие с концептуално значение.
В съвременните етерни таблици: 1 - не се вижда, 2 - не се отгатва (поради липсата на нулева група).
Такава целенасочена фалшификация пречи на развитието на прогреса на цивилизацията.
Катастрофите, причинени от човека (напр. Чернобил и Фукушима), щяха да бъдат избегнати, ако бяха инвестирани достатъчно ресурси своевременно в разработването на истинска периодична таблица. Укриването на концептуално знание се случва на глобално ниво към „нисшата“ цивилизация.
Резултат. В училищата и университетите преподават изрязана периодична таблица.
Оценка на ситуацията. Периодичната таблица без етер е същото като човечеството без деца - можете да живеете, но няма да има развитие и бъдеще.
Резюме. Ако враговете на човечеството крият знание, то нашата задача е да разкрием това знание.
Заключение. Старата периодична таблица има по-малко елементи и повече прозорливост от съвременната.
Заключение. Ново ниво е възможно само ако се промени информационното състояние на обществото.
Долен ред. Връщането към истинската периодична таблица вече не е научен, а политически въпрос.
Какъв е основният политически смисъл на учението на Айнщайн?Тя се състоеше в прекъсване на достъпа на човечеството до неизчерпаеми природни източници на енергия по всякакъв начин, които бяха открити чрез изучаването на свойствата на световния етер. Ако успее по този път, глобалната финансова олигархия ще загуби властта в този свят, особено в светлината на ретроспективата на онези години: Рокфелер направиха невъобразимо състояние, надхвърлящо бюджета на Съединените щати, от петролни спекулации и загуба за ролята на петрола, която "черното злато" заемаше в този свят - ролята на кръвоносната система на глобалната икономика - не ги вдъхновяваше.
Това не вдъхнови други олигарси – кралете на въглищата и стоманата. Така финансовият магнат Морган веднага спря финансирането на експериментите на Никола Тесла, когато се доближи до безжичния пренос на енергия и извличането на енергия „от нищото“ – от световния етер. След това собственикът на огромен брой прилага на практика технически решенияникой не оказа финансова помощ - солидарността на финансовите магнати е като на крадците в закона и феноменално усещане откъде идва опасността. Защото срещу човечеството и е извършен саботаж, наречен „ Специална теорияОтносителност."
Един от първите удари дойде върху таблицата на Дмитрий Менделеев, в която етерът беше първото число; именно мислите за етера доведоха до брилянтното прозрение на Менделеев - неговата периодична таблица на елементите.

Глава от статията: V.G. Родионов. Мястото и ролята на световния етер в истинската таблица на D.I. Менделеев
6. Argumentum ad rem
Това, което сега се представя в училищата и университетите под заглавието „Периодична таблица на химичните елементи D.I. Менделеев” е откровена лъжа.
Последният път, когато истинската периодична система е публикувана в неизкривен вид през 1906 г. в Санкт Петербург (учебник „Основи на химията“, VIII издание). И само след 96 години забрава, оригиналната периодична таблица се издига за първи път от пепелта благодарение на публикуването на дисертация в списание ZhRFM на Руското физическо общество.
След внезапната смърт на Д. И. Менделеев и смъртта на неговите верни научни колеги в Руското физико-химическо общество, синът на приятеля и колега на Д. И. Менделеев в обществото, Борис Николаевич Меншуткин, пръв вдигна ръка за безсмъртното творение на Менделеев. Разбира се, Меншуткин не действа сам - той само изпълнява заповедта. В края на краищата новата парадигма на релативизма изискваше изоставянето на идеята за световния етер; и затова това изискване е издигнато до ранг на догма, а работата на Д. И. Менделеев е фалшифицирана.
Основното изкривяване на Таблицата е пренасянето на “нулевата група” на Таблицата в нейния край, надясно, и въвеждането на т.нар. "периоди". Подчертаваме, че такава (само на пръв поглед безобидна) манипулация е логически обяснима само като съзнателно премахване на основното методологично звено в откритието на Менделеев: периодичната система от елементи в нейното начало, източник, т.е. в горния ляв ъгъл на таблицата, трябва да има нулева група и нулев ред, където се намира елементът “X” (според Менделеев - “Нютоний”), - т.е. световно излъчване.
Освен това, бидейки единственият системообразуващ елемент от цялата таблица на производните елементи, този елемент “X” е аргументът на цялата периодична таблица. Прехвърлянето на нулевата група на таблицата към нейния край разрушава самата идея за този основен принцип на цялата система от елементи според Менделеев.
За да потвърдим горното, ще дадем думата на самия Д. И. Менделеев.
„... Ако аналозите на аргона изобщо не дават съединения, тогава е очевидно, че е невъзможно да се включи някоя от групите на предварително известни елементи и за тях трябва да се отвори специална група нула... Тази позиция на аргоновите аналози в нулевата група е строго логично следствие от разбирането на периодичния закон и следователно (поставянето в група VIII е очевидно неправилно) беше прието не само от мен, но и от Braizner, Piccini и други... Сега, когато стана извън най-малкото съмнение, че преди тази група I, в която трябва да бъде поставен водородът, съществува нулева група, чиито представители имат атомни тегла по-малки от тези на елементите от група I, струва ми се невъзможно да се отрече съществуването елементи, по-леки от водорода.


От тях нека първо да обърнем внимание на елемента от първия ред от 1-ва група. Означаваме го с "у". Очевидно ще има фундаменталните свойства на аргоновите газове... „Короний“, с плътност от около 0,2 спрямо водорода; и по никакъв начин не може да бъде световният етер.
Този елемент "y" обаче е необходим, за да се доближим мислено до този най-важен и следователно най-бързо движещ се елемент "x", който според мен може да се счита за етер. Бих искал условно да го нарека “Нютоний” - в чест на безсмъртния Нютон... Проблемът за гравитацията и проблемът за цялата енергия (!!! - В. Родионов) не може да си представим наистина решен без истинско разбиране на етера като световна среда, която предава енергия на разстояния. Истинското разбиране на етера не може да бъде постигнато, като се игнорира химията му и не се разглежда като елементарно вещество; елементарните субстанции вече са немислими без тяхното подчинение на периодичния закон” („Опит за химическо разбиране на световния етер.” 1905 г., стр. 27).

„Тези елементи, според големината на техните атомни тегла, заемат точно място между халидите и алкалните метали, както показва Рамзи през 1900 г. От тези елементи е необходимо да се формира специална нулева група, която за първи път е призната от Errere в Белгия през 1900 г. Считам за полезно да добавя тук, че пряко съдейки по невъзможността да се комбинират елементи от нулева група, аналозите на аргона трябва да се поставят преди елементите от група 1 и в духа на периодичната система да се очаква по-ниско атомно тегло за тях от за алкални метали.
Точно това се оказа. И ако е така, тогава това обстоятелство, от една страна, служи като потвърждение за правилността на периодичните принципи, а от друга страна, ясно показва връзката на аналозите на аргон с други известни преди това елементи. В резултат на това е възможно да се прилагат анализираните принципи дори по-широко от преди и да се очакват елементи от нулевата серия с атомни тегла, много по-ниски от тези на водорода.
Така може да се покаже, че в първия ред, първо преди водорода, има елемент от нулевата група с атомно тегло 0,4 (може би това е короният на Йонг), а в нулевия ред, в нулевата група, има е ограничаващ елемент с пренебрежимо малко атомно тегло, неспособен на химични взаимодействия и в резултат на това притежава изключително бързо собствено частично (газово) движение.
Тези свойства може би трябва да се припишат на атомите на всепроникващия (!!! – В. Родионов) световен етер. Посочих тази идея в предговора към тази публикация и в статия в руски журнал от 1902 г. ...” (“Основи на химията.” VIII изд., 1906 г., стр. 613 и сл.)
Истинската периодична таблица. Рибников Юрий Степанович.
Забранена физика. Теория на етера
Цялото видео от лекцията тук: Фалшификация на периодичната таблица
От коментарите:
За химията е достатъчна съвременната периодична таблица на елементите.
Ролята на етера може да бъде полезна в ядрени реакции, но това не е много важно.
Отчитането на влиянието на етера е най-близо до явленията на изотопния разпад. Това отчитане обаче е изключително сложно и наличието на модели не се приема от всички учени.
Най-простото доказателство за наличието на етер: Феноменът на анихилация на двойка позитрон-електрон и появата на тази двойка от вакуум, както и невъзможността за улавяне на електрон в покой. Също електромагнитното поле и пълна аналогия между фотони във вакуум и звукови вълни - фонони в кристали.
Етерът е диференцирана материя, така да се каже, атоми в разглобено състояние, или по-правилно, елементарни частици, от които се образуват бъдещи атоми. Следователно тя няма място в периодичната таблица, тъй като логиката на изграждане на тази система не предполага включването на неинтегрални структури, каквито са самите атоми. Иначе е възможно да се намери място за кварки, някъде в минус първия период.
Самият етер има по-сложна многостепенна структура на проявление в световното съществуване, отколкото е известно за него съвременна наука. Веднага след като тя разкрие първите тайни на този неуловим етер, тогава ще бъдат изобретени нови двигатели за всички видове машини на напълно нови принципи.
Всъщност Тесла беше може би единственият, който беше близо до разгадаването на мистерията на така наречения етер, но той умишлено беше възпрепятстван да осъществи плановете си. И така, до ден днешен не се е родил геният, който ще продължи делото на великия изобретател и ще ни разкаже какво всъщност представлява тайнственият етер и на какъв пиедестал може да бъде поставен.
Мнозина са чували за Дмитрий Иванович Менделеев и за „Периодичния закон за промените в свойствата на химичните елементи в групи и серии“, който той открива през 19 век (1869 г.) (авторското име на таблицата е „Периодична система от елементи в Групи и серии”).
Откриването на таблицата на периодичните химични елементи беше един от важните етапи в историята на развитието на химията като наука. Откривателят на таблицата е руският учен Дмитрий Менделеев. Един необикновен учен с широк научен възглед успя да обедини всички идеи за природата на химичните елементи в една последователна концепция.
История на отваряне на маса
До средата на 19 век са открити 63 химични елемента и учените по света многократно са правили опити да комбинират всички съществуващи елементи в една концепция. Беше предложено елементите да се поставят в реда на увеличаване на атомната маса и да се разделят на групи според сходни химични свойства.
През 1863 г. химикът и музикант Джон Александър Нюланд предлага своята теория, който предлага схема на химични елементи, подобна на откритата от Менделеев, но работата на учения не е приета на сериозно от научната общност поради факта, че авторът е увлечен чрез търсенето на хармония и връзката на музиката с химията.
През 1869 г. Менделеев публикува своята диаграма на периодичната таблица в Journal of the Russian Chemical Society и изпраща известие за откритието до водещите световни учени. Впоследствие химикът многократно усъвършенства и подобрява схемата, докато придобие обичайния си вид.
Същността на откритието на Менделеев е, че с увеличаване на атомната маса химичните свойства на елементите се променят не монотонно, а периодично. След определен брой елементи с различни свойства, свойствата започват да се повтарят. Така калият е подобен на натрия, флуорът е подобен на хлора, а златото е подобно на среброто и медта.
През 1871 г. Менделеев най-накрая комбинира идеите в периодичния закон. Учените предсказаха откриването на няколко нови химически елемента и описаха техните химични свойства. Впоследствие изчисленията на химика бяха напълно потвърдени - галий, скандий и германий напълно съответстваха на свойствата, които им приписва Менделеев.
Но не всичко е толкова просто и има някои неща, които не знаем.
Малко хора знаят, че Д. И. Менделеев е един от първите световноизвестни руски учени от края на 19 век, който защитава в световната наука идеята за етера като универсална субстанциална същност, който му придава фундаментално научно и приложно значение в разкриването на тайните на Съществуването и за подобряване на икономическия живот на хората.
Има мнение, че периодичната система на химичните елементи, която се преподава официално в училищата и университетите, е фалшификация. Самият Менделеев в работата си, озаглавена „Опит за химическо разбиране на световния етер“, даде малко по-различна таблица.
Последният път, когато истинската периодична система е публикувана в неизкривен вид през 1906 г. в Санкт Петербург (учебник „Основи на химията“, VIII издание).
Разликите са видими: нулевата група е преместена в 8-ма, а елементът, по-лек от водорода, с който трябва да започне таблицата и който условно се нарича нютоний (етер), е напълно изключен.
Същата маса е увековечена и от другаря "КРЪВАВ ТИРАН". Сталин в Санкт Петербург, Московски авеню. 19. ВНИИМ им. Д. И. Менделеева (Всеруски изследователски институт по метрология)
Паметникът-таблица на Периодичната система на химичните елементи от Д. И. Менделеев е изработен с мозайки под ръководството на професора от Художествената академия В. А. Фролов (архитектурен проект на Кричевски). Паметникът се основава на таблица от последното приживе 8-то издание (1906 г.) на Основите на химията на Д. И. Менделеев. Елементите, открити по време на живота на Д. И. Менделеев, са посочени в червено. Елементи, открити от 1907 до 1934 г , обозначено в синьо.
Защо и как стана така, че ни лъжат така нагло и открито?
Мястото и ролята на световния етер в истинската таблица на Д. И. Менделеев
Мнозина са чували за Дмитрий Иванович Менделеев и за „Периодичния закон за промените в свойствата на химичните елементи в групи и серии“, който той открива през 19 век (1869 г.) (авторското име на таблицата е „Периодична система от елементи в Групи и серии”).
Мнозина също са чували, че D.I. Менделеев е организатор и постоянен ръководител (1869-1905) на Руското обществено научно сдружение, наречено „Руско химическо общество“ (от 1872 г. - „Руско физико-химическо общество“), което през цялото си съществуване издава световноизвестното списание ZhRFKhO, до до ликвидацията както на дружеството, така и на неговото списание от Академията на науките на СССР през 1930 г.
Но малко хора знаят, че Д. И. Менделеев е един от последните световноизвестни руски учени от края на 19 век, който защитава в световната наука идеята за етера като универсална субстанциална същност, който му придава фундаментално научно и приложно значение в разкриването на тайни Битие и за подобряване на икономическия живот на хората.
Още по-малко са тези, които знаят, че след внезапната (!!?) смърт на Д. И. Менделеев (27.01.1907 г.), тогава признат за изключителен учен от всички научни общности по света, с изключение на Петербургската академия на науките, неговият Основното откритие беше "Периодичният закон" - беше умишлено и широко фалшифициран от световната академична наука.
И много малко са онези, които знаят, че всичко това е свързано с нишката на жертвеното служение на най-добрите представители и носители на безсмъртната руска физическа мисъл за благото на народа, обществената полза, въпреки нарастващата вълна на безотговорност. във висшите слоеве на обществото от онова време.
По същество настоящата дисертация е посветена на цялостното развитие на последната теза, тъй като в истинската наука всяко пренебрегване на съществени фактори винаги води до неверни резултати.
Елементите от нулевата група започват всеки ред от други елементи, разположени от лявата страна на таблицата, "... което е строго логично следствие от разбирането на периодичния закон" - Менделеев.
Особено важно и дори изключително място в смисъла на периодичния закон принадлежи на елемента “х” – “Нютоний” – към световния етер. И този специален елемент трябва да се намира в самото начало на цялата таблица, в така наречената „нулева група на нулевия ред“. Освен това, като системообразуващ елемент (по-точно системообразуваща същност) на всички елементи на Периодичната таблица, световният етер е същественият аргумент на цялото многообразие от елементи на Периодичната таблица. Самата таблица в това отношение действа като затворен функционал на самия този аргумент.
източници:
Всъщност немският физик Йохан Волфганг Доберейнер забеляза групирането на елементи още през 1817 г. В онези дни химиците все още не са разбрали напълно природата на атомите, както е описано от Джон Далтън през 1808 г. В неговия " нова системахимическа философия", обясни Далтън химична реакция, като приемем, че всяко елементарно вещество се състои от определен вид атом.
Далтън предположи, че химичните реакции произвеждат нови вещества, когато атомите се разделят или съединят. Той вярваше, че всеки елемент се състои изключително от един вид атом, който се различава от другите по тегло. Кислородните атоми тежаха осем пъти повече от водородните атоми. Далтън вярва, че въглеродните атоми са шест пъти по-тежки от водорода. Когато елементите се комбинират, за да създадат нови вещества, количеството на реагиращите вещества може да се изчисли с помощта на тези атомни тегла.
Далтън греши за някои от масите - кислородът всъщност е 16 пъти по-тежък от водорода, а въглеродът е 12 пъти по-тежък от водорода. Но неговата теория направи идеята за атомите полезна, вдъхновявайки революция в химията. Точното измерване на атомната маса се превърна в основен проблем за химиците през следващите десетилетия.
Размишлявайки върху тези скали, Доберейнер отбеляза, че някои групи от три елемента (той ги нарече триади) показват интересна връзка. Бромът, например, имаше атомна маса някъде между тази на хлора и йода и всичките три елемента показаха подобно химично поведение. Литият, натрият и калият също бяха триада.
Други химици забелязаха връзки между атомните маси и , но чак през 1860-те атомни масистанат достатъчно добре разбрани и измерени, за да се развие по-задълбочено разбиране. Английският химик Джон Нюландс забеляза, че подреждането на известни елементи в реда на увеличаване на атомната маса води до повтаряне на химичните свойства на всеки осми елемент. Той нарече този модел „закон на октавите“ в статия от 1865 г. Но моделът на Нюландс не се задържа много добре след първите две октави, което накара критиците да предложат той да подреди елементите по азбучен ред. И както скоро разбира Менделеев, връзката между свойствата на елементите и атомните маси е малко по-сложна.
Организация на химичните елементи
Менделеев е роден в Тоболск, Сибир, през 1834 г., седемнадесетото дете на родителите си. Той живееше пъстър живот, преследвайки различни интереси и пътувайки по пътя към видни хора. В момента на получаване висше образование V педагогически институтв Петербург едва не умира от тежка болест. След дипломирането си той преподава в средни училища (това е необходимо, за да получава заплата в института), като едновременно изучава математика и природни наукиза магистърска степен.
След това работи като учител и преподавател (и пише научни трудове), докато не получи стипендия за продължително изследване на най-добрите химически лабораторииЕвропа.
Връщайки се в Санкт Петербург, той се оказва без работа, затова написва отлично ръководство с надеждата да спечели голяма парична награда. През 1862 г. това му донася Демидовската награда. Работил е и като редактор, преводач и консултант в различни области на химията. През 1865 г. той се връща към научните изследвания, получава докторска степен и става професор в университета в Санкт Петербург.
Скоро след това Менделеев започва да преподава неорганична химия. Докато се подготвяше да овладее тази нова (за него) област, той беше недоволен от наличните учебници. Затова реших да напиша своя. Организацията на текста изискваше организиране на елементите, така че въпросът за най-доброто им подреждане постоянно го вълнуваше.
До началото на 1869 г. Менделеев е постигнал достатъчно напредък, за да осъзнае, че някои групи от подобни елементи показват редовно увеличаване на атомните маси; други елементи с приблизително същите атомни маси имаха подобни свойства. Оказа се, че подреждането на елементите по тяхното атомно тегло е ключът към тяхната класификация.

Периодична таблица от Д. Менелеев.
от по мои собствени думиМенделеев, той структурира мисленето си, като записва всеки от 63-те известни тогава елемента на отделна карта. След това, чрез нещо като игра на химически пасианс, той намери модела, който търсеше. Подреждайки картите във вертикални колони с атомни маси от ниски към високи, той постави елементи с подобни свойства във всеки хоризонтален ред. Родена е периодичната таблица на Менделеев. Той го състави на 1 март, изпрати го за печат и го включи в учебника си, който скоро ще бъде публикуван. Той също така бързо подготви работата за представяне пред Руското химическо общество.
„Елементите, подредени по размерите на техните атомни маси, се показват ясно периодични свойства“, пише Менделеев в своя труд. „Всички сравнения, които направих, ме доведоха до заключението, че размерът на атомната маса определя природата на елементите.“
Междувременно немският химик Лотар Майер също работи върху организацията на елементите. Той подготви таблица, подобна на Менделеевата, може би дори по-рано от Менделеев. Но Менделеев публикува първия си.
Въпреки това, много по-важно от победата над Майер беше как Периодик използва своята таблица, за да направи изводи за неоткритите елементи. Докато приготвяше масата си, Менделеев забеляза, че някои карти липсват. Трябваше да остави празни места, за да могат известните елементи да се подредят правилно. По време на живота му три празни пространства бяха запълнени с неизвестни досега елементи: галий, скандий и германий.
Менделеев не само предсказа съществуването на тези елементи, но и правилно описа техните свойства в детайли. Галият, например, открит през 1875 г., имаше атомна маса 69,9 и плътност шест пъти по-голяма от тази на водата. Менделеев предсказа този елемент (той го нарече ека-алуминий) само с тази плътност и атомна маса от 68. Неговите предсказания за ека-силиций съвпадаха много с германия (открит през 1886 г.) по атомна маса (72 прогнозирана, 72,3 действителна) и плътност. Той също така правилно прогнозира плътността на съединенията на германия с кислорода и хлора.
Периодичната таблица стана пророческа. Изглеждаше, че в края на тази игра този пасианс от елементи ще се разкрие. В същото време самият Менделеев беше майстор в използването на собствената си таблица.
Успешните предсказания на Менделеев му спечелиха легендарен статут на майстор на химическото вълшебство. Но историците днес спорят дали откриването на предсказаните елементи циментира приемането на неговия периодичен закон. Приемането на закон може да има повече общо с неговата способност да обяснява установените химически връзки. Във всеки случай точността на предсказване на Менделеев със сигурност привлече вниманието към достойнствата на неговата таблица.
До 1890 г. химиците широко приемат неговия закон като крайъгълен камък в химическите познания. През 1900 г. бъдещето Нобелов лауреатв областта на химията, Уилям Рамзи го нарече „най-голямото обобщение, правено някога в химията“. И Менделеев направи това, без да разбира как.
Математическа карта
В много случаи в историята на науката велики прогнози, базирани на нови уравнения, са се оказвали верни. По някакъв начин математиката разкрива някои от тайните на природата, преди експериментаторите да ги открият. Един пример е антиматерията, друг е разширяването на Вселената. В случая на Менделеев предсказанията за нови елементи възникват без творческа математика. Но всъщност Менделеев открива дълбока математическа карта на природата, тъй като неговата таблица отразява стойността, математически правила, управляващ атомната архитектура.
В книгата си Менделеев отбелязва, че "вътрешните различия в материята, която съставят атомите" може да са отговорни за периодично повтарящите се свойства на елементите. Но той не следваше тази линия на мислене. Всъщност дълги години той размишляваше колко важна е атомната теория за неговата маса.
Но други успяха да прочетат вътрешното съобщение на масата. През 1888 г. немският химик Йоханес Вислицен обяви, че периодичността на свойствата на елементите, подредени по маса, показва, че атомите са съставени от правилни групи от по-малки частици. Така че, в известен смисъл, периодичната таблица наистина предвижда (и предоставя доказателства за) комплекс вътрешна структураатоми, докато никой нямаше ни най-малка представа как всъщност изглежда един атом или дали изобщо има някаква вътрешна структура.
По времето на смъртта на Менделеев през 1907 г. учените знаеха, че атомите са разделени на части: плюс някои положително заредени компоненти, което прави атомите електрически неутрални. Ключът към подреждането на тези части идва през 1911 г., когато физикът Ърнест Ръдърфорд, работещ в Университета на Манчестър в Англия, открива атомно ядро. Малко след това Хенри Моузли, работещ с Ръдърфорд, демонстрира, че количеството положителен заряд в ядрото (броят на протоните, които то съдържа, или неговият „атомен номер“) определя правилния ред на елементите в периодичната таблица.

Хенри Моузли.
Атомната маса беше тясно свързана с атомното число на Моузли — достатъчно тясно, че подреждането на елементите по маса се различаваше само на няколко места от подреждането по номер. Менделеев настоя, че тези маси са неверни и трябва да бъдат преизмерени и в някои случаи беше прав. Останаха няколко несъответствия, но атомното число на Моузли се вписа идеално в таблицата.
Приблизително по същото време датският физик Нилс Бор осъзнава, че квантовата теория определя разположението на електроните около ядрото и че най-външните електрони определят химичните свойства на елемента.
Подобни подредби на външни електрони ще се повтарят периодично, обяснявайки моделите, които периодичната таблица първоначално разкрива. Бор създава своя собствена версия на таблицата през 1922 г., базирана на експериментални измервания на енергиите на електроните (заедно с някои улики от периодичния закон).
Таблицата на Бор добавя елементи, открити от 1869 г., но това е същият периодичен ред, открит от Менделеев. Без да има ни най-малка представа за , Менделеев създава таблица, отразяваща атомната архитектура, продиктувана от квантовата физика.
Новата таблица на Бор не е нито първата, нито последната версия на оригиналния дизайн на Менделеев. Оттогава са разработени и публикувани стотици версии на периодичната таблица. Модерна форма- в хоризонтален дизайн, за разлика от оригиналната вертикална версия на Менделеев - става широко популярен едва след Втората световна война, благодарение до голяма степен на работата на американския химик Глен Сиборг.
Сиборг и колегите му създадоха няколко нови елемента синтетично, с атомни номера след урана, последният естествен елемент на масата. Сиборг видя, че тези елементи, трансураниевите (плюс трите елемента, които предхождат урана), изискват нов ред в таблицата, което Менделеев не е предвидил. Таблицата на Сиборг добави ред за тези елементи под сходния редкоземен ред, който също нямаше място в таблицата.
Приносът на Seaborg към химията му спечели честта да назове собствения си елемент, seaborgium, с числото 106. Това е един от няколкото елемента, кръстени на известни учени. И в този списък, разбира се, има елемент 101, открит от Сийборг и колегите му през 1955 г. и наречен менделевий - в чест на химика, който преди всички други е спечелил място в периодичната таблица.
Посетете нашия канал за новини, ако искате повече истории като тази.
Периодичната система е подреден набор от химични елементи, тяхната естествена класификация, която е графичен (табличен) израз на периодичния закон на химичните елементи. Неговата структура, в много отношения подобна на съвременната, е разработена от Д. И. Менделеев въз основа на периодичния закон през 1869–1871 г.
Прототипът на периодичната система е „Опитът на система от елементи, основана на тяхното атомно тегло и химическо сходство“, съставен от Д. И. Менделеев на 1 март 1869 г. В продължение на две години и половина ученият непрекъснато подобрява „Опитът на една система“ въведе идеята за групи, серии и периоди от елементи. В резултат на това структурата на периодичната таблица придоби до голяма степен съвременни очертания.
Понятието за мястото на даден елемент в системата, определено от номерата на групата и периода, става важно за нейното развитие. Въз основа на тази концепция Менделеев стига до извода, че е необходимо да се променят атомните маси на някои елементи: уран, индий, церий и неговите спътници. Това беше първото практическа употребапериодична система. Менделеев също предсказва за първи път съществуването и свойствата на няколко неизвестни елемента. Ученият описва подробно най-важните свойства на ека-алуминия (бъдещето на галия), ека-бора (скандия) и ека-силиция (германия). Освен това той прогнозира съществуването на аналози на манган (бъдещи технеций и рений), телур (полоний), йод (астат), цезий (Франция), барий (радий), тантал (протактиний). Предсказанията на учения по отношение на тези елементи са от общ характер, тъй като тези елементи се намират в малко проучени области на периодичната таблица.
Първите версии на периодичната система до голяма степен представляват само емпирично обобщение. В крайна сметка физическият смисъл на периодичния закон беше неясен; нямаше обяснение за причините за периодичната промяна на свойствата на елементите в зависимост от увеличаването на атомните маси. В това отношение много проблеми останаха нерешени. Има ли граници на периодичната таблица? Възможно ли е да се определи точният брой на съществуващите елементи? Структурата на шестия период остава неясна - какво е точното количество редкоземни елементи? Не беше известно дали все още съществуват елементи между водорода и лития, каква е структурата на първия период. Следователно, чак до физическото обосноваване на периодичния закон и развитието на теорията на периодичната система, са възниквали сериозни трудности повече от веднъж. Откритието през 1894–1898 г. е неочаквано. пет инертни газове, който сякаш нямаше място в периодичната таблица. Тази трудност беше елиминирана благодарение на идеята за включване на независима нулева група в структурата на периодичната таблица. Масово откриване на радиоелементи в началото на 19-ти и 20-ти век. (до 1910 г. техният брой е около 40) доведе до остро противоречие между необходимостта от поставянето им в периодичната таблица и съществуващата й структура. В шестия и седмия период за тях имаше само 7 свободни места. Този проблем беше решен чрез установяването на правила за смяна и откриването на изотопи.
Една от основните причини за невъзможността да се обясни физическият смисъл на периодичния закон и структурата на периодичната система беше, че не беше известно как е устроен атомът (виж Атом). Най-важният крайъгълен камък в развитието на периодичната таблица е създаването на атомния модел от Е. Ръдърфорд (1911 г.). На негова основа холандският учен А. Ван ден Брук (1913) предполага, че поредният номер на елемент в периодичната таблица е числено равен на заряда на ядрото на неговия атом (Z). Това е експериментално потвърдено от английския учен Г. Моузли (1913 г.). Периодичният закон получи физическа обосновка: периодичността на промените в свойствата на елементите започна да се разглежда в зависимост от Z - заряда на ядрото на атома на елемента, а не от атомната маса (вижте Периодичния закон на химичните елементи).
В резултат на това структурата на периодичната таблица беше значително укрепена. Определена е долната граница на системата. Това е водород - елементът с минимално Z = 1. Стана възможно точно да се оцени броят на елементите между водорода и урана. Бяха идентифицирани „пропуски“ в периодичната таблица, съответстващи на неизвестни елементи с Z = 43, 61, 72, 75, 85, 87. Въпросите за точния брой на редкоземните елементи обаче остават неясни и, най-важното, причините за периодичността на промените в свойствата на елементите не е разкрита в зависимост от Z.
Въз основа на установената структура на периодичната система и резултатите от изучаването на атомните спектри, датският учен Н. Бор през 1918–1921 г. развива идеи за последователността на изграждане на електронни обвивки и подобвивки в атомите. Ученият стигнал до извода, че подобни видове електронни конфигурации на външните обвивки на атомите периодично се повтарят. По този начин беше показано, че периодичността на промените в свойствата на химичните елементи се обяснява с наличието на периодичност в изграждането на електронни обвивки и подобвивки на атомите.
Периодичната таблица обхваща повече от 100 елемента. От тях всички трансуранови елементи (Z = 93–110), както и елементи с Z = 43 (технеций), 61 (прометий), 85 (астат), 87 (франция) са получени изкуствено. През цялата история на съществуването на периодичната система са предложени много голям брой (> 500) варианти за нейното графично представяне, главно под формата на таблици, както и под формата на различни геометрични форми(пространствени и равнинни), аналитични криви (спирали и др.) и др. Най-разпространени са късите, полудълги, дълги и стълбовидни форми на таблици. В момента се предпочита кратката форма.
Основният принцип за конструиране на периодичната таблица е нейното разделяне на групи и периоди. Концепцията на Менделеев за редица елементи не се използва днес, тъй като липсва физически смисъл. Групите от своя страна се делят на главна (а) и вторична (б) подгрупи. Всяка подгрупа съдържа елементи - химични аналози. Елементите на a- и b-подгрупите в повечето групи също показват известно сходство помежду си, главно в по-високи степени на окисление, които като правило са равни на номера на групата. Периодът е съвкупност от елементи, която започва с алкален метал и завършва с инертен газ (специален случай е първият период). Всеки период съдържа строго определен брой елементи. Периодичната таблица се състои от осем групи и седем периода, като седмият период все още не е завършен.
Особеност първипериод е, че съдържа само 2 газообразни елемента в свободна форма: водород и хелий. Мястото на водорода в системата е двусмислено. Тъй като проявява свойства, общи за алкалните метали и халогените, той се поставя или в 1а-, или в Vlla-подгрупа, или в двете едновременно, затваряйки символа в скоби в една от подгрупите. Хелият е първият представител на VIIIa‑подгрупа. Дълго време хелият и всички инертни газове бяха разделени в независима нулева група. Тази разпоредба изисква преразглеждане след синтеза химични съединениякриптон, ксенон и радон. В резултат на това благородните газове и елементите от предишната група VIII (желязо, кобалт, никел и платинени метали) бяха комбинирани в една група.
Второпериодът съдържа 8 елемента. Започва с алкалния метал литий, чиято единствена степен на окисление е +1. Следва берилий (метал, степен на окисление +2). Борът вече проявява слабо изразен метален характер и е неметал (степен на окисление +3). След бора, въглеродът е типичен неметал, който проявява както +4, така и -4 степени на окисление. Азотът, кислородът, флуорът и неонът са неметали, като азотът има най-висока степен на окисление +5, съответстваща на номера на групата. Кислородът и флуорът са сред най-активните неметали. Инертният газ неон завършва периода.
третопериод (натрий - аргон) също съдържа 8 елемента. Характерът на промяната в техните свойства е до голяма степен подобен на този, наблюдаван при елементите от втория период. Но тук има и известна специфика. Така магнезият, за разлика от берилия, е по-метален, както и алуминият в сравнение с бора. Силицият, фосфорът, сярата, хлорът, аргонът са типични неметали. И всички те, с изключение на аргона, показват по-високи степени на окисление, равни на номера на групата.
Както виждаме, и в двата периода, когато Z нараства, има ясно отслабване на металните елементи и увеличаване на неметални свойстваелементи. Д. И. Менделеев нарича елементите на втория и третия период (по думите му малки) типични. Елементите от малки периоди са сред най-често срещаните в природата. Въглеродът, азотът и кислородът (заедно с водорода) са органогени, т.е. основните елементи на органичната материя.
Всички елементи от първи-трети периоди са поставени в а-подгрупи.
Четвъртопериод (калий - криптон) съдържа 18 елемента. Според Менделеев това е първият голям период. След алкален металкалий и алкалоземен металкалцият е последван от поредица от елементи, състоящи се от 10 така наречени преходни метала (скандий - цинк). Всички те са включени в b-подгрупи. Повечето преходни метали показват по-високи степени на окисление, равни на номера на групата, с изключение на желязото, кобалта и никела. Елементите, от галий до криптон, принадлежат към а-подгрупите. За криптона са известни редица химични съединения.
ПетоПериодът (рубидий - ксенон) е подобен по структура на четвъртия. Съдържа и вложка от 10 преходни метала (итрий - кадмий). Елементите на този период имат свои собствени характеристики. В триадата рутений - родий - паладий са известни съединения за рутений, където той показва степен на окисление +8. Всички елементи от a-подгрупи показват по-високи степени на окисление, равни на номера на групата. Характеристиките на промените в свойствата на елементите от четвъртия и петия период с увеличаване на Z са по-сложни в сравнение с втория и третия период.
Шестопериод (цезий - радон) включва 32 елемента. Този период, освен 10 преходни метала (лантан, хафний - живак), съдържа и набор от 14 лантанида - от церий до лутеций. Елементите от церий до лутеций са химически много подобни и поради тази причина отдавна са включени в семейството на редкоземните елементи. В кратката форма на периодичната таблица серия от лантаниди е включена в клетката на лантана и декодирането на тази серия е дадено в долната част на таблицата (вижте Лантаниди).
Каква е спецификата на елементите на шестия период? В триадата осмий - иридий - платина степента на окисление +8 е известна за осмий. Астатът има доста ясно изразен метален характер. Радонът има най-голяма реактивност от всички благородни газове. За съжаление, поради факта, че е силно радиоактивен, химията му е малко проучена (вижте Радиоактивни елементи).
Седмопериодът започва от Франция. Подобно на шестия, той също трябва да съдържа 32 елемента, но все още са известни 24. Франций и радий са съответно елементи от подгрупи Ia и IIa, актиний принадлежи към подгрупа IIIb. Следва семейството на актинидите, което включва елементи от торий до лауренций и е разположено подобно на лантанидите. Декодирането на тази поредица от елементи също е дадено в долната част на таблицата.
Сега нека видим как се променят свойствата на химичните елементи подгрупипериодична система. Основният модел на тази промяна е засилването на металния характер на елементите с увеличаване на Z. Този модел е особено ясно проявяван в подгрупите IIIa–VIIa. За металите от Ia–IIIa подгрупи се наблюдава повишаване на химичната активност. За елементите от IVa–VIIa подгрупи с увеличаване на Z се наблюдава отслабване на химичната активност на елементите. За елементите от b-подгрупа естеството на промяната в химичната активност е по-сложно.
Теорията на периодичната система е разработена от Н. Бор и други учени през 20-те години. ХХ век и се основава на реална схема за образуване на електронни конфигурации на атомите (виж Атом). Според тази теория, с увеличаването на Z, запълването на електронни обвивки и подобвивки в атомите на елементите, включени в периодите на периодичната таблица, става в следната последователност:
| Цифри на периода | ||||||
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 1s | 2s2p | 3s3p | 4s3d4p | 5s4d5p | 6s4f5d6p | 7s5f6d7p |
Въз основа на теорията на периодичната система можем да дадем следната дефиниция на период: периодът е набор от елементи, започващ с елемент със стойност n, равна на номера на периода и l = 0 (s-елементи) и завършващ с елемент със същата стойност n и l = 1 (p-елементи елементи) (виж Атом). Изключение прави първият период, който съдържа само 1s елементи. От теорията на периодичната система следват номерата на елементите в периодите: 2, 8, 8, 18, 18, 32...
В таблицата символите на елементи от всеки тип (s-, p-, d- и f-елементи) са изобразени на определен цветен фон: s-елементи - на червено, p-елементи - на оранжево, d-елементи - на синьо, f-елементи - на зелено. Всяка клетка показва атомните номера и атомните маси на елементите, както и електронните конфигурации на външните електронни обвивки.
От теорията на периодичната система следва, че a-подгрупите включват елементи с n, равно на номера на периода, и l = 0 и 1. B-подгрупите включват онези елементи, в чиито атоми завършването на черупки, които преди това са останали възниква непълна. Ето защо първият, вторият и третият период не съдържат елементи от b-подгрупи.
Структурата на периодичната таблица на елементите е тясно свързана със структурата на атомите на химичните елементи. С увеличаването на Z подобни типове конфигурация на външните електронни обвивки периодично се повтарят. Именно те определят основните характеристики на химичното поведение на елементите. Тези особености се проявяват по различен начин за елементите от a-подгрупите (s- и p-елементи), за елементите от b-подгрупите (преходни d-елементи) и елементите от f-семействата - лантаниди и актиниди. Специален случай представляват елементите от първия период - водород и хелий. Водородът се характеризира с висока химическа активност, тъй като неговият единствен 1s електрон се отстранява лесно. В същото време конфигурацията на хелия (1s 2) е много стабилна, което определя неговата химическа неактивност.
За елементите на а-подгрупите външните електронни обвивки на атомите са запълнени (с n равно на номера на периода), следователно свойствата на тези елементи се променят значително с увеличаването на Z. Така във втория период литият (2s конфигурация ) - активен метал, лесно губейки единствения си валентен електрон; берилият (2s 2) също е метал, но по-малко активен поради факта, че неговите външни електрони са по-здраво свързани с ядрото. Освен това борът (2s 2 p) има слабо изразен метален характер и всички следващи елементи от втория период, в който е изградена подобвивката 2p, вече са неметали. Осемелектронната конфигурация на външната електронна обвивка на неона (2s 2 p 6) - инертен газ - е много силна.
Химичните свойства на елементите от втория период се обясняват с желанието на техните атоми да придобият електронна конфигурациянай-близкия инертен газ (хелиева конфигурация за елементи от литий до въглерод или неонова конфигурация за елементи от въглерод до флуор). Ето защо, например, кислородът не може да прояви по-висока степен на окисление, равна на номера на неговата група: за него е по-лесно да постигне неонова конфигурация чрез придобиване на допълнителни електрони. Същият характер на промените в свойствата се проявява в елементите на третия период и в s- и p-елементите на всички следващи периоди. В същото време отслабването на силата на връзката между външните електрони и ядрото в a-подгрупи с увеличаване на Z се проявява в свойствата на съответните елементи. По този начин за s-елементите има забележимо повишаване на химическата активност с увеличаване на Z, а за p-елементите има увеличение на металните свойства.
В атомите на преходните d-елементи се завършват преди това непълни обвивки със стойността на основната квантово число n, едно по-малко от номера на периода. С няколко изключения, конфигурацията на външните електронни обвивки на атомите на преходните елементи е ns 2. Следователно всички d-елементи са метали и затова промените в свойствата на d-елементите с увеличаване на Z не са толкова драматични, както тези, наблюдавани за s- и p-елементите. В по-високи степени на окисление d-елементите показват известно сходство с p-елементите от съответните групи на периодичната таблица.
Особеностите на свойствата на елементите на триадите (VIIIb-подгрупа) се обясняват с факта, че b-подчерупките са близо до завършване. Ето защо металите желязо, кобалт, никел и платина обикновено не са склонни да образуват съединения по-високи степениокисляване. Единствените изключения са рутеният и осмият, които дават оксидите RuO 4 и OsO 4 . За елементи от подгрупи Ib и IIb, d-подобвивката е действително пълна. Следователно, те показват степени на окисление, равни на номера на групата.
В атомите на лантанидите и актинидите (всички те са метали) предишните незавършени електронни обвивки се допълват със стойността на основното квантово число n, което е две единици по-малко от номера на периода. В атомите на тези елементи конфигурацията на външната електронна обвивка (ns 2) остава непроменена, а третата външна N-обвивка е изпълнена с 4f-електрони. Ето защо лантанидите са толкова сходни.
При актинидите ситуацията е по-сложна. В атоми на елементи с Z = 90–95 могат да участват 6d и 5f електрони химични взаимодействия. Следователно актинидите имат много повече степени на окисление. Например за нептуний, плутоний и америций са известни съединения, при които тези елементи се появяват в седемвалентно състояние. Само за елементи, започващи с курий (Z = 96), тривалентното състояние става стабилно, но това също има свои собствени характеристики. По този начин свойствата на актинидите се различават значително от свойствата на лантанидите и следователно двете семейства не могат да се считат за подобни.
Семейството на актинидите завършва с елемента с Z = 103 (лауренций). Оценката на химичните свойства на курчатовия (Z = 104) и нилсбория (Z = 105) показва, че тези елементи трябва да бъдат аналози съответно на хафний и тантал. Следователно учените смятат, че след семейството на актинидите в атомите започва систематичното запълване на 6d подобвивката. Химическата природа на елементите с Z = 106–110 не е оценена експериментално.
Окончателният брой на елементите, които обхваща периодичната таблица, е неизвестен. Проблемът с горната му граница е може би основната загадка на периодичната таблица. Най-тежкият елемент, открит в природата, е плутоният (Z = 94). Изкуственият лимит е достигнат ядрен синтез- елемент с пореден номер 110. Остава открит въпросът: ще могат ли да се получат елементи с големи поредни номера, кои и колко? На това все още не може да се отговори със сигурност.
Използвайки сложни изчисления, извършени на електронни компютри, учените се опитаха да определят структурата на атомите и да оценят най-важните свойства на „суперелементите“, чак до огромни серийни номера (Z = 172 и дори Z = 184). Получените резултати бяха доста неочаквани. Например, в атом на елемент с Z = 121 се очаква да се появи 8p електрон; това е след като образуването на подчерупката 8s е завършило в атоми с Z = 119 и 120. Но появата на p-електрони след s-електрони се наблюдава само в атоми на елементи от втория и третия период. Изчисленията показват също, че в елементите от хипотетичния осми период запълването на електронните обвивки и под-обвивките на атомите става в много сложна и уникална последователност. Следователно оценката на свойствата на съответните елементи е много труден проблем. Изглежда, че осмият период трябва да съдържа 50 елемента (Z = 119–168), но според изчисленията той трябва да завърши на елемента с Z = 164, т.е. 4 поредни номера по-рано. А „екзотичният” девети период, оказва се, трябва да се състои от 8 елемента. Ето неговия „електронен“ запис: 9s 2 8p 4 9p 2. С други думи, той ще съдържа само 8 елемента, като втория и третия период.
Трудно е да се каже колко верни биха били изчисленията, направени с помощта на компютър. Въпреки това, ако те бъдат потвърдени, тогава ще бъде необходимо сериозно да се преразгледат моделите, лежащи в основата на периодичната таблица на елементите и нейната структура.
Периодичната таблица е играла и продължава да играе огромна роля в развитието на различни области на природните науки. Това беше най-важното постижение на атомно-молекулярната наука и допринесе за появата модерна концепция„химичен елемент“ и изясняване на понятията за прости веществаи връзки.
Закономерностите, разкрити от периодичната система, оказаха значително влияние върху развитието на теорията за структурата на атома, откриването на изотопите и появата на идеи за ядрената периодичност. Периодичната система е свързана със строго научна формулировка на проблема за прогнозиране в химията. Това се проявява в предвиждането на съществуването и свойствата на неизвестни елементи и нови характеристики на химическото поведение на вече открити елементи. В днешно време периодичната система представлява основата на химията, предимно неорганичната, като значително помага за решаването на проблема с химичния синтез на вещества с предварително определени свойства, разработването на нови полупроводникови материали, избора на специфични катализатори за различни химични процеси и т.н. И накрая , периодичната система е в основата на обучението по химия.