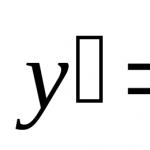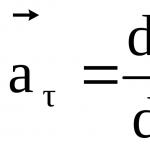Концентрация на охратоксин А в пробата, mg/kg
Граници на относителна грешка ( процент на точност) (±d), %, Р = 0,95
Стандартно отклонение на повторяемостта (s r), %
Граница на повторяемост ( r), %
Пълнота на извличане на веществото, %
4. Измервателни уреди, спомагателни устройства, стъклария, реактиви и материали
4.1. Измервателни инструменти
4.2. Помощно оборудване
|
Апарат за разклащане на проби тип AVU-6S или подобен |
ТУ 64-1-2451 |
|
Ротационен изпарител IR-1M с уловител или подобен |
ТУ 25-11917 |
|
Електрически лабораторен сушилен шкаф с грешка в поддържане на температурата ±2,5 в диапазона от 50 до 350 °C |
ТУ 16-531.639 |
|
Домакински хладилник |
|
|
Електрическа лабораторна мелница EM-3A или подобен pH метър |
ТУ 46-22-236-79 |
|
Магнитна бъркалка тип ММ 5 с бъркалка |
ТУ 25-11.834-80 |
|
Колби плоскодънни конични 250 см 3 с НШ 29, тип КнКШ 250-29/32 |
ГОСТ 10394-74 |
|
Завинтващи се стъклени бутилки от тъмно стъкло (виле), обем 7 см3 |
|
|
Мерителни колби вместимост 100, 500, 1000 cm 3 тип 2-100-2,2-500-2 |
|
|
Лабораторни фунии |
|
|
Крушовидни колби 10 см 3 с НШ 14,5 тип ГрКШ-10-14/23 |
ГОСТ 10394-72 |
4.3. Реактиви и материали
|
Натриев фосфат, монозаместен, 2-воден, аналитично чисто |
|
|
Натриев хлорид, реактивен клас |
|
|
Ацетонитрил, степен на специална чистота, степен 0 |
|
|
Метанол, специална чистота |
|
|
Фосфорна киселина, специална чистота |
TU 2612-014-00203677-97 |
|
Ледена оцетна киселина, реактивен клас |
|
|
Толуен, аналитична чистота |
|
|
Имуноафинитетни колони Ochraprep (R-Biopharm, UK) |
. Подготовка за вземане на измервания
5.1. Приготвяне на стандартни разтвори на охратоксин А
За да се приготви стандартен разтвор за съхранение (концентрация на охратоксин А - 10 ng/μl), проба от 5 mg кристален охратоксин А се поставя в мерителна колба от 500 cm 3, 50 cm 3 смес от толуол-оцетна киселина (98:2% об.) се добавя, внимателно се разбърква, докато веществото се разтвори напълно и се разрежда със същата смес от разтворители до марката. За да се установи точната концентрация на разтвора за съхранение, неговата оптична плътност се измерва при дължина на вълната 333 nm (D 333). Концентрацията на разтвора се изчислява по формулата:
След това 5 cm 3 стандартен разтвор на охратоксин А с концентрация 10 ng/μl се разреждат със смес от толуен-оцетна киселина (98: 2 об.%) до обем 100 cm 3, като се получава работен разтвор с концентрация 0,5 ng/μl.
Да се приготвят работни разтвори на охратоксин А с концентрация 0,005; 0,05 и 0,1 ng/μl, вземат се съответно 50, 500 и 1000 μl разтвор с концентрация 0,5 ng/μl, изпаряват се до сухо и се разтварят в 5 cm 3 от подвижната фаза.
Разтворът за съхранение на охратоксин А се съхранява в стъклен съд с шлифована запушалка на тъмно и хладно място (при температура около 0 °C) до една година и се използва за приготвяне на работни стандартни разтвори. Работните стандартни разтвори се съхраняват в тъмни стъклени флакони на хладно и тъмно място (при температура около 0 °C) в продължение на 1 месец.
Преди да използвате работни стандартни разтвори, те трябва да бъдат доведени до стайна температура и едва тогава да се отворят капачките.
5.2. Приготвяне на фосфатен буферен разтвор, рН = 7,4
Проба от двузаместен натриев фосфат 12-вода с тегло 1,15 g, проба от натриев монозаместен 2-вода с тегло 0,124 g и проба от натриев хлорид с тегло 1,74 g се прехвърлят в мерителна колба с вместимост 100 cm 3, добавят се 10 - 20 cm 3 дестилирана вода. Разбъркайте и регулирайте обема на разтвора в колбата до маркировката. Срок на годност: 1 месец в хладилник.
5.3. Приготвяне на смеси от разтворители
Толуен-оцет киселина (98:2 % относно.).
Добавете 20 cm 3 оцетна киселина в 1000 cm 3 мерителна колба и при разбъркване се регулира до марката с толуен. Срок на годност: 1 месец на хладно и тъмно място.
Ацетонитрил-вода (60:40 % относно.).
Добавете 600 cm 3 ацетонитрил в 1000 cm 3 мерителна колба и като разбърквате, довеждайте до марката с вода. Срок на годност: 1 месец на хладно и тъмно място.
Ацетонитрил-вода (60:40 % относно.; pH = 3 ,0 ).
Добавете 600 cm 3 ацетонитрил в 1000 cm 3 мерителна колба и като разбърквате, довеждайте до марката с двойно дестилирана вода. Чрез добавяне на фосфорна киселина рН на сместа се регулира до стойност 3,0. Срок на годност: 1 месец на хладно и тъмно място.
Метанол-оцет киселина (98:2 % относно.).
Добавят се 20 cm 3 оцетна киселина в 1000 cm 3 мерителна колба и при разбъркване се довежда до марката с метанол. Срок на годност: 1 месец на хладно и тъмно място.
. Подбор и подготовка на проби за анализ
6.1. Избор на проба
За да вземете предвид спецификата на вземане на проби от определени видове продукти, трябва да се ръководите от текущата нормативна и техническа документация:
„Царевица. Правила за приемане и методи за вземане на проби" GOST 13586.3-83;
„Зърнени храни. Правила за приемане и методи за вземане на проби" GOST 26312.1-84;
„Брашно и трици. Методи за приемане и вземане на проби" GOST 27668-88;
„Консервирани хранителни продукти. Вземане на проби и подготовката им за изпитване" ГОСТ 8756.0-70.
Проби за анализ, представителни за концентрацията на микотоксини за цялата партида, трябва да се вземат от предварително хомогенизирана средна (първоначална) проба с тегло 2 kg.
6.2. Подготовка на проби за анализ
Избраните проби се раздробяват за 1 - 2 минути в лабораторна мелница. В този случай се използват две паралелни проби.
6.2.1. Екстракция
25 g проба от натрошена проба се поставя в 250 cm плоскодънна конична колба и се добавят 100 cm 3 смес от ацетонитрил-вода (60:40 об.%). Екстрахирайте с помощта на шейкър за проби за 30 минути. Получената смес се филтрира през хартиен филтър със синя лента. Вземете 10 cm3 филтрат и добавете 90 cm фосфат буферен разтвор, рН = 7,4.
6.2.2. Пречистване на екстракта
100 ml от получената смес се нанасят върху имуноафинитетната колона със скорост 1 - 2 капки в секунда, промиват се с 20 cm 3 разтвор на фосфатен буфер, рН = 7,4. Охратоксин А се елуира с 3 cm 3 смес от метанол-оцетна киселина (98: 2 об.%).
. Вземане на измервания
7.1. Подготовка на пробата за изследване
Елуатът се изпарява до сухо. Сухият остатък се разтваря в 400 μl подвижна фаза (разтвор А).
7.2. Хроматографски условия
HPLC условия: подвижна фаза - ацетонитрил-вода (60:40% vol.; pH = 3.0); скорост на подвижната фаза - 1,5 cm 3 /min.
Флуориметричният детектор е инсталиран на вълнуваща дължина на вълната на излъчване от 333 nm, а на емисионната линия е монтиран емисионен филтър с пропускателна лента от 466 nm.
За да се анализират проби, 50 μl от тестова проба (разтвор А) се инжектират в хроматографския инжектор с помощта на микроспринцовка. Ако има пик, който съвпада във времето на задържане с охратоксин А, масата на охратоксин А в инжекцията се изчислява с помощта на калибровъчна графика.
. Обработка на резултатите от измерванията
8.1. Изграждане на градуирана връзка
За да се изгради калибровъчна крива, се извършва хроматографски анализ на серия от работни разтвори на стандарти. С помощта на микроспринцовка в инжектора се впръскват 50 μl работен стандартен разтвор с концентрация 0,005 ng/μl, което съответства на 0,25 ng охратоксин А. Същото се прави и за други стандартни разтвори с концентрации 0,05 и 0,10 ng/μl , което от своя страна съответства на 2,5 и 5,0 ng охратоксин А в инжекцията. При тези условия времето на задържане на охратоксин А е от порядъка на 4 до 5 минути. Въз основа на получените данни се изгражда графика за калибриране (зависимост на площта на хроматографския пик от масата на охратоксин А в инжекцията).
8.2. Регистрация на резултатите
Концентрацията на охратоксин А в пробата се изчислява по формулата:
![]()
C (пазач A)- концентрация на охратоксин А в пробата, mg/kg;
М- маса на пробата за анализ, g (25,0);
T- маса на охратоксин А, съответстваща на обема на разтвор А, въведен в хроматографа, ng;
V 1 - обем на разтвора за екстракция, cm3 (100);
д - граница на абсолютна грешка:
![]()
д - граница на относителната грешка на метода (показател за точност), % (Таблица 1).
Ако съдържанието на охратоксин А в пробата е по-малко от долната граница на обхвата на определените концентрации, резултатът от анализа се представя като:
* 0,0001 mg/kg е границата на откриване.
8.3. Проверка на приемливостта на резултатите от паралелни определяния
Допустимо несъответствие между паралелни измервания (Р) се определят въз основа на границата на повторяемост (r) (Маса 1):
Р = 0,01 (r, %) × , mg/kg
Ако несъответствието между паралелните дефиниции не надвишава допустимата граница:
![]()
тогава средноаритметичното се приема като резултат от анализа.
Ако нормата е превишенаРизмерванията трябва да се повторят, като се използват резервни проби.
. Контрол на качеството на резултатите от измерванията
Честотата на наблюдение на грешката на измерване зависи от броя на работните измервания през контролирания период и се определя от контролните планове.
Контролните проби са работни проби от хранителни суровини и хранителни продукти. Вземете проба и я разделете на 2 равни части. Едната се оставя непроменена, а към другата се добавя такова количество стандартен разтвор на охратоксин А, че масовата му част в пробата се увеличава с 50 - 100% спрямо първоначалната стойност. Добавката трябва да се въведе в пробата преди да започне подготовката на пробата.
И двете проби се анализират в строго съответствие с указанията на методологията и се получават резултатите от анализа на оригиналната проба ( C (отрицателен A)) и проби с добавка ( СЪС ¢ (отрицателен A)). Определянето се извършва при същите условия, а именно: анализът се извършва от един анализатор, като се използва един комплект обемна стъклария, реактиви, разтвори и др.
Алгоритъмът за провеждане на контрол на оперативната грешка с помощта на адитивния метод се състои в сравняване на резултата от контролно определяне, равен на разликата между резултата от контролно измерване на проба с добавка ( СЪС
¢
(охра)), проби без добавки ( C (пазач A)) и количеството добавка ( С екст (гард A)) със стандарти за оперативен контрол (К). Решението за задоволителна грешка се взема, когато е изпълнено следното условие (ако R и Околна температура от 15 до 25 °C. Относителна влажност на въздуха не повече от 80% при 25 °C. Атмосферно налягане 730 - 760 mm Hg. Захранващо напрежение: 210 - 220 V. AC честота: 45 - 50 Hz.
Охратоксините се произвеждат от някои видове гъбички АспергилусИ Пеницил. Основните производители са A.ochraceusИ P. viridicatum. Тези гъби се срещат навсякъде. Аспергилуспроизвежда охратоксини при повишени температури и влажност, и Пеницилвече при 5ºС. Охратоксините са силно токсични съединения с изразен тератогенен ефект.
Охратоксини A, B и C са група от структурно подобни съединения, които са изокумарини, свързани с Л-фенилаланинова пептидна връзка. В зависимост от природата на радикалите се образуват различни видове охратоксини (Таблица 2.3.).
Охратоксин А – безцветен кристално вещество, слабо разтворим във вода, умерено разтворим в полярни органични разтворители (метанол, хлороформ), както и във воден разтвор на натриев карбонат. В химически чист вид е нестабилен и много чувствителен към светлина и въздух, но в етанолов разтвор може да остане непроменен дълго време. В UV светлина има зелена флуоресценция.
Охратоксин Б е кристално вещество, аналог на охратоксин А, което не съдържа хлорен атом. Той е приблизително 50 пъти по-малко токсичен от охратоксин А. Той флуоресцира в синьо на UV светлина.
Охратоксин С е аморфно вещество, етилов естер на охратоксин А, близко до него по токсичност, но не се среща като естествен замърсител на храни и фуражи. В U-светлина има бледозелена флуоресценция.
Охратоксините принадлежат към токсичните микотоксини, имат висока токсичност за черния дроб, бъбреците, тератогенни и имуносупресивни свойства и изразен хемолитичен ефект. От охратоксините най-токсичен е охратоксин А (LD 50 = 3,4 mg/kg, (еднодневни пилета, перорално)). Той е по-токсичен от афлатоксините. Други микотоксини в тази група са с порядък по-малко токсични.
Биохимичните, молекулярните и клетъчните механизми на действие на охратоксините не са достатъчно проучени. Известно е, че охратоксин А потиска протеиновия синтез и въглехидратния метаболизъм, по-специално глюконогенезата, като инхибира активността на фенилаланин - t-RNA - специфичен ензим, който играе ключова роля в начална фазапротеинов синтез.
Охратоксин А се намира в царевица, ечемик, пшеница, овес и ечемик. Важен и опасен факт е, че когато фуражните зърна и фуражите са силно замърсени, охратоксин А се открива в животински продукти (шунка, бекон, колбаси). Охратоксин B е рядък. Охратоксините също засягат всички плодове на градински култури. Ябълките са особено силно засегнати: до 50% от реколтата може да бъде заразена с микотоксини.
Трябва да се отбележи, че охратоксините са стабилни съединения. Например, при продължително нагряване на пшеница, заразена с охратоксин А, съдържанието му намалява само с 32% (при температура 250–300ºC). По този начин разпространението в храната, токсичността и устойчивостта на охратоксините представляват реална опасност за човешкото здраве.
Методи за анализ
Охратоксин А се намира в окислените храни. Той е лесно разтворим в много органични разтворители, които се използват за екстракция. Най-често използваната е екстракция с хлороформ и воден разтвор на фосфорна киселина, последвана от колонно пречистване и количествено определяне с помощта на метода TLC.
Разработен е и HPLC метод. Преди HPLC анализ, пробата се приготвя, както следва. Натрошената проба се третира със смес от 2 М на солна киселинаи 0.4 М разтвор на магнезиев хлорид. След хомогенизиране се екстрахира с толуен за 60 минути. Сместа се центрофугира. Центрофугата се прекарва през колона със силикагел и се промива със смес от толуен и ацетон (подвижна фаза). Охратоксин А се елуира със смес от толуен и оцетна киселина (9:1) и се суши при 40°С. Остатъкът се разтваря и филтрира. Анализът се извършва чрез HPLC.
Освен това са разработени редица биотестове върху скариди и бактерии, но получените резултати не позволяват използването на тези методи за определяне на охратоксини.
Държавен изследователски институт по хранене на Руската академия на медицинските науки, Москва
Охратоксин А, вторичен метаболит на широко разпространените микроскопични плесени от родовете Penicillium (P. verrucosum) и Aspergillius (A. ochraceus), е сред приоритетните микотоксини – замърсители на храните, и представлява реална опасност за човешкото здраве. Охратоксин А има изразен нефротоксичен, канцерогенен, както и тератогенен, имунотоксичен, невротоксичен, генотоксичен и цитотоксичен ефект. Охратоксин А е класифициран като вещество, вероятно канцерогенно за хората (група 2B) от Международната агенция за изследване на рака (IARC). Когато се прилага перорално, LD50 варира за различни видовеживотни от 20-30 mg/kg телесно тегло (за плъхове) до 1 mg/kg телесно тегло (за прасета). Охратоксин А се счита за един от етиологичните фактори на балканската ендемична нефропатия - тежко бъбречно заболяване, регистрирано в някои източноевропейски страни (в частност България, Румъния, Сърбия, Хърватска, Босна и Херцеговина, Словения, Македония). Охратоксин А се среща най-често в зърнените продукти, кафето и подправките. IN напоследъкИма данни за значително замърсяване на сушени плодове, вино и плодови сокове с охратоксин А. Така в резултат на проучвания, проведени в страните от ЕС, беше установено, че около 70% от партидите зърнени продукти съдържат охратоксин А в диапазона от 0,00001 до 0,041 mg/kg, около 60% от изследваните партиди вино са замърсени с охратоксин А в количества от 0 .000003 до 0.016 mg/l. Особено внимание заслужават данните за честото откриване на охратоксин А в кръвта, както и в майчиното мляко, в населението на много европейски страни, което показва постоянното постъпване на този микотоксин в човешкото тяло. Основният принос за количеството прием на охратоксин А от храната са зърнените храни (44%), виното (10%) и кафето (9%). Препоръчано от Съвместния експертен комитет на ФАО/СЗО по Хранителни добавки(JECFA) допустимият седмичен прием на охратоксин А е 100 ng/kg/m2. T. . Съдържанието на охратоксин А в страните от ЕС е регламентирано на ниво от 0,005 mg/kg в хранителните суровини и 0,003 mg/kg в хранителните продукти. Няма надеждни данни за замърсяване на храните с охратоксин А в Руската федерация.
Метод за определяне на охратоксин А, разработен преди това за нуждите на санитарно-епидемиологичната служба на СССР хранителни продукти, който използва разпределение течност-течност за пречистване на екстракта, има редица недостатъци: относително ниска чувствителност на метода (граница на откриване - 0,001-0,002 mg/kg), значително време за анализ и необходимост от използване на големи количества хлорсъдържащ органични разтворители.
Към днешна дата нови повече ефективни методиопределяне на охратоксин А в хранителни продукти въз основа на използването на твърдофазова екстракция (SPE). SPE се характеризира с добро пречистване на екстракта, високо възстановяване и ниска консумация на разтворител. SPE използва нормалнофазова адсорбционна хроматография върху силикагел, обратнофазова разделителна хроматография върху силикагел, химически модифициран с октадецилсилан, имуноафинитетна хроматография, както и колонна хроматография върху други сорбенти (диатомитна пръст (целит), полиамид, полимери, получени чрез отпечатване и др. . ) .
Слабокиселинните свойства (pKA = 4.4) на охратоксин А (фиг. 1) определят необходимостта от екстракцията му или в недисоциирана форма със смеси от органични разтворители с кисели водно-солеви разтвори, или под формата на сол - с водни слабо алкални разтвори, например разтвор на натриев бикарбонат.
HPLC с обърната фаза (RP HPLC) с флуориметрично откриване е най-широко използваният метод за определяне на охратоксин А в храни.
Целта на изследването беше да се разработи чувствителен метод за откриване, идентифициране и количествено определяне на охратоксин А в храни чрез оптимизиране на аналитичните подходи, базирани на използването на SPE.
експериментална част
Оборудване и реактиви. Хроматографската система се състои от помпа за високо налягане Jasco 880-PU, инжектор Rheodyne-7125 с обем на дозиращата верига от 20 μl, флуориметричен детектор FL детектор модел LC305 (Linear Instruments) (лекс. = 250 nm, лам. = 458 nm) и система за събиране и обработка на данни "Мултихром" (Ampersend). Хроматографска колона (250 * 4,6 mm) със стационарна фаза Kromasil C18 (MetaChem Technologies Inc.), с размер на частиците 5 μm.
Екстракцията се извършва с помощта на клатачен апарат s-3.08L (ELMI); за центрофугиране на пробите се използва центрофуга TsLS 31M. Екстракцията в твърда фаза се извършва с помощта на колектор Macherey-Nagel, патрони със силикагел DIAPAK (BioKhimMak ST) и имуноафинитетни колони OCHRAPREP (IAC) (R-BIOFARM RHONE LTD). рН на разтворите се измерва с рН метър MP 230 (Mettler Toledo). Концентрирането на пробата се извършва с помощта на ротационен изпарител Laborota 4000 (Heidolph). За разтваряне на стандартите и изпарените екстракти се използва ултразвукова вана UZV-12l (PKF SAPFIR). За да се изберат оптималните вълни на възбуждане и излъчване, беше използван флуоресцентен спектрофотометър Cary Eclipse (Varian). За стандарт е използвана стандартна проба от охратоксин А в смес бензен-оцетна киселина (99:1) с концентрация C = 9,2 ng/μl.
Твърдофазова екстракция:
Пречистване чрез колонна хроматография (CC) върху диатомит. Екстракцията на охратоксин А от 25,0 g натрошена проба се извършва с 125 ml хлороформ след добавяне на 20 ml 2% оцетна киселина. Разбърква се с разклащащ апарат за 30 минути. 50 ml екстракт от хлороформ, преминал през хартиен филтър, се нанася върху колона от диатомитна пръст, импрегнирана с натриев бикарбонат. Колоната се промива последователно със 70 ml хексан и 30 ml хлороформ. Охратоксин А се елуира от колоната със 150 ml смес от бензен - оцетна киселина (86:12:2). Елуатът се изпарява до сухо, разтваря се в 3 ml от подвижната фаза (ацетонитрил - воден разтвор на H3PO4 (рН = 2.6) (62:38), като се използва ултразвукова баня.
Почистване с CC върху силикагел. Екстракцията на охратоксин А от 20.0 g натрошена проба се извършва със 100 ml толуен след последователно добавяне на 30 ml 2 М разтвор на солна киселина и 50 ml 0.4 М разтвор на магнезиев хлорид. Разбърква се в продължение на 60 минути, центрофугира се при 3500 rpm в продължение на 5 минути. Горният толуенов слой се филтрува през хартиен филтър, като се събират 50 ml от филтрата. След кондициониране с 10 ml толуен, 50 ml филтрат се прилага към патрона със силикагел, промива се два пъти с 10 ml n-хексан и 10 ml смес от толуен-ацетон (85:15), след това с 5 ml толуен . Охратоксин А се елуира с 40 ml смес от толуен – ацетон – оцетна киселина (89:10:1). Елуатът се изпарява до сухо, разтваря се в 1 ml подвижна фаза (ацетонитрил - воден разтвор на H3PO4 (рН = 2.6) (62:38), като се използва ултразвукова баня.
Пречистване чрез имуноафинитет СС. Екстракция на охратоксин А от 50,0 g. Натрошената проба се третира с 200 ml смес от ацетонитрил и вода (60:40). Разбърква се 30 минути. 4 ml от екстракта, преминал през хартиен филтър, се смесва с 44 ml фосфат и се нанася в имуноафинитетна колона (IAC), която след това се промива с 20 ml фосфатен буфер. Останалият фосфатен буфер се отстранява чрез продухване на IAC с въздух. Охратоксин А се елуира с 3 ml смес от метанол и оцетна киселина (98:2). Елуатът се изпарява до сухо, разтваря се в 1 ml подвижна фаза (ацетонитрил - воден разтвор на H3PO4 (рН = 2.6) (62:38), като се използва ултразвукова баня.
HPLC условия. Идентифицирането и количественото определяне на охратоксин А се извършва чрез RP HPLC в режим на изократно елуиране с флуоресцентно откриване (lvoz.=250 nm, lam.=458 nm). Като подвижна фаза се използва смес от ацетонитрил и воден разтвор на H3P04 (рН = 2.6) (62:38). Скоростта на елуиране е 1 ml/min. 20 μl от тестовия разтвор се инжектират в HPLC системата.
Резултати и тяхното обсъждане.
При пречистване на екстракта чрез СС с диатомитна пръст, импрегнирана с натриев бикарбонат, като основен метод е използван методът AOAC 975.38, който включва използването на TLC за идентифициране и количествено определяне на охратоксин А. За да се повиши чувствителността и специфичността на метода, използвахме RP HPLC с флуоресцентно откриване. В резултат на прилагането на основния метод степента на екстракция на охратоксин А от матрица, изкуствено замърсена с охратоксин А на ниво 0,01 mg/kg при нашите условия не надвишава 40%. За да увеличим скоростта на екстракция, направихме редица промени в условията на екстракция и пречистване: към екстрахиращата смес беше добавена оцетна киселина; обемът на хлороформа, използван за промиване на колоната, се намалява до 30 ml; ацетонът е включен в сместа за елуиране; обемът на елуиращата смес се увеличава до 150 ml. В резултат на оптимизация на метода стойността на екстракция на охратоксин А от пшеница се повишава до 60% (Таблица 1).
Степента на екстракция беше значително повишена чрез използване на метода на твърдофазова екстракция върху патрони с немодифициран силикагел (схема, близка до ICC метод № 000). Корекцията на основния метод (съдържанието на толуен в сместа толуен-ацетон, използвана за промиване на колоната, се повишава до 85%, към елуиращата смес се добавя ацетон, обемът на елуиращата смес се увеличава до 40 ml) направи възможно увеличете степента на възстановяване до 80%.
При използване на имуноафинитет CH се наблюдава максимална степен на екстракция на охратоксин А от хранителната матрица (до 100%), докато границата на откриване (0,0005 mg/kg) е по-висока, отколкото при пречистване на CH върху силикагел (0,00005 mg/kg ).
За откриване, идентифициране и количествено определяне на охратоксин А с помощта на HPLC, беше избран оптималният състав на подвижната фаза (МР) и дължините на вълната на флуоресценцията и емисиите бяха прецизирани, което осигури максимален сигнал и селективност при откриване на охратоксин А (Таблица 2). Избраните дължини на вълната на възбуждане (250 nm вместо 333 nm) и флуоресцентни емисии за оптимизираната мобилна фаза позволиха увеличаване на съотношението сигнал/шум със съответно намаляване на границата на откриване на метода. Промяната на състава на PF направи възможно подобряването на разделянето на пиковете на охратоксин А и компонентите на матрицата на хранителния продукт, като същевременно намали времето на задържане на пика на охратоксин А (фиг. 2).
Възможността за използване на разработения от нас модифициран метод, базиран на използването на патрони със силикагел, в рутинния анализ на охратоксин А беше потвърдена от селективно изследване на честотата и нивото на замърсяване на основните видове хранителни суровини с този микотоксин . За тази цел е изследвано хранително зърно от реколта 2004 г. от различни региони на Руската федерация (Таблица 3). Девет от изследваните 46 зърнени проби съдържат охратоксин А в границите от 0,00005 до 0,005 mg/kg, което не надвишава нормите, приети в страните от ЕС.
По този начин, чрез оптимизиране на съществуващите аналитични подходи, са предложени два варианта на метода за откриване, идентифициране и количествено определяне на охратоксин А в хранителни продукти: използване на силикагел CC или имуноафинитет CC за пречистване на екстракти и оптимизирани HPLC условия. Методът, базиран на използването на CC върху силикагел, се характеризира с ниска граница на откриване и ниска цена на консумативи. Осигурява пречистване с помощта на имуноафинитет CC висока степенекстракция и чистота на екстракта, а също така се характеризира с по-висока граница на откриване (0,0005 mg/kg вместо 0,00005 mg/kg за версията с пречистване на химичната смес върху силикагел). Данните, получени в резултат на селективно изследване на съдържанието на охратоксин А в хранителните суровини, показват необходимостта по-нататъшно проучванезамърсяване на хранителни продукти с охратоксин А, за да се оцени рискът от замърсяване на хранителни продукти с този микотоксин за здравето на населението на Руската федерация.
Държавен изследователски институт по хранене на Руската академия на медицинските науки
109240, Москва, Устински проезд, 2/14
И. В. Аксенов, К. И. Елер, В. А. Тутелян
Оптимизиране на аналитични методи за анализ на охратоксин А в храни.
Охратоксин А е микотоксин, произведен от широко разпространени видове Aspergillus и Penicillium. Микотоксинът е често срещан замърсител на зърнени храни, кафе, вино, сушени плодове и подправки. Доказано е, че охратоксин А е нефротоксичен, имуносупресивен, ембриотоксичен, тератогенен и канцерогенен при много видове бозайници. Codex Alimentarius и ЕК са установили максимално допустимо ниво от 5 mg/kg за охратоксин А в сурови житни зърна и 3 mg/kg – за готови за консумация продукти, получени от зърнени култури. Бяха разработени две прости и надеждни модификации на методите за анализ на ократоксин А в храната, които се основават на имуноафинитет или колонно почистване със силикагел и HPLC с флуоресцентно откриване. Границите на откриване са съответно 0,5 mg/kg и 0,05 mg/kg. Успешно са използвани методи за анализ на охратоксин А в 46 проби от сурови зърнени култури, събрани в различни региони на Русия. Установено е, че девет проби са замърсени с охратоксин А в нива от 0,05 до 5 mg/kg.
Оптимизиране на аналитични методи за откриване, идентифициране и количествено определяне на охратоксин А в хранителни продукти.
Охратоксин А е микотоксин, произведен от широко разпространени плесени от родовете Aspergillius и Penicillium. Той е често срещан замърсител на зърнени продукти, кафе, вино, сушени плодове и подправки. Нефротоксичните, имуносупресивните, ембриотоксичните, тератогенните и канцерогенните ефекти на охратоксин А са доказани за много видове бозайници. Максимално допустимото ниво на охратоксин А в зърнени култури, установено от Codex Alimentarius и ЕС, е 5 µg/kg, а в готовите за консумация зърнени продукти – 3 µg/kg. Предложени са два оптимизирани метода за откриване, идентифициране и количествено определяне на охратоксин А в хранителни продукти: използване на силикагел CC или имуноафинитет CC за пречистване на екстракт и HPLC с флуоресцентно откриване. Границата на откриване е съответно 0,05 и 0,5 μg/kg. Разработените методи бяха използвани за анализ на съдържанието на охратоксин А в 46 проби от зърно, събрани в различни региони на Русия. Девет проби са замърсени с охратоксин А на нива, вариращи от 0,05 до 5 μg/kg.
Надписи за рисунки.
Снимка 1. Химическа структураохратоксин А.
Фигура 2. Хроматограми на проба от пшеница, замърсена с охратоксин А на ниво от 0,01 mg/kg, използвайки различни методи за пречистване:
A) CH върху диатомит B) CH върху силикагел C) имуноафинитет CH.



Маса 1. Сравнителна характеристика по различни начинипречистване на екстракта.
Таблица 2. Сравнителни характеристики на HPLC параметрите (за 1 ng инжектиран охратоксин А).
PF състав | Дължини на вълните на флуориметрично детектиране, nm | Време за запазване на сигурността А, мин | Съотношение сигнал/шум |
||
ацетонитрил – вода – оцетна киселина (99:99:2) | |||||
ацетонитрил – вода – оцетна киселина (102:94:4) | |||||
Оптимизирана техника | |||||
ацетонитрил – воден H3PO4 (pH=2,6) (124:76) |
Таблица 3. Извадково изследване на нивата на замърсяване с охратоксин А в хранителни зърна от реколта 2004 г.
Литература
Методически препоръки за откриване, идентифициране и определяне на охратоксин А в хранителни продукти. - М., 1985. , Кравченко (Медицински и биологични аспекти) - М., 1985. AOAC, Определяне на охратоксин А във вино и бира 2001.01 // J. AOAC Int. – 2001. - кн. 84. - P. 1818. AOAC, охратоксин А в царевица и ечемик 991.44 // J. AOAC Int. – 1996. - кн. 79. – С. 1102-1105. AOAC, охратоксин А в зелено кафе 975.38 // J. AOAC Int. – 1975. - кн. 58. - P. 258. Бележка за приложение за анализ на охратоксин А в зърнени култури с използване на екстракт от натриев бикарбонат във връзка с Ochraprep. – Глазгоу, 2001. Baggiani C., Giraudi G., Vanni A. // Биоразделяне. - 2002. - Т.10. – P. 389–мисия Регламент (ЕО) № 000/2002 // Официален вестник на Европейските общности. - 2002. - L 75. - P. 18-20. Монографии на IARC по оценкатана канцерогенните рискове за хората. Vol. 56. – Lion, 1993. Jodlbauer J., Maier N.M., Lindner W. // Journal of Chromatography A. - 2002. - Vol. 945. – С. 45–63. Jornet D., Busto O., Guasch J // Journal of Chromatography A. - 2000. - Vol. 882. – С. 29–35. Крог П. // Ендемична нефропатия, Доклади на втория международен симпозиум по ендемична нефропатия 9-12 ноември 1972 г. - София, 1972. – С. 266-277. Kuhn I., Valenta H., Rohr K. // Journal of Chromatography B. - 1995. - Vol. 668. – С. 333–337. Majerus P., Weber R., Wolff J. // Bundesgesundheitsblatt. – 1994. – B. 37, N. 11. – S. 454 – 458. Monaci L., Palmisano F. // Anal. Биоанал. Chem. - 2004. - кн. 378. - С. 96-103. Monaci L., Tantillo G., Palmisano F. // Anal. Биоанал. Chem. - 2004. - кн. 378. – С. 1777–1782. Количествено откриване на Охратоксин А. - Глазгоу, 2003 г. Доклад на експерти, участващи в Задача 3.2.7 „Оценка на хранителния прием на Охратоксин А от населението на държавите-членки на ЕС”. – Рим, 2002 г. Оценка на безопасността на определени микотоксини в храните. // Серия хранителни добавки на СЗО, No.47; FAO Food and Nutrition Paper 74. – Женева, 2001. Schwartz G. G. // Cancer Causes Control. - 2002. - Т.13. - С. 91-100. Скот П. М. // Адв. Exp. Med. Biol. - 2002. - кн. 504. – С. 117-134. Skaug MA, Helland I, Solvoll K, Saugstad O.D. // Food Addit. Contam. - 2001. - кн. 18. – С. 321-327. Visconti A., Pascale M., Centonze G. // Journal of Chromatography A. - 1999. - Vol. 864. – С. 89–101. Zimmerli B., Dick R. // Journal of Chromatography B. - 1995. - Vol. 666. – С. 85 – 99.Концентрация на охратоксин А в пробата, mg/kg
Граници на относителна грешка (индикатор за точност) (±d), %, Р = 0,95
Стандартно отклонение на повторяемостта (s r), %
Граница на повторяемост ( r), %
Пълнота на извличане на веществото, %
4.2. Помощно оборудване
|
Апарат за разклащане на проби тип AVU-6S или подобен |
|
|
Ротационен изпарител IR-1M с уловител или подобен |
|
|
Електрически лабораторен сушилен шкаф с грешка в поддържане на температурата ±2,5 в диапазона от 50 до 350 °C |
|
|
Домакински хладилник |
|
|
Електрическа лабораторна мелница EM-3A или подобен pH метър |
ТУ 46-22-236-79 |
|
Магнитна бъркалка тип ММ 5 с бъркалка |
ТУ 25-11.834-80 |
|
Конусовидни плоскодънни колби 250 см3 с НШ 29 тип КнКШ 250-29/32 |
ГОСТ 10394-74 |
|
Завинтващи се стъклени бутилки от тъмно стъкло (виле) с обем 7 см3 |
|
|
Мерителни колби вместимост 100, 500, 1000 cm3 тип 2-100-2,2-500-2 |
|
|
Лабораторни фунии |
|
|
Колби крушовидни 10 см3 с НШ 14,5 тип ГрКШ-10-14/23 |
ГОСТ 10394-72 |
4.3. Реактиви и материали
. Подготовка за вземане на измервания
5.1. Приготвяне на стандартни разтвори на охратоксин А
За да се приготви стандартен разтвор за съхранение (концентрацията на охратоксин А е 10 ng/μl), проба от 5 mg кристален охратоксин А се поставя в мерителна колба от 500 cm3, 50 cm3 смес от толуол-оцетна киселина (98:2 об.%). ) се добавя, разбърква се старателно до пълното разтваряне на веществото и се довежда същата смес от разтворители до марката. За да се установи точната концентрация на разтвора за съхранение, неговата оптична плътност се измерва при дължина на вълната 333 nm (D333). Концентрацията на разтвора се изчислява по формулата:
Да се приготвят работни разтвори на охратоксин А с концентрация 0,005; 0,05 и 0,1 ng/μl, вземат се съответно 50, 500 и 1000 μl разтвор с концентрация 0,5 ng/μl, изпаряват се до сухо и се разтварят в 5 cm3 от подвижната фаза.
Разтворът за съхранение на охратоксин А се съхранява в стъклен съд с шлифована запушалка на тъмно и хладно място (при температура около 0 °C) до една година и се използва за приготвяне на работни стандартни разтвори. Работните стандартни разтвори се съхраняват в тъмни стъклени флакони на хладно и тъмно място (при температура около 0 °C) в продължение на 1 месец.
Преди да използвате работни стандартни разтвори, те трябва да бъдат доведени до стайна температура и едва тогава да се отворят капачките.
5.2. Приготвяне на фосфатен буферен разтвор, рН = 7,4
Проба от двузаместен натриев фосфат 12-вода с тегло 1,15 g, проба от натриев монозаместен 2-вода с тегло 0,124 g и проба от натриев хлорид с тегло 1,74 g се прехвърлят в мерителна колба с вместимост 100 cm3, добавят се 10 - 20 cm3 дестилирана вода. Разбъркайте и регулирайте обема на разтвора в колбата до маркировката. Срок на годност: 1 месец в хладилник.
5.3. Приготвяне на смеси от разтворители
Толуен-оцет киселина (98:2 % относно.).
Добавете 20 cm3 оцетна киселина в мерителна колба от 1000 cm3 и при разбъркване се регулира до марката с толуен. Срок на годност: 1 месец на хладно и тъмно място.
Ацетонитрил-вода (60:40 % относно.).
Добавете 600 cm3 ацетонитрил в 1000 cm3 мерителна колба и при разбъркване добавете вода до марката. Срок на годност: 1 месец на хладно и тъмно място.
Ацетонитрил-вода (60:40 % относно.; pH = 3 ,0 ).
Добавете 600 cm3 ацетонитрил в мерителна колба от 1000 cm3 и при разбъркване се довежда до марката с двойно дестилирана вода. Чрез добавяне на фосфорна киселина рН на сместа се регулира до стойност 3,0. Срок на годност: 1 месец на хладно и тъмно място.
Метанол-оцет киселина (98:2 % относно.).
Добавете 20 cm3 оцетна киселина в 1000 cm3 мерителна колба и като разбърквате, довеждайте до марката с метанол. Срок на годност: 1 месец на хладно и тъмно място.
. Подбор и подготовка на проби за анализ
6.1. Избор на проба
За да вземете предвид спецификата на вземане на проби от определени видове продукти, трябва да се ръководите от текущата нормативна и техническа документация:
„Царевица. Правила за приемане и методи за вземане на проби" GOST 13586.3-83;
„Зърнени храни. Правила за приемане и методи за вземане на проби" GOST 26312.1-84;
„Брашно и трици. Методи за приемане и вземане на проби" GOST 27668-88;
„Консервирани хранителни продукти. Вземане на проби и подготовката им за изпитване" ГОСТ 8756.0-70.
Проби за анализ, представителни за концентрацията на микотоксини за цялата партида, трябва да се вземат от предварително хомогенизирана средна (първоначална) проба с тегло 2 kg.
6.2. Подготовка на проби за анализ
Избраните проби се раздробяват за 1 - 2 минути в лабораторна мелница. В този случай се използват две паралелни проби.
6.2.1. Екстракция
25 g проба от натрошена проба се поставя в 250 cm плоскодънна конична колба и се добавят 100 cm3 смес от ацетонитрил-вода (60:40 об.%). Екстрахирайте с помощта на шейкър за проби за 30 минути. Получената смес се филтрира през хартиен филтър със синя лента. Вземете 10 cm3 филтрат и добавете 90 cm фосфатен буферен разтвор, pH = 7,4.
6.2.2. Пречистване на екстракта
100 ml от получената смес се нанасят в имуноафинитетната колона със скорост 1 - 2 капки в секунда, промиват се с 20 cm3 разтвор на фосфатен буфер, pH = 7,4. Охратоксин А се елуира с 3 cm3 смес от метанол-оцетна киселина (98: 2 об.%).
. Вземане на измервания
7.1. Подготовка на пробата за изследване
Елуатът се изпарява до сухо. Сухият остатък се разтваря в 400 μl подвижна фаза (разтвор А).
7.2. Хроматографски условия
HPLC условия: подвижна фаза - ацетонитрил-вода (60:40% vol.; pH = 3.0); скорост на подвижната фаза - 1,5 cm3/min.
Флуориметричният детектор е инсталиран на вълнуваща дължина на вълната на излъчване от 333 nm, а на емисионната линия е монтиран емисионен филтър с пропускателна лента от 466 nm.
За да се анализират проби, 50 μl от тестова проба (разтвор А) се инжектират в хроматографския инжектор с помощта на микроспринцовка. Ако има пик, който съвпада във времето на задържане с охратоксин А, масата на охратоксин А в инжекцията се изчислява с помощта на калибровъчна графика.
. Обработка на резултатите от измерванията
8.1. Изграждане на градуирана връзка
За да се изгради калибровъчна крива, се извършва хроматографски анализ на серия от работни разтвори на стандарти. С помощта на микроспринцовка в инжектора се впръскват 50 μl работен стандартен разтвор с концентрация 0,005 ng/μl, което съответства на 0,25 ng охратоксин А. Същото се прави и за други стандартни разтвори с концентрации 0,05 и 0,10 ng/μl , което от своя страна съответства на 2,5 и 5,0 ng охратоксин А в инжекцията. При тези условия времето на задържане на охратоксин А е от порядъка на 4 до 5 минути. Въз основа на получените данни се изгражда графика за калибриране (зависимост на площта на хроматографския пик от масата на охратоксин А в инжекцията).
Резултатът от анализа се представя във формата (с вероятност Р = 0,95):
![]()
D - граница на абсолютна грешка:
![]()
d е границата на относителната грешка на техниката (показател за точност), % (Таблица 1).
* 0,0001 mg/kg е границата на откриване.
. Изисквания за квалификация на изпълнителя
До извършване на анализ на охратоксин А в зърно и зърнени продукти се допускат лица със специална квалификация. висше образованиеили средно специално образованиекоито владеят техники за HPLC анализ, преминали са подходящо обучение и имат опит в химическа лаборатория.
. Условия на измерване
Околна температура от 15 до 25 °C.
Относителна влажност на въздуха не повече от 80% при 25 °C.
Атмосферно налягане 730 - 760 mm Hg.
Захранващо напрежение: 210 - 220 V. AC честота: 45 - 50 Hz.