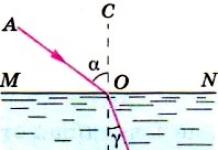
Самойонизация на водата
Водата, дори след многократна дестилация, запазва способността да провежда електрически ток. Тази способност на водата се дължи на нейната самойонизация.
$2H_2O ↔ H_3O^+ + OH^-$
Константата на термодинамичното равновесие има формата:
Снимка 1.
където $a_X^(rel)=\frac(a_X^(equal))(a_X^0)$ е относителната активност на частицата $X$ в равновесната система;
$aX^(equal)$ е абсолютната активност на частицата $X$ в равновесна система;
$(a_x)^0$ е абсолютната активност на $X$ в термодинамичното състояние на системата.
Относителната активност на водата в равновесие е практически равна на единица, тъй като степента на реакция е много малка (ако вземем теоретично нейонизирана вода като стандартно състояние.
Коефициентите на активност на $OH^-$ и $H_3O^+$ йони ще бъдат близки до единица в чиста вода. Равновесието на реакцията е силно изместено наляво. Относителните активности на $OH^-$ и $H_3O^+$ са почти равни на техните моларни концентрации. Където
$(K_a)^0 \sim K_(автоматично) = $
където $ и $ са моларни концентрации;
$K_(auto)$ - константа на автопролиза на вода, равна на $1,00\cdot 10^(-14) \mol^2/l^2$ при $25^\circ \C.$
Следователно в чиста вода концентрациите на $ и $ ще бъдат равни
$==\sqrt(10^(-14))=10^(-7)$ при $25^\circ \ C.$
За по-лесно изчисление концентрацията е посочена като отрицателен логаритъм, означен като $pH$:
$pH= -lg $
Показателите $pH$ за чиста вода са $7$, за киселинни разтвори $pH$ 7$.
Киселинна дисоциация и киселинна константа
За киселина $AH$, дисоциацията може да се изрази с уравнението:
$AH + H_2O ↔ A^- + H_3O^+$
В състояние на равновесие относителната плътност на водата се променя леко при преминаване от една киселина към друга и при безкрайно разреждане се доближава до нула. Следователно се използва термодинамичната киселинна константа $K_a^0$ ($AH$).
Съотношението на коефициентите на активност е еднакво за всички киселини и е равно на единица, ако процесите протичат в разредени разтвори.
След това, в разреден воден разтвор, киселинната константа $Ka (AH$) се използва като мярка за силата на киселината, която може да се определи по формулата:
$Ka (AH)=\frac()()$
Формулата показва моларната концентрация на частици при фиксирана температура $(25^\circ \C)$ в състояние на равновесие.
Колкото по-висока е киселинната константа, толкова по-висока е степента на дисоциация, толкова по-силна е киселината. За изчисления и характеризиране на киселинността се използва отрицателният логаритъм на константата на киселинността $pKa$.
$pKa (AH)= -lgKa (AH)$
Колкото по-висока е стойността на киселинната константа, толкова по-слаба е киселината.
Стойността на константата на киселинността е равна на $pH$ стойността на разтвора, при която киселината ще бъде наполовина йонизирана:
$pKa (AH) = pH - log \frac()()$
Стойността, характеризираща киселинността на водните молекули във воден разтвор, е равна на:
$Ka=\frac()()=\frac(Ka_(auto))()=\frac(10^(-14))(55,5)$
Така при температура от $25^\circ C$, $pKa (H_2O) = 15,7$. Тази стойност характеризира киселинността на водните молекули в разтвора.
За хидрониев йон $pKa (H_3O^+) = pK_(auto) - pKa = 14-15,7 = -1,7.$
Стойностите $pKa$ са таблични данни. Въпреки това, за киселини с $pKa 0$ данните в таблицата ще бъдат неточни.
Възможно е да се определят киселинните константи във водата чрез директно измерване на концентрациите на $A^-$ и $AH$ само когато киселинната дисоциация настъпи поне до известна степен, дори едва забележима.
Ако киселината е много слаба, така че практически не се дисоциира, тогава концентрацията на $A^-$ не може да бъде точно измерена. Ако, напротив, киселината е толкова силна, че се дисоциира почти напълно, тогава е невъзможно да се измери концентрацията на $AH$. В този случай ще се използват косвени методи за определяне на киселинността.
Основна йонизационна константа
За да изразим константата на дисоциация на база във вода, използваме уравнението:
$B + H_2O ↔ BH^+ + OH^-$
Константата на основност е:
$Kb=\frac())([B])$
Напоследък константите на основност практически не се използват в изчисленията, тъй като от константата на киселинността на спрегнатата киселина може да се получи цялата необходима информация за основата $BH^+.$
$BH^+ + H_2O ↔ B + H_3O^+$
$Ka (BH^+) = \frac([B])()$
Киселинната константа на киселина ще бъде мярка за сила:
- $AH$ или $BH^+$ като донори на протони;
- $A^-$ или $B$ като акцептори на протони;
- силна киселина $AH$ или $BH^+$ съответства на слаба спрегната основа $A^-$ или $B$ и тогава стойността на $pKa$ е малка или отрицателна;
- силна основа $A^-$ или $B$ съответства на слаба киселина $AH$ или $BH^+$ и константата на киселинност ще бъде положителна
Силата на киселините или основите може да бъде директно измерена само в тесен диапазон от $pKa (BH^+).$ Извън диапазона основността ще бъде определена чрез косвени методи. Стойностите на $pka (BH^+)$ извън интервала от $-2$ до $17$ ще бъдат неточни.
Връзка между структурата и силата на киселините
Относителната сила на киселините може да се предвиди въз основа на естеството на централния атом и структурата на киселинната молекула.
Силата на безкислородната киселина $HX$ и $H_2X$ (където $X$ е халоген) е толкова по-висока, колкото по-слаба е връзката $X-H$, тоест колкото по-голям е радиусът на атома $X$.
В сериите $HF - HCl - HBr - HI$ и $H_2S - H_2Se - H_2Te$ силата на киселините нараства.
За кислородсъдържащи киселини, колкото по-голяма е стойността на m в съединението със състав $E(OH)nOm$, толкова по-висока е силата на киселините.
Видове протолитични реакции.
МУ "Решения" стр. 52-55
Автопротолиза на вода. Йонно произведение на вода.МУ "Решения"» страница 56
Малка част от водните молекули винаги са в йонно състояние, въпреки че е много слаб електролит. Йонизацията и по-нататъшната дисоциация на водата, както вече беше споменато, се описва от уравнението на протолитичната реакция на киселинно-базово диспропорциониране или автопротолиза.
Водата е много слаб електролит, следователно образуваната спрегната киселина и спрегната основа са силни. Следователно равновесието на тази протолитична реакция е изместено наляво.
Константата на това равновесие K е равна на =
Количествената стойност на произведението на концентрацията на водни йони × е йонен продукт на вода.
То е равно на: × = K равно. × 2 = 1 × 10 – 14
Следователно: KH 2O = × = 10 – 14 или опростено KH 2O = × = 10 – 14
KH2O е йонният продукт на водата, автопротолизната константа на водата или просто константата на водата. KH2O зависи от температурата. Увеличава се с повишаване на температурата.
В химически чиста вода = = = 1×10 – 7. Това е неутрална среда.
Разтворът може да съдържа > – средата е кисела или< – среда щелочная
= ; =
pH стойност
За да изразите количествено киселинността на разтворите, използвайте индикатор за концентрация на водородни йони pH.
Водородният индекс е стойност, равна на отрицателния десетичен логаритъм от концентрацията на свободни водородни йони в разтвор.
pH = – log ⇒ = 10 – pH
В неутрална среда pH = 7
При кисело pH< 7
При алкално pH > 7
За характеризиране на основността на средата се използва хидроксилният индикатор pOH
рОН = – log [ОH - ] ⇒ [ОH - ] = 10 – рОН
pH + pOH = 14 Þ pH = 14 – pOH и pOH = 14 – pH
Формули за изчисляване на рН за разтвори на киселини и основи.
pH = – log
- Силни киселини: = C(1/z киселина)
Изчислете pH на разтвор на HCl с C(HCl) = 0,1 mol/l при условие на пълната му дисоциация.
C(HCl) = 0,1 mol/l; pH = – log 0,1 = 1
2. Силни бази: [ОH - ] = С(1/z база)
Изчислете pH на разтвора на NaOH при същите условия.
C(NaOH) = 0,1 mol/l; = = 10 – 13 ; pH = – log 10 – 13 = 13
3. Слаби киселини
Изчислете pH на разтвор на оцетна киселина с моларна концентрация 0,5 mol/L. K CH 3COOH = 1,8×10 – 5.
3×10 – 3
pH = – log 3×10 – 3 = 2,5
4. Слаби основи
Изчислете pH на разтвор на амоняк с моларна концентрация 0,2 mol/L.
K NН 3 = 1,76×10 – 5
1,88×10 – 3
0,53×10 – 11; pH = – log 0,53×10 – 11 = 11,3
5. C(H +) = [H + ] = 10 – pH
При pH = 7, [H + ] = 10 – 7
Има различни методи за определяне на pH: с помощта на индикатори и йономерни устройства.
Стойността на pH за химични реакции и биохимични процеси в тялото.
Много реакции изискват строго определена стойност на pH, за да протичат в определена посока.
Обикновено в здраво тяло реакцията на околната среда на повечето биологични течности е близка до неутрална.
Кръвно – 7,4
Слюнка – 6,6
Чревен сок – 6,4
Жлъчка – 6,9
Урина – 5,6
Стомашен сок: а) в покой – 7,3
б) в състояние на храносмилане – 1,5-2
Отклонението на рН от нормата има диагностично (определение на заболяването) и прогностично (протичане на заболяването) значение.
Ацидозата е изместване на рН към киселата страна, рН намалява, концентрацията на водородни йони се увеличава.
Алкалозата е изместване на рН към алкална област, рН се повишава и концентрацията на водородни йони намалява.
Временното отклонение на рН на кръвта от нормата с десети води до сериозни смущения в организма. Дългосрочните отклонения в pH на кръвта могат да бъдат фатални. Отклоненията в pH на кръвта могат да бъдат 6,8 - 8; промени извън този диапазон във всяка посока са несъвместими с живота.
Комбинирани и изолирани протолитични равновесия.
Протолитичните процеси са обратими реакции. Протолитичните равновесия се изместват към образуването на по-слаби киселини и основи. Те могат да се разглеждат като конкуренция между бази с различна сила за притежаването на протон. Те говорят за изолирани и комбинирани равновесия.
Ако няколко едновременно съществуващи равновесия са независими едно от друго, те се наричат изолирани. Изместването на равновесието на единия от тях не води до промяна на равновесното положение на другия.
Ако промяната в равновесието на едно от тях води до промяна на равновесието на другото, тогава говорим за комбинирани (спрегнати, конкурентни) равновесия. Преобладаващият процес в системите с комбинирано равновесие е този, който се характеризира с по-голяма стойност на равновесната константа.
Вторият процес ще бъде преобладаващ, т.к неговата равновесна константа е по-голяма от равновесната константа на първия процес. Равновесието във втория процес е изместено в по-голяма степен надясно, т.к метиламинът е по-силна основа от амоняка, NH 4 + е по-силна киселина от CH 3 NH 3 +.
Заключение: По-силната основа потиска йонизацията на по-слабата основа. Следователно, когато малко количество солна киселина се добави към смес от амоняк и метиламин, основно метиламинът ще претърпи протониране.
И още: най-силната киселина потиска йонизацията на слабите киселини. Така солната киселина, намираща се в стомашния сок, потиска йонизацията на оцетната киселина (постъпваща от храната) или ацетилсалициловата киселина (лечебно вещество).
______________________________________________________________
Към равновесието, което се установява в разтвор на слаб електролит между молекули и йони, можем да приложим законите на химичното равновесие и да запишем израза за равновесната константа. Например, за електролитната дисоциация (протолиза) на оцетна киселина, протичаща под действието на водни молекули,
CH 3 COOH + H 2 O ↔ H 3 O + + CH 3 COO –
равновесната константа има формата
Използват се два метода за записване на стойностите на константите на киселинност и основност. При първия метод стойностите на константата и температурата са посочени на един и същи ред след уравнението на реакцията и запетая, например,
HF + H 2 O ↔ H 3 O + + F – , K k = 6,67·10 –4 mol·l –1 (25°С).
При втория метод стойността на константата първо се записва, а след това киселинната и основната форма на електролита, разтворителя (обикновено вода) и температурата се дават в скоби:
Kk = 6,67·10 –4 (HF, F – , H 2 O, 25°C) mol L –1.
Константите на киселинност и основност зависят от естеството на електролита, разтворителя и температурата, но не зависят от концентрацията на разтвора. Те характеризират способността на дадена киселина или дадена основа да дисоциира на йони: колкото по-висока е стойността на константата, толкова по-лесно се дисоциира електролитът.
Многоосновните киселини, както и основите на два или повече валентни метала, се дисоциират стъпаловидно. В разтворите на тези вещества се установяват сложни равновесия, в които участват йони с различни заряди. Например, дисоциацията на въглеродната киселина протича на два етапа:
H 2 CO 3 + H 2 O ↔ H 3 O + + HCO 3 – ;
HCO 3 – + H 2 O ↔ H 3 O – + CO 3 2–.
Първото равновесие е първи етап на протолиза- характеризира се с константа на киселинност, означена K k1:
Общ баланс
H 2 CO 3 + 2H 2 O ↔ 2H 3 O + + CO 3 2 –
Константата на общата киселинност K до съответства на:
| K k = |
Величините K k, K k1 и K k2 са свързани помежду си по отношение:
K k = K k1 K k2.
При поетапната дисоциация на веществата разлагането в следващия етап винаги се извършва в по-малка степен, отколкото в предишния (във втория по-малко, отколкото в първия и т.н.) С други думи, наблюдават се следните неравенства:
K k > K k2 > K k3 и K 01 > K 02 > K 03. . .
Това се обяснява с факта, че енергията, която трябва да се изразходва за отстраняване на йон, е минимална, когато той се отделя от неутрална молекула и става по-голяма по време на дисоциацията във всяка следваща стъпка.
Ако означим концентрацията на електролит, който се разпада на два йона с c in, и степента на неговата дисоциация в даден разтвор с α, тогава концентрацията на всеки йон ще бъде c in α, а концентрацията на недисоциираните молекули ще бъде c в (1 – α). Тогава уравнението за константата на протолизата K k,ω (константата на киселинността или константата на основността) приема формата:
Това уравнение изразява закона за разреждане на Оствалд. Той дава възможност да се изчисли степента на дисоциация при различни концентрации на електролит, ако е известна константата му на дисоциация. Използвайки това уравнение, можете също да изчислите константата на дисоциация на електролит, като знаете неговата степен на дисоциация при определена концентрация.
За разтвори, в които дисоциацията на електролита е много малка, уравнението на закона на Оствалд е опростено. Тъй като в такива случаи α<<, то величиной α в знаменателе уравнения для К к,ω можно пренебречь. При этом уравнение принимает вид.
1. Реакции на протолиза (йонизация).
Те включват реакции между киселина или основа и вода:
Комплект 1 основен 2 комплект 2 основен 1
Комплект 1 основен 2 комплект 2 основен. 1
2. Реакции на автопротолиза, свързан с прехвърлянето на протон от една водна молекула към друга.
Реакции на хидролиза
CH 3 COONa+ H 2 O ←→ CH 3 COOH + NaOH
CH 3 COO - + H 2 O ←→ CH 3 COOH + OH -
основен 2 комплект 1 комплект 2 основен 1
Киселинно-алкални реакции
NH 3 + HCl → NH 4 + + Cl -
основен 2 комплект 1 комплект 2 основен 1
От аналитична гледна точка се разграничават следните видове реакции:
1) с пренос на протон – киселинно-базов;
2) с пренос на електрони – ОВ реакция;
3) с прехвърлянето на електронни двойки с образуването на връзки според донорно-акцепторния механизъм - реакции на комплексообразуване.
2.2.2 Константа на киселинност и основност. pH изчисления
Способността на киселината да отдаде протон и основата да го приеме (т.е. силата на киселините и основите) може да се характеризира с равновесни константи,
 HS – разтворител
HS – разтворител
които се наричат киселинни константи (К А ) и основност (К b ).


Активността на разтворителя е постоянна стойност (таблични данни)

Позиции на киселинно-алкални равновесия

и стойностите на съответните константи на киселинност и основност зависят от природата на разтворителя.
Ако разтворителят е по-силен акцептор на протони от водата (например амоняк), тогава силата на киселините в него се увеличава. Така че киселини, които са слаби във водни разтвори, могат да бъдат силни в амоняк.
Колкото по-силни са основните свойства на разтворителя, толкова повече киселини са изравнени в него.
По същия начин, колкото по-силни са киселинните свойства на разтворителя, толкова повече основи той неутрализира.
При преминаване от повече към по-малко основен разтворител силните киселини могат да станат слаби (например HCl и HClO 4 във водата са силни киселини, но в ледената оцетна киселина те стават слаби).
изчисляване на pH
Изчисленията на киселинно-алкалното равновесие се използват за:
1) намиране на pH на разтвора, като се използват известни равновесни концентрации;
2) определяне на равновесните концентрации въз основа на известна стойност на pH
pH е важна оценка за биологични течности.
Живите организми се характеризират с поддържане на киселинно-алкалното състояние на определено ниво. Това се изразява в сравнително постоянни стойности на pH на биологичните среди и способността за възстановяване на нормалните стойности на pH, когато са изложени на протолити.
Системата, която поддържа протолитичната хомеостаза, включва не само физиологични механизми (белодробна и бъбречна компенсация), но и физикохимично действие, йонен обмен и дифузия.
В аналитичната химия е важно да се знаят концентрациите на всички частици в разтвор на киселина или основа след установяване на равновесие, по-специално концентрацията на H + йони (pH).
 - слаб електролит
- слаб електролит
 - силен електролит
- силен електролит
Чиста вода





Няма такова нещо като чиста вода. Морската вода съдържа почти всички химични елементи.
Разтвори на слаби киселини
 защото
защото  , Че
, Че


Разтвори на слаби основи






Разтвори на силни киселини

За да се вземе предвид влиянието на електростатичното взаимодействие на йони, концепцията йонна сила на разтвора. Зависи от концентрацията на йона и неговия заряд.
За силните електролити законът за масовото действие е изпълнен, ако се използват дейности. Активността отчита концентрацията на реагентите, взаимодействието между йони (йон-йон, йон-дипол, дипол-дипол, водородни връзки).
Според теорията на Дебай и Хюкел


 - зависимост на коефициента на подвижност от йонната сила
- зависимост на коефициента на подвижност от йонната сила
A зависи от диелектричната константа на разтворителя и температурата на системата. При t=25°C A=0,512 и за бинарен електролит

![]()





Разтвори на силни основи

3.3Протолитично равновесие в буферни разтвори
В широк смисъл буферните системи са системи, които поддържат определена стойност на параметър, когато съставът се промени.
Буферните разтвори могат да бъдат киселинно-базови - те поддържат постоянна стойност на pH при въвеждане на киселини или основи; редокс - запазват потенциала на системата постоянен при въвеждане на окислители или редуциращи агенти; известни са метални буферни разтвори.
Буферният разтвор е конюгирана двойка; по-специално киселинно-базовият буфер е спрегната киселинно-базова двойка:

Така според тази теория Киселина е всяко вещество, чиито молекули (включително йони) са способни да отдадат протон, т.е. да бъде донор на протони; Основа е всяко вещество, чиито молекули (включително йони) са способни да прикрепят протон, т.е. да бъде акцептор на протони; Амфолит е всяко вещество, което е едновременно донор и акцептор на протони.
Тази теория обяснява киселинно-алкалните свойства не само на неутралните молекули, но и на йоните. Една киселина, отдавайки протон, се превръща в основа, която е конюгат на тази киселина. Термините "киселина" и "основа" са относителни понятия, тъй като едни и същи частици - молекули или йони - могат да проявяват както основни, така и киселинни свойства, в зависимост от партньора.
По време на протолитичното равновесие се образуват киселинно-алкални двойки. Според протонната теория реакциите на хидролиза, йонизация и неутрализация не се считат за специално явление, а се считат за обичайно прехвърляне на протони от киселина към основа.
Частицата А се образува след отделянето на водороден йон
pH стойност
Водата, като слаб електролит, се подлага на йонизация в малка степен:
H 2 O ↔ H + + OH - .
Йоните във воден разтвор претърпяват хидратация (воден)
Водата се характеризира с протолитична амфотерност. Реакцията на самойонизация (автопротолиза) на водата, по време на която протон от една водна молекула (киселина) преминава към друга водна молекула (основа), се описва с уравнението:
H 2 O + H 2 O ↔ H 3 O + + OH - .
Равновесната константа на водната автопротолиза е равна на:
Законът за действието на масите се прилага към йонизационната константа:
където a е дейност.
За краткост вместо H 3 O + в киселинно-алкално равновесие пишем
Тъй като водата е в разтвор в голям излишък и се подлага на йонизация в малка степен, може да се отбележи, че нейната концентрация е постоянна и равна на 55,6 mol (1000 g: 18 g/mol = 56 mol) на литър вода.
Следователно произведението на K и (H 2 O) и концентрацията на водата са равни на 1,8 10 -16 mol/l 55,6 mol/l = 10 -14 mol 2 /l 2. Така = 10 -14 (при 25 °C) е постоянна стойност, означено с Kwи се нарича водна автопротолиза константа. Понякога се използва остарялото име - йонен продукт на водата.
Разтвори, в които концентрацията на водородните йони и хидроксидните йони е еднаква, се наричат неутрални разтвори = = = 10 -7 mol/l. В киселинни разтвори > , > 10 -7 mol/l, а в алкални разтвори > , > 10 -7 mol/l.
За да опростим, вземаме за основа водородния индикатор pH - десетичния логаритъм от концентрацията на водородни йони, взет с противоположния знак: pH = -lg.
Интересни факти:
Нарушаване на изохидричното състояние (постоянство на pH) наблюдава се при сърдечно-съдови заболявания, исхемия, захарен диабет (развива се ацидоза). Киселинно-алкалният баланс се поддържа чрез дишане, уриниране и изпотяване. Тези системи работят бавно и незабавната неутрализация на киселинните и алкалните метаболитни продукти се извършва от буферните системи на тялото. Състоянието на изохидрия се осигурява от комбинираното действие на редица физикохимични и физиологични механизми. Буферният ефект се постига чрез комбиниране на няколко протолитични равновесия.
Силата на киселините се определя от способността им да отдават протон.Мярката за тази способност е киселинна константа (Ка).
Колкото по-висока е киселинната константа, толкова по-силна е киселината.Например, оцетната киселина е по-силна от циановодородната киселина, тъй като Ka (CH 3 COOH) = 1,74 10 -5, Ka (HCN) = 1 10 -9. За удобство на изчисленията и записването те често използват не самите константи, а техните отрицателни десетични логаритми: pKa = -lgKa. Извиква се стойността на pKa индикатор за сила на киселина.Колкото по-висока е стойността на pKa, толкова по-слаба е киселината.
Силните киселини почти напълно даряват своя протон на водните молекули, така че присъстващата киселина в разтвора всъщност е хидрониев йон.
В тази връзка, когато се изчислява рН на разтвор на силна едноосновна киселина, концентрацията на протоните се приравнява на концентрацията на киселината
° С(H3O+) = ° С(HB).
В разтвори на слаби киселини концентрацията на хидрониеви йони е значително по-ниска от концентрацията на киселината. Изчислява се въз основа на
двете страни на това уравнение дават формула за изчисляване на pH на разтвори на слаби киселини: pH = 0,5(pKa - log ° С(HB)).