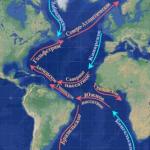
Химична реакция, протичащи с промяна в степента на окисление на елементите, които съставляват реагиращите вещества, се наричат редокс.
Окислението е процесът на загуба на електрони от атом, молекула или йон. Ако един атом отдаде своите електрони, той придобива положителен заряд, например:
Ако отрицателно зареден йон (заряд -1), например, отдаде 1 електрон, тогава той става неутрален атом:
![]()
Ако положително зареден йон или атом отдаде електрони, тогава големината на неговия положителен заряд се увеличава в зависимост от броя на отдадените електрони:

Редукцията е процес на получаване на електрони от атом, молекула или йон.
Ако един атом получи електрони, той се превръща в отрицателно зареден йон:

Ако положително зареден йон приеме електрони, неговият заряд намалява, например:

или може да отиде в неутрален атом:

Окислителят е атом, молекула или йон, който приема електрони. Редуциращият агент е атом, молекула или йон, който отдава електрони.
Окислителят се редуцира по време на реакцията, а редукторът се окислява.
Трябва да се помни, че разглеждането на окислението (редукция) като процес на отдаване (и приемане) на електрони от атоми или йони не винаги отразява истинската ситуация, тъй като в много случаи няма пълен трансфер на електрони, а само изместване на електронният облак от един атом към друг.
Въпреки това, за съставяне на уравнения за редокс реакции, не е от съществено значение коя връзка се образува - йонна или ковалентна. Следователно, за простота, ще говорим за добавяне или даряване на електрони, независимо от вида на връзката.
Съставяне на уравнения на редокс реакции и избор на коефициенти. При съставянето на уравнението за редокс реакция е необходимо да се определи редукторът, окислителят и броят на отдадените и получените електрони.
Обикновено коефициентите се избират, като се използва или методът на електронен баланс, или методът на електронно-йонния баланс (понякога последният се нарича метод на полуреакция).
Като пример за съставяне на уравнения за редокс реакции, разгледайте процеса на окисление на пирит с концентрирана азотна киселина:
Първо, нека определим продуктите на реакцията. е силен окислител, така че сярата ще се окисли до максималното си състояние на окисление, а желязото ще се окисли до , докато може да се редуцира до или. Ние ще изберем.
Все още не знаем къде ще бъде (от лявата или от дясната страна).
1. Нека първо приложим метода на електронно-йонния баланс. Този метод разглежда прехвърлянето на електрони от един атом или йон към друг, като се взема предвид естеството на средата (киселинна, алкална или неутрална), в която протича реакцията. - При изготвяне на уравнения за процесите на окисление и редукция, за да се изравни броят на водородните и кислородните атоми, водните молекули и водородните йони (ако средата е кисела), или водните молекули и хидроксидните йони (ако средата е алкална), са въведени (в зависимост от носителя). Съответно в получените продукти от дясната страна на електронно-йонното уравнение ще има водородни йони и водни молекули (киселинна среда) или хидроксидни йони и водни молекули (алкална среда).
По този начин, когато пишете електронно-йонни уравнения, трябва да изхождате от състава на йоните, които действително присъстват в разтвора. Освен това, както при писане на съкратени йонни уравнения, веществата, които се дисоциират слабо, са слабо разтворими или се отделят като газ, трябва да бъдат записани в молекулярна форма.
Нека разгледаме полуреакцията на окисление за нашия случай.
Молекулата се превръща в йон и напълно се дисоциира на йони (пренебрегваме хидролизата) и два йона (дисоциация):
За да изравним кислорода, добавяме 8 молекули отляво и 16 йона отдясно (средата е кисела!):
Зарядът от лявата страна е 0, следователно зарядът от дясната страна трябва да отдаде 15 електрона:
Нека сега разгледаме полуреакцията на редукция на нитратен йон:
![]()
Необходимо е да се извади от атома O. За да направите това, добавете 4 йона (киселинна среда) към лявата страна и 2 молекули към дясната страна
За да изравним заряда, добавяме 3 електрона към лявата страна (заряд):
Накрая имаме:

Намалявайки двете страни с, получаваме съкратеното йонно уравнение на редокс реакцията:
Като добавим съответния брой йони към двете страни на уравнението, намираме молекулярно уравнениереакции:
Имайте предвид, че никога не е трябвало да определяме степента на окисление на елементите, за да определим броя на дадените и получените електрони. Освен това взехме предвид влиянието на околната среда и автоматично определихме какво е от дясната страна на уравнението. Няма съмнение, че този метод е много по-съвместим с химичното значение от стандартен методелектронен баланс, въпреки че последният е малко по-лесен за разбиране.
2. Нека изравним тази реакция с помощта на метода на електронния баланс. Процесът на възстановяване е описан просто:
По-трудно е да се състави схема на окисление, тъй като 2 елемента се окисляват наведнъж - Fe и S. Можете да присвоите степента на окисление на сярата на желязото и да вземете предвид, че за всеки 1 Fe атом има два S атома:

Можете обаче да се откажете от определянето на степени на окисление и да напишете диаграма, напомняща диаграма (7.1):
Дясната страна има заряд +15, лявата - 0, така че трябва да отдаде 15 електрона. Записваме общия баланс:

5 молекули отиват в окисление, а за образуването са необходими още 3 молекули
За да изравните водорода и кислорода, добавете 2 молекули от дясната страна:
Методът на електронно-йонния баланс е по-универсален в сравнение с метода на електронния баланс и има неоспоримо предимство при избора на коефициенти в много редокс реакции, особено тези, включващи органични съединения, при които дори процедурата за определяне на степента на окисление е много сложна.
Помислете например за процеса на окисление на етилен, който се случва, когато той премине през воден разтвор на калиев перманганат. В резултат на това етиленът се окислява до етиленгликол, а перманганатът се редуцира до манганов (IV) оксид, освен това, както ще бъде очевидно от уравнението на крайния баланс, калиевият хидроксид също се образува отдясно:

След като направим необходимите редукции на подобни членове, ние записваме уравнението в неговата крайна молекулярна форма
Количествени характеристики на редокс реакциите. Диапазон от стандартни електродни потенциали. Възможността за протичане на окислително-възстановителна реакция в реални условия се определя от редица причини: температура, естество на окислителя и редуциращия агент, киселинност на средата, концентрация на вещества, участващи в реакцията и др.
Може да е трудно да се вземат предвид всички тези фактори, но като се помни, че всяка редокс реакция протича с прехвърляне на електрони от редуциращ агент към окислител, е възможно да се установи критерий за възможността за такава реакция.
Количествена характеристика на редокс процесите са нормалните редокс потенциали на окислители и редуциращи агенти (или стандартни електродни потенциали).
За да се разбере физикохимичният смисъл на такива потенциали, е необходимо да се анализират така наречените електрохимични процеси.
Химически процеси, придружени от външния вид електрически токили причинени от него се наричат електрохимични.
За да разберем природата на електрохимичните процеси, нека разгледаме няколко доста прости ситуации. Нека си представим метална плоча, потопена във вода. Под въздействието на полярните водни молекули металните йони се отделят от повърхността на плочата и преминават хидратирани в течната фаза. Последният се зарежда положително и върху металната плоча се появява излишък от електрони. Колкото по-нататък протича процесът, толкова по-голям става зарядът както на плочата, така и на течната фаза.
Поради електростатичното привличане на катиони на разтвора и излишни метални електрони, така нареченият двоен електрически слой, което инхибира по-нататъшния преход на металните йони в течната фаза. Накрая идва момент, в който се установява равновесие между разтвора и металната плоча, което може да се изрази с уравнението:
или като се вземе предвид хидратацията на йони в разтвора:
Състоянието на това равновесие зависи от природата на метала, концентрацията на неговите йони в разтвора, температурата и налягането.
Когато металът се потапя не във вода, а в разтвор на сол на този метал, равновесието, в съответствие с принципа на Le Chatelier, се измества наляво и колкото по-голяма е концентрацията на метални йони в разтвора, толкова по-голяма е концентрацията . Активни метали, чиито йони имат добра способност да преминават в разтвор, в този случай ще бъдат отрицателно заредени, макар и в по-малка степен, отколкото в чистата вода.
Равновесието (7.2) може да бъде изместено надясно, ако електроните бъдат отстранени от метала по един или друг начин. Това ще доведе до разтваряне на металната плоча. Напротив, ако електроните се подават към метална плоча отвън, тогава йони ще се отложат от разтвора върху нея.
Както вече беше отбелязано, когато метал се потопи в разтвор, на границата се образува двоен електрически слой. Потенциалната разлика, която възниква между метала и околната течна фаза, се нарича електроден потенциал. Този потенциал е характеристика на редокс-способността на метала под формата на твърда фаза.
Имайте предвид, че изолиран метален атом (състояние на моноатомна пара, което възниква, когато високи температурии висока степен на разреждане), редокс свойствата се характеризират с друго количество, наречено йонизационен потенциал. Йонизационният потенциал е енергията, необходима за отстраняване на електрон от изолиран атом.
Абсолютната стойност на потенциала на електрода не може да бъде измерена директно. В същото време не е трудно да се измери потенциалната разлика на електрода, която възниква в система, състояща се от две двойки метал-разтвор. Такива двойки се наричат полуелементи. Ние се съгласихме да определим електродните потенциали на металите по отношение на така наречения стандартен водороден електрод, чийто потенциал произволно беше приет за нула. Стандартният водороден електрод се състои от специално подготвена платинена плоча, потопена в киселинен разтвор с концентрация на водородни йони и промита от поток от водороден газ под налягане Pa, при температура
Появата на потенциал върху стандартен водороден електрод може да си представим по следния начин. Водородният газ, адсорбиран от платина, преминава в атомно състояние:
![]()
Осъществява се състояние на динамично равновесие между атомния водород, образуван на повърхността на плочата, водородните йони в разтвора и платината (електрони!):
![]()
Общият процес се изразява с уравнението:
![]()
Платината не участва в редокс процеса, а е само носител на атомарния водород.
Ако метална пластина, потопена в разтвор на нейната сол с концентрация на метални йони равна на 1 mol/l, се свърже със стандартен водороден електрод, се получава галваничен елемент. Електродвижеща силана този елемент (ЕМП), измерен при и характеризира стандартния електроден потенциал на метала, обикновено означаван като .
Таблица 7.1 представя стойностите на стандартните електродни потенциали за някои метали. Стандартните потенциали на електродите, действащи като редуциращи агенти по отношение на водорода, имат знак "-", а знакът "+" показва стандартните потенциали на електродите, действащи като окислители.
Металите, подредени в нарастващ ред на техните стандартни електродни потенциали, образуват така наречената електрохимична серия от метални напрежения:
Редица напрежения характеризират Химични свойстваметали:
1. Колкото по-отрицателен е електродният потенциал на даден метал, толкова по-голяма е неговата редуцираща способност.
2. Всеки метал е в състояние да измести (редуцира) от солеви разтвори онези метали, които са след него в електрохимичната серия от метални напрежения.
3. Всички метали, които имат отрицателен стандартен електроден потенциал, т.е. металите, разположени отляво на водорода в електрохимичните серии на напрежение, са способни да го изместят от киселинни разтвори.
Трябва да се отбележи, че представената серия характеризира поведението на металите и техните соли само във водни разтвори и при стайна температура. Освен това трябва да се има предвид, че стандартните електродни потенциали, посочени в таблицата, отчитат особеностите на взаимодействието на определен йон с молекулите на разтворителя. Това може да наруши някои очаквани модели в подреждането на металите в серията електрохимични напрежения на металите. Например, електрохимичната серия от напрежение на металите започва с литий, докато по-химически активните рубидий и калий са разположени вдясно от лития. Това се дължи на изключително високата енергия на процеса на хидратация на литиевите йони в сравнение с йоните на други алкални метали.
В същото време таблица 7.1 показва стандартните редокс потенциали, които са измерени за неметални системи от тип (7.3), разположени в равновесно състояниеспрямо нормален водороден електрод.
Таблицата показва редукционните полуреакции на следната обща форма:
Както в случая на определяне на стойностите на металите, стойностите на неметалите се измерват при температура от 25 ° C и при концентрация на всички атомни и молекулни видове, участващи в равновесието, равна на 1 mol/l.
Таблица 7.1. Стандартни редокс потенциали при 25 °C (298 K)
(виж сканиране)
Алгебричната стойност на стандартния редокс потенциал характеризира окислителната активност на съответната окислена форма. Следователно сравнението на стойностите на стандартните редокс потенциали ни позволява да отговорим на въпроса: случва ли се тази или онази редокс реакция?
По този начин всички полуреакции на окисление на халогенидни йони до свободни халогени

може да се приложи при стандартни условия, като се използва оловен (IV) оксид или калиев перманганат като окислител. Когато се използва калиев дихромат, могат да се проведат само реакции (7.5) и (7.6). И накрая, използването на азотна киселина като окислител позволява само полуреакция, включваща йодидни йони (7.6).
По този начин количественият критерий за оценка на възможността за протичане на определена редокс реакция е положителна стойностразлики в стандартните редокс потенциали на полуреакциите на окисление и редукция.
Химичните реакции, протичащи с промени в степента на окисление на елементите, се наричат редокс.
Основни принципи на теорията на окисление-редукция
1. Процесът на отдаване на електрони от атом или йон се нарича окисление:
S 0 - 4e - ® S 4+ (окисление)
Атомът или йонът, който отдава електрони, се нарича редуциращ агент (редуциращ агент): Zn 0 -2e - ® Zn 2+ (окисление).
2. Процесът на добавяне на електрони от атом или йон се нарича редукция: S 6+ + 8e - ® S 2- (редукция).
Атомите или йоните, които приемат електрони, се наричат окислители (окислител): Cl - + e - ® Cl 0 (редукция).
Окислителят се редуцира по време на реакцията, а редукторът се окислява. Окисляването е невъзможно без едновременно с него да протича редукция и обратно, редукцията на едно вещество е невъзможно без едновременното окисление на друго.
3. При редокс процесите броят на електроните, отдадени в процеса на окисление, винаги трябва да бъде равен на броя на електроните, приети в процеса на редукция.
Пример:
Cu 2+ O 2- + H 2 0 = Cu 0 + H 2 O 2-
окислител Cu 2+ +2e - ® Cu 0 редукция
редуциращ агент H 2 0 - 2e - ® 2H + окисление
4. Изравняването на броя на дадените и получените електрони се извършва чрез избор на коефициенти с предварително съставяне на уравнение на електронен баланс
Пример:
Pb 2+ S 2- + HNO 3 ® S 0 + Pb 2+ (NO 3) 2 + N 2+ O 2- + H 2 O
Редуктор S 2- - 2e - ® S 0 3 окисление
окислител N 5+ + 3e - ® N 2+ 2 редукция
3PbS + 8HNO 3 ® 3S + 3Pb(NO 3) 2 + 2NO + 4H 2 O.
5. При съставянето на уравнението на електронния баланс е необходимо да се изхожда от броя на атомите или йоните, които са включени в молекулата на изходното вещество, а понякога и в молекулата на реакционните продукти
Пример:
K 2 Cr 2 6+ O 7 + H 2 SO 4 + KJ - ® J 2 0 + Cr 2 3+ (SO 4) 3 + K 2 SO 4 + H 2 O
Окислител 2Cr 6+ + 6e - ® 2Cr 3+ 2 1 редукция
редуктор 2J - - 2e - ® J 2 0 6 3 окисление
6. Редокс процесите протичат най-често в присъствието на среда: неутрална, кисела или алкална.
Избор на коефициенти при редокс реакции
При избора на коефициенти трябва да се вземе предвид основната позиция: броят на електроните, отдадени чрез редукция, е равен на броя на електроните, получени чрез окисление.
След идентифициране на окислителя, редуциращия агент, се съставя цифрова диаграма на електронния преход (уравнение на електронен баланс) до съответното уравнение на реакцията.
Пример 1. Al + Cl 2 ® AlCl 3, където Al – редуциращ агент, Cl2-окислител.
Диаграма на електронния преход:
Al 0 - 3e - ® Al +3 3 1 окисление
Cl 0 + e - ® Cl 1 1 3 редукция
От тази диаграма става ясно, че за един алуминиев атом, който се окислява, са необходими три хлорни атома, за да приемат тези три електрона (вижте втората колона). Следователно за всеки алуминиев атом са необходими три хлорни атома или за два алуминиеви атома са необходими три хлорни молекули. Получаваме коефициентите:
2Al + 3Cl2 = AlCl3.
Пример 2. N 3- H 3 + O 0 2 ® N 2+ O 2- + H 2 O, където O 2 е типичен окислител, а N 3- H 3 играе ролята на редуциращ агент.
Изготвяме диаграма (електронен баланс):
N 3- - 5e - ® N +2 5 2 4 окисление
O 0 + 2e - ® O -2 2 5 10 възстановяване
За 4 азотни атома са необходими 10 атома или 5 кислородни молекули. Получаваме коефициентите:
4NH3 + 5O2 = 4NO + 6H2O.
Специални случаи на съставяне на равенства за окислително-възстановителни реакции
1. Ако при реакция броят на електроните, загубени от редуктора, и броят на електроните, приети от окислителя, са четни числа, тогава при намиране на коефициентите броят на електроните се разделя на най-големия общ делител.
Пример:
H 2 SO 3 + HClO 3 ® H 2 SO 4 + HCl
Редуктор S +4 - 2e - ® S +6 6 3 окисление
окислител Cl +5 + 6e - ® Cl - 2 1 редуц
Коефициентите на редуциращия агент и окислителя няма да бъдат 2 и 6, а 1 и 3:
3H2SO3 +3HC1O3 =3H2SO4 +HC1.
Ако броят на електроните, загубени от редуктора и придобити от окислителя, е нечетен и резултатът от реакцията трябва да бъде четен бройатоми, тогава коефициентите се удвояват.
Пример:
KJ - + KMn +7 O 4 + H 2 S +6 O 4 ® J o 2 + K 2 S +6 O 4 + Mn +2 SO 4 + H 2 O
Редуктор J - -1e - ® J o 5 10 окисление
Коефициентите на окислителя и редуциращия агент няма да бъдат 1 и 5, а 2 и 10:
10KJ + 2KMnO 4 + 8H 2 SO 4 = 5J 2 + 6K 2 SO 4 + 2MnSO 4 + 8H 2 O.
2. Понякога допълнително се изразходва редуциращ агент или окислител за свързване на продуктите, образувани в резултат на реакцията.
Пример:
HBr - + KMn +7 O 4 + HBr ®Br 0 2 + KBr - + Mn +2 Br 2 0 + H 2 O
Редуктор Br - - e - ® Br 0 5 10 окисление
окислител Mn +7 + 5e - ® Mn +2 1 2 редукция
В тази реакция десет молекули HBr реагират като редуциращи агенти и шест молекули HBr са необходими за свързване на получените вещества (образуване на сол):
10HBr + 2KMnO 4 + 6HBr = 5Br 2 + 2KBr + 2MnBr 2 + 8H 2 O.
3. Както положителните, така и отрицателните йони на молекулата на редуциращия агент се окисляват едновременно.
Пример:
As 2 +3 S 3 -2 + HN +5 O 3 ® H 3 As +5 O 4 + H 2 S +6 O 4 + N +2 O + H 2 O
Тук As +3 йони се окисляват до As 2 +3 йони и в същото време S -2 йони се окисляват до S +6 йони и N +5 аниони се редуцират до N +2.
2Аs +3 - 4e - ® 2Аs +5
редуктори 3S -2 - 24e - ® 3S +6 окисление
окислител N +5 + 3e - ® N +2 редукция
При тази реакция за всеки три As 2 S 3 молекули реагират 28 HNO 3 молекули. Проверяваме правилността на уравненията за реакцията, като преброим водородните и кислородните атоми от дясната и лявата страна. Така откриваме, че в реакцията влизат още 4 водни молекули, които трябва да бъдат приписани към лявата страна на равенството за окончателния му запис:
3As 2 S 3 + 28HNO 3 + 4H 2 O = 6H 3 AsO 4 + 9H 2 SO 4 + 28NO
2As +3 –4e®2As +5 4
3S -2 –24e®3S + 24
Редуктори 2As +3 + 3S -2 - 28e - ®2As +5 + 3S +6 3 окисление
окислител N +5 + 3e - ®N +2 28 редукция
4. Редукторът и окислителят са йони на един и същи елемент, но влизат в състава на различни вещества.
Пример:
KJ - + KJ +5 O 3 + H 2 SO 4 ® J 0 2 + K 2 SO 4 + H 2 O
Редуктор J - - e - ® J 0 5 окисление
окислител J +5 + 5e - ®J 0 1 редукция
5KJ + KJO 3 + 3H 2 SO 4 = 3J 2 + 3K 2 SO 4 + 3H 2 O.
5. Редукторът и окислителят са йони на един и същи елемент, които са част от едно вещество (автоокисление - самовъзстановяване).
Пример:
HN +3 O 2 ® HN +5 O 3 + N +2 O + H 2 O
Редуциращ агент N +3 - 2e - ® N +5 1 окисление
окислител N +3 + e - ® N +2 2 редукция
Следователно, равенството на реакцията
Редокс реакции – реакции, протичащи с промяна в степента на окисление на елементите.
Окисляване- процес на отдаване на електрони от атом
Възстановяване- процесът на получаване на електрони от атом
Редуциращ агент- елемент, който отдава електрони
Окислител– елемент, който приема електрони
За визуална, но опростена представа за причините за промяната в зарядите на елементите, нека се обърнем към цифрите:
Атомът е електрически неутрална частица. Следователно броят на протоните е равен на броя на електроните

Ако даден елемент отдаде електрон, неговият заряд се променя. Става положително зареден (ако приеме, напротив, отрицателно)

Че. Зарядът на даден елемент се влияе от броя на дадените или получените електрони
I. Съставяне на уравнения за редокс реакции
1. Запишете схемата на реакцията
Na + Cl 2 -> NaCl
2. Подреждаме степените на окисление на елементите:
Na 0 + Cl 2 0 -> Na + Cl -
3. Записваме елементите, които са променили степента на окисление и определяме броя на отдадените/приетите електрони:
Na 0 -1e -> Na +
Cl 2 +2e ->2Cl -
4. Намерете най-малкото общо кратно на броя на дарените и прикрепените електрони:
Че. получихме необходимите коефициенти
5. Задаваме коефициентите:
2Na 0 + Cl 2 0 -> 2Na + Cl —
Описание
По време на редокс реакцията редукторът отдава електрони, т.е. окислява се; Окислителят получава електрони, т.е. се възстановява. Освен това всяка редокс реакция представлява единство от две противоположни трансформации - окисление и редукция, протичащи едновременно и без да се отделят една от друга.
Окисляване
Окислението е процесът на загуба на електрони с повишаване на степента на окисление.
Когато дадено вещество се окислява, степента му на окисление се повишава в резултат на загубата на електрони. Атомите на веществото, което се окислява, се наричат донори на електрони, а атомите на окислителя се наричат акцептори на електрони.
В някои случаи, по време на окисление, молекулата на изходното вещество може да стане нестабилна и да се разпадне на по-стабилни и по-малки съставни части (вижте Свободни радикали). Освен това някои от атомите на получените молекули имат повече висока степенокисление от същите атоми в оригиналната молекула.
Окислителят, приемайки електрони, придобива редуциращи свойства, превръщайки се в конюгиран редуциращ агент:
окислител + e − ↔ конюгиран редуциращ агент.
Възстановяване
По време на редукция атомите или йоните получават електрони. В този случай степента на окисление на елемента намалява. Примери: редукция на метални оксиди до свободни метали с помощта на водород, въглерод и други вещества; редукция на органични киселини до алдехиди и алкохоли; хидрогениране на мазнини и др.
Редуциращият агент, даряващ електрони, придобива окислителни свойства, превръщайки се в конюгиран окислител:
редуциращ агент - e − ↔ конюгиран окислител.
Несвързаният свободен електрон е най-силният редуциращ агент.
Редокс двойка
Окислителят и неговата редуцирана форма или редуциращият агент и неговата окислена форма са спрегнати редокс двойкаи техните взаимопревръщания са редокс полуреакции.
Във всяка редокс реакция участват две конюгирани редокс двойки, между които има конкуренция за електрони, в резултат на което възникват две полуреакции: едната е свързана с добавянето на електрони, т.е. намаляване, другият - с освобождаване на електрони, т.е. окисляване.
Видове редокс реакции
Междумолекулни - реакции, при които окислителни и редуциращи атоми се намират в молекули на различни вещества, например:
H 2 S + Cl 2 → S + 2HCl
Вътрешномолекулярни - реакции, при които окислителни и редуциращи атоми се намират в молекули на едно и също вещество, например:
2H 2 O → 2H 2 + O 2
Диспропорциониране (автоокисление-самовъзстановяване) - реакции, при които един и същи елемент действа едновременно като окислител и редуциращ агент, например:
Cl 2 + H 2 O → HClO + HCl
Препропорциониране (пропорциониране) - реакции, при които едно състояние на окисление се получава от две различни степени на окисление на един и същ елемент, например:
NH 4 NO 3 → N 2 O + 2H 2 O
Примери
Редокс реакция между водород и флуор
Разделя се на две полуреакции:
1) Окисляване:
2) Възстановяване:
Окисляване, редукция
При редокс реакциите електроните се прехвърлят от един атом, молекула или йон към друг. Процесът на загуба на електрони е окисление. По време на окисляването степента на окисление се повишава:
По време на химичните реакции броят и характерът на връзките между взаимодействащите атоми могат да се променят, т.е. Степените на окисление на атомите в молекулите могат да се променят.
Реакциите, които водят до промени в степента на окисление на атомите, се наричат редокс.
Примери за окислително-редукционни реакции (съкратено ORR):
Промяната в степента на окисление се дължи на изместването или прехвърлянето на електрони. Независимо от това дали електроните преминават от един атом към друг или са само частично изтеглени от един от атомите, обикновено говорим за получаване и загуба на електрони.
Процессе завръща електрони в атом или йон се наричаокисление . Процесприсъединяване електрони се наричареставрация .
Наричат се вещества, чиито атоми или йони отдават електрони реставратори . По време на реакцията те се окисляват. Наричат се вещества, чиито атоми или йони получават електрони окислители . По време на реакцията те се възстановяват.
Процесите на окисление и редукция са представени чрез електронни уравнения, които показват промяната в степента на окисление на взаимодействащите атоми и броя на електроните, отдадени от редуктора или приети от окислителя.
Примери за уравнения, изразяващи процеси на окисление:

Уравнения, изразяващи процеси на възстановяване:

Редокс реакцията е единичен процес, при който окислението и редукцията протичат едновременно. Окислението на един атом винаги е придружено от редукция на друг и обратно. При което общ броят на електроните, отдадени от редуциращия агент, е равен на броя на електроните, получени от окислителя.
Според закона на еквивалентите Масите на реагиращите вещества са свързани една с друга като моларни маси на техните еквиваленти. Еквивалентното количество вещество в ORR зависи от броя на електроните, отдадени или получени от неговите атоми; моларна масаеквивалентът се изчислява по формулата:
 , (1)
, (1)
Където М– моларна маса на веществото, g/mol
М екв – моларна маса на еквивалента на веществото, g/mol
 – брой дарени или добавени електрони
– брой дарени или добавени електрони
Например в реакцията
мангановият атом добавя 5 електрона, така че еквивалентното количество  е 1/5 къртица,и серният атом отдава 2 електрона и еквивалентно количество
е 1/5 къртица,и серният атом отдава 2 електрона и еквивалентно количество  е 1/2 къртица. Моларните маси на еквивалентите са съответно
е 1/2 къртица. Моларните маси на еквивалентите са съответно
Видове редокс реакции
Има три типа химични ORR: междумолекулни, вътрешномолекулни и реакции на автоокисление-саморедукция. Отделна група се състои от електрохимични реакции.
1. Междумолекулните редокс реакции са реакции, при които окислителят и редукторът са различни вещества:

2. Вътрешномолекулни ORR са реакции, при които се променят степените на окисление на различни атоми на една молекула:

3. Реакциите на самоокисление и саморедукция са реакции, при които протича окисление и редукция на атоми на един и същи елемент:

4. Електрохимичните реакции са ORR, при които процесите на окисление и редукция са разделени пространствено (протичат на отделни електроди), а електроните се прехвърлят от редуктора към окислителя чрез външна електрическа верига:
Редокс реакциите обикновено са сложни, но като знаете формулите на реагентите и реакционните продукти и можете да определите степента на окисление на атомите, можете лесно да поставите коефициентите в уравнението на всяка редокс реакция.