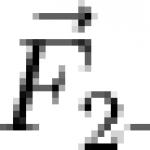ION
(от гръцки ion - ходене), електрически зареждащ. частици, образувани по време на загубата или добавянето на електрони от атоми, молекули, радикали и т.н. I. съответно може да бъде положителен (със загуба на електрони) и отрицателен (с добавяне на електрони), I. е кратно на заряда на електронът -on. I. може да бъде част от молекули и да съществува в несвързано състояние (в газове, течности, плазма).
Физически енциклопедичен речник. - М.: Съветска енциклопедия. . 1983 .
ЙОН (от гръцки ion - отиващ) е електрически заредена частица, образувана от отделянето или присъединяването на една или повече. електрони (или други заредени частици) към атом, молекула, радикал или друг йон. Положително заредените И. се наричат. катиони, отрицателно заредени - аниони и др. I. обозначават химически. символ с индекс (горе вдясно), показващ знака и големината на заряда - множественост I. - в единици електронен заряд (например Li +, H 2 +, SO 4 2-). Атомните I. също означават химически. символ на елемент с римски цифри, показващи множествеността на I. (например NI, NII, NIII, което съответства на N, N +, N 2+; в този случай римските цифри са спектроскопични символи Z , те са по-големи от заряда на йона Z i с единица: Z = Z i + l). Последователност на I. различни химикали. образуват се елементи, съдържащи еднакъв брой електрони (виж, например, водородоподобни атоми).Концепцията и терминът "аз." (както и " " и "анион") са въведени през 1834 г. от М. Фарадей. За да премахнете електрон от неутрален атом или е необходимо да похарчите определена сума. енергия, т.нар йонизационна енергия. Енергията на йонизация на заряд на електрона се нарича йонизационен потенциал.Характеристиката, противоположна на йонизационната енергия - - е равна на енергията на свързване на комплемента, електрона в отрицателната. I. Неутралните атоми се йонизират под действието на оптични кванти. радиация, рентген и g-лъчение, електрически. полета по време на сблъсък с други атоми, електрони и други частици и др. ДНК молекула, носеща отрицателно заредена фосфатна група PO 4 - във всяка от нейните повтарящи се единици. Някои молекули, открити в разтвори и кристали, остават като цяло електрически неутрални, въпреки че съдържат разлагане. в неговите области има противоположно заредени групи, те се наричат. цвитериони. По този начин молекулата на аминокиселината H 2 N - CHP-COOH (P е страничен радикал) се трансформира в цвитерионна форма H 3 N-CHP-COO -, която е придружена от прехвърляне на протон от COOH групата към H 2 N група. Комплекс, състоящ се от няколко. неутрални атоми или молекули и простите И. образува сложни И., т.нар. клъстерен йон.В газовете при нормални условия образуваните йони са краткотрайни, но при високи температури и налягания степента на йонизация на газа се увеличава с повишаване на температурата и налягането, а при много високи температури и налягания газът се превръща в плазма.В течностите, в зависимост от естеството на разтворителя и разтвореното вещество, катионите и анионите могат да бъдат разположени на почти безкрайно разстояние един от друг (в случай, че са заобиколени от молекули на разтворителя), но те също могат да бъдат доста близо един до друг и, взаимодействайки си силно, образуват т.нар йонни двойки. Обикновено се образуват твърди соли йонни кристали.Енергията на взаимодействие на атомните частици като функция на разстоянието между тях може да се изчисли с помощта на разлагане. приблизителни методи (вж Междумолекулно взаимодействие).Енергийните нива на атомните и молекулярните частици и неутралните частици са различни и по принцип могат да бъдат изчислени чрез методи квантова механика, както и йонизационни енергии. Оптичен Спектрите на атомната енергия са подобни на спектрите на неутралните атоми със същия брой електрони, те са само изместени към късовълновия диапазон, тъй като дължините на спектралните линии съответстват на квантовите преходи между енергийните нива с различни стойности; на гл. квантово число, са пропорционални на квадрата на ядрения заряд. В спектрите на I. т.нар сателитни линии, чийто анализ позволява да се изследва структурата и свойствата многозарядни йони.Йонната компонента оказва значително влияние върху параметрите на лабораторната и астрофизичната плазма. Изследването на енергията е важно за различни области на физиката и химията на плазмата, астрофизиката, квантовата електроника, за изследване на структурата на веществата и др. Енергията се използва широко в експериментите. изследвания и инструменти (масспектрометри, камери на Уилсън, йонен проектор, йонни лъчи и др.). Лит.:Смирнов Б. М., Отрицателни йони, М., 1978; Пресняков Л.П., Шевелко В.П., Янев Р.К., Елементарни с участието на многозарядни йони, М., 1986. В.Г. Дашевски.
Физическа енциклопедия. В 5 тома. - М.: Съветска енциклопедия. Главен редактор А. М. Прохоров. 1988 .
Синоними:
Вижте какво е „ION“ в други речници:
Този термин има други значения, вижте Йон (значения). Тип "ЙОН". Частна фирма... Уикипедия
йон- Атом или група от атоми, които чрез загуба или печалба на един или повече електрони са придобили електрически заряд. Ако йонът е получен от водороден атом или метален атом, той обикновено е положително зареден; ако йонът се получава от неметален атом... ... Ръководство за технически преводач
Ах съпруг. Разг. до (виж Йона). разграждане Йоних. Речник на личните имена. Йон Вижте Ивон. Ден на ангела. Ръководство за имена и рождени дни. 2010... Речник на личните имена
- (Йон, Ιων). Син на Ксутус, прародител на йонийското племе. (Източник: " Кратък речникмитология и антики“. М. Корш. Санкт Петербург, публикувано от А. С. Суворин, 1894 г.) ИОН (Ίων), в гръцката митология, атинският цар, син на Креуса. Баща И. най... Енциклопедия на митологията
ИОН, съпруг. хармония, смисъл, смисъл, пригодност. Той е неудобен, няма йон в него. Прозорецът не беше прорязан до йона, затова го запечатах. РечникДалия. В.И. Дал. 1863 1866 … Обяснителен речник на Дал
Съществува., брой синоними: 17 допълнение (1) амфион (2) анион (1) ... Речник на синонимите
Атом (или група атоми, сложен йон), който носи положителен (катион) или отрицателен (анион) електрически заряд и е независим или относително независим неразделна част(строителна единица) за улавяне или... ... Геоложка енциклопедия
Йон, Йон, от Хиос, ок. 490 прибл. 421 пр.н.е е., гръцки поет. Той често посещава Атина, въпреки че не се установява там завинаги. Той беше в приятелски отношения с Тимон и Темистокъл, познаваше също Есхил и Софокъл. Той постави първата трагедия през 451 г. За нас... ... Древни писатели
В гръцката митология внук на елини, син на Ксут (или Аполон); прародител на йонийското племе. Става крал на Атина; неговите синове Хоплет, Хелеонт, Егикорей, Аргад са епоними на четирите най-древни фили на Атика... Голям Енциклопедичен речник
- (Ain) (вероятно руини), град и равнина, разположена на север. източникът на Йордан (3 Царе 15:20; 4 Царе 15:29). I. е завладян от Арам. (Сър.) от цар Бенхадад, а по-късно от Тиглатпаласар III (bib. Feglathpileser). В 3 Царе 15:20 имената на местата са изброени в... ... Библейска енциклопедия на Брокхаус
Книги
- Йон Креанга. Избрани произведения. Спомени от детството. Приказки. Разкази, Йон Креанга. Букурещ, 1959 г. Издателство на чужди езици. С илюстрации. Обвързване на издателя. Състоянието е добро. Класикът на румънската и молдовската литература Йон Креангъ (1837-1889) в своята…
Йоне електрически заредена частица. В този случай йонът може да има положителен или отрицателен електрически заряд. В първия случай се нарича катион, а във втория - анион.
Йонът може да бъде атом, молекула или свободен радикал, стига да има някакъв заряд. Между другото, зарядът на един йон не може да бъде безкрайно малък и частицата, с която е представен, не може да бъде елементарна.
Йоните също са химически активни частици, така че могат да реагират както с други частици (незаредени), така и помежду си.
Йоните, като независими частици, се срещат почти навсякъде. Те присъстват в атмосферата, в различни течности, в твърди веществаи дори в междузвездно пространство, където по принцип има много малко въздух или някакво вещество.
История
Понятието „йон“ е въведено за първи път от известния учен Майкъл Фарадей през 1834 г. Докато изучава разпределението на електричеството в различни среди, той предполага, че електрическата проводимост на някои от тях може да се дължи на наличието на определени електрически заредени частици в тези среди и вещества. Затова той ги нарече йони. Ученият въвежда и концепциите за катиони и аниони. Тъй като положителните йони се движат към отрицателно зареден електрод, катода, той ги нарече катиони. Отрицателните йони се движат обратно - към анода, което означава, че трябва да се наричат аниони.
Йон- едноатомна или многоатомна електрически заредена частица от вещество, образувана в резултат на загуба или печалба от атом в молекулата на един или повече електрони.
Зарядът на йона е кратен на заряда на електрона. Понятието и терминът "йон" е въведено през 1834 г. от Майкъл Фарадей, който, докато изучава действието електрически токкъм водни разтвори на киселини, алкали и соли, предполага, че електрическата проводимост на такива разтвори се дължи на движението на йони. Фарадей нарече положително заредени йони, движещи се в разтвор към отрицателния полюс (катод) катиони, и отрицателно заредени, движещи се към положителния полюс (анод) - аниони.
Свойствата на йоните се определят:
1) знака и големината на техния заряд;
2) структурата на йоните, т.е. разположението на електроните и силата на техните връзки, като външните електрони са особено важни;
3) техните размери, определени от радиуса на орбитата на външния електрон.
4) здравина на електронната обвивка (деформируемост на йони).
Под формата на независими частици йоните се намират във всички агрегатни състояния на материята: в газове (по-специално в атмосферата), в течности (в стопилки и разтвори), в кристали и в плазма (по-специално в междузвездното пространство) .
Като химически активни частици, йоните реагират с атоми, молекули и помежду си. В разтворите йоните се образуват в резултат на електролитна дисоциация и определят свойствата на електролитите.
Броят на елементарните електрически заряди на йони в разтвори почти винаги съвпада с валентността на даден атом или група; газовите йони могат да имат различен брой елементарни такси. Под въздействието на достатъчно енергийни въздействия ( висока температура, високочестотно лъчение, високоскоростни електрони) могат да се образуват положителни йони с различен брой електрони, до голи ядра. Положителните йони се означават със знак + (плюс) или точка (например Mg***,Al +++), отрицателните йони със знак - (минус) или знак "(Cl -, Br"). Броят на знаците показва броя на излишните елементарни заряди. Най-често йоните се образуват със стабилни външни електронни обвивки, съответстващи на обвивката благородни газове. Йоните, от които са изградени кристалите, и йоните, открити в разтвори и разтворители с висока диелектрична константа, принадлежат предимно към този тип, например алкални и алкалоземни метали, халогени и пр. Има обаче и т.нар. преходни йони, в които външните обвивки съдържат от 9 до 17 електрона; тези йони могат относително лесно да се трансформират в йони от различен тип и значение (например Fe - -, Cu и др.).
Химични и физични свойства
Химически и физически свойствайони се различават рязко от свойствата на неутралните атоми, наподобявайки в много отношения свойствата на атомите на други елементи, които имат същия брой електрони и същата външна електронна обвивка (например K" прилича на Ar, F" - Ne). Простите йони, както е показано от вълновата механика, имат сферична форма. Размерите на йоните се характеризират с големината на техните радиуси, които могат да бъдат определени емпирично чрез рентгенов анализ на кристали (Goldschmidt) или изчислени теоретично чрез вълнова механика (Paulig) или статистика (Fermi). Резултатите, получени и при двата метода, дават доста задоволително съответствие. Редица свойства на кристалите и разтворите се определят от радиусите на йоните, от които са съставени; в кристалите тези свойства са енергия кристална решеткаи до голяма степен неговия вид; в разтворите йоните поляризират и привличат молекулите на разтворителя, образувайки обвивки с променлив състав; тази поляризация и силата на връзката между йони и молекули на разтворителя се определят почти изключително от радиусите и зарядите на йоните. Колко силен е ефектът на йонното поле върху молекулите на разтворителя като цяло, показват изчисленията на Zwicky, който установи, че водните молекули са близо до йоните под налягане от около 50 000 atm. Силата (деформируемостта) на външната електронна обвивка зависи от степента на свързаност на външните електрони и определя главно оптични свойствайони (цвят, пречупване). Цветът на йоните обаче е свързан и с образуването на йони на различни съединения с молекули на разтворителя. Теоретичните изчисления на ефектите, свързани с деформацията на електронните обвивки, са по-трудни и по-малко овластяващи от изчисленията на силите на взаимодействие между йони. Причините за образуването на йони в разтворите не са точно известни; най-правдоподобното мнение е, че молекулите на разтворимите вещества се разграждат на йони от молекулната нула на разтворителя; хетерополярни, т.е. кристали, изградени от йони, очевидно дават йони веднага след разтваряне. Значението на молекулярното поле на разтворителя се потвърждава от паралелизма между диелектричната константа на разтворителя, която е приблизителна мярка за напрежението на неговото молекулярно поле, и степента на дисоциация (правилото на Нернст-Томсън, експериментално потвърдено от Уолдън). Но йонизация се случва и при вещества с ниска диелектрична константа, но тук се разтварят предимно електролити, които произвеждат сложни йони. Понякога комплексите се образуват от йони на разтворимото вещество; понякога в тяхното образуване участва и разтворителят. Веществата с ниска диелектрична константа също се характеризират с образуването на комплексни йони, когато се добавят неелектролити, например (C 2 H 5) 0Br 3 дава проводящо съединение, когато се смеси с хлороформ
система. Външен признак за образуването на комплексни йони е т.нар. аномална електрическа проводимост, при която графика, изобразяваща зависимостта на моларната електрическа проводимост от разреждането, дава максимум в областта на концентрираните разтвори и минимум при по-нататъшно разреждане.
Номенклатура Според химическата номенклатура името на катион, състоящ се от един атом, съвпада с името на елемента, например Na + се нарича натриев йон, понякога се добавя заряд в скоби, например името на Fe 2 + катион е железен (II) йон. Името се състои от един атом на аниона и се образува от корена на латинското име на елемента и наставката " -id/-id", например F - се нарича флуорен йон.
Не много хора са добре запознати с различните термини, теории и закони на физиката и химията. А някои може просто да започнат да изучават тези дисциплини. Следователно определени концепции може да са неизвестни или забравени. Например думата „йон“ е позната на много хора, но нека си спомним какво е йон и какви свойства има.
Какво е йон
Думата и понятието "йон" дойде при нас от старогръцки езики се превежда като „отивам“. Йонът е заредена частица. Следователно един йон може да има или положителен, или отрицателен заряд. Заредената частица може да бъде атом, молекула или свободен радикал. Зарядът е кратен на заряда на електрона.
В свободно състояние йоните се намират навсякъде във всеки агрегатно състояниевещества. Те могат да бъдат намерени в газове, течности, сплави, кристали и плазма.
Ако йонът е отрицателен, тогава той се нарича анион, а положителният заряд се нарича катион. Тези имена са въведени от учения Майкъл Фарадей, който открива йоните.
Терминът "йон" също е въведен от физика и химика Майкъл Фарадей през 1834 г., когато той изучава ефектите на електрическия ток върху различни водни разтвори. Тогава той стигна до заключението, че електрическата проводимост на различни алкални, киселинни и солеви разтвори зависи от движението на специални частици, които той нарече йони и раздели на положителни и отрицателни заряди.
Йоните имат няколко основни физични свойства:
- Йоните са активни вещества и взаимодействат с атоми, молекули, свободни радикали и същите йони. Те участват в много различни реакции.
- В електрическо поле йоните пренасят електричество към желаните електроди с противоположни заряди.
- В живите организми йоните също играят огромна роля, провеждане на нервни импулси.
- Йоните могат да действат като катализатори или междинни продукти в химичните реакции.
- Йонни реакциив електролитни разтвори възникват мигновено;
- Положителните водородни йони са протони във физиката. Протоните и неутроните образуват всички атомни ядра. Такъв протон може да се получи чрез йонизация на водороден атом.
Можете също така да прочетете нашия полезен раздел