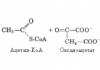
II Състав и структура на HNO3
1. Реакции с метали. Тъй като азотният атом в положителни степени на окисление е окислител и колкото по-висока е степента на окисление, толкова по-силна е способността да се вземат електрони от други атоми, тогава азотните оксиди ще реагират с метали - по същество редуциращи агенти. Получените продукти могат да бъдат напълно различни, в зависимост от условията на реакцията и самия метал. Например при гореща мед всички азотни оксиди отделят кислород и се превръщат в простото вещество азот:
По количеството образувани меден оксид и азотен оксид е възможно да се определи кой азотен оксид е реагирал с медта.
2. Реакции с неметали. Първо, нека разгледаме реакциите с кислорода. Тук има разлика между оксидите, и то много съществена.
Оксид NOреагира с кислород, за да образува азотен оксид (IV). Реакцията е обратима. Освен това с повишаване на температурата скоростта на тази реакция намалява:
2NO + O2 = 2NO2.
NO2 оксидът изобщо не реагира с кислорода.
Озонът превръща двата оксида в азотен оксид (V).
Азотният (II) оксид NO абсорбира напълно озона:
2NO + O3 = N2O5.
Азотният оксид (IV) NO2 при реакция с озон също освобождава кислород:
2NO2 + O3 = N2O5 + O2.
3. Реакции с вода. NO оксид не реагира с вода. NO2 оксидът с вода образува две киселини - азотна (степен на окисление на азот +5) и азотна (степен на окисление на азот +3). В присъствието на кислород NO2 оксидът се превръща напълно в азотна киселина:
2NO2 + H2O = HNO3 + HNO2,
4NO2 + O2 + 2H2O = 4HNO3.
4. Реакции с киселини. Нито един от оксидите - NO или NO2 - не реагира с киселини.
5. Реакции с алкали. И двата азотни оксида реагират с алкали.
NO оксидът образува с алкали сол на азотиста киселина, азотен оксид (I) и азот:
10NO + 6NaOH = 6NaNO2 + N2O + N2 + 3H2O.
NO2 оксидът образува соли на две киселини с алкални - азотна и азотна:
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O.
Да се върнем към нашата мистерия на степента на окисление. При преход кислородни съединенияазот от състояние „газ“, където можете да се движите свободно, към състояние „воден разтвор“, където има повече суматоха, където колективизмът процъфтява, където полярните водни молекули съществуват и са активни, никой няма да допусне молекула, атом или йон да бъде сам, случва се "смяна на ориентация" Нечетните степени на окисление стават стабилни, както подобава на елемент от нечетна група. (Стабилно обаче е относително. Азотната киселина например може да съществува само в разтвор, в противен случай се разлага. Но киселини, формално съответстващи на азотни оксиди (II) и (IV), изобщо не съществуват. Всичко се познава чрез сравнение. )
Интересно е, че не само ясно киселинният оксид NO2 реагира с алкали, но и NO, който е некиселинен по свойства и степен на окисление, и се получават съединения с други степени на окисление - странни! Тайна? Пълна киселина, молекулна структура и препарат.
Експериментално е доказано, че в молекулата на азотната киселина между два кислородни атома и азотен атом има два химични връзкиабсолютно идентични - облигации една и половина. Степента на окисление на азота е +5, а валентността е IV.
Азотната киселина HNO3 в чиста форма е безцветна течност с остра задушлива миризма, безкрайно разтворима във вода; t°pl.= -41°C; t° на кипене = 82,6°C, r = 1,52 g/cm3. В бр големи количестваа, образува се по време на мълния и присъства в дъждовната вода.
Под въздействието на светлината азотната киселина частично се разлага с отделянето на NO2 и поради това придобива светлокафяв цвят:
N2 + O2 мълния електрически разряд→ 2NO
2NO + O2 → 2NO2
4HNO3 светлина → 4NO2 (кафяв газ) + 2H2O + O2
Азотната киселина с висока концентрация отделя газове във въздуха, които в затворена бутилка се откриват като кафяви пари (азотни оксиди). Тези газове са много отровни, така че трябва да внимавате да не ги вдишвате. Азотната киселина окислява много органична материя. Хартията и тъканите се унищожават поради окисляването на веществата, които образуват тези материали. Концентрираната азотна киселина причинява тежки изгаряния при продължителен контакт и пожълтяване на кожата за няколко дни при кратък контакт. Пожълтяването на кожата показва разрушаването на протеина и освобождаването на сяра (качествена реакция към концентрирана азотна киселина - жълто оцветяване поради освобождаването на елементарна сяра, когато киселината действа върху протеина - ксантопротеинова реакция). Тоест, това е изгаряне на кожата. За да предотвратите изгаряния, трябва да работите с концентрирана азотна киселина с гумени ръкавици.
разписка
1. Лабораторен метод
KNO3 + H2SO4 (конц.) → KHSO4 + HNO3 (при нагряване)
2. Индустриален метод
Извършва се на три етапа:
а) Окисляване на амоняк върху платинен катализатор до NO
4NH3 + 5O2 → 4NO + 6H2O (Условия: катализатор – Pt, t = 500˚С)
б) Окисляване на NO до NO2 от атмосферния кислород
2NO + O2 → 2NO2
в) Абсорбция на NO2 от вода в присъствието на излишък на кислород
4NO2 + O2 + 2H2O ↔ 4HNO3 и 3NO2 + H2O ↔ 2HNO3+NO (без излишък на кислород)
Приложение
Най-важните азотни оксиди са представени в таблица 1.
Азотният оксид (V) е твърдо, останалите оксиди са газообразни при нормални условия. Най-великият практическо значениеот тях имат азотен оксид (II) и азотен оксид (IV). Всички азотни оксиди са отровни, с изключение на азотния оксид (I).
Азотен оксид (I) N 2 O.При стайна температура N 2 0 е безцветен газ (t pl = _ 91 ° C, t кипене = -89 ° C), без мирис, сладък на вкус, слабо разтворим във вода. Когато се вдишва в малки количества, N20 предизвиква конвулсивен смях, поради което се нарича „смеещ се газ“. Молекулата N 2 0 е линейна, нискополярна. Използвайки метода на валентната връзка, неговата структура се описва с помощта на две резонансни структури:
Връзката между азотните атоми (0,113 nm) е само малко по-дълга от тройната връзка в молекулата на N2 (0,110 nm).
Азотният оксид (1) се получава чрез термично разлагане на амониев нитрат при температура малко над точката му на топене (170 °C):
NH 4 NO 3 → N 2 0 + 2H 2 0
По-чистият N 2 0 се образува чрез копропорциониране на нитрит и хидразин или хидроксиламинова сол:
NH3OHCI + NaNO2 = N2O + 2H20 + NaCl
Азотен оксид (II) NO- безцветен газ, слабо разтворим във вода и не реагира химически с нея. Лесно се свързва с кислорода, за да образува азотен оксид (IV):
2NO + O 2 → 2NO 2 + 113 kJ
Азотният оксид (II) се получава в лаборатория чрез действието на разредена азотна киселина (ρ = 1,2 g/cm 3, ω = 33%) върху мед. Уравнението на реакцията е:
3Cu + 8HNO 3 = 3Cu(NO 3) 2 + 2NO + 4H 2 O
Молекулата NO има нечетно числовъншни електрони, следователно има един допълнителен електрон. Ненаситеният характер на молекулата на NO се проявява в способността й да образува комплекси с определени метални йони. Така, когато NO преминава в разтвор на FeSO 4, последният става кафяв поради образуването на съединение със състав SO 4. При нагряване това крехко съединение се разлага.
Азотният оксид (II) е типичен редуциращ агент. Обезцветява подкиселен разтвор на калиев перманганат:
5NO + 3KMn0 4 + 2H 2 S0 4 = 2MnS0 4 + 3KN0 3 + Mn(N0 3) 2 + 2H 2 0
лесно се окислява от кислород:
2NO + 0 2 = 2N0 2
Процесът протича с много висока скорост, тъй като и двете реагиращи частици са радикали.
Поради наличието на един несдвоен електрон в антисвързващата 2π орбитала, азотният (II) оксид се характеризира с едноелектронни окислителни процеси с образуването на катион нитрозил (нитрозоний) N0+ : N0 – e - = N0 + . В този случай множествеността N-O връзкинараства до три, а енергията му нараства от 627 (NO) до 1046 (NO +) kJ/mol. Нитрозилови производни са ковалентни азотни оксихалогениди NOX (X - халоген), както и йонни соли, например нитрозониев перхлорат, нитрозониев селенат (N0) 2 Se0 4. Нитрозониевият хидрогенсулфат се получава чрез преминаване на серен диоксид през димяща азотна киселина:
HN0 3 + S0 2 =
Други нитрозониеви соли също могат да бъдат получени чрез взаимодействие на азотни оксиди с концентрирани киселини, Например:
N 2 0 3 + H 2 Se0 4 = (N0) 2 Se0 4 + H 2 0
Нитрозониевите соли са термично нестабилни и в присъствието на вода се хидролизират необратимо:
2 + H 2 0 = NO + N0 2 + 2H 2 S0 4
Ковалентен нитрозил хлорид N0C1 - оранжево-червен газ (тпл= -65 °C, t кип =-6 °C), образуван по време на хлориране на NO в присъствието на активен въглен:
NO + C1 2 = 2N0C1
когато нитритът реагира с хлороводород:
NaN0 2 + 2HC1 = N0C1 + NaCl + H 2 0
или при заместване на анион в нитрозониеви соли:
NaCl = N0C1 + NaHS0 4
Окислителните свойства са по-малко характерни за NO. Например, при взаимодействие със силни редуциращи агенти се образува азот:
2N0 + 2H 2 S = N 2 + 2S↓ + 2H 2 0
На родиев катализатор NO окислява въглеродния оксид до въглероден диоксид:
2N0 + 2СО = N 2 + 2С0 2
Такива катализатори се монтират в изпускателните тръби на автомобилите, за да се избегне замърсяването на атмосферата с отровни газове NO x.
При взаимодействие с разтопена основа NO диспропорционира:
6N0 + 4KON = N 2 + 4KN0 2 + 2H 2 0
Азотен(III) оксид N 2 0 3 .Тази връзка е много нестабилна и съществува само когато ниски температури. В твърдо и течно състояние (t pl = -100 °C) това вещество е оцветено в ярко синьо; над O °C се разлага:
N 2 0 3 =N0 + N0 2
За разлика от N 2 0 и NO, азотният оксид (II) е типичен киселинен оксид; той се разтваря в ледена вода, за да образува син разтвор на азотиста киселина;
N 2 0 3 + H 2 0 = 2HNO 2
При взаимодействие с алкални разтвори N 2 0 3 се превръща количествено в нитрити:
N 2 0 3 + 2NaOH = 2NaNO 2 + H 2 0
В силно кисела среда настъпва хетеролитично разлагане на връзката NO-N0 2, което води до образуването на нитрозониеви соли:
N 2 0 3 + 3H 2 S0 4 = 2NO + + H 3 0 + + 3HSO 4
При охлаждане до -36 °C, еквимоларна смес от оксиди N0 и N0 2, образувана при редукция на 50% HNO 3 с арсенов (III) оксид или нишесте, кондензира N 2 0 3:
2HN0 3 + As 2 0 3 + 2H 2 0 = 2H 3 As0 4 + N 2 0 3
1 / n (C 6 H 10 O 5) n +12HN0 3 = 6C0 2 + 11H 2 0 + 6N 2 0 3
Азотни (IV) оксиди: NO 2 и N 2 0 4.Азотният (IV) оксид съществува в широк температурен диапазон като равновесна смес от мономер N0 2 и димер N 2 0 4.
Равновесие
2N0 2 ↔ N 2 0 4 , ΔН =-57,2 kJ/mol
Кафяв газ Безцветен газ
парамагнитен диамагнитен
силно зависи от температурата. Твърдият азотен оксид (IV) е безцветен, тъй като се състои изключително от N 2 0 4 молекули. При нагряване до t, w= -12,8 °C се появява кафяв цвят, който се засилва с повишаване на температурата, тъй като делът на мономера в сместа се увеличава.
Азотният оксид (IV) (както мономер, така и димер) е силно разтворим във вода и реагира с нея. Тъй като азотните съединения в равномерни степени на окисление не съществуват във водни разтвори, възниква диспропорциониране в азотната и азотната киселина:
N 2 0 4 + N 2 0 = HN0 3 + HN0 2
Последният е стабилен само на студено, а при стайна температура и по-висока е непропорционален на N0 и HN0 3, следователно при стайна температура и по-високи температури реакцията протича съгласно уравнението
3N0 2 + H 2 0 = 2HN0 3 + NO
Въпреки това, ако смес от N0 2 и въздух преминава през вода, тогава се образува само HN0 3:
2N0 2 + H 2 0 + 1 / 2 0 2 = 2HN0 3
Подобно на NO, оксидът N 2 0 4 е обект на едноелектронно окисление, за да образува катион нитроил (нитроний) N0 2 , имащ линейна структура и изоелектронен (16 e - за три атома) CO 2. Нитроилов йон също се образува по време на самойонизация на азотна киселина:
2HN0 3 ↔ N0 2 + + NO 3 - + N 2 0
Диоксидът NO 2 е силен окислител, в атмосферата на който горят въглерод, сяра и много метали:
C + 2N0 2 = C0 2 + 2NO
В газовата фаза азотният диоксид окислява хлороводорода до хлор:
2N0 2 + 4НС1 = 2NOC1 + 2Н 2 0 + С1 2
NO 2 се получава чрез взаимодействие на мед с гореща концентрирана азотна киселина:
Сu + 4HN0 3 = Cu(N0 3) 2 + 2N0 2 + 2Н 2 0
или термично разлагане (350-500 °C) на напълно изсушени нитрати тежки метали:
2Pb(N0 3) 2 → 2РbО + 4N0 2 + 0 2
Реакцията се провежда в присъствието на силициев диоксид, който свързва получения оловен оксид в силикат PbSi0 3, като по този начин измества равновесието надясно.
Азотният (IV) оксид също се образува при окисляването на NO с кислород:
2NO + 0 2 = 2N0 2, ΔН°= -114 kJ/mol
Интересното е, че тази реакция е обратима и при 200°C равновесието е значително изместено наляво.
Азотен оксид (V) N 2 0 5 .Азотният анхидрид N 2 0 5 се образува под формата на летливи (t subl = 32,3 ° C) безцветни хигроскопични кристали, когато парите на азотната киселина преминават през колона с фосфорен (V) оксид:
4HN0 3 + P 4 0 10 → 2N 2 0 5 + 4НР0 3
Твърдият N 2 0 5 е изграден от N0 2 + и N0 3 - йони, а в газовата фаза и в разтворите се състои от 0 2 N-O-N0 2 молекули. Това вещество е много нестабилно и се разпада в рамките на няколко часа (период на полуразпад 10 часа при нагряване експлодира):
2N 2 0 5 = 4N0 2 + 0 2
Когато N 2 0 5 се разтвори във вода, се образува азотна киселина.
Висшият азотен оксид е силен окислител, например:
N 2 0 5 + I 2 = I 2 0 5 + N 2
В безводни киселини (сярна, азотна, ортофосфорна, перхлорна) N 2 0 5 се разлага, образувайки нитрониев катион N0 2:
N 2 0 5 + HClO 4 = N0 2 + C10 4 - + HN0 3
Нитрониевите соли са силни окислители. Когато попаднат във вода, те се хидролизират:
N0 2 + C10 4 - + H 2 0 = HN0 3 + HC10 4
Нитроил хлорид N0 2 C1 (t pl = -145 °C, t кипене = -16 °C) е безцветен газ, образуван при преминаване на хлор върху твърд сребърен нитрат или при взаимодействие на димяща азотна и хлоросулфонова киселини:
HN0 3 + ClSO 3 H = N0 2 C1 + H 2 S0 4
В алкална среда се разпада на хипохлорит и нитрит.
Оксиди – сложни вещества, състоящ се от два елемента, единият от които е кислород. В имената на оксидите първо се посочва думата оксид, а след това името на втория елемент, от който се образува. Какви характеристики имат киселинните оксиди и как се различават от другите видове оксиди?
Класификация на оксидите
Оксидите се делят на солеобразуващи и несолеобразуващи. Още от името става ясно, че несолеобразуващите не образуват соли. Има няколко такива оксиди: вода H 2 O, кислороден флуорид OF 2 (ако условно се счита за оксид), въглероден оксид или въглероден оксид (II), въглероден оксид CO; азотни оксиди (I) и (II): N 2 O (диазотен оксид, смешен газ) и NO (азотен оксид).
Солеобразуващите оксиди образуват соли при взаимодействие с киселини или основи. Като хидроксиди те съответстват на основи, амфотерни основи и кислородсъдържащи киселини. Съответно те се наричат основни оксиди (например CaO), амфотерни оксиди (Al 2 O 3) и киселинни оксиди или киселинни анхидриди (CO 2).

ориз. 1. Видове оксиди.
Често учениците се сблъскват с въпроса как да разграничат основен оксид от киселинен. На първо място, трябва да обърнете внимание на втория елемент до кислорода. Киселинни оксиди - съдържат неметален или преходен метал(CO 2, SO 3, P 2 O 5) основни оксиди - съдържат метал (Na 2 O, FeO, CuO).
Основни свойства на киселинните оксиди
Киселинните оксиди (анхидриди) са вещества, които проявяват киселинни свойстваи образуват кислородсъдържащи киселини. Следователно киселинните оксиди съответстват на киселини. Например киселинните оксиди SO 2 и SO 3 съответстват на киселините H 2 SO 3 и H 2 SO 4 .

ориз. 2. Киселинни оксиди със съответните киселини.
Киселинни оксиди, образувани от неметали и метали с променлива валентност най-висока степенокисление (например SO 3, Mn 2 O 7), реагират с основни оксиди и алкали, образувайки соли:
SO 3 (киселинен оксид) + CaO (основен оксид) = CaSO 4 (сол);
Типичните реакции са взаимодействието на киселинни оксиди с основи, което води до образуването на сол и вода:
Mn 2 O 7 (киселинен оксид) + 2KOH (алкален) = 2KMnO 4 (сол) + H 2 O (вода)
Всички киселинни оксиди, с изключение на силициев диоксид SiO 2 (силициев анхидрид, силициев диоксид), реагират с вода, образувайки киселини:
SO 3 (киселинен оксид) + H 2 O (вода) = H 2 SO 4 (киселина)
Киселинните оксиди се образуват при взаимодействие с кислород на прости и сложни вещества (S+O 2 =SO 2) или чрез разлагане в резултат на нагряване на сложни вещества, съдържащи кислород - киселини, неразтворими основи, соли (H 2 SiO 3 =SiO 2 +H 2 O).
Списък на киселинни оксиди:
| Име на киселинния оксид | Формула на киселинен оксид | Свойства на киселинния оксид |
| Серен (IV) оксид | SO 2 | безцветен токсичен газ с остра миризма |
| Серен (VI) оксид | SO 3 | силно летлива, безцветна, токсична течност |
| Въглероден окис (IV) | CO2 | безцветен газ без мирис |
| Силициев(IV) оксид | SiO2 | безцветни кристали, имайки сила |
| Фосфорен (V) оксид | P2O5 | бял, запалим прах с неприятна миризма |
| Азотен оксид (V) | N2O5 | вещество, състоящо се от безцветни летливи кристали |
| Хлорен (VII) оксид | Cl2O7 | безцветна маслена токсична течност |
| Манганов (VII) оксид | Mn2O7 | течност с метален блясък, която е силен окислител. |

ориз. 3. Примери за киселинни оксиди.
Какво научихме?
Киселинните оксиди са солеобразуващи оксиди и се образуват с помощта на киселини. Киселинните оксиди реагират с основи и вода и образуването им става при нагряване и разлагане на сложни вещества.
Тест по темата
Оценка на доклада
Средна оценка: 4.5. Общо получени оценки: 532.
Днес започваме да се запознаваме с най-важните класове неорганични съединения. Неорганичните вещества се разделят според състава си, както вече знаете, на прости и сложни.
|
ОКСИД |
КИСЕЛИНА |
БАЗА |
СОЛ |
|
E x O y |
НпА А – киселинен остатък |
Me(OH)b ОН – хидроксилна група |
Аз n A b |
Сложните неорганични вещества се делят на четири класа: оксиди, киселини, основи, соли. Започваме с класа на оксида.
ОКСИДИТЕ
Оксиди
- това са сложни вещества, състоящи се от два химични елемента, единият от които е кислород, с валентност 2. Само един химичен елемент - флуор, когато се комбинира с кислород, образува не оксид, а кислороден флуорид OF 2.
Те се наричат просто „оксид + име на елемента“ (виж таблицата). Ако валентност химичен елементпроменлива, след което се обозначава с римска цифра, оградена в скоби след името на химичния елемент.
|
Формула |
Име |
Формула |
Име |
|
въглероден(II) оксид |
Fe2O3 |
железен (III) оксид |
|
|
азотен оксид (II) |
CrO3 |
хром(VI) оксид |
|
|
Al2O3 |
алуминиев оксид |
цинков оксид |
|
|
N2O5 |
азотен оксид (V) |
Mn2O7 |
манганов (VII) оксид |
Класификация на оксидите
Всички оксиди могат да бъдат разделени на две групи: солеобразуващи (основни, киселинни, амфотерни) и несолеобразуващи или индиферентни.
|
Метални оксиди Козина x O y |
Неметални оксиди neMe x O y |
|||
|
Основен |
киселинен |
Амфотерни |
киселинен |
Безразличен |
|
I, II мех |
V-VII аз |
ZnO, BeO, Al 2 O 3, Fe 2 O 3, Cr 2 O 3 |
> II neMe |
I, II neMe CO, NO, N2O |
1). Основни оксидиса оксиди, които съответстват на основи. Основните оксиди включват оксиди метали 1 и 2 група, както и метали странични подгрупи с валентност аз И II (с изключение на ZnO - цинков оксид и BeO – берилиев оксид):

2). Киселинни оксиди- Това са оксиди, които отговарят на киселини. Киселинните оксиди включват неметални оксиди (с изключение на несолеобразуващите - индиферентни), както и метални оксиди странични подгрупи с валентност от V към VII (Например CrO 3 - хром (VI) оксид, Mn 2 O 7 - манганов (VII) оксид):

3). Амфотерни оксиди- Това са оксиди, които отговарят на основи и киселини. Те включват метални оксиди главни и вторични подгрупи с валентност III , Понякога IV , както и цинк и берилий (Напр. BeO, ZnO, Al 2 O 3, Cr 2 O 3).
4). Несолеобразуващи оксиди– това са оксиди, индиферентни към киселини и основи. Те включват неметални оксиди с валентност аз И II (Например N2O, NO, CO).
Заключение: естеството на свойствата на оксидите зависи преди всичко от валентността на елемента.
Например хромни оксиди:
CrO(II- основен);
Cr 2 O 3 (III- амфотерни);
CrO3(VII- кисела).
Класификация на оксидите
(по разтворимост във вода)
|
Киселинни оксиди |
Основни оксиди |
Амфотерни оксиди |
|
Разтворим във вода. Изключение – SiO 2 (неразтворим във вода) |
Във вода се разтварят само оксиди на алкални и алкалоземни метали (това са метали I "А" и II "A" група, изключение Be, Mg) |
Те не взаимодействат с водата. Неразтворим във вода |
Изпълнете задачите:
1. Напишете го отделно химични формулисолеобразуващи киселинни и основни оксиди.
NaOH, AlCl3, K2O, H2SO4, SO3, P2O5, HNO3, CaO, CO.
2. Дадени вещества : CaO, NaOH, CO 2, H 2 SO 3, CaCl 2, FeCl 3, Zn(OH) 2, N 2 O 5, Al 2 O 3, Ca(OH) 2, CO 2, N 2 O, FeO,
SO 3, Na 2 SO 4, ZnO, CaCO 3, Mn 2 O 7, CuO, KOH, CO, Fe(OH) 3
Получаване на оксиди
Симулатор "Взаимодействие на кислород с прости вещества"
|
1. Изгаряне на вещества (окисление с кислород) |
а) прости вещества Треньор |
2Mg +O 2 =2MgO |
|
б) сложни вещества |
2H 2 S+3O 2 =2H 2 O+2SO 2 |
|
|
2. Разграждане на сложни вещества (използвайте таблица с киселини, вижте приложенията) |
а) соли СОЛt= ОСНОВЕН ОКСИД+КИСЕЛИНЕН ОКСИД |
СaCO 3 =CaO+CO 2 |
|
б) Неразтворими основи Me(OH)bt= Аз х О у+ з 2 О |
Cu(OH)2t=CuO+H2O |
|
|
в) кислородсъдържащи киселини НпА=КИСЕЛИНЕН ОКСИД + з 2 О |
H2SO3 =H2O+SO2 |
Физични свойства на оксидите
При стайна температура повечето оксиди са твърди вещества (CaO, Fe 2 O 3 и т.н.), някои са течности (H 2 O, Cl 2 O 7 и т.н.) и газове (NO, SO 2 и т.н.).



Химични свойства на оксидите
|
ХИМИЧНИ СВОЙСТВА НА ОСНОВНИТЕ ОКСИДИ 1. Основен оксид + Киселинен оксид = Сол (р. съединения) CaO + SO 2 = CaSO 3 2. Основен оксид + киселина = сол + H 2 O (обменен разтвор) 3 K 2 O + 2 H 3 PO 4 = 2 K 3 PO 4 + 3 H 2 O 3. Основен оксид + Вода = Алкал (съединение) Na 2 O + H 2 O = 2 NaOH |
|
ХИМИЧНИ СВОЙСТВА НА КИСЕЛНИТЕ ОКСИДИ 1. Киселинен оксид + вода = киселина (стр. съединения) С O 2 + H 2 O = H 2 CO 3, SiO 2 – не реагира 2. Киселинен оксид + Основа = Сол + H 2 O (обменен r.) P 2 O 5 + 6 KOH = 2 K 3 PO 4 + 3 H 2 O 3. Основен оксид + киселинен оксид = сол (р. съединения) CaO + SO 2 = CaSO 3 4. По-малко летливите изместват по-летливите от техните соли CaCO 3 + SiO 2 = CaSiO 3 + CO 2 |
|
ХИМИЧНИ СВОЙСТВА НА АМФОТЕРНИТЕ ОКСИДИ Те взаимодействат както с киселини, така и с основи. ZnO + 2 HCl = ZnCl 2 + H 2 O ZnO + 2 NaOH + H 2 O = Na 2 [Zn (OH) 4] (в разтвор) ZnO + 2 NaOH = Na 2 ZnO 2 + H 2 O (когато е слят) |
Приложение на оксиди
Някои оксиди са неразтворими във вода, но много от тях реагират с вода, за да образуват съединения:
SO 3 + H 2 O = H 2 SO 4
CaO + з 2 О = ок( ОХ) 2
Резултатът често е много необходими и полезни съединения. Например H 2 SO 4 – сярна киселина, Ca(OH) 2 – гасена вар и др.
Ако оксидите са неразтворими във вода, тогава хората умело използват това свое свойство. Например цинковият оксид ZnO е бяло вещество, поради което се използва за приготвяне на бяла маслена боя (цинкова бяла). Тъй като ZnO е практически неразтворим във вода, всяка повърхност може да бъде боядисана с цинково бяло, включително тези, които са изложени на валежи. Неразтворимостта и нетоксичността позволяват този оксид да се използва в производството на козметични кремове и пудри. Фармацевтите го правят на стягащ и изсушаващ прах за външна употреба.
Титановият (IV) оксид – TiO 2 – има същите ценни свойства. Освен това има красив бял цвят и се използва за превръщането на титана в бяло. TiO 2 е неразтворим не само във вода, но и в киселини, така че покритията, направени от този оксид, са особено стабилни. Този оксид се добавя към пластмасата, за да й придаде бял цвят. Влиза в състава на емайллакове за метални и керамични съдове.
Хром (III) оксид - Cr 2 O 3 - много здрави тъмнозелени кристали, неразтворими във вода. Cr 2 O 3 се използва като пигмент (боя) при производството на декоративно зелено стъкло и керамика. Добре познатата паста GOI (съкращение от името „Държавен оптичен институт“) се използва за шлайфане и полиране на оптика, метал продукти, в бижутерията.
Поради неразтворимостта и силата на хромовия (III) оксид той се използва и в печатарски мастила (например за оцветяване на банкноти). По принцип оксидите на много метали се използват като пигменти за голямо разнообразие от бои, въпреки че това далеч не е единственото им приложение.
Задачи за затвърдяване
1. Напишете отделно химичните формули на солеобразуващите киселинни и основни оксиди.
NaOH, AlCl3, K2O, H2SO4, SO3, P2O5, HNO3, CaO, CO.
2. Дадени вещества : CaO, NaOH, CO 2, H 2 SO 3, CaCl 2, FeCl 3, Zn(OH) 2, N 2 O 5, Al 2 O 3, Ca(OH) 2, CO 2, N 2 O, FeO, SO 3, Na 2 SO 4, ZnO, CaCO 3, Mn 2 O 7, CuO, KOH, CO, Fe(OH) 3
Изберете от списъка: основни оксиди, киселинни оксиди, индиферентни оксиди, амфотерни оксидии им дайте имена.
3. Попълнете CSR, посочете вида на реакцията, назовете продуктите на реакцията
Na 2 O + H 2 O =
N 2 O 5 + H 2 O =
CaO + HNO3 =
NaOH + P2O5 =
K 2 O + CO 2 =
Cu(OH) 2 =? + ?
4. Извършете трансформации по схемата:
1) K → K 2 O → KOH → K 2 SO 4
2) S→SO 2 → H 2 SO 3 → Na 2 SO 3
3) P→P 2 O 5 → H 3 PO 4 → K 3 PO 4
Резюме по темата:
Азотен оксид (II)
план:
- Въведение
- 1 Разписка
- 2 Химични свойства
- 3 Физиологично действие
- 4 Приложение
- 5 Вижте също
Въведение
Азотен оксид (II) (моно(о)азотен оксид, азотен оксид, нитрозил радикал) NO - несолеобразуващ азотен оксид. Това е безцветен газ, слабо разтворим във вода. Втечнява се трудно; в течна и твърда форма има син цвят.
Наличието на несдвоен електрон определя тенденцията на NO да образува слабо свързани N 2 O 2 димери. Това са слаби съединения с ΔH° на димеризация = 17 kJ. Течният азотен оксид (II) се състои от 25% молекули N 2 O 2, а твърдият оксид се състои изцяло от тях.
1. Разписка
Азотният оксид (II) е единственият азотен оксид, който може да се получи директно от свободни елементи чрез комбиниране на азот с кислород при високи температури (1200-1300 °C) или при електрически разряд. В природата се образува в атмосферата по време на гръмотевични разряди:
N 2 + O 2 → 2NO - 180,9 kJ
и веднага реагира с кислорода:
2NO + O 2 → 2NO 2.
Когато температурата се понижи, азотният (II) оксид се разлага на азот и кислород, но ако температурата спадне рязко, тогава оксидът, който не е имал време да се разложи, съществува доста дълго време: при ниски температури скоростта на разлагане е ниска . Това внезапно охлаждане се нарича "закаляване" и се използва в един от методите за производство на азотна киселина.
В лабораторията обикновено се получава чрез взаимодействие на 30% HNO 3 с определени метали, например мед:
3Cu + 8HNO 3 (30%) → 3Cu(NO 3) 2 + 2NO + 4H 2 O.
По-чист NO, незамърсен с примеси, може да се получи чрез следните реакции:
FeCl 2 + NaNO 2 + 2HCl → FeCl 3 + NaCl + NO + H 2 O;
2HNO 2 + 2HI → 2NO + I 2 ↓ + 2H 2 O. Промишленият метод се основава на окисляването на амоняк привисока температура
и налягане с участието на Pt, Cr 2 O 3 (като катализатори):
4NH3 + 5O2 → 4NO + 6H2O.
2. Химични свойства При стайна температура иатмосферно налягане
окислението на NO от атмосферния кислород става незабавно:
2NO + O 2 → 2NO 2
NO също се характеризира с реакции на присъединяване на халогени с образуване на нитрозилхалогениди, в тази реакция NO проявява свойствата на редуциращ агент:
2NO + Cl 2 → 2NOCl (нитрозил хлорид).
В присъствието на по-силни редуциращи агенти NO проявява окислителни свойства:
2SO 2 + 2NO → 2SO 3 + N 2.
NO е слабо разтворим във вода и не реагира с нея, тъй като е несолеобразуващ оксид.
Азотен оксид (бял) в цитоплазмата на клетки от иглолистни дървета един час след механично въздействие. Тъмнозелените кръгове в клетките са ядрата, а в някои от ядрата се забелязват нуклеоли (светлозелени).
Както всички азотни оксиди (с изключение на N 2 O), NO е токсичен и при вдишване засяга дихателните пътища.
През последните две десетилетия беше установено, че тази NO молекула има широк спектър от биологични ефекти, които могат да бъдат разделени на регулаторни, защитни и вредни. NO, като един от посланиците, участва в регулирането на вътре- и междуклетъчните сигнални системи. Азотният оксид, произвеждан от съдовите ендотелни клетки, е отговорен за отпускането на гладките мускули на съдовете и тяхното разширяване (вазодилатация), предотвратява агрегацията на тромбоцитите и адхезията на неврофилите към ендотела и участва в различни процеси в нервната, репродуктивната и имунната система. . NO също има цитотоксични и цитостатични свойства. Клетки убийци имунната системаизползвайте азотен оксид, за да убиете бактерии и клетки злокачествени тумори. Нарушенията в биосинтезата и метаболизма на NO са свързани със заболявания като есенциална артериална хипертония, коронарна болест на сърцето, инфаркт на миокарда, първична белодробна хипертония, бронхиална астма, невротична депресия, епилепсия, невродегенеративни заболявания (болест на Алцхаймер, болест на Паркинсон), захарен диабет, импотентност и др.
Азотният оксид може да се синтезира по няколко начина. Растенията използват неензимна фотохимична реакция между NO 2 и каротеноидите. При животните синтезът се осъществява от семейството на NO синтаза (NOS). NOS ензимите са членове на хем-съдържащо суперсемейство от ензими, наречени монооксигенази. Въз основа на структурата и функцията NOS може да бъде разделена на три групи: ендотелна (eNOS), невронална (nNOS) и индуцируема (iNOS). Активният център на всяка NO синтаза включва железен порфиринов комплекс, съдържащ аксиално координиран цистеин или метионин. Въпреки че всички NOS изоформи катализират образуването на NO, всички те са продукти на различни гени, всеки от тях има свои собствени характеристики както в механизмите на действие и локализация, така и в биологично значениеза тялото. Следователно, тези изоформи също обикновено се разделят на конститутивни (cNOS) и индуцируеми (iNOS) синтази на азотен оксид.
cNOS се намира постоянно в цитоплазмата, зависи от концентрацията на калциеви йони и калмодулин (протеин, който е вътреклетъчен медиатор на транспорта на калциевите йони) и насърчава освобождаването на малки количества NO за кратък период в отговор на рецепторна стимулация. Индуцираният NOS се появява в клетките само след тяхното индуциране от бактериални ендотоксини и някои възпалителни медиатори, като гама интерферон, тумор некрозис фактор и др. Количеството на NO, образувано под въздействието на iNOS, може да варира и да достигне големи количества (наномоли). В същото време производството на NO продължава по-дълго.
Характерна особеност на NO е способността бързо (за по-малко от 5 секунди) да дифундира през мембраната на клетката, която го синтезира, в междуклетъчното пространство и лесно (без участието на рецептори) да проникне в целевите клетки. Вътре в клетката той активира някои ензими и инхибира други, като по този начин участва в регулацията клетъчни функции. По същество азотният оксид е локален тъканен хормон. NO играе ключова роля в инхибирането на активността на бактериалните и туморните клетки чрез блокиране на някои от техните съдържащи желязо ензими или чрез увреждане на техните клетъчни структури с азотен оксид или свободни радикали, генерирани от азотен оксид. В същото време супероксидът се натрупва на мястото на възпалението, което причинява увреждане на протеините и липидите клетъчни мембрани, което обяснява неговия цитотоксичен ефект върху таргетната клетка. Следователно NO, прекомерно натрупвайки се в клетката, може да действа по два начина: от една страна, да причини увреждане на ДНК и, от друга, да има провъзпалителен ефект.
Азотният оксид е в състояние да инициира образуването на кръвоносни съдове. В случай на инфаркт на миокарда азотният оксид играе роля положителна роля, тъй като предизвиква нов съдов растеж, но при рак, същият процес причинява развитието на тумори чрез насърчаване на храненето и растежа на раковите клетки. От друга страна, това подобрява доставянето на азотен оксид до туморните клетки. Увреждането на ДНК под въздействието на NO е една от причините за развитието на апоптоза (програмиран процес на клетъчно „самоубийство“, насочен към отстраняване на клетки, които са загубили своите функции). При експерименти се наблюдава дезаминиране на дезоксинуклеозиди, дезоксинуклеотиди и непокътната ДНК, когато се изложи на разтвор, наситен с NO. Този процес е отговорен за повишаване на чувствителността на клетките към алкилиращи агенти и йонизиращо лъчение, който се използва в противоракова терапия.
Клирънсът на NO (скоростта, с която кръвта се изчиства от NO по време на нейните химични трансформации) се осъществява чрез образуването на нитрити и нитрати и е средно не повече от 5 секунди. Междинните етапи могат да бъдат включени в клирънса, включващ взаимодействие със супероксид или хемоглобин за образуване на пероксинитрит. Азотният оксид може да бъде намален от NO редуктаза, ензим, тясно свързан с NO синтазата.
През 1998 г. трима американци - Furchgott, Ignarro и Murad - бяха удостоени с Нобелова награда за физиология "за техните открития относно азотния оксид като сигнална молекула в сърдечно-съдовата система".