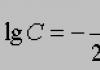Както дисперсионната среда, така и дисперсната фаза могат да бъдат съставени от вещества в различни агрегатни състояния. В зависимост от комбинацията от състояния на дисперсионната среда и дисперсната фаза могат да се разграничат осем вида такива системи
Класификация на дисперсните системи по агрегатно състояние
|
Дисперсионна среда |
Дисперсна фаза |
Примери за някои природни и битови дисперсни системи |
|
Течност |
Мъгла, свързан газ с капчици масло, карбураторна смес в автомобилни двигатели (капчици бензин във въздуха) |
|
|
Твърди |
Прах във въздуха, дим, смог, simooms (прашни и пясъчни бури) |
|
|
Течност |
Газирани напитки, пяна за вана |
|
|
Течност |
Течни среди на тялото (кръвна плазма, лимфа, храносмилателни сокове), течно съдържание на клетки (цитоплазма, кариоплазма) |
|
|
Твърди |
Кисели, желета, лепила, речна или морска тиня, суспендирана във вода, хавани |
|
|
Твърди |
Снежна кора с въздушни мехурчета в нея, пръст, текстилни тъкани, тухли и керамика, порест каучук, газиран шоколад, прахове |
|
|
Течност |
Влажна почва, медицински и козметични продукти (мехлеми, спирала, червило и др.) |
|
|
Твърди |
Скали, цветни стъкла, някои сплави |
Също така, като класификационен признак, можем да разграничим такова понятие като размер на частиците на дисперсна система:
- - Грубо диспергирани (> 10 микрона): гранулирана захар, почва, мъгла, дъждовни капки, вулканична пепел, магма и др.
- - Средно фини (0,1-10 микрона): еритроцити от човешка кръв, E. coli и др.
диспергирана емулсия суспензия гел
- - Високо диспергирани (1-100 nm): грипен вирус, дим, мътност в естествени води, изкуствено получени золи на различни вещества, водни разтвори на естествени полимери (албумин, желатин и др.) и др.
- - Наноразмер (1-10 nm): молекула гликоген, фини пори от въглища, метални золи, получени в присъствието на молекули органична материя, ограничаване на растежа на частиците, въглеродни нанотръби, магнитни нанопроводници от желязо, никел и др.
Грубодисперсни системи: емулсии, суспензии, аерозоли
Въз основа на размера на частиците на веществото, които съставляват дисперсната фаза, дисперсните системи се разделят на груби с размери на частиците над 100 nm и фино диспергирани с размери на частиците от 1 до 100 nm. Ако веществото се раздроби на молекули или йони с размер под 1 nm, се образува хомогенна система - разтвор. Разтворът е хомогенен, няма интерфейс между частиците и средата, поради което не принадлежи към дисперсните системи. Грубодисперсните системи се делят на три групи: емулсии, суспензии и аерозоли.
Емулсиите са дисперсни системи с течна дисперсна среда и течна дисперсна фаза.
Те също могат да бъдат разделени на две групи: 1) директни - капки от неполярна течност в полярна среда (масло във вода); 2) реверс (вода в масло). Промени в състава на емулсиите или външни влияния могат да доведат до превръщането на директна емулсия в обратна емулсия и обратно. Примери за най-известните природни емулсии са мляко (директна емулсия) и масло (обратна емулсия). Типична биологична емулсия са мастните капчици в лимфата.
От известните в практически дейностичовешки емулсии могат да се нарекат флуиди за рязане, битумни материали, пестициди, лекарства и козметика, хранителни продукти. Например в медицинската практика мастните емулсии се използват широко за осигуряване на енергия на гладуващо или отслабено тяло чрез интравенозна инфузия. За получаване на такива емулсии се използват маслиново, памучно и соево масло. В химическата технология емулсионната полимеризация се използва широко като основен метод за получаване на каучуци, полистирен, поливинилацетат и др. Суспензиите са груби системи с твърда дисперсна фаза и течна дисперсионна среда.
Обикновено частиците на дисперсната фаза на суспензията са толкова големи, че се утаяват под въздействието на гравитацията - утайка. Системи, в които седиментацията протича много бавно поради малката разлика в плътността на дисперсната фаза и дисперсионната среда, се наричат още суспензии. Практически значимите строителни суспензии са вар („варово мляко“), емайллакове и различни строителни суспензии, например тези, наречени „циментов разтвор“. Суспензиите също включват лекарства, например течни мехлеми - линименти. Специална група представляват грубо дисперсните системи, в които концентрацията на дисперсната фаза е относително висока в сравнение с ниската й концентрация в суспензиите. Такива диспергирани системи се наричат пасти. Например добре познатият ви от Ежедневиетостоматологични, козметични, хигиенни и др.
Аерозолите са едродисперсни системи, в които дисперсионната среда е въздух, а дисперсната фаза може да бъде течни капчици (облаци, дъги, лак за коса или дезодорант, изпускани от кутия) или частици от твърдо вещество (облак прах, торнадо).
Колоидни системи – при тях размерите на колоидните частици достигат до 100 nm. Такива частици лесно проникват в порите на хартиените филтри, но не проникват в порите на биологичните мембрани на растенията и животните. Тъй като колоидните частици (мицели) имат електрически заряд и солватни йонни обвивки, поради което остават суспендирани, те може да не се утаяват доста дълго време. Ярък пример за колоидна система са разтворите на желатин, албумин, гума арабика и колоидни разтвори на злато и сребро.
Колоидните системи заемат междинна позиция между грубите системи и истинските разтвори. Те са широко разпространени в природата. Почвата, глината, природните води, много минерали, включително някои скъпоценни камъни, са колоидни системи.
Има две групи колоидни разтвори: течни (колоидни разтвори - золи) и гелообразни (желе - гелове).
Повечето биологични течности на клетката (вече споменатата цитоплазма, ядрен сок - кариоплазма, съдържание на вакуоли) и живия организъм като цяло са колоидни разтвори (золи). Всички жизнени процеси, протичащи в живите организми, са свързани с колоидното състояние на материята. Във всяка жива клетка има биополимери ( нуклеинова киселина, протеини, гликозаминогликани, гликоген) са под формата на диспергирани системи.
Геловете са колоидни системи, в които частиците на дисперсната фаза образуват пространствена структура.
Геловете могат да бъдат: хранителни – мармалад, блатове, желирани меса, желе; биологични - хрущяли, сухожилия, коса, мускулна и нервна тъкан, тела на медузи; козметика - душ гелове, кремове; медицински - лекарства, мехлеми; минерал - перли, опал, карнеол, халцедон.
Колоидните системи са от голямо значение за биологията и медицината. Съставът на всеки жив организъм включва твърди, течни и газообразни вещества, които са в сложна връзка с заобикаляща среда. От химическа гледна точка тялото като цяло е сложна съвкупност от много колоидни системи.
Биологичните течности (кръв, плазма, лимфа, цереброспинална течност и др.) са колоидни системи, в които такива органични съединения, подобно на протеините, холестерола, гликогена и много други, са в колоидно състояние. Защо природата му дава такова предпочитание? Тази характеристика се дължи главно на факта, че веществото в колоидно състояние има голяма граница между фазите, което допринася за по-добри метаболитни реакции.
Примери за естествени и изкуствени дисперсни системи. Минерали и скали като природни смеси
Цялата природа, която ни заобикаля - животински и растителни организми, хидросферата и атмосферата, земната кора и подпочвата са сложна съвкупност от много различни и различни видове груби и колоидни системи. Облаците на нашата планета са същите живи същества като цялата природа, която ни заобикаля. Те са от голямо значение за Земята, тъй като са информационни канали. В крайна сметка облаците се състоят от капилярната субстанция на водата, а водата, както знаете, е много добро устройство за съхранение на информация. Водният цикъл в природата води до факта, че информацията за състоянието на планетата и настроението на хората се натрупва в атмосферата и заедно с облаците се движи из цялото пространство на Земята. Удивително творение на природата - облаци, които доставят на хората радост, естетическо удоволствие и просто желание понякога да погледнат към небето.
Мъглата също може да бъде пример за естествена дисперсна система, натрупването на вода във въздуха, когато се образуват малки кондензационни продукти от водна пара (при температура на въздуха над? 10° - малки капчици вода, при? 10..? 15° - смес от водни капчици и кристали лед, при температура под? 15° - ледени кристали, искрящи на слънчевите лъчи или на светлината на луната и фенерите). Относителната влажност на въздуха по време на мъгла обикновено е близо до 100% (поне надвишава 85-90%). Въпреки това, при тежки студове (? 30 ° и по-ниски) в населени места, На железопътни гарии летища, мъгли могат да се наблюдават при всякаква относителна влажност на въздуха (дори под 50%) - поради кондензацията на водни пари, образувани при изгарянето на гориво (в двигатели, печки и др.) и изхвърлени в атмосферата през изпускателните тръби и комини.
Продължителността на мъглата обикновено варира от няколко часа (а понякога и от половин час до час) до няколко дни, особено през студения сезон.
Мъглите възпрепятстват нормалното функциониране на всички видове транспорт (особено на авиацията), така че прогнозите за мъгли са от голямо икономическо значение.
Пример за сложна дисперсна система е млякото, осн компонентикоито (без да броим водата) са мазнини, казеин и млечна захар. Мазнината е под формата на емулсия и когато млякото престои, тя постепенно се издига до върха (сметаната). Казеинът се съдържа под формата на колоиден разтвор и не се освобождава спонтанно, но може лесно да се утаи (под формата на извара) при подкисляване на млякото, например с оцет. В естествени условия при вкисването на млякото се отделя казеин. И накрая, млечната захар е под формата на молекулен разтвор и се освобождава само когато водата се изпари.
Много газове, течности и твърди веществаразтворете във вода. Захарта и готварската сол се разтварят лесно във вода; въглероден двуокис, амоняк и много други вещества, когато се сблъскат с вода, преминават в разтвор и губят предишното си агрегатно състояние. разтворено вещество по определен начинможе да се изолира от разтвора. Ако изпарите разтвор на готварска сол, солта остава под формата на твърди кристали.
Когато веществата се разтварят във вода (или друг разтворител), се образува еднаква (хомогенна) система. Следователно разтворът е хомогенна система, състояща се от два или повече компонента. Разтворите могат да бъдат течни, твърди и газообразни. Течните разтвори включват например разтвор на захар или трапезна сол във вода, алкохол във вода и други подобни. Твърдите разтвори на един метал в друг включват сплави: месингът е сплав от мед и цинк, бронзът е сплав от мед и калай и други подобни. Газообразно веществое въздух или изобщо всяка смес от газове.
В света около нас чистите вещества са изключително редки; основно повечето вещества на земята и в атмосферата са различни смеси, съдържащи повече от два компонента. Частиците с размери от приблизително 1 nm (няколко молекулни размера) до 10 µm се наричат разпръснато(лат. dispergo – разпръсвам, пръскам). Различни системи (неорганични, органични, полимерни, протеинови), в които поне едно от веществата е под формата на такива частици, се наричат диспергирани. Разпръснато - това са хетерогенни системи, състоящи се от две или повече фази със силно развита граница между тях или смес, състояща се от най-малко две вещества, които са напълно или практически несмесими едно с друго и не реагират помежду си химически. Една от фазите - дисперсната фаза - се състои от много малки частици, разпределени в друга фаза - дисперсионната среда.
Дисперсна система
Според агрегатното си състояние диспергираните частици могат да бъдат твърди, течни, газообразни и в много случаи имат сложна структура. Дисперсионните среди също са газообразни, течни и твърди. Повечето от реалните тела на света около нас съществуват под формата на разпръснати системи: морска вода, почви и почви, тъкани на живи организми, много технически материали, хранителни продукти и др.
Класификация на дисперсните системи
Въпреки многобройните опити да се предложи единна класификация на тези системи, тя все още липсва. Причината е, че при всяка класификация не всички свойства на дисперсните системи се вземат като критерий, а само едно от тях. Нека разгледаме най-често срещаните класификации на колоидни и микрохетерогенни системи.
Във всяка област на знанието, когато трябва да се работи със сложни обекти и явления, за да се улеснят и установят определени закономерности, е препоръчително те да бъдат класифицирани според определени критерии. Това важи и за областта на дисперсните системи; По различно време за тях бяха предложени различни принципи на класификация. Въз основа на интензивността на взаимодействие между веществата на дисперсионната среда и дисперсната фаза се разграничават лиофилни и лиофобни колоиди. Други техники за класифициране на дисперсни системи са описани накратко по-долу.
Класификация по наличие или отсъствие на взаимодействиемежду частиците на дисперсната фаза.Според тази класификация дисперсните системи се разделят на свободно диспергирани и кохерентно диспергирани; класификацията е приложима за колоидни разтвори и разтвори на съединения с високо молекулно тегло.
Свободно диспергираните системи включват типични колоидни разтвори, суспензии, суспензии и различни разтвори на високомолекулни съединения, които имат течливост, като обикновени течности и разтвори.
Кохезионно диспергираните системи включват така наречените структурирани системи, в които в резултат на взаимодействието между частиците възниква пространствена ажурна мрежеста рамка и системата като цяло придобива свойството на полутвърдо тяло. Например золите на някои вещества и разтвори на високомолекулни съединения при понижаване на температурата или при повишаване на концентрацията над определена граница, без да претърпяват никакви външни промени, губят течливост - желатинизират (желатинизират) и преминават в състояние на гел (желе). Това включва също концентрирани пасти и аморфни утайки.
Класификация по дисперсия.Физичните свойства на веществото не зависят от размера на тялото, но при висока степен на смилане те стават функция на дисперсията. Например металните золове имат различни цветове в зависимост от степента на смилане. По този начин колоидните разтвори на злато с изключително висока дисперсия имат лилав цвят, по-малко диспергираните имат син цвят, а още по-малко диспергираните имат зелен цвят. Има причина да се смята, че други свойства на золите на същото вещество се променят, докато се смила: Естественият критерий за класифициране на колоидните системи по дисперсност се предполага, т.е. разделяне на областта на колоидното състояние (10 -5 -10 -7 см) в редица по-тесни интервали. Такава класификация беше предложена по едно време, но се оказа безполезна, тъй като колоидните системи почти винаги са полидисперсни; монодисперсните са много редки. В допълнение, степента на дисперсия може да се промени с времето, т.е. зависи от възрастта на системата.
Дисперсни системи
Чистите вещества са много редки в природата. Смеси от различни вещества в различно агрегатно състояние могат да образуват разнородни и хомогенни системи - дисперсни системи и разтвори.
Разпръснато
се наричат хетерогенни системи, в които едно вещество под формата на много малки частици е равномерно разпределено в обема на друго.
Веществото, което присъства в по-малки количества и е разпределено в обема на друго, се нарича диспергирана фаза
. Може да се състои от няколко вещества.
Вещество, присъстващо в Повече ▼, в чийто обем е разпределена дисперсната фаза, се нарича дисперсионна среда
. Между него и частиците на дисперсната фаза има граница, поради което дисперсните системи се наричат хетерогенни (нехомогенни).
Както дисперсната среда, така и дисперсната фаза могат да бъдат представени от вещества в различно агрегатно състояние - твърдо, течно и газообразно.
В зависимост от комбинацията от агрегатното състояние на дисперсионната среда и дисперсната фаза могат да се разграничат 9 вида такива системи.
Въз основа на размера на частиците на веществата, които изграждат дисперсната фаза, дисперсните системи се делят на грубо диспергирани (суспензии) с размер на частиците над 100 nm и фино диспергирани (колоидни разтвори или колоидни системи) с размер на частиците от 100 до 1 nm. Ако веществото се раздроби на молекули или йони с размер под 1 nm, се образува хомогенна система - разтвор. Той е еднороден (хомогенен), няма граница между частиците и средата.
Вече бързото запознаване с дисперсните системи и решения показва колко важни са те в ежедневието и в природата.
Съдете сами: без тиня от Нил нямаше да се случи велика цивилизация Древен Египет; без вода, въздух, скали и минерали, живата планета - нашата - изобщо не би съществувала. общ дом- Земя; без клетки не би имало живи организми и т.н.
Класификация на дисперсни системи и разтвори
Спиране
Спиране
- това са дисперсни системи, в които размерът на фазовите частици е повече от 100 nm. Това са непрозрачни системи, чиито отделни частици могат да се видят с просто око. Дисперсната фаза и дисперсионната среда лесно се разделят чрез утаяване. Такива системи са разделени на:
1) емулсии
(както средата, така и фазата са течности, неразтворими една в друга). Това са добре познатите млечни, лимфни, бои на водна основа и др.;
2) суспензии
(средата е течност, а фазата е твърдо вещество, неразтворимо в нея). Това са строителни разтвори (например „варно мляко“ за варосване), речна и морска тиня, суспендирана във вода, жива суспензия от микроскопични живи организми в морска вода - планктон, с който се хранят гигантските китове и др .;
3) аерозоли
- суспензии в газ (например във въздух) на малки частици от течности или твърди вещества. Правете разлика между прах, дим и мъгла. Първите два вида аерозоли са суспензии на твърди частици в газ (по-големи частици в прах), а вторият е суспензия на малки капчици течност в газ. Например естествени аерозоли: мъгла, гръмотевични облаци - суспензия от водни капчици във въздуха, дим - малки твърди частици. И смогът, надвиснал над най-големите градове в света, също е аерозол с твърда и течна диспергирана фаза. Жителите на населени места в близост до циментови фабрики страдат от най-финия циментов прах, винаги висящ във въздуха, който се образува по време на смилането на циментовите суровини и продукта от неговото изпичане - клинкер. Подобни вредни аерозоли – прах – има и в градовете с металургично производство. Дим от фабрични комини, смог, малки капчици слюнка, излитащи от устата на болен от грип, а също и вредни аерозоли.
Аерозолите играят важна роля в природата, ежедневието и човешките производствени дейности. Натрупвания на облаци, химическо третиране на полета, нанасяне на боя със спрей, пулверизиране на гориво, производство на мляко на прах и лечение на дихателните пътища (вдишване) са примери за явления и процеси, при които аерозолите осигуряват ползи. Аерозолите са мъгла над морския прибой, близо до водопади и фонтани; дъгата, която се появява в тях, доставя на човек радост и естетическо удоволствие.
За химията най-висока стойностимат дисперсни системи, в които средата е вода и течни разтвори.
Природната вода винаги съдържа разтворени вещества. Естествените водни разтвори участват в процесите на почвообразуване и доставят на растенията хранителни вещества. Сложните жизнени процеси, протичащи в човешките и животинските тела, също протичат в разтвори. Много технологични процеси в химическата и други индустрии, например производството на киселини, метали, хартия, сода, торове, протичат в разтвори.
Колоидни системи
Колоидни системи
- това са дисперсни системи, в които размерът на фазовите частици е от 100 до 1 nm. Тези частици не се виждат с просто око и дисперсната фаза и дисперсионната среда в такива системи трудно се разделят чрез утаяване.
Те се делят на золи (колоидни разтвори) и гелове (желе).
1.
Колоидни разтвори или золи.
Това е по-голямата част от течностите на живата клетка (цитоплазма, ядрен сок - кариоплазма, съдържание на органели и вакуоли) и живия организъм като цяло (кръв, лимфа, тъканна течност, храносмилателни сокове, хуморални течности и др.). Такива системи образуват адхезиви, нишесте, протеини и някои полимери.
Колоидните разтвори могат да се получат в резултат на химични реакции; например, когато разтвори на калиеви или натриеви силикати („разтворимо стъкло“) реагират с киселинни разтвори, се образува колоиден разтвор на силициева киселина. По време на хидролизата на железен хлорид (III) в гореща вода също се образува зол. Колоидните разтвори са подобни на външния вид на истинските разтвори. Отличават се от последните по „светещата пътека”, която се образува – конус при преминаване на светлинен лъч през тях.
Частиците от дисперсната фаза на колоидните разтвори често не се утаяват дори при дългосрочно съхранение поради непрекъснати сблъсъци с молекули на разтворителя поради топлинно движение. Те не се слепват, когато се приближават един към друг поради наличието на едно и също име на повърхността им електрически заряди. Но при определени условия може да възникне процес на коагулация.
Коагулация - феноменът на слепване и утаяване на колоидни частици - наблюдава се, когато зарядите на тези частици се неутрализират при добавяне на електролит към колоидния разтвор. В този случай разтворът се превръща в суспензия или гел. Някои органични колоиди коагулират при нагряване (лепило, яйчен белтък) или при промяна на киселинно-алкалната среда на разтвора.
2.
Гелове
, или желета, които са желатинови утайки, образувани по време на коагулацията на золите. Те включват голям брой полимерни гелове, така добре познатите ви сладкарски, козметични и медицински гелове (желатин, желирано месо, желе, мармалад, торта с птиче мляко) и разбира се безкрайно разнообразие от естествени гелове: минерали (опал), медуза тела, хрущяли, сухожилия, коса, мускулна и нервна тъкан и др. Историята на развитието на живота на Земята може едновременно да се счита за история на еволюцията на колоидното състояние на материята. С времето структурата на геловете се нарушава и от тях се отделя вода. Това явление се нарича синерезис
.
Решения
Извиква се решение
хомогенна система, състояща се от две или повече вещества.
Разтворите винаги са еднофазни, т.е. те са хомогенен газ, течност или твърдо вещество. Това се дължи на факта, че едно от веществата е разпределено в масата на другото под формата на молекули, атоми или йони (размер на частиците под 1 nm).
Решенията се наричат вярно
, ако искате да подчертаете разликата им от колоидните разтвори.
Разтворителят се счита за вещество, чието агрегатно състояние не се променя по време на образуването на разтвор. Например вода във водни разтвори на готварска сол, захар, въглероден диоксид. Ако разтвор е образуван чрез смесване на газ с газ, течност с течност и твърдо с твърдо вещество, разтворителят се счита за компонента, който е по-изобилен в разтвора. И така, въздухът е разтвор на кислород, благородни газове, въглероден диоксид в азот (разтворител). Трапезният оцет, който съдържа от 5 до 9% оцетна киселина, е разтвор на тази киселина във вода (разтворителят е вода). Но в оцетната есенция оцетната киселина играе ролята на разтворител, тъй като нейната масова част е 70-80%, следователно е разтвор на вода в оцетна киселина.
При кристализиране на течна сплав от сребро и злато могат да се получат твърди разтвори с различен състав.
Решенията се разделят на:
молекулярни - това са водни разтвори на неелектролити - органични вещества (алкохол, глюкоза, захароза и др.);
молекулен йон- това са разтвори на слаби електролити (азотиста, хидросулфидна киселина и др.);
йонни - това са разтвори на силни електролити (алкали, соли, киселини - NaOH, K 2 S0 4, HN0 3, HC1O 4).
Преди това имаше две гледни точки за естеството на разтварянето и разтворите: физическа и химическа. Според първия разтворите се разглеждат като механични смеси, според втория - като нестабилни химични съединения на частици от разтворено вещество с вода или друг разтворител. Последната теория е изразена през 1887 г. от Д. И. Менделеев, който посвети повече от 40 години на изследване на разтворите. Съвременна химияразглежда разтварянето като физикохимичен процес, а разтворите като физикохимични системи.
| Повече ▼ точно определениерешението е:
Решение
- хомогенна (хомогенна) система, състояща се от частици от разтворено вещество, разтворител и продуктите на тяхното взаимодействие.
Поведението и свойствата на електролитните разтвори, както добре знаете, се обясняват с друга важна теория на химията - теорията на електролитната дисоциация, разработена от С. Арениус, разработена и допълнена от учениците на Д. И. Менделеев и предимно от И. А. Каблуков.
Въпроси за консолидиране:
1. Какво представляват дисперсните системи?
2. При увреждане на кожата (рана) се наблюдава кръвосъсирване - коагулация на зола. Каква е същността на този процес? Защо това явление изпълнява защитна функция за тялото? Как се нарича заболяване, при което кръвосъсирването е затруднено или не се наблюдава?
3. Разкажете ни за значението на различните дисперсни системи в ежедневието.
4. Проследете еволюцията на колоидните системи по време на развитието на живота на Земята.
ОПРЕДЕЛЕНИЕ
Дисперсни системи– образувания, състоящи се от две или повече фази, които практически не се смесват и не реагират помежду си. Вещество, което е фино разпределено в друго вещество (дисперсионна среда), се нарича диспергирана фаза.
Съществува класификация на дисперсните системи въз основа на размера на частиците на дисперсната фаза. Има молекулярни йонни (< 1 нм) – глюкоза, сахароза, коллоидные (1-100 нм) – эмульсии (масло) и суспензии (раствор глины) и грубодисперсные (>100 nm) системи.
Различават се хомогенни и разнородни дисперсни системи. Хомогенните системи се наричат още истински разтвори.
Решения
ОПРЕДЕЛЕНИЕ
Решение– хомогенна система, състояща се от два или повече компонента.
Според агрегатното си състояние разтворите се делят на газообразни (въздух), течни и твърди (сплави). В течните разтвори има понятието разтворител и разтворено вещество. В повечето случаи разтворителят е вода, но могат да бъдат и неводни разтворители (етанол, хексан, хлороформ).
Методи за изразяване на концентрацията на разтворите
За да изразите концентрацията на разтворите, използвайте: масова частразтворено вещество (, %), което показва колко грама разтворено вещество се съдържат в 100 g разтвор.
![]()
Моларна концентрация (С М, mol/l)показва колко мола разтворено вещество се съдържат в един литър разтвор. Разтворите с концентрация 0,1 mol/l се наричат децимоларни, 0,01 mol/l се наричат сантимоларни, а разтворите с концентрация 0,001 mol/l се наричат милимоларни.
Нормална концентрация (CH, mol-equiv/l)показва броя на еквивалентите на разтвореното вещество в един литър разтвор.
Молна концентрация (С m, mol/1kg H 2 O)– броя на моловете разтворено вещество на 1 kg разтворител, т.е. на 1000 гр. вода.
Моларна фракция на разтвореното вещество (N)е отношението на броя молове разтворено вещество към броя молове разтвор. За газовите разтвори молната част на веществото съвпада с обемната фракция ( φ ).
Разтворимост
ОПРЕДЕЛЕНИЕ
Разтворимост(s, g/100 g H 2 O) – свойството на веществото да се разтваря във вода или друг разтворител.
Въз основа на разтворимостта разтворите и веществата се делят на 3 групи: силно разтворими (захар), слабо разтворими (бензен, гипс) и практически неразтворими (стъкло, злато, сребро). Във водата няма абсолютно неразтворими вещества, няма инструменти, с които да се изчисли количеството на разтвореното вещество. Разтворимостта зависи от температурата (фиг. 1), естеството на веществото и налягането (за газове). С повишаване на температурата разтворимостта на веществото се увеличава.

Ориз. 1. Пример за зависимостта на някои соли във водата от температурата
Концепцията за наситен разтвор е тясно свързана с концепцията за разтворимост, тъй като разтворимостта характеризира масата на разтвореното вещество в наситен разтвор. Докато веществото може да се разтвори, разтворът се нарича ненаситен; ако веществото спре да се разтваря, той се нарича наситен; може да се създаде свръхнаситен разтвор за известно време.
Парно налягане на разтвори
Парата, която е в равновесие с течността, се нарича наситена. При дадена температура налягането на наситените пари над всяка течност е постоянна стойност. Следователно всяка течност има присъщо налягане на наситени пари. Нека разгледаме това явление, като използваме следния пример: разтвор на неелектролит (захароза) във вода - молекулите на захарозата са много по-големи от водните молекули. Налягането на наситените пари в разтвора създава разтворителя. Ако сравним налягането на разтворителя и налягането на разтворителя над разтвора при една и съща температура, тогава в разтвора броят на молекулите, които са преминали в пара над разтвора, е по-малък, отколкото в самия разтвор. От това следва, че налягането на наситените пари на разтворител над разтвор винаги е по-ниско, отколкото над чист разтворител при същата температура.
Ако означим налягането на наситените пари на разтворителя над чистия разтворител като p 0, а над разтвора като p, тогава относителното намаление на налягането на парите над разтвора ще бъде (p 0 -p)/p 0.
Въз основа на това F.M. Raoult извежда закона: относителното намаляване на наситените пари на разтворителя над разтвора е равно на моларната част на разтвореното вещество: (p 0 -p)/p 0 = N (моларна фракция на разтвореното вещество).
Криоскопия. Ебулиоскопия. Вторият закон на Раул
Понятията криоскопия и ебулиоскопия са тясно свързани съответно с точките на замръзване и кипене на разтворите. По този начин точката на кипене и кристализацията на разтворите зависят от налягането на парите над разтвора. Всяка течност кипи при температурата, при която нейното налягане на наситените пари достига външно (атмосферно налягане).
По време на замръзване кристализацията започва при температурата, при която налягането на наситените пари над течната фаза е равно на налягането на наситените пари над твърдата фаза. Оттук и вторият закон на Раул: намаляването на температурата на кристализация и повишаването на точката на кипене на разтвора е пропорционално на концентрациите на разтвореното вещество. Математически изразтози закон:
Δ T crist = K × C m,
Δ T kip = E × C m,
където К и Е са криоскопични и ебулиоскопични константи в зависимост от природата на разтворителя.
Примери за решаване на проблеми
ПРИМЕР 1
| Упражнение | Какво количество вода и 80% разтвор на оцетна киселина трябва да се вземат, за да се получат 200 g 8% разтвор? |
| Решение |
Нека масата на 80% разтвор на оцетна киселина е равна на x g. Нека намерим масата на веществото, разтворено в него: m разтвор (CH 3 COOH) = m разтвор × /100% m r.v-va (CH 3 COOH) 1 =x × 0,8 (g) Нека намерим масата на разтвореното вещество в разтвор на 8% оцетна киселина: m r.v-va (CH 3 COOH) 2 = 200 (g) × 0,08 = 16 (g) m r.v-va (CH 3 COOH) 2 = x × 0,8 (g) = 16 (g) Нека намерим x: x = 16/0,8 = 20 Масата на 80% разтвор на оцетна киселина е 20 (g). Нека намерим необходимото количество вода: m(H 2 O) = m разтвор 2 – m разтвор 1 m(H 2 O) = 200 (g) – 20 (g) = 180 (g) |
| Отговор | m разтвор (CH 3 COOH) 80% = 20 (g), m (H 2 O) = 180 (g) |
ПРИМЕР 2
| Упражнение | Смесват се 200 g вода и 50 g натриев хидроксид. Определете масовата част на натриевия хидроксид в разтвора. | |||||||||||||||||||||||||||||||||||||
| Решение | Записваме формулата за намиране на масовата част:
Нека намерим масата на разтвора на натриев хидроксид: m разтвор (NaOH) = m(H 2 O) + m(NaOH) m разтвор (NaOH) = 200 +50 = 250 (g) Нека намерим масовата част на натриевия хидроксид. Изпратете добрата си работа в базата знания е лесно. Използвайте формата по-долуСтуденти, докторанти, млади учени, които използват базата от знания в обучението и работата си, ще ви бъдат много благодарни. публикувано на http://www.allbest.ru/ Министерството на общите и професионално образованиеСвердловска област "Екатеринбургски колеж по транспортно строителство" по дисциплина "Химия" Дисперсни системи За химията най-голямо значение имат дисперсните системи, в които средата е вода и течни разтвори. Чистите вещества са много редки в природата. Смеси от различни вещества в различно агрегатно състояние могат да образуват разнородни и хомогенни системи - дисперсни системи и разтвори. Запознаването с дисперсните системи и решения показва колко важни са те в ежедневието и природата. Цивилизацията на Древен Египет не би се състояла без тиня от Нил; без вода, въздух, скали, минерали изобщо не би съществувала живата планета – нашият общ дом – Земята; без клетки нямаше да има живи организми. Както е известно, химическа основаСъществуването на живия организъм е метаболизма на протеините в него. Средно концентрацията на протеини в тялото варира от 18 до 21%. Повечето протеини се разтварят във вода (концентрацията на която в човешкото и животинското тяло е приблизително 65%) и образуват колоидни разтвори. Дисперсните системи са разнородни системи, състоящи се от две или Повече ▼фази със силно развит интерфейс между тях. Специалните свойства на дисперсните системи се дължат именно на малкия размер на частиците и наличието на голяма междуфазна повърхност. В това отношение определящите свойства са свойствата на повърхността, а не на частиците като цяло. Характерни процеси са тези, протичащи на повърхността, а не във фазата. От това става ясно защо колоидната химия се нарича физикохимия на повърхностните явления и дисперсните системи. Дисперсна фаза и дисперсна среда. Това вещество (или няколко вещества), което присъства в дисперсна система в по-малки количества и е разпределено в целия обем, се нарича дисперсна фаза. Присъстващото в големи количества вещество, в чийто обем е разпределена дисперсната фаза, се нарича дисперсионна среда. Между дисперсионната среда и частиците на дисперсната фаза има граница, поради което дисперсните системи се наричат хетерогенни, т.е. разнородни. Класификация на дисперсните системи Както дисперсионната среда, така и дисперсната фаза могат да бъдат съставени от вещества в различни агрегатни състояния. В зависимост от комбинацията от състояния на дисперсионната среда и дисперсната фаза могат да се разграничат осем вида такива системи Класификация на дисперсните системи по агрегатно състояние
Също така, като класификационен признак, можем да разграничим такова понятие като размер на частиците на дисперсна система: Груби (> 10 микрона): гранулирана захар, почва, мъгла, дъждовни капки, вулканична пепел, магма и др. Средно фин (0,1-10 микрона): човешки червени кръвни клетки, E. coli и др. диспергирана емулсия суспензия гел Силно диспергирани (1-100 nm): грипен вирус, дим, мътност в естествени води, изкуствено получени золи на различни вещества, водни разтвори на естествени полимери (албумин, желатин и др.) и др. Наноразмер (1-10 nm): молекула гликоген, фини пори от въглища, метални золи, получени в присъствието на молекули на органични вещества, които ограничават растежа на частици, въглеродни нанотръби, магнитни нанонишки от желязо, никел и др. Грубодисперсни системи: емулсии, суспензии, аерозоли Въз основа на размера на частиците на веществото, които съставляват дисперсната фаза, дисперсните системи се разделят на груби с размери на частиците над 100 nm и фино диспергирани с размери на частиците от 1 до 100 nm. Ако веществото се раздроби на молекули или йони с размер под 1 nm, се образува хомогенна система - разтвор. Разтворът е хомогенен, няма интерфейс между частиците и средата, поради което не принадлежи към дисперсните системи. Грубодисперсните системи се делят на три групи: емулсии, суспензии и аерозоли. Емулсиите са дисперсни системи с течна дисперсна среда и течна дисперсна фаза. Те също могат да бъдат разделени на две групи: 1) директни - капки от неполярна течност в полярна среда (масло във вода); 2) реверс (вода в масло). Промени в състава на емулсиите или външни влияния могат да доведат до превръщането на директна емулсия в обратна емулсия и обратно. Примери за най-известните природни емулсии са мляко (директна емулсия) и масло (обратна емулсия). Типична биологична емулсия са мастните капчици в лимфата. Сред емулсиите, познати в човешката практика, са режещи течности, битумни материали, пестициди, лекарства и козметика и хранителни продукти. Например в медицинската практика мастните емулсии се използват широко за осигуряване на енергия на гладуващо или отслабено тяло чрез интравенозна инфузия. За получаване на такива емулсии се използват маслиново, памучно и соево масло. В химическата технология емулсионната полимеризация се използва широко като основен метод за получаване на каучуци, полистирен, поливинилацетат и др. Суспензиите са груби системи с твърда дисперсна фаза и течна дисперсионна среда. Обикновено частиците на дисперсната фаза на суспензията са толкова големи, че се утаяват под въздействието на гравитацията - утайка. Системи, в които седиментацията протича много бавно поради малката разлика в плътността на дисперсната фаза и дисперсионната среда, се наричат още суспензии. Практически значимите строителни суспензии са вар („варово мляко“), емайллакове и различни строителни суспензии, например тези, наречени „циментов разтвор“. Суспензиите също включват лекарства, например течни мехлеми - линименти. Специална група представляват грубо дисперсните системи, в които концентрацията на дисперсната фаза е относително висока в сравнение с ниската й концентрация в суспензиите. Такива диспергирани системи се наричат пасти. Например зъболекарски, козметични, хигиенни и др., които са ви добре познати от ежедневието. Аерозолите са едродисперсни системи, в които дисперсионната среда е въздух, а дисперсната фаза може да бъде течни капчици (облаци, дъги, лак за коса или дезодорант, изпускани от кутия) или частици от твърдо вещество (облак прах, торнадо). Колоидни системи – при тях размерите на колоидните частици достигат до 100 nm. Такива частици лесно проникват в порите на хартиените филтри, но не проникват в порите на биологичните мембрани на растенията и животните. Тъй като колоидните частици (мицели) имат електрически заряд и солватни йонни обвивки, поради което остават суспендирани, те може да не се утаяват доста дълго време. Ярък пример за колоидна система са разтворите на желатин, албумин, гума арабика и колоидни разтвори на злато и сребро. Колоидните системи заемат междинна позиция между грубите системи и истинските разтвори. Те са широко разпространени в природата. Почвата, глината, природните води, много минерали, включително някои скъпоценни камъни, са колоидни системи. Има две групи колоидни разтвори: течни (колоидни разтвори - золи) и гелообразни (желе - гелове). Повечето биологични течности на клетката (вече споменатата цитоплазма, ядрен сок - кариоплазма, съдържание на вакуоли) и живия организъм като цяло са колоидни разтвори (золи). Всички жизнени процеси, протичащи в живите организми, са свързани с колоидното състояние на материята. Във всяка жива клетка биополимерите (нуклеинови киселини, протеини, гликозаминогликани, гликоген) се намират под формата на диспергирани системи. Геловете са колоидни системи, в които частиците на дисперсната фаза образуват пространствена структура. Геловете могат да бъдат: хранителни – мармалад, блатове, желирани меса, желе; биологични - хрущяли, сухожилия, коса, мускулна и нервна тъкан, тела на медузи; козметика - душ гелове, кремове; медицински - лекарства, мехлеми; минерал - перли, опал, карнеол, халцедон. Колоидните системи са от голямо значение за биологията и медицината. Съставът на всеки жив организъм включва твърди, течни и газообразни вещества, които са в сложна връзка с околната среда. От химическа гледна точка тялото като цяло е сложна съвкупност от много колоидни системи. Биологичните течности (кръв, плазма, лимфа, цереброспинална течност и др.) са колоидни системи, в които органични съединения като протеини, холестерол, гликоген и много други са в колоидно състояние. Защо природата му дава такова предпочитание? Тази характеристика се дължи главно на факта, че веществото в колоидно състояние има голяма граница между фазите, което допринася за по-добри метаболитни реакции. Примери за естествени и изкуствени дисперсни системи. Минерали и скали като природни смеси Цялата природа, която ни заобикаля - животински и растителни организми, хидросферата и атмосферата, земната кора и подпочвата са сложна съвкупност от много различни и различни видове груби и колоидни системи. Облаците на нашата планета са същите живи същества като цялата природа, която ни заобикаля. Те са от голямо значение за Земята, тъй като са информационни канали. В крайна сметка облаците се състоят от капилярната субстанция на водата, а водата, както знаете, е много добро устройство за съхранение на информация. Водният цикъл в природата води до факта, че информацията за състоянието на планетата и настроението на хората се натрупва в атмосферата и заедно с облаците се движи из цялото пространство на Земята. Удивително творение на природата - облаци, които доставят на хората радост, естетическо удоволствие и просто желание понякога да погледнат към небето. Мъглата също може да бъде пример за естествена дисперсна система, натрупването на вода във въздуха, когато се образуват малки кондензационни продукти от водна пара (при температура на въздуха над? 10° - малки капчици вода, при? 10..? 15° - смес от водни капчици и кристали лед, при температура под? 15° - ледени кристали, искрящи на слънчевите лъчи или на светлината на луната и фенерите). Относителната влажност на въздуха по време на мъгла обикновено е близо до 100% (поне надвишава 85-90%). Въпреки това, при силни студове (? 30 ° и по-ниски) в населени места, на железопътни гари и летища, мъгли могат да се наблюдават при всякаква относителна влажност на въздуха (дори по-малко от 50%) - поради кондензацията на водни пари, образувани по време на изгарянето на горивото (в двигатели, пещи и др.) и се отделят в атмосферата през изпускателни тръби и комини. Продължителността на мъглата обикновено варира от няколко часа (а понякога и от половин час до час) до няколко дни, особено през студения сезон. Мъглите възпрепятстват нормалното функциониране на всички видове транспорт (особено на авиацията), така че прогнозите за мъгли са от голямо икономическо значение. Пример за сложна дисперсна система е млякото, чиито основни компоненти (без водата) са мазнини, казеин и млечна захар. Мазнината е под формата на емулсия и когато млякото престои, тя постепенно се издига до върха (сметаната). Казеинът се съдържа под формата на колоиден разтвор и не се освобождава спонтанно, но може лесно да се утаи (под формата на извара) при подкисляване на млякото, например с оцет. В естествени условия при вкисването на млякото се отделя казеин. И накрая, млечната захар е под формата на молекулен разтвор и се освобождава само когато водата се изпари. Много газове, течности и твърди вещества се разтварят във вода. Захарта и готварската сол се разтварят лесно във вода; въглероден диоксид, амоняк и много други вещества, когато се сблъскат с вода, преминават в разтвор и губят предишното си агрегатно състояние. Разтвореното вещество може да бъде изолирано от разтвор по определен начин. Ако изпарите разтвор на готварска сол, солта остава под формата на твърди кристали. Когато веществата се разтварят във вода (или друг разтворител), се образува еднаква (хомогенна) система. Следователно разтворът е хомогенна система, състояща се от два или повече компонента. Разтворите могат да бъдат течни, твърди и газообразни. Течните разтвори включват например разтвор на захар или трапезна сол във вода, алкохол във вода и други подобни. Твърдите разтвори на един метал в друг включват сплави: месингът е сплав от мед и цинк, бронзът е сплав от мед и калай и други подобни. Газообразно вещество е въздух или смес от газове. Минерали и скали като природни смеси. Общоприето е, че скалите са естествени минерални агрегати с определен състав и структура, образувани в резултат на геоложки процеси и възникващи в земната корапод формата на независими органи. В съответствие с основните геоложки процеси, водещи до образуването на скалите, сред тях по произход се разграничават три генетични класа: седиментни, магмени и метаморфни. В природата няма прости скали, но това са или твърди диспергирани фази на суспензии, или дисперсионни среди на порести тела, или втвърдени емулсии. Геолозите казват, че глина се натрупва на дъното на морето. В действителност отложената глинеста утайка е рохкава, фино дисперсна минерална маса, наситена морска вода. Първоначалната порьозност на глинестите тини варира от 70 до 90%, или 1 m 3 тиня съдържа 700-900 литра морска вода. Както знаете, съд с обем 1 m 3 съдържа 1000 литра вода. Такава формация от практически същата вода (дисперсионна среда), в която глинените частици са изолирани в малки количества една от друга, не може да се нарече скала. Това е физико-химична система от тип суспензия. С потапяне в недрата на литосферата и припокриване с нови слоеве, водата започва да се изстисква от суспензията, глинените минерали влизат в контакт, компресират се взаимно, което води до намаляване на разстоянието на техните атоми кристални решетки. Веществото на дисперсната фаза на суспензията започва да рекристализира с увеличаване на размера на кристала. Рохавата минерална глинеста маса е циментирана от появяващите се кристали, преходите в циментираната глинеста маса са аргилитни. Нарастващото литостатично натоварване (маса) на слоевете, натрупващи се отгоре, причинява силен едностранен натиск. Според принципа (закона) на Рике минералите започват да се разтварят по посока на това налягане. При продължаващо отстраняване на част от дисперсионната среда на суспензията, което е придружено от намаляване на плътността на системата, минералите кристализират в посока, перпендикулярна на статичното налягане. С увеличаване на размера на кристалите физикохимичната система се превръща от суспензия в система от поресто тяло, състоящо се от кристална дисперсна среда и нагрята течна дисперсна фаза. В кристална дисперсионна среда се появяват шистозна (кристални шисти) и паралелно-ивични (гнайси) текстури. По-долу водно-силикатен разтвор на базалтов състав се отстранява от порестото тяло. Останалата дисперсионна среда от гранитни кристали има плътност, по-ниска от глинените частици. Намаляването на плътността се регистрира чрез образуването на гранит с хаотична текстура. Когато глинесто диспергираната фаза на суспензията се прекристализира в кристална дисперсионна среда на поресто тяло с увеличаване на размера на кристала, това се придружава от освобождаване на потенциална свободна повърхност, вътрешна енергия (натрупана по време на хипергенеза) от глинести минерали слънчева енергия) под формата на кинетична термична. Прекристализацията на веществото с отстраняването на примеси от силикатни минерали (в крайна сметка всички катиони) води до намаляване на плътността на веществото с дълбочина, което допринася за промяна на координационното число на алуминия в глините от 4 на 6 във фелдшпатите на гнайси и гранити, което е съпроводено с отделяне на геохимична енергия под формата на топлина. Отстраненият нагрят водно-силикатен разтвор на базалтов състав е емулсия от разтвори на електролити, неелектролити, а силикатната му част е колоиден разтвор. Коагулация - феноменът на слепване и утаяване на колоидни частици - се наблюдава, когато зарядите на тези частици се неутрализират, когато към колоидния разтвор се добави електролит. В този случай разтворът се превръща в суспензия или гел. Някои органични колоиди коагулират при нагряване (лепило, яйчен белтък) или при промяна на киселинно-алкалната среда на разтвора. Синереза. С течение на времето структурата на геловете се нарушава - от тях се отделя течност. Настъпва синереза - спонтанно намаляване на обема на гела, придружено от отделяне на течност. Syneresis определя срока на годност на хранителни, медицински и козметични гелове. Биологичният синерезис е много важен при производството на сирене и извара. Топлокръвните животни имат процес, наречен коагулация на кръвта: под въздействието на специфични фактори разтворимият кръвен протеин фибриноген се превръща във фибрин, чийто съсирек по време на процеса на синереза се сгъстява и запушва раната. Ако кръвосъсирването е трудно, тогава човекът може да има хемофилия. Жените носят гена на хемофилията, а мъжете го получават. Добре известен исторически династичен пример: руската династия Романови, която царува повече от 300 години, страда от това заболяване. Заключение В дисперсните системи специфичната повърхност на дисперсната фаза е много голяма. Една от най-важните последици от голямата повърхност на дисперсната фаза е, че лиофобните дисперсни системи имат излишък на повърхностна енергия и следователно са термодинамично нестабилни. Следователно в дисперсните системи различни спонтанни процеси, които водят до намаляване на излишната енергия. Най-честите процеси са намаляването на специфичната повърхност поради уголемяване на частиците. В крайна сметка подобни процеси водят до разрушаване на системата. По този начин основното свойство, което характеризира самото съществуване на дисперсните системи, е тяхната стабилност или, обратно, нестабилност. Глобалната роля на колоидите се състои в това, че те са основните компоненти на такива биологични образувания като живите организми. Всички вещества в човешкото тяло са колоидни системи. Колоидите влизат в тялото под формата на хранителни вещества и в процеса на храносмилане се превръщат в специфични колоиди, характерни за даден организъм. Богатите на протеини колоиди изграждат кожата, мускулите, ноктите, косата, кръвоносните съдове и др. Можем да кажем, че цялото човешко тяло е сложна колоидна система. Списък на източниците на информация 1. Официален уебсайт Руска академияЕстествени науки 2. Wikipedia, безплатната енциклопедия 3. Rebinder P. A Дисперсни системи 4. Сайт за химия “Химик” 5. Официален сайт на сп. “Химия и живот” Публикувано на Allbest.ru ...Подобни документиКонцепцията за дисперсни системи. Разнообразие от дисперсни системи. Грубодисперсни системи с твърда дисперсна фаза. Значението на колоидната система за биологията. Мицелите като частици от дисперсната фаза на золите. Последователност при съставяне на мицелната формула. резюме, добавено на 15.11.2009 г Същност и класификация на дисперсните системи. Газове, течности и твърди вещества. Грубодисперсни системи (емулсии, суспензии, аерозоли), използването им в практическата човешка дейност. Характеристика на основните видове колоидни системи: золи и гелове. презентация, добавена на 12/04/2010 Концепцията за дисперсна система, фаза и среда. Оптични свойства на дисперсните системи и ефекта на Тиндал. Молекулно-кинетични свойства на дисперсните системи. Теория Брауново движениеи видове дифузия. Процесът на осмоза и уравнението на осмотичното налягане. резюме, добавено на 22.01.2009 г Концепцията и същността на дисперсията, нейните характеристики. Дисперсионна скала. Специфична повърхност и нейната степен на дисперсност. Класификация на дисперсните системи. Понятия: дисперсна фаза и дисперсионна среда. Методи за получаване на дисперсни системи и техните особености. резюме, добавено на 22.01.2009 г Емулсии. Условия за тяхното образуване, класификация и свойства. Примери за емулсии сред хранителни продукти. Коагулация на дисперсна система. Скорост на коагулация. Причините, предизвикващи процеса на спонтанна коагулация. Адсорбционна хроматография. Топлинно неутрален тест, добавен на 25.07.2008 г Основните характеристики на дисперсните системи, тяхната класификация, свойства и методи за получаване, диализа (пречистване) на золове. Определянето на заряда на колоидната частица, законите на електролитната коагулация, концепцията за адсорбция на границата разтвор-газ са същността на теорията на Langmuir. ръководство за обучение, добавено на 14.12.2010 г Класификация на дисперсните системи по размер на частиците на дисперсната фаза и по агрегатни състоянияфази Условия за получаване на стабилни емулсии. Молекулно-кинетични свойства на золите, сравнението им с истински разтвори. Външни признаци на коагулация. тест, добавен на 21.07.2011 г История на учението за дисперсното състояние на веществата. Образуване на дисперсна фаза в петролни системи. Надмолекулни структури и фазови преходи в петролни системи. Колоидно-дисперсните свойства на петролните продукти са основният фактор при избора на технология за преработка. резюме, добавено на 10/06/2011 Частици от газообразна, течна или твърда фаза в течност. Класификация на различни дисперсни системи според размера на частиците на дисперсната фаза, разпределени в дисперсионната среда. Специфичен фазов интерфейс. Повърхностни процеси, адсорбция и адхезия. презентация, добавена на 30.04.2014 г Състав на емулсии и фактори, определящи тяхната стабилност. Кремът е козметичен продукт за грижа за кожата, неговите видове в зависимост от предназначението. Компоненти на гелове и пени, тяхното образуване и използване. Състав и лечебни свойства на мехлеми, техните разновидности. |