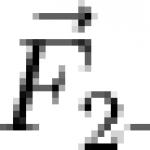Дифузионните потенциали възникват на границата между два разтвора.Освен това това могат да бъдат решения различни вещества, и разтвори на едно и също вещество, само че във втория случай те трябва да се различават един от друг по своите концентрации.
Когато два разтвора влязат в контакт, частици (йони) от разтворени вещества проникват взаимно в тях поради процеса на дифузия.
Причината за възникването на дифузионен потенциал в този случай е неравномерната подвижност на йоните на разтворените вещества. Ако електролитните йони имат различни скорости на дифузия, тогава по-бързите йони постепенно се появяват пред по-малко подвижните. Сякаш се образуват две вълни от различно заредени частици.
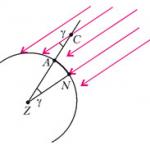
Ако се смесят разтвори на едно и също вещество, но с различни концентрации, тогава по-разреденият разтвор придобива заряд, който съвпада по знак със заряда на по-подвижните йони, а по-малко разреденият разтвор придобива заряд, който съвпада по знак със заряда на по-малко подвижни йони (фиг. 90).
ориз. 90. Появата на дифузионен потенциал поради различни скорости на йони: аз– „бързи” нони, отрицателно заредени; II– “бавни” йони, положително заредени
На границата на разтвора възниква така нареченият дифузионен потенциал. Осреднява скоростта на движение на йоните (забавя „по-бързите“ и ускорява „по-бавните“).
Постепенно, със завършване на процеса на дифузия, този потенциал намалява до нула (обикновено в рамките на 1-2 часа).
Дифузионни потенциали могат да възникнат и в биологични обекти, когато клетъчните мембрани са повредени. В този случай тяхната пропускливост се нарушава и електролитите могат да дифундират от клетката в тъканната течност или обратно, в зависимост от разликата в концентрацията от двете страни на мембраната.
В резултат на дифузията на електролитите възниква така нареченият потенциал на увреждане, който може да достигне стойности от порядъка на 30-40 mV. Освен това увредената тъкан най-често се зарежда отрицателно по отношение на неувредената тъкан.
Потенциалът на дифузия възниква в галваничните клетки на границата на контакт на два разтвора. Следователно, при точно изчисляване на емф. галваничните вериги задължително трябва да въвеждат корекция за неговата стойност. За да се елиминира влиянието на дифузионния потенциал, електродите в галваничните клетки често са свързани помежду си чрез "солев мост", който е наситен разтворKCl.
Калиеви и хлорни йони имат почти еднаква подвижност, така че използването им позволява значително да се намали влиянието на дифузионния потенциал върху стойността на ЕДС.
Дифузионният потенциал може значително да се увеличи, ако разтвори на електролити с различен състав или различни концентрации са разделени от мембрана, която е пропусклива само за йони с определен знак или тип заряд. Такива потенциали ще бъдат много по-устойчиви и могат да се запазят за по-дълго време - те се наричат по различен начин мембранни потенциали. Мембранните потенциали възникват, когато има неравномерно разпределение на йони от двете страни на мембраната, в зависимост от нейната селективна пропускливост, или в резултат на обмена на йони между самата мембрана и разтвора.
Принципът на действие на т.нар йон-селективенили мембранен електрод.
Основата на такъв електрод е получена по определен начин полупропусклива мембрана, която има селективна йонна проводимост. Характеристика на мембранния потенциал е, че електроните не участват в съответната електродна реакция. Тук се извършва обмен на йони между мембраната и разтвора.
Електродите с твърда мембрана съдържат тънка мембрана, от двете страни на която има различни разтвори, съдържащи едни и същи откриваеми йони, но в различни концентрации. Отвътре мембраната се измива със стандартен разтвор с точно известна концентрация на определяните йони, а отвън с анализирания разтвор с неизвестна концентрация на определяните йони.
Поради различните концентрации на разтвори от двете страни на мембраната, йоните се обменят по различен начин с вътрешната и външната страна на мембраната. Това води до образуването на различни електрически заряди в резултат на това възниква мембранна потенциална разлика.
Сред йон-селективните електроди стъкленият електрод, който се използва за определяне на рН на разтвори, стана широко разпространен.
Централната част на стъкления електрод (фиг. 91) е топка, изработена от специално проводимо хидратирано стъкло. Напълва се с воден разтвор на HCl с известна концентрация (0,1 mol/dm 3 ). В този разтвор се поставя електрод от втория вид – най-често сребърнохлориден, който играе ролята на референтен електрод. По време на измерванията стъклена перла се потапя в анализирания разтвор, който съдържа втори референтен електрод.
Принципът на работа на електрода се основава на факта, че в стъклената структура K +, Na +, Li + йони се заместват с H + йони чрез продължително накисване в киселинен разтвор. По този начин стъклената мембрана може да обменя своите H + йони с вътрешни и външни разтвори (фиг. 92). Освен това в резултат на този процес от двете страни на мембраната възникват различни потенциали.

ориз. 91. Схема на стъклен електрод: 1 – стъклена топка (мембрана); 2 – вътрешен разтвор на НС1; 3 – сребърнохлориден електрод; 4 – измерван разтвор; 5 – метален проводник

ориз. 92. Стъклен електрод в разтвор с неизвестна концентрация на H + йони (а) и диаграма на йонен обмен между две фази (b)
С помощта на референтни електроди, поставени във външния и вътрешния разтвор, се измерва тяхната разлика.
Потенциалът от вътрешната страна на мембраната е постоянен, така че потенциалната разлика на стъкления електрод ще зависи само от активността на водородните йони в тестовия разтвор.
Общата електрическа схема, включваща стъклен електрод и два референтни електрода, е показана на фиг. 93.
ориз. 93. Схема на веригата, обясняваща принципа на работа на стъклен електрод
Стъкленият електрод има редица значителни предимства пред водородния електрод, който също може да се използва за измерване на концентрацията на H + йони в разтвор.
Той е напълно нечувствителен към различни примеси в разтвора, „не е отровен от тях“, може да се използва, ако анализираните течности съдържат силни окислители и редуциращи агенти, както и в най-широк диапазон от стойности на pH - от 0 до 12. Недостатъкът на стъкления електрод е неговата голяма чупливост.
Напрежението на електрохимична система с течен интерфейс между два електролита се определя от разликата в електродните потенциали с точност до потенциала на дифузия.
ориз. 6.12. Елиминиране на дифузионния потенциал с помощта на електролитни мостове
Най-общо казано, дифузионните потенциали на границата на два електролита могат да бъдат доста значителни и във всеки случай често правят резултатите от измерването несигурни. По-долу са дадени стойностите на дифузионните потенциали за някои системи (концентрацията на електролита в kmol/m 3 е посочена в скоби):
В това отношение дифузионният потенциал трябва или да бъде елиминиран, или точно измерен. Елиминирането на дифузионния потенциал се постига чрез включване на допълнителен електролит с подобна подвижност на катиони и аниони в електрохимичната система. Когато се правят измервания във водни разтвори, като такива електролити се използват наситени разтвори на калиев хлорид, калиев нитрат или амоний.
Допълнителен електролит се включва между основните електролити с помощта на електролитни мостове (фиг. 6.12), запълнени с основните електролити. Тогава потенциалът на дифузия между основните електролити, например в случая, показан на фиг. 6.12, - между разтвори на сярна киселина и меден сулфат, се заменя с дифузионни потенциали на границите на сярна киселина - калиев хлорид и калиев хлорид - меден сулфат. В същото време, на границите с калиев хлорид, електричеството се пренася главно от K + и C1 – йони, които са много повече от йоните на основния електролит. Тъй като подвижността на K + и C1 – йони в калиев хлорид е почти равна една на друга, потенциалът на дифузия ще бъде малък. Ако концентрациите на основните електролити са ниски, тогава с помощта на допълнителни електролити потенциалът на дифузия обикновено се намалява до стойности, които не надвишават 1 - 2 mV. Така в експериментите на Аббег и Къминг беше установено, че дифузионният потенциал на границата 1 kmol/m3 LiCl - 0,1 kmol/m3 LiCl е равен на 16,9 mV. Ако между разтворите на литиев хлорид се включат допълнителни електролити, дифузионният потенциал намалява до следните стойности:
Допълнителен електролит Дифузионен потенциал на системата, mV
NH4NO3 (1 kmol/m3) 5.0
NH 4 NO 3 (5 kmol/m 3) –0,2
NH 4 NO 3 (10 kmol/m 3) –0,7
KNO 3 (наситен) 2.8
KCl (наситен) 1.5
Елиминирането на дифузионните потенциали чрез включване на допълнителен електролит с равни числа на йонен трансфер дава добри резултати при измерване на дифузионни потенциали в неконцентрирани разтвори с малко по-различна подвижност на аниона и катиона. При измерване на напрежения на системи, съдържащи разтвори на киселини или основи
Таблица 6.3.Дифузионни потенциали на границата KOH – KCl и NaOH – KCl (по В. Г. Локщанов)
с много различни скорости на движение на катиона и аниона, трябва да се обърне специално внимание. Например, на границата HC1 - KS1 (наситена), дифузионният потенциал не надвишава 1 mV само ако концентрацията на разтвора на HC1 е под 0,1 kmol/m 3 . В противен случай потенциалът на дифузия нараства бързо. Подобно явление се наблюдава при алкали (Таблица 6.3). По този начин дифузионният потенциал, например в система
(–) (Pt)H 2 | KOH | KOH | H 2 (Pt) (+)
4,2 kmol/m3 20,4 kmol/m3
е 99 mV, а в в този случайне може да се намали значително с помощта на солен мост.
За да се намалят дифузионните потенциали до незначителни стойности, Нернст предложи да се добави голям излишък от някакъв индиферентен електролит към контактните разтвори. Тогава дифузията на основни електролити вече няма да води до появата на значителен градиент на активността на интерфейса и, следователно, дифузионния потенциал. За съжаление, добавянето на индиферентен електролит променя активността на йоните, участващи в реакцията, определяща потенциала, и води до изкривени резултати. Следователно този метод може да се използва само в тези
случаи, когато добавянето на индиферентен електролит не може да повлияе на промяната в активността или тази промяна може да бъде взета под внимание. Например при измерване на системното напрежение Zn | ZnSO 4 | CuSO 4 | Cu, в която концентрацията на сулфати не е по-ниска от 1,0 kmol / m 3, добавянето на магнезиев сулфат за намаляване на дифузионния потенциал е напълно приемливо, тъй като средните коефициенти на йонна активност на цинковите и медните сулфати практически няма да се променят.
Ако при измерване на напрежението на електрохимична система дифузионните потенциали не се елиминират или трябва да бъдат измерени, тогава преди всичко трябва да се внимава да се създаде стабилна контактна граница между двата разтвора. Непрекъснато обновяващата се граница се създава чрез бавно насочено движение на разтвори, успоредни един на друг. По този начин е възможно да се постигне стабилност на дифузионния потенциал и неговата възпроизводимост с точност до 0,1 mV.
Дифузионният потенциал се определя по метода на Коен и Томброк от измервания на напрежението на две електрохимични системи, като електродите на едната от тях са обратими към катиона на солта, а другият към аниона. Да кажем, че трябва да определим дифузионния потенциал на границата ZnSO 4 (a 1)/ZnSO 4 (a 2). За да направим това, измерваме напреженията на следните електрохимични системи (да приемем, че 1< < а 2):
1. (–) Zn | ZnSO 4 | ZnSO 4 | Zn(+)
2. (–) Hg | Hg 2 SO 4 (твърд), ZnSO 4 | ZnSO 4, Hg 2 SO 4 (твърд) | Hg(+)
Напрежение на системата 1

системи 2

Като се има предвид, че φ d 21 = – φ d 12 и като се извади второто уравнение от първото, получаваме:
Когато измерванията се извършват при не много високи концентрации, при които все още може да се приеме, че = и = или че : = : последните два члена на последното уравнение се анулират и
![]()
Дифузионният потенциал в система 1 може да се определи и по малко по-различен начин, ако вместо система 2 използваме двойна електрохимична система:
3. (–) Zn | ZnSO 4, Hg 2 SO 4 (твърд) | Hg - Hg | Hg 2 SO 4 (твърд), ZnSO 4 | Zn(+)
Дифузионните потенциали възникват на границата между два разтвора.Освен това, това могат да бъдат или разтвори на различни вещества, или разтвори на едно и също вещество, само във втория случай те трябва да се различават един от друг по своите концентрации.
Когато два разтвора влязат в контакт, частици (йони) от разтворени вещества проникват взаимно в тях поради процеса на дифузия.
Причината за възникването на дифузионен потенциал в този случай е неравномерната подвижност на йоните на разтворените вещества. Ако електролитните йони имат различни скорости на дифузия, тогава по-бързите йони постепенно се появяват пред по-малко подвижните. Сякаш се образуват две вълни от различно заредени частици.
Ако се смесят разтвори на едно и също вещество, но с различни концентрации, тогава по-разреденият разтвор придобива заряд, който съвпада по знак със заряда на по-подвижните йони, а по-малко разреденият разтвор придобива заряд, който съвпада по знак със заряда на по-малко подвижни йони (фиг. 90).
ориз. 90. Появата на дифузионен потенциал поради различни скорости на йони: аз– “бързи” йони, отрицателно заредени;
II– “бавни” йони, положително заредени
На границата на разтвора възниква така нареченият дифузионен потенциал. Осреднява скоростта на движение на йоните (забавя „по-бързите“ и ускорява „по-бавните“).
Постепенно, със завършване на процеса на дифузия, този потенциал намалява до нула (обикновено в рамките на 1-2 часа).
Дифузионни потенциали могат да възникнат и в биологични обекти, когато клетъчните мембрани са повредени. В този случай тяхната пропускливост се нарушава и електролитите могат да дифундират от клетката в тъканната течност или обратно, в зависимост от разликата в концентрацията от двете страни на мембраната.
В резултат на дифузията на електролитите възниква така нареченият потенциал на увреждане, който може да достигне стойности от порядъка на 30-40 mV. Освен това увредената тъкан най-често се зарежда отрицателно по отношение на неувредената тъкан.
Потенциалът на дифузия възниква в галваничните клетки на границата между два разтвора. Следователно, при точно изчисляване на емф. галваничните вериги задължително трябва да въвеждат корекция за неговата стойност. За да се елиминира влиянието на дифузионния потенциал, електродите в галваничните клетки често са свързани помежду си чрез "солев мост", който е наситен разтвор на KCl.
Калиеви и хлорни йони имат почти еднаква подвижност, така че използването им позволява значително да се намали влиянието на дифузионния потенциал върху стойността на ЕДС.
Дифузионният потенциал може значително да се увеличи, ако разтвори на електролити с различен състав или различни концентрации са разделени от мембрана, която е пропусклива само за йони с определен знак или тип заряд. Такива потенциали ще бъдат много по-устойчиви и могат да се запазят за по-дълго време - те се наричат по различен начин мембранни потенциали. Мембранните потенциали възникват, когато има неравномерно разпределение на йони от двете страни на мембраната, в зависимост от нейната селективна пропускливост, или в резултат на обмена на йони между самата мембрана и разтвора.
Принципът на действие на т.нар йон-селективенили мембранен електрод.
Основата на такъв електрод е получена по определен начин полупропусклива мембрана, която има селективна йонна проводимост. Характеристика на мембранния потенциал е, че електроните не участват в съответната електродна реакция. Тук се извършва обмен на йони между мембраната и разтвора.
Електродите с твърда мембрана съдържат тънка мембрана, от двете страни на която има различни разтвори, съдържащи едни и същи откриваеми йони, но в различни концентрации. Отвътре мембраната се измива със стандартен разтвор с точно известна концентрация на определяните йони, а отвън с анализирания разтвор с неизвестна концентрация на определяните йони.
Поради различните концентрации на разтвори от двете страни на мембраната, йоните се обменят по различен начин с вътрешната и външната страна на мембраната. Това води до образуването на различни електрически заряди от различни страни на мембраната и в резултат на това възниква мембранна потенциална разлика.
При създаването на която и да е електродна двойка винаги се използва „солев мост“. Използването на "солен мост" решава няколко проблема, които възникват пред изследователите на електрохимичните процеси. Една от тези задачи е да се повиши точността на определянията чрез елиминиране или значително намаляване на дифузионния потенциал . Дифузионен потенциалв галваничните клетки възниква, когато разтвори с различни концентрации влязат в контакт. Електролитът от разтвор с по-висока концентрация дифундира (преминава) в по-малко концентриран разтвор. Ако абсолютните скорости на движение на катионите и анионите на дифузиращия електролит са различни, тогава по-малко концентрираният разтвор придобива потенциала на знака на заряда на "по-бързите йони", а по-концентрираният разтвор придобива потенциала на противоположния знак. За да се елиминира дифузионният потенциал, е необходимо да се сведе до минимум разликата в скоростите на движение на катиони и аниони на дифузиращия електролит. За тази цел е избран наситен разтвор на KCl, т.к абсолютни скорости на движение K + и Cl ¯ почти идентични и имат една от най-високите стойности.
Появата на дифузионен потенциал също е характерна за биологични системи. Например, когато една клетка е повредена, когато полупропускливостта на нейната мембрана е нарушена, електролитът започва да дифундира в или извън клетката. Това създава дифузионен потенциал, който тук се нарича „потенциал за увреждане“. Стойността му може да достигне 30 - 40 mV, "потенциалът за увреждане" е стабилен за около един час.
Стойността на дифузионния потенциал се увеличава значително, ако разтворите на електролити с различни концентрации са разделени от мембрана, която позволява преминаването само на катиони или аниони. Селективността на такива мембрани се дължи на собствения им заряд. Мембранните потенциали са много стабилни и могат да се запазят няколко месеца.
Потенциометрия
Видове електроди
За аналитични и технически цели са разработени много различни електроди, които образуват електродни двойки (елементи).
Има два основни вида класификация на електродите.
от химичен състав :
1. Електроди от 1-ви вид - това са електроди, чиято електродна реакция е обратима само по отношение на катиона или аниона. Например, електродите, които образуват елемента Якоби-Даниел, са медни и цинкови (виж по-горе).
2. Електроди 2 вида - това са електроди, чиято електродна реакция е обратима за два вида йони: катиони и аниони.
3. Редокс електроди (червено – Ox) . Терминът „червен – Ox – електрод“ се отнася до електрод, при който всички елементи на полуреакцията (както окислени, така и редуцирани форми) са в разтвор. Металните електроди, потопени в разтвора, не участват в реакцията, а служат само като носител на електрони.
По предназначение:
1. Еталонни електроди .
Референтните електроди са електроди, чийто потенциал е точно известен, стабилен е във времето и не зависи от концентрацията на йони в разтвора. Такива електроди включват: стандартен водороден електрод, каломелов електрод и електрод от сребърен хлорид.Нека разгледаме всеки електрод по-подробно.
Стандартен водороден електрод.
Този електрод представлява затворен съд, в който е поставена платинена пластина. Съдът се пълни с разтвор солна киселина, активността на водородните йони, в които е 1 mol/l. Водородният газ се пропуска в съд под налягане от 1 атмосфера. Водородните мехурчета се адсорбират върху платинена плоча, където се дисоциират до атомен водород и се окисляват.
Характеристики на стандартен водороден електрод:
1. Електродна диаграма: Pt(H 2) / H +
2. Електродна реакция: ½ Н 2 – ē ↔ Н +
Както е лесно да се види, тази реакция е обратима само за катиона (H +), следователно стандартният водороден електрод е електрод тип 1.
3. Изчисляване на електроден потенциал.
Уравнението на Нернст приема формата:
eH2/H+ = e ° Н 2 /N + RT ln a n +
nF (P n 2) 1/2
защото и n+ = 1 mol/l, р n+ = 1 atm, тогава В a n+ = 0,Ето защо
(Rn 2) 1/2
eH2/H+ = e ° Н 2 /Н+
Така при n + = 1 mol/l и p(n 2) = 1 atm потенциалът на водородния електрод е нула и се нарича „стандартен водороден потенциал“.
Още един пример – каломелов електрод(виж снимката)
Съдържа паста, включваща каломел (Hg 2 Cl 2), живак и калиев хлорид. Пастата е на базата на чист живак и е напълнена с разтвор на калиев хлорид. Вътре в тази система е потопена платинена плоча.
Характеристики на електрода:
1. Електродна диаграма: Hg 2 Cl 2, Hg(Pt) / Cl¯
2. В този електрод протичат две паралелни реакции:
Hg 2 Cl 2 ↔2Hg + +2Cl¯
2 Hg + + 2ē →2Hg
Hg 2 Cl 2 + 2ē → 2Hg +2Cl¯ - обща реакция.
От горните уравнения става ясно, че каломеловият електрод е електрод от тип 2.
3. Електродният потенциал се определя с помощта на уравнението на Нернст, което след подходящи трансформации приема формата:
 e = e o - RT ln a Cl¯
e = e o - RT ln a Cl¯
Друг важен пример е сребърнохлориден електрод(вижте снимката).
Тук сребърната тел е покрита със слой от слабо разтворима сол AgCl и е потопена в наситен разтвор на калиев хлорид.
Характеристики на електрода:
1. Диаграма на електродите: Ag, AgCl / Cl¯
2. Електродни реакции: AgCl ↔ Ag + + Cl¯
Ag + + ē → Ag
AgCl + ē ↔ Ag + Cl¯ -обща реакция.
Както може да се види от тази реакция, полученият метал се утаява върху жицата и Cl¯ йони преминават в разтвор. Металният електрод придобива положителен заряд, чийто потенциал зависи от концентрацията (активността) на Cl¯ йони.
3. Потенциалът на електрода се определя с помощта на уравнението на Нернст, което след подходящи трансформации вече приема известни видове:
e = e o - RT ln a Cl¯
В електродите от сребърен хлорид и каломел концентрацията на Cl¯ йони се поддържа постоянна и следователно техните електродни потенциали са известни и постоянни във времето.
2. Електроди за определение - това са електроди, чийто потенциал зависи от концентрацията на всякакви йони в разтвора, следователно концентрацията на тези йони може да се определи от стойността на потенциала на електрода.
Най-често като индикаторни електроди се използват: водородни, стъклени и хинхидронови електроди.
Водороден електроде проектиран подобно на стандартен водороден електрод, но ако киселинен разтвор с активност на H + йони, по-голяма от единица, се постави в контейнера на водородния електрод, тогава върху електрода се появява положителен потенциал, пропорционален на активността (т.е. концентрация ) от протони. Когато концентрацията на протони намалява, напротив, електродът ще бъде отрицателно зареден. Следователно чрез определяне на потенциала на такъв електрод е възможно да се изчисли рН на разтвора, в който е потопен.
Характеристики на електродите.
1. Електродна диаграма: Pt(H 2) / H +
2. Електродна реакция: ½ Н 2 – ē ↔ Н +
3. e H 2 /H+ = e o H 2 /H + + 0,059 lg a n+
п
защото n =1 и e o N 2 / H+= 0, тогава уравнението на Нернст приема формата:
e H2/H+ = 0,059 lg a n+ = - 0,059 pH pH = - e
0,059
Стъклен електродпредставлява сребърна пластина, покрита с неразтворима сребърна сол, затворена в стъклена обвивка от специално стъкло, завършваща с тънкостенна проводима топка. Вътрешна средаЕлектродът е разтвор на солна киселина. Потенциалът на електрода зависи от концентрацията на Н + и се определя от уравнението на Нернст, което има формата:
e st = e o st + 0,059 lg a n +
Квинхидронов електродсе състои от платинена плоча, потопена в разтвор на хинхидрон - еднаква моларна смес от хинон C 6 H 4 O 2 и хидрохинон C 6 H 4 (OH) 2, между които бързо се установява динамично равновесие:

Тъй като протоните участват в тази реакция, потенциалът на електрода зависи от pH.
Характеристики на електрода:
1. Електродна диаграма: Pt / H +, C 6 H 4 O 2, C 6 H 4 O 2-
2. Електродна реакция:
C 6 H 4 (OH) 2 - 2ē ↔ C 6 H 4 O 2 + 2H + -
редокс процес.
3. Електродният потенциал се определя с помощта на уравнението на Нернст, което след подходящи трансформации приема формата:
e x. g. = e o x. g. + 0,059 lg a H +
Хинхидроновият електрод се използва само за определяне на рН на тези разтвори, където този показател е не повече от 8. Това се дължи на факта, че в алкална среда хидрохинонът се държи като киселина и стойността на потенциала на електрода престава да зависи от концентрация на протони.
защото в хинхидронов електрод Плоча от благороден метал се потапя в разтвор, съдържащ както окислената, така и редуцираната форма на едно вещество, след което може да се разглежда като типична система „червено – вол“.
Компонентите на редокс системата могат да бъдат както органични, така и неорганични вещества, Например:
Fe 3+ / Fe 2+ (Pt).
Въпреки това, за органична материя, "червен - вол" - електродите са особено важни, защото са единственият начинобразуват електрод и определят неговия потенциал.
Големината на електродните потенциали, възникващи върху метални пластини в червен вол – системи, могат да се изчислят не само чрез уравнението на Нернст, но и чрез уравнението на Петерс:
2 * 10 -4 C вол
e red-ox = e 0 red-ox + * T * lg ;(IN)
Т– температура, 0 К.
C волИ C червено– концентрации съответно на окислената и редуцирана форма на веществото.
e 0 red - ox е стандартният редокс потенциал, който възниква в системата, когато съотношението на концентрациите на окислената и редуцирана форма на съединението е равно на 1.
ДИФУЗИОНЕН ПОТЕНЦИАЛ,
потенциална разлика на границата на два контактуващи разтвора на електролити. Това се дължи на факта, че скоростите на пренос на катиони и аниони през границата, причинени от разликата в техните електрохимични свойства. потенциалите в разтвори 1 и 2 са различни. Наличието на D. точка може да причини грешка при измерването на потенциала на електрода, така че се полагат усилия за изчисляване или премахване на D. точка. Точното изчисление е невъзможно поради несигурността на коефициента. йонна активност, както и липсата на информация за разпределението на йонните концентрации в граничната зона между съседни разтвори. Ако решенията на едно и също z са в контакт, z - зареждащ електролит (z - брой катиони, равен на броя на анионите) разг. концентрации и можем да приемем, че числата на пренос на аниони и катиони, съответно. t + и t_ не зависят от тяхната активност, а от коеф. Активностите на анионите и катионите са равни една на друга в двата разтвора, тогава D. p.
Където 1 и a 2 - средни активности на йони в разтвори 1 и 2, T - абс. t-ra, R - , F - Константата на Фарадей. Има и други приблизителни формули за определяне на D. p. Намалете D. p. в случаите е възможно чрез разделяне на разтвори 1 и 2 със „солев мост“ от концентрата. разтвори, катиони и разрез имат приблизително равни числатрансфер (KCl, NH4NO3 и др.). Лит.: Fetter K., Електрохимична кинетика, прев. от немски, М., 1967, с. 70-76; Ротинян А. Л., Тихонов К. И., Шошина И. А., Теор. Л., 1981, с. 131-35. А. Д. Давидов.
Химическа енциклопедия. - М.: Съветска енциклопедия. Изд. И. Л. Кнунянц. 1988 .
Вижте какво е "ДИФУЗИОНЕН ПОТЕНЦИАЛ" в други речници:
дифузионен потенциал- – потенциал, възникващ в галваничен елемент при контакт на електролити; поради различни скорости на йонна дифузия. Обща химия: учебник / А. В. Жолнин ... Химически термини
дифузионен потенциал- - [L.G.Sumenko. Английско-руски речник по информационни технологии. М.: Държавно предприятие ЦНИИС, 2003.] Теми информационни технологииобщ EN дифузионен потенциал...
дифузионен потенциал- difuzijos potencijalas statusas T sritis Standartizacija и метрология apibrėžtis Potencialo pokytis, susidarantis dėl koncentracijų skirtumo kietųjų kūnų, tirpalų ir pan. sąlyčio riboje. атитикменйс: англ. дифузионен потенциал vok.… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
дифузионен потенциал- difuzinis potencijalas statusas T sritis chemija apibrėžtis Potencialo šuolis, atsirandantis tirpalų sąlyčio riboje. атитикменйс: англ. дифузионен потенциал рус. дифузионен потенциал... Chemijos terminų aiškinamasis žodynas
дифузионен потенциал- difuzijos potencijalas statusas T sritis fizika atitikmenys: англ. дифузионен потенциал vok. Дифузионен потенциал, n rus. дифузионен потенциал, m pranc. potentiel de diffusion, m … Fizikos terminų žodynas
дифузионен потенциал на спонтанна поляризация в кладенец- дифузионен потенциал Ed Електродвижеща сила, което възниква при контакта на разтвори с различна минерализация. [GOST 22609 77] Теми: геофизични изследвания в кладенци Общи термини: обработка и интерпретация на геофизични резултати... ... Ръководство за технически преводач
ПОТЕНЦИАЛ- ПОТЕНЦИАЛ. Количеството на всеки вид енергия може да бъде изразено като произведение на две различни количества, от които едното характеризира „нивото на енергията“ и определя посоката, в която трябва да се осъществи нейният преход; така напр тежко тяло..... Голяма медицинска енциклопедия
потенциал на спонтанна поляризация в кладенец- спонтанен поляризационен потенциал Ups Потенциал, създаден в кладенеца от спонтанни поляризационни токове. Забележка Потенциалът на спонтанна поляризация включва потенциал на дифузия, дифузионна абсорбция и филтрация. [ГОСТ... ... Ръководство за технически преводач
вълнов потенциал- – в класическата полярография, потенциалът, при който дифузионният ток, причинен от редукция на веществото върху индикаторния електрод, достига половината от максималната си стойност. Речник от аналитична химия … Химически термини
Разлика електростатичен потенциали между електрода и електролита в контакт с него. Появата на електрическата енергия се дължи на космоса. разделяне на заряди с противоположен знак на фазовата граница и образуване на двойни... ... Химическа енциклопедия