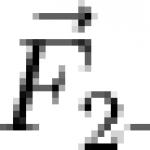15. Берилий, магнезий и алкалоземни метали
Основната подгрупа на група II включва берилий (Be), магнезий (Mg), калций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Калций, стронций, барий и радий са алкалоземни метали. Първият елемент от тази подгрупа, берилият, в повечето свойства е много по-близо до алуминия, отколкото до по-високите аналози на групата, към която принадлежи. Вторият елемент от тази група, магнезият, в някои отношения е значително различен от алкалоземните метали по редица химични свойстваАтомите на елементите от група II имат два електрона във външното си енергийно ниво, които те предават, когато химични взаимодействия, и следователно са най-силните редуциращи агенти. Във всички съединения те имат степен на окисление +2.
В редокс реакциите всички метали от подгрупата се държат като силни редуциращи агенти, но малко по-слаби от алкални метали. Това се обяснява с факта, че атомите на металите от група II имат по-малък размер атомни радиуси. С увеличаването на атомния номер на даден елемент загубата на електрони става по-лесна и следователно металните свойства се увеличават.
Берилият, магнезият и алкалоземните метали са прости вещества. Леки сребристо-бели метали, с изключение на стронций, който има златист оттенък.
Например, калцият е сребристо-бял и доста твърд метал, лек. Точките на топене и кипене са по-високи от тези на алкалните метали.Тъй катоТъй като калцият има 2 електрона на своето енергийно ниво, неговата степен на окисление във всички съединения винаги е +2. Калцият се окислява във въздуха, така че се съхранява в затворени съдове, обикновено в керосин.
Нека разгледаме химичните свойства на тази група метали, като използваме калций като пример.
От биологична гледна точка калцият играе важна роля за растенията, животните и хората. В нашето тяло е част от костите. Калцият придава твърдост на костите. Например, при нормални условия калцият реагира с
халогени, а със сяра, азот и въглерод - при нагряване.Когато калцият реагира с хлора, се образува калциев хлорид.
ок + C.I. 2 = CaCI 2 (калций плюс хлор две е равно на калций хлор две)
Когато калцият реагира със сярата, се образува калциев сулфид.
СЪСа + С = CaS
(калций плюс сяра е равно на калций)
Когато калцият реагира с азота, се образува калциев нитрид.
(три калций плюс en две стрелка калций три en две)
Тези реакции протичат при нагряване.
калций (ок) като активен метал измества водорода от водата:
СЪСа+ 2H 2 О =ок(ТОЙ) 2 +З 2
(калций плюс две като две o стрелка калций o като два пъти плюс две стрелка нагоре)
Въпреки това, не всички метали основна подгрупа IIгрупи Периодична таблицареагират еднакво с вода: берилият практически не взаимодейства с вода, т.к взаимодействието се предотвратява от защитен филм на повърхността му, реакцията на магнезий с вода протича доста бавно, докато други метали взаимодействат с водата по подобен начин на калция.
При нагряване на въздух калцият изгаря, за да образува калциев оксид:
2Cа+ О 2 = 2 окЗА
(две калция плюс o две е равно на две калций o)

Когато калцият реагира с въглерода, той образува калциев карбид СaC 2
СЪСа+ 2C =окСЪС 2
(калций плюс две е стрелка калций е две)
Поради високата си химична активност алкалоземните метали се срещат в природата само под формата на съединения.
Оксидите на тези метали са твърди, бели, огнеупорни вещества, които са устойчиви на високи температури. Покажете основни свойства. Изключение прави берилиевият оксид, който е амфотерен по природа.
Нека да разгледаме оксидите, използвайки калций като пример.
Калциевият оксид (техническо наименование: негасена вар, горена вар) е бял прах.
Калциевият оксид реагира енергично с вода, за да образува калциев хидроксид:
CaO + з 2 О = ок( ОХ) 2 + Q
(калций o плюс пепел две o е равно на калций o пепел два пъти плюс ku)
Реакцията на калциев оксид с вода е придружена от отделяне на голямо количество топлина и се нарича гасене на вар, а полученият Ca(OH) 2 - гасена вар.
гасена вар – твърдобял, разтворим във вода. Разтвор на гасена вар във вода се нарича варна вода. Разтворът има алкални свойства.
Нека да разгледаме алкалните свойства, използвайки пример:
ок( ОХ)2 + CO2 → CaCO3↓ + з2 О
(калций o пепел два пъти плюс tse o две стрелки калций tse o три стрелки надолу плюс две o)
Когато въглеродният окис преминава през варовита водаIV) разтворът става мътен
(калций tse o три плюс tse o две плюс като две o две стрелки, насочени една срещу друга калций като tse o три два пъти)
При по-нататъшно предаване забелязваме, че утайката изчезва.
Соли на берилий, магнезий и алкалоземни метали се получават чрез взаимодействието им с киселини.
Калциевите соли включват калциев карбонат.Калциевият карбонат има следната формула -CaCO3 (калциев це или три)
Намира се във варовик, креда и мрамор. Мраморът се използва широко в скулптурата и архитектурата; нито едно строителство не може да се направи без варовик, защото... самият той е отличен строителен камък и се използва за производство на материали като стъкло, цимент, гасена и негасена вар. В природата кредата е останки от черупки на древни животни, може да се види в училище (училищни пастели), използва се в паста за зъби, в производството на хартия и в избелването.
Калциевият сулфат се среща естествено като минералгипс -CaSO 4 *2 з 2 ЗА (калций es o четири умножение две пепел две o).
Изпичане на гипс при 150-180С 0 получите бял прах - изгорял гипс или алабастър
CaSO4*0,5 з2O(калций es o четири умножение нула точка пет пепел две o).
Ако алабастърът се смеси с вода, той бързо се втвърдява и отново се превръща в гипс.
например,
CaSO4*0,5 з2О +1,5з2O =CaSO4* 2 з2O
(калций es o четири умножете нула точка пет пепел две o плюс една точка пет пепел две o е равно на калций es o четири умножете две пепел две o)
Калциевият сулфат се използва широко в строителството за производство на скулптури и скулптурни елементи, за облицовъчни и довършителни работи, а в медицината за производство на гипсови отливки.
Свойства на елементи от II А група.
|
Свойства |
4Be |
12 мг |
20Ca |
38Sr |
56Ba |
88Ra |
|
9,012 |
24,305 |
40,80 |
87,62 |
137,34 |
226,025 |
|
|
Електронна конфигурация* |
||||||
|
0,113 |
0,160 |
0,190 |
0,213 |
0,225 |
0,235 |
|
|
0,034 |
0,078 |
0,106 |
0,127 |
0,133 |
0,144 |
|
|
Йонизационна енергия |
9,32 |
7,644 |
6,111 |
5,692 |
5,21 |
5,28 |
|
Относително електро- |
1,5 |
1,2 |
1,0 |
1,0 |
0,9 |
0,9 |
|
Възможни степени на окисление |
||||||
|
Кларк, при.% (разпространени |
1*10 -3 |
1,4 |
1,5 |
8*10 -3 |
5*10 -3 |
8*10 -12 |
|
(Е.). |
СОЛИДНИ НЕЩА |
|||||
|
Цвят |
сиво- |
сребро- |
С Е Р Е Б Р И С Т О - БЯЛО |
|||
|
1283 |
649,5 |
850 |
770 |
710 |
700 |
|
|
2970 |
1120 |
1487 |
1367 |
1637 |
1140 |
|
|
Плътност |
1,86 |
1,741 |
1,540 |
2,67 |
3,67 |
|
|
Стандартен електроден потенциал |
1,73 |
2,34 |
2,83 |
2,87 |
2,92 |
|
*Конфигурации на външни електронни нивелириатоми на съответните елементи. Конфигурациите на останалите електронни нива съвпадат с тези за благородни газове, завършващ предходния период и посочен в скоби.
Както следва от данните, дадени в таблицата, елементите от група IIA имат ниски (но все още не най-ниските: сравнете с група IA) стойности на йонизационна енергия и относителна електроотрицателност, като тези стойности намаляват от Be до Ba, което ни позволява да заключим, че тези елементи са типични редуциращи метали и Ba е по-активен от Be.
Be - проявява, подобно на алуминия, амфотерни свойства. Въпреки това, металните свойства на Be все още са по-изразени от неметалните. Берилият реагира, за разлика от други елементи от група IIA, с основи.
Химичните връзки в съединенията Be са предимно ковалентни, докато връзките в съединенията на всички други елементи (Mg - Ra) са йонни по природа. В същото време, както при елементите от група IA, връзките с халогени и кислород са много силни, а с водород, въглерод, азот, фосфор и сяра те лесно се хидролизират.
Физични свойства.Това са сребристо-бели метали, сравнително леки, меки (с изключение на берилий), пластични, стопими (всички с изключение на берилий) и имат добра електрическа и топлопроводимост.
Практическо приложение. Be се използва в ядрената технология като модератор и абсорбатор на неутрони. Сплавите на берилий с мед - бронз - са много устойчиви, а с никел - имат висока химическа устойчивост, поради което се използват в хирургията.
Mg, Ca - използват се като добри редуциращи агенти в металотермията.
Ca, Sr, Ba - реагират доста лесно с газове и се използват като геттери (абсорбери от въздуха) във вакуумната техника.
разписка.Тъй като са силно химически активни, алкалоземните метали не се срещат в природата в свободно състояние, те се получават чрез електролиза на халогенни стопилки или металотермия. В природата алкалоземните елементи влизат в състава на следните минерали: - берил; - фелдшпат; - бишофит - използва се в медицината и за получаване на магнезий чрез електролиза. За получаване на берилий в металургията се използват флуороберилати: .
Химични свойства.Алкалоземните метали реагират лесно с кислород, халогени, неметали, вода и киселини, особено при нагряване:
Тази реакция протича особено лесно при калций и барий, така че те се съхраняват при специални условия.
Бариевият персулфид BaS е фосфор.
Хидролизата на ацетиленидите произвежда ацетилен:
Получаване на Be и Mg съединения с водород чрез директно взаимодействие прости веществанеуспешно:няма реакция докатостава доста лесно. Получените хидриди са силни редуциращи агенти.пасивация, без реакция
Оксиди на алкалоземни метали.Оксидите на алкалоземните елементи се използват широко в строителството. Получават се чрез разлагане на соли: - CaO - негасена вар.
В поредицата от оксиди от BeO до BaOОтляво надясно разтворимостта на оксидите във вода, техните основни свойства и химична активност се увеличават, както следва: BeO - неразтворим във вода, амфотерен, MgO - слабо разтворим във вода и CaO, SrO, BaO - силно разтворим във вода с образуването на хидроксиди Me(OH) : .
Точките на топене на оксидите намаляват в серията BeO ® BaO. Точките на топене на BeO и MgO оксидите са » 2500 ° C, което им позволява да се използват като огнеупорни материали.
Хидроксиди на алкалоземни метали.В серията Be (OH) 2 ® Ba (OH) 2 радиусът на Me 2+ йони се увеличава и в резултат на това се увеличава вероятността за проявление на основните свойства на хидроксидите, тяхната разтворимост във вода: Be (OH) 2 - слабо разтворим във вода, поради своята амфотерност проявява слаби киселинни и основни свойства, а Ba (OH) 2 е силно разтворим във вода и по своята сила може да се сравни с такава силна основа като NaOH.
Амфотерността на берилиевия хидроксид може да се илюстрира със следните реакции:
Соли на алкалоземни метали. Разтворими соли Be и Ba са токсични, отровни! CaF 2- слабо разтворима сол, намираща се в природата като флуорит или флуорит и се използва в оптиката. CaCl2, MgCl2- силно разтворими във вода, те се използват в медицината и химическия синтез като десиканти. Карбонатите също се използват широко в строителството: CaCO 3H MgCO 3- доломит - използва се в строителството и за получаване на Vg и Ca. CaCO 3 -калцит, креда, мрамор, исландски шпат, MgCO 3- магнезит. Съдържанието на разтворими карбонати в природната вода определя нейната твърдост: . Сулфатите също са широко разпространени естествено срещащи се съединения на алкалоземни метали: CaSO 4H 2H 2 O- гипс - широко приложение в строителството. MgSO 4H 7H 2 O- епзомит, "английска горчива сол", BaSO 4- намира приложение при флуороскопия. Фосфати: Ca 3 (PO 4) 2- фосфорит, Ca(H2PO4)2, CaHPO4- утайка - използва се за производство на торове, Ca 5 (PO 4) 3H (OH -, F -, Cl -) -апатитът е естествен минерал Ca, NH 4 Mg (PO 4)- слабо разтворимо съединение. Известни са и други соли: Ca(NO 3) 2H 2H 2 O- норвежка селитра, Mg(ClO 4) 2- Анхидронът е много добър десикант.
Към семейството алкалоземни елементивключват калций, стронций, барий и радий. Д. И. Менделеев включва магнезия в това семейство. Алкалоземните елементи се наричат, защото техните хидроксиди, подобно на хидроксидите на алкални метали, са разтворими във вода, т.е. те са основи. „...Те се наричат земни, защото в природата се намират в състояние на съединения, които образуват неразтворима земна маса, а самите те, под формата на оксиди RO, имат земен вид“, обясни Менделеев в „Основи на Химия.”
Обща характеристика на елементи от IIа група

Металите от основната подгрупа на II група имат електронна конфигурациявъншно енергийно ниво ns² и са s-елементи.
Лесно отдава два валентни електрона и във всички съединения имат степен на окисление +2
Силни редуциращи агенти
Активността на металите и тяхната редукционна способност нараства в редица: Be–Mg–Ca–Sr–Ba
Алкалоземните метали включват само калций, стронций, барий и радий, по-рядко магнезий
Берилият е по-близо до алуминия в повечето свойства
Физични свойства на простите вещества
Алкалоземните метали (в сравнение с алкалните метали) имат по-високи температури. и точка на кипене, йонизационни потенциали, плътности и твърдост.
Химични свойства на алкалоземните метали + Be
1. Реакция с вода.
При нормални условия повърхността на Be и Mg е покрита с инертен оксиден филм, така че те са устойчиви на вода. Обратно, Ca, Sr и Ba се разтварят във вода, за да образуват основи:
Mg + 2H 2 O – t° → Mg(OH) 2 + H 2
Ca + 2H 2 O → Ca(OH) 2 + H 2
2. Реакция с кислород.
Всички метали образуват оксиди RO, бариев пероксид - BaO 2:
2Mg + O 2 → 2MgO
Ba + O 2 → BaO 2
3. Те образуват бинарни съединения с други неметали:
Be + Cl 2 → BeCl 2 (халогениди)
Ba + S → BaS (сулфиди)
3Mg + N 2 → Mg 3 N 2 (нитриди)
Ca + H 2 → CaH 2 (хидриди)
Ca + 2C → CaC 2 (карбиди)
3Ba + 2P → Ba 3 P 2 (фосфиди)
Берилият и магнезият реагират относително бавно с неметалите.
4. Всички алкалоземни метали се разтварят в киселини:
Ca + 2HCl → CaCl 2 + H 2
Mg + H 2 SO 4 (разреден) → MgSO 4 + H 2
5. Берилият се разтваря в водни разтвориалкали:
Be + 2NaOH + 2H 2 O → Na 2 + H 2
6. Летливите съединения на алкалоземните метали придават на пламъка характерен цвят:
калциевите съединения са керемидено червени, стронциевите съединения са карминово червени, а бариевите съединения са жълтеникавозелени.

 Берилият, подобно на лития, е един от s-елементите. Четвъртият електрон, който се появява в атома Be, се поставя в 2s орбитала. Енергията на йонизация на берилия е по-висока от тази на лития поради по-високия ядрен заряд. В силни основи образува берилатен йон BeO 2-2. Следователно берилият е метал, но неговите съединения са амфотерни. Берилият, въпреки че е метал, е значително по-малко електроположителен в сравнение с лития.
Берилият, подобно на лития, е един от s-елементите. Четвъртият електрон, който се появява в атома Be, се поставя в 2s орбитала. Енергията на йонизация на берилия е по-висока от тази на лития поради по-високия ядрен заряд. В силни основи образува берилатен йон BeO 2-2. Следователно берилият е метал, но неговите съединения са амфотерни. Берилият, въпреки че е метал, е значително по-малко електроположителен в сравнение с лития.
Високата йонизационна енергия на берилиевия атом е значително различна от другите елементи на подгрупата PA (магнезий и алкалоземни метали). Неговият химичен състав е до голяма степен подобен на този на алуминия (диагонално сходство). По този начин това е елемент с амфотерни качества в неговите съединения, сред които все още преобладават основните.
Електронната конфигурация на Mg: 1s 2 2s 2 2p 6 3s 2 в сравнение с натрия има една важна характеристика: дванадесетият електрон е поставен в 2s орбитала, където вече има 1e - .
Магнезиевите и калциевите йони са незаменими елементи от живота на всяка клетка. Съотношението им в организма трябва да бъде строго определено. Магнезиевите йони участват в активността на ензимите (например карбоксилаза), калциевите - в изграждането на скелета и метаболизма. Повишаването на нивата на калций подобрява усвояването на храната. Калцият стимулира и регулира работата на сърцето. Излишъкът му рязко повишава дейността на сърцето. Магнезият играе ролята на калциев антагонист. Въвеждането на Mg 2+ йони под кожата причинява анестезия без период на възбуда, парализа на мускулите, нервите и сърцето. Попадайки в раната под формата на метал, той причинява дълготрайни незарастващи гнойни процеси. Магнезиевият оксид в белите дробове причинява това, което се нарича леярска треска. Честият контакт на повърхността на кожата с неговите съединения води до дерматит. Най-широко използваните калциеви соли в медицината са CaSO 4 сулфат и CaCL 2 хлорид. Първият се използва за гипсови превръзки, а вторият се използва за венозни вливания и като вътрешно средство. Помага при подуване, възпаление, алергии, облекчава спазмите на сърдечно-съдовата система и подобрява съсирването на кръвта.
Всички бариеви съединения, с изключение на BaSO 4, са отровни. Те причиняват менегоенцефалит с увреждане на малкия мозък, увреждане на гладката сърдечна мускулатура, парализа, а в големи дози - дегенеративни промени в черния дроб. В малки дози бариевите съединения стимулират активността на костния мозък.
Когато стронциевите съединения се въвеждат в стомаха, се появява стомашно разстройство, парализа и повръщане; симптомите на лезиите са подобни на лезиите от бариеви соли, но стронциевите соли са по-малко токсични. Особено безпокойство е появата в тялото на радиоактивния изотоп на стронций 90 Sr. Изключително бавно се отделя от организма, а неговата дълъг периодполуживотът и следователно продължителността на действие може да причини лъчева болест.
Радият е опасен за тялото поради своята радиация и огромен полуживот (T 1/2 = 1617 години). Първоначално, след откриването и производството на радиеви соли в повече или по-малко чиста форма, той започна да се използва доста широко за флуороскопия, лечение на тумори и някои сериозни заболявания. Сега, с появата на други по-достъпни и по-евтини материали, използването на радий в медицината на практика е преустановено. В някои случаи се използва за производство на радон и като добавка към минерални торове.
В калциевия атом запълването на 4s орбитала е завършено. Заедно с калий образува двойка s-елементи от четвъртия период. Калциевият хидроксид е доста силна основа. Калцият, най-малко активният от всички алкалоземни метали, има йонна връзка в своите съединения.
По своите характеристики стронцийът заема междинна позиция между калций и барий.
Свойствата на бария са най-близки до свойствата на алкалните метали.
Берилият и магнезият се използват широко в сплавите. Берилиевите бронзи са еластични сплави на мед с 0,5-3% берилий; Авиационните сплави (плътност 1,8) съдържат 85-90% магнезий („електрон“). Берилият се различава от другите метали от група IIA - не реагира с водород и вода, но се разтваря в основи, тъй като образува амфотерен хидроксид:
Be+H2O+2NaOH=Na2+H2.
Магнезият реагира активно с азота:
3 Mg + N 2 = Mg 3 N 2.
Таблицата показва разтворимостта на хидроксидите на елементите от група II.
Традиционен технически проблем - твърдост на водата, свързано с наличието на Mg 2+ и Ca 2+ йони в него. От хидрокарбонати и сулфати по стените на отоплителни котли и тръби с топла водаУтаяват се магнезиеви и калциеви карбонати и калциев сулфат. Те пречат особено на работата на лабораторните дестилатори.
S-елементите в живия организъм изпълняват важна роля биологична функция. Таблицата показва тяхното съдържание.
Извънклетъчната течност съдържа 5 пъти повече натриеви йони, отколкото вътре в клетките. Изотоничен разтвор („физиологична течност“) съдържа 0,9% натриев хлорид, използва се за инжекции, промиване на рани и очи и др. Хипертоничните разтвори (3-10% натриев хлорид) се използват като лосиони при лечението на гнойни рани („ издърпване на гной). 98% от калиевите йони в тялото се намират в клетките и само 2% в извънклетъчната течност. Човек се нуждае от 2,5-5 g калий на ден. В 100 г сушени кайсии се съдържат до 2 г калий. 100 г пържени картофи съдържат до 0,5 г калий. АТФ и АДФ участват във вътреклетъчните ензимни реакции под формата на магнезиеви комплекси.
Всеки ден човек се нуждае от 300-400 mg магнезий. Постъпва в организма с хляб (90 mg магнезий на 100 g хляб), зърнени храни (100 g овесени ядки съдържат до 115 mg магнезий) и ядки (до 230 mg магнезий на 100 g ядки). В допълнение към изграждането на костите и зъбите на базата на хидроксилапатит Ca 10 (PO 4) 6 (OH) 2, калциевите катиони участват активно в съсирването на кръвта, предаването на нервни импулси и мускулната контракция. Един възрастен трябва да приема около 1 g калций на ден. 100 г твърдо сирене съдържа 750 мг калций; 100 г мляко – 120 мг калций; в 100 г зеле – до 50 мг.

Изпращането на вашата добра работа в базата знания е лесно. Използвайте формата по-долу
Студенти, докторанти, млади учени, които използват базата от знания в обучението и работата си, ще ви бъдат много благодарни.
Все още няма HTML версия на произведението.
Можете да изтеглите архива на работата, като кликнете върху връзката по-долу.
Подобни документи
Обща характеристика на групата. Берилий и магнезий. История, разпространение, получаване, характеристики, физически свойства, използването на алкалоземни метали. Химични свойства на алкалоземните метали и техните съединения.
резюме, добавено на 30.05.2003 г
Метали. Методи за получаване на метали. Химични свойства на металите. Характеристики на металите от основната подгрупа на I група. Характеристика на елементите от главната подгрупа на II група. Характеристика на елементите на главната подгрупа III група. Алуминий. Преходни метали
резюме, добавено на 18.05.2006 г
Съединения на магнезий, калций и барий като лекарства. Промени в групата радиуси на атоми и йони, йонизационен потенциал. Качествени реакцииза йони на магнезий, калций, стронций. Биологична роля на магнезия и калция, значение за организма.
резюме, добавено на 14.04.2015 г
Историята на откриването на елементите, тяхното разпространение в природата. Промени в групата от стойности на радиусите на атомите и йоните. Сравнение на свойствата на прости вещества от група IIA. Антагонизъм на магнезий и калций, техните биологична роляв тялото. Токсичност на берилий и барий.
резюме, добавено на 30.11.2011 г
Физиологичната роля на берилия в човешкото тяло, неговите синергисти и антагонисти. Ролята на магнезия в човешкото тяло за осигуряване на протичането на различни жизнени процеси. Неутрализиране на излишната киселинност на организма. Стойността на стронция за хората.
резюме, добавено на 05/09/2014
Взаимодействие на литий, натрий, калий с вода. Изследване на физичните и химичните свойства на двойната кислородни съединения. Най-важните съединения на алкалоземните метали. Редокс свойства на пероксидите. Приложение на органометалните съединения.
презентация, добавена на 07.08.2015 г
Магнезият като елемент от основната подгрупа на втората група, третият период с атомен номер 12, неговите основни физически и химични свойства, структура на атома. Разпространение на магнезий, съединения и техните сфери практическо приложение. Клетъчна регенерация.