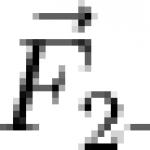Как да използваме периодичната таблица? За непосветен човек четенето на периодичната таблица е същото като за гном, който гледа древните руни на елфите. А периодичната таблица може да ви каже много за света.
Освен че ви служи добре на изпита, той е просто незаменим при решаването на огромен брой химични и физични проблеми. Но как да го разчетем? За щастие днес всеки може да научи това изкуство. В тази статия ще ви кажем как да разберете периодичната таблица.
Периодична таблица химически елементи(периодична таблица) е класификация на химичните елементи, която установява зависимостта на различни свойства на елементите от заряда на атомното ядро.
История на създаването на таблицата
Дмитрий Иванович Менделеев не е бил обикновен химик, ако някой мисли така. Бил е химик, физик, геолог, метролог, еколог, икономист, нефтен работник, аеронавт, производител на инструменти и учител. По време на живота си ученият успя да проведе много фундаментални изследвания в повечето случаи различни областизнания. Например, широко разпространено е мнението, че именно Менделеев е изчислил идеалната сила на водката - 40 градуса.
Не знаем какво е отношението на Менделеев към водката, но знаем със сигурност, че дисертацията му на тема „Беседа за комбинацията на алкохол с вода“ няма нищо общо с водката и разглежда концентрации на алкохол от 70 градуса. С всички заслуги на учения, откриването на периодичния закон на химичните елементи - един от основните закони на природата, му донесе най-широка слава.

Има легенда, според която учен сънувал периодичната таблица, след което трябвало само да усъвършенства появилата се идея. Но ако всичко беше толкова просто.. Тази версия за създаването на периодичната таблица, очевидно, не е нищо повече от легенда. На въпрос как е отворена масата, самият Дмитрий Иванович отговори: „ Мислех за това от може би двадесет години, но вие си мислите: седях там и изведнъж... свърши.“
В средата на деветнадесети век опитите за подреждане на известните химични елементи (известни са 63 елемента) са предприети паралелно от няколко учени. Например през 1862 г. Александър Емил Шанкуртоа поставя елементи по спирала и отбелязва цикличното повторение на химичните свойства.
Химикът и музикант Джон Александър Нюландс предложи своята версия на периодичната таблица през 1866 г. Интересен факт е, че ученият се е опитал да открие някаква мистична музикална хармония в подредбата на елементите. Сред другите опити имаше и опитът на Менделеев, който се увенча с успех.

През 1869 г. е публикувана първата таблична диаграма, а 1 март 1869 г. се счита за деня, в който е открит периодичният закон. Същността на откритието на Менделеев е, че свойствата на елементите с нарастваща атомна маса не се променят монотонно, а периодично.
Първата версия на таблицата съдържаше само 63 елемента, но Менделеев предприе редица много нестандартни решения. И така, той се досети да остави място в таблицата за все още неоткрити елементи и също се промени атомни масинякои елементи. Фундаменталната правилност на закона, извлечен от Менделеев, се потвърждава много скоро, след откриването на галий, скандий и германий, чието съществуване е предсказано от учения.
Модерен изглед на периодичната таблица
По-долу е самата таблица

Днес, вместо атомно тегло (атомна маса), концепцията за атомно число (броят на протоните в ядрото) се използва за подреждане на елементите. Таблицата съдържа 120 елемента, които са подредени отляво надясно по ред на нарастване на атомния номер (брой протони)
Колоните на таблицата представляват така наречените групи, а редовете представляват периоди. Таблицата има 18 групи и 8 периода.
- Металните свойства на елементите намаляват, когато се движат по период отляво надясно и навътре обратна посока– увеличение.
- Размерите на атомите намаляват при движение отляво надясно по периоди.
- Докато се движите отгоре надолу през групата, свойствата на редуциращия метал се увеличават.
- Окислително и неметални свойствапри движение по периода отляво надясно те се увеличават.
Какво научаваме за даден елемент от таблицата? Например, нека вземем третия елемент в таблицата - литий, и да го разгледаме подробно.

На първо място виждаме самия символ на елемента и името му под него. В горния ляв ъгъл е атомният номер на елемента, в който ред е подреден елементът в таблицата. Атомното число, както вече беше споменато, равно на числотопротони в ядрото. Броят на положителните протони обикновено е равен на броя на отрицателните електрони в атома (с изключение на изотопите).
Атомната маса е посочена под атомния номер (в тази версия на таблицата). Ако закръглим атомната маса до най-близкото цяло число, получаваме това, което се нарича масово число. Разликата между масовото число и атомното число дава броя на неутроните в ядрото. По този начин броят на неутроните в ядрото на хелия е два, а в литиевото е четири.
Нашият курс “Периодична таблица за манекени” приключи. В заключение ви каним да гледате тематично видео и се надяваме, че въпросът как да използвате периодичната таблица на Менделеев е станал по-ясен за вас. Напомняме ви, че винаги е по-ефективно да изучавате нов предмет не сам, а с помощта на опитен наставник. Ето защо никога не трябва да забравяте за, който с радост ще сподели своите знания и опит с вас.
ПЕРИОДИЧНА СИСТЕМА НА ХИМИЧНИТЕ ЕЛЕМЕНТИ
Графично представяне на периодичния закон е периодичната таблица. Съдържа 7 периода и 8 групи.
Кратка форма на таблица D.I. Менделеев.
Полу-дълъг вариант на маса D.I. Менделеев.
Има и дълга версия на таблицата, тя е подобна на полудългата, но само лантанидите и актинидите не са извадени от таблицата.
Оригинална таблица на Д. И. Менделеев
1. Точка – химични елементи, подредени в една линия (1 – 7)
малък (1, 2, 3) – състоят се от един ред елементи
Голям (4, 5, 6, 7) – състоят се от два реда – четен и нечетен
Периодите могат да се състоят от 2 (първи), 8 (втори и трети), 18 (четвърти и пети) или 32 (шести) елемента. Последният, седми период е незавършен.
Всички периоди (с изключение на първия) започват с алкален метал и завършват с благороден газ.
Във всички периоди с увеличаване на относителните атомни маси на елементите се наблюдава увеличаване на неметалните свойства и отслабване на металните свойства. В големи периоди преходът на свойствата от активен метал към благороден газ става по-бавно (през 18 и 32 елемента), отколкото в кратки периоди (през 8 елемента). Освен това, в кратки периоди, отляво надясно, валентността в съединенията с кислород се увеличава от 1 до 7 (например от Na до Cl ). В големи периоди валентността първоначално се увеличава от 1 до 8 (например в петия период от рубидий до рутений), след това настъпва рязък скок и валентността намалява до 1 за среброто, след което отново се увеличава.
2. Групи - вертикални колони от елементи с еднакъв брой валентни електрони, равен на номера на групата. Има основни (А) и вторични подгрупи (В).
Основни подгрупи се състоят от елементи на малки и големи периоди.
Странични подгрупи се състоят от елементи само на големи периоди.
В основните подгрупи, отгоре надолу, металните свойства се увеличават, а неметалните свойства отслабват. Елементите на основната и вторичната група се различават значително по свойства.
Номерът на групата показва най-високата валентност на елемента (с изключение на N,О, Е).
Формулите на висшите оксиди (и техните хидрати) са общи за елементите от главните и вторичните подгрупи. Във висшите оксиди и техните хидрати на елементите I - III групи (с изключение на бор) основните свойства преобладават, с IV до VIII - кисели.
|
Група |
III |
VII |
VIII (с изключение на инертни газове) |
|||||
|
Висш оксид |
Е 2 О |
EO |
E 2 O 3 |
EO 2 |
E 2 O 5 |
EO 3 |
E 2 O 7 |
EO 4 |
|
Висш оксиден хидрат |
EON |
E(OH) 2 |
E(OH) 3 |
N 2 EO 3 |
N 3 EO 4 |
N 2 EO 4 |
НЕО 4 |
N 4 EO 4 |
Елементите от основните подгрупи имат общи формули за водородни съединения. Елементи на главните подгрупи I - III формират групи твърди вещества- хидриди (водород в степен на окисление - 1) и IV - VII групи – газообразни. Водородни съединения на елементи от основните подгрупи IV групи (EN 4) - неутрални, V групи (EN 3) - бази, VI и VII групи (H 2 E и NE) - киселини.
Периодичната таблица е една от най-големите откритиячовечеството, което направи възможно организирането на знания за света около нас и откриването нови химични елементи. Необходим е за ученици, както и за всички, които се интересуват от химия. В допълнение, тази схема е незаменима в други области на науката.
Тази диаграма съдържа всичко познати на човекаелементи и те са групирани в зависимост от атомна маса и атомен номер. Тези характеристики влияят върху свойствата на елементите. В кратката версия на таблицата има общо 8 групи; елементите, включени в една група, имат много сходни свойства. Първата група включва водород, литий, калий, мед, чието латинско произношение на руски е cuprum. А също и аргентум - сребро, цезий, злато - аурум и франций. Втората група съдържа берилий, магнезий, калций, цинк, следвани от стронций, кадмий, барий и групата завършва с живак и радий.
Третата група включва бор, алуминий, скандий, галий, следвани от итрий, индий, лантан и групата завършва с талий и актиний. Четвъртата група започва с въглерод, силиций, титан, продължава с германий, цирконий, калай и завършва с хафний, олово и ръдърфордий. Петата група съдържа елементи като азот, фосфор, ванадий, по-долу са арсен, ниобий, антимон, след това идва тантал, бисмут и допълва групата с дубний. Шестият започва с кислород, следван от сяра, хром, селен, след това молибден, телур, след това волфрам, полоний и сиборгий.
В седмата група първият елемент е флуор, последван от хлор, манган, бром, технеций, следван от йод, след това рений, астат и бор. Последната група е най-многобройните. Той включва газове като хелий, неон, аргон, криптон, ксенон и радон. Тази група включва още метали желязо, кобалт, никел, родий, паладий, рутений, осмий, иридий и платина. Следват hannium и meitnerium. Елементите, които образуват актинидни серии и лантанидни серии. Те имат подобни свойства на лантана и актиния.

Тази схема включва всички видове елементи, които са разделени на 2 големи групи - метали и неметали, имащи различни свойства. Как да определите дали даден елемент принадлежи към една или друга група, ще бъде подпомогнато от конвенционална линия, която трябва да бъде начертана от бор до астат. Трябва да се помни, че такава линия може да бъде начертана само навътре пълна версиямаси. Всички елементи, които са над тази линия и са разположени в основните подгрупи, се считат за неметали. А тези отдолу, в основните подгрупи, са метали. Металите също са вещества, открити в странични подгрупи. Има специални снимки и снимки, където можете да се запознаете подробно с позицията на тези елементи. Струва си да се отбележи, че тези елементи, които са на тази линия, показват същите свойства както на металите, така и на неметалите.
Отделен списък е съставен от амфотерни елементи, които имат двойни свойства и могат да образуват 2 вида съединения в резултат на реакции. В същото време те проявяват както основни, така и киселинни свойства . Преобладаването на определени свойства зависи от условията на реакцията и веществата, с които амфотерен елементреагира.

Струва си да се отбележи, че тази схема, в традиционния си дизайн с добро качество, е цветна. В същото време, за по-лесно ориентиране, те са посочени в различни цветове. главни и второстепенни подгрупи. Елементите също се групират в зависимост от сходството на техните свойства.
Въпреки това, в наши дни, заедно с цветовата схема, черно-бялата периодична таблица на Менделеев е много разпространена. Този тип се използва за черно-бял печат. Въпреки привидната си сложност, работата с него е също толкова удобна, ако вземете предвид някои от нюансите. И така, разграничете основна подгрупаВ този случай той може да бъде разграничен от вторичен чрез разлики в нюансите, които са ясно забележими. Освен това в цветната версия са посочени елементи с наличие на електрони на различни слоеве различни цветове.
Струва си да се отбележи, че в едноцветен дизайн не е много трудно да се ориентирате в схемата. За целта ще бъде достатъчна информацията, посочена във всяка отделна клетка на елемента.

Единният държавен изпит днес е основният вид тест в края на училището, което означава, че трябва да се обърне специално внимание на подготовката за него. Ето защо при избора финален изпит по химия, трябва да обърнете внимание на материали, които могат да ви помогнат да го преминете. По правило на учениците е разрешено да използват някои таблици по време на изпита, по-специално периодичната таблица в добро качество. Следователно, за да донесе само ползи по време на тестването, трябва предварително да се обърне внимание на неговата структура и изследване на свойствата на елементите, както и тяхната последователност. Вие също трябва да се научите използвайте черно-бялата версия на таблицатаза да не срещнете някои затруднения на изпита.

В допълнение към основната таблица, характеризираща свойствата на елементите и тяхната зависимост от атомната маса, има и други диаграми, които могат да помогнат при изучаването на химията. Например, има таблици за разтворимост и електроотрицателност на веществата. Първият може да се използва, за да се определи доколко дадено съединение е разтворимо във вода при нормална температура. В този случай анионите са разположени хоризонтално - отрицателно заредени йони, а катионите - тоест положително заредени йони - са разположени вертикално. За да разберете степен на разтворимостна едно или друго съединение е необходимо да се намерят неговите компоненти с помощта на таблицата. И на мястото на тяхното пресичане ще има необходимото обозначение.
Ако това е буквата "r", тогава веществото е напълно разтворимо във вода в нормални условия. Ако присъства буквата „m“, веществото е слабо разтворимо, а ако присъства буквата „n“, то е почти неразтворимо. Ако има знак „+“, съединението не образува утайка и реагира с разтворителя без остатък. Ако има знак "-", това означава, че такова вещество не съществува. Понякога можете да видите и знака „?“ в таблицата, тогава това означава, че степента на разтворимост на това съединение не е известна със сигурност. Електроотрицателност на елементитеможе да варира от 1 до 8; има и специална таблица за определяне на този параметър.
 Друга полезна таблица е серията метални дейности. Всички метали са разположени в него според нарастващите степени на електрохимичен потенциал. Поредицата от метални напрежения започва с литий и завършва със злато. Смята се, че колкото по-наляво един метал заема място в даден ред, толкова по-активен е в химически реакции. по този начин най-много активен метал
Литият се счита за алкален метал. Списъкът с елементи също съдържа водород към края. Смята се, че металите, разположени след него, са практически неактивни. Те включват елементи като мед, живак, сребро, платина и злато.
Друга полезна таблица е серията метални дейности. Всички метали са разположени в него според нарастващите степени на електрохимичен потенциал. Поредицата от метални напрежения започва с литий и завършва със злато. Смята се, че колкото по-наляво един метал заема място в даден ред, толкова по-активен е в химически реакции. по този начин най-много активен метал
Литият се счита за алкален метал. Списъкът с елементи също съдържа водород към края. Смята се, че металите, разположени след него, са практически неактивни. Те включват елементи като мед, живак, сребро, платина и злато.
Снимки на периодичната таблица с добро качество
Тази схема е едно от най-големите постижения в областта на химията. В същото време има много видове тази маса– къс вариант, дълъг, както и екстра-дълъг. Най-разпространена е късата таблица, но дългата версия на диаграмата също е често срещана. Струва си да се отбележи, че късата версия на веригата в момента не се препоръчва за използване от IUPAC.
Общо имаше Разработени са повече от сто вида маси, различаващи се по представяне, форма и графично представяне. Те се използват в различни области на науката или изобщо не се използват. Понастоящем изследователите продължават да разработват нови конфигурации на вериги. Основният вариант е къса или дълга верига с отлично качество.
Химията е увлекателна, но трудна тема. И ако училището все още не разполагаше с пособия за провеждане на експерименти, тогава можем да кажем, че то напълно премина. Но има нещо, което всеки човек трябва поне минимално да разбере. Това е периодичната таблица.
За учениците ученето е истинско мъчение. Ако я видят в сънища, тогава само кошмарни. Има толкова много елементи, всеки със своя номер... Но една многодетна майка измисли забавен начин за как да научите периодичната таблица. Подходящ е както за деца, така и за възрастни, а реакцията с радост ще ви разкаже за това „Толкова просто!“.

Периодична таблица на химичните елементи
Както показва майката на четири деца Карин Трип, с правилния подход е възможно да се научи всичко. За да се присъедините изучаване на химиядори малки деца, тя реши да се обърне периодична таблицаелементи в полето за морска битка.

Играта съдържа четири страници с периодичната таблица - по две за всеки играч. Всеки играч трябва да нарисува своите кораби на една маса, а на другата да маркира своите удари и повредените кораби на врага с точки.

Правилата на морския бой са същите като в класическата игра. Само за да свалите лодката на противника, трябва да посочите не буква с цифра, а съответния химичен елемент.

Тази техника ще позволи на децата не само да научат имената на химичните елементи. Насърчава развитието на паметта и логическо мислене. В крайна сметка децата ще анализират серийни номера и цветове.

За да улесните децата да намерят правилния елемент в началото, редовете и колоните трябва да бъдат номерирани. Но, според Карин, децата й, само след няколко дни игра на „химическа морска битка“, започнаха да разбират перфектно периодичната таблица. Те дори знаеха атомните маси и серийните номера на елементите.

С течение на времето правилата на играта могат да станат по-сложни. Например, поставяне на кораб само в едно семейство химически елементи.

Дори осемгодишната дъщеря на изобретателна майка, която все още не е учила химия в училище, обича да играе тази игра. А за възрастни това е чудесен начин да се забавляват.

Всички страници от периодичната таблица за игра на морска битка могат да бъдат отпечатани на обикновен или цветен принтер и използвани неограничен брой пъти.