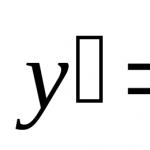Молекулярно-кинетична теория (MKT)е клон на физиката, който изучава свойствата на различни състояния на материята, въз основа на идеята за съществуването на молекули и атоми като най-малките частици на материята. MCT се основава на три основни точки:
1
. Всички вещества са изградени от малки частици: молекули, атоми или йони.
2
. Тези частици са в непрекъснато хаотично движение, чиято скорост определя температурата на веществото.
3
. Между частиците съществуват сили на привличане и отблъскване, чиято природа зависи от разстоянието между тях, т.е. частиците взаимодействат една с друга.
Основните положения на ИКТ се потвърждават от много експериментални факти.
Съществуването на молекули, атоми и йони е доказано експериментално; молекулите са достатъчно проучени и фотографирани с помощта на електронни микроскопи.
Способността на газовете да се разширяват неограничено и да заемат целия предоставен им обем се обяснява с непрекъснатото хаотично движение на молекулите.
Еластичността на газовете, твърдите тела и течностите, способността на течностите да намокрят някои твърди тела, процесите на оцветяване, слепване, запазване на формата от твърдите тела и много други показват съществуването на сили на привличане и отблъскване между молекулите.
Феномен дифузия- способността на молекулите на едно вещество да проникват в пространствата между молекулите на друго - също потвърждава основните разпоредби на MCT. Феноменът на дифузията обяснява, например, разпространението на миризми, смесването на различни течности и процеса на разтваряне твърди веществав течности, заваряване на метали чрез разтопяване или чрез натиск. Потвърждение за непрекъснатото хаотично движение на молекулите също е Брауново движение- непрекъснато хаотично движение на микроскопични частици, неразтворими в течност. Движението на брауновите частици се обяснява с хаотичното движение на течни частици, които се сблъскват с микроскопични частици и ги привеждат в движение. Опитен начинДоказано е, че скоростта на брауновите частици зависи от температурата на течността. Теорията за брауновото движение е разработена от А. Айнщайн.
Всяко вещество се състои от частици, така че количеството вещество ν се счита за пропорционална на броя на частиците, съдържащи се в тялото. Единицата за количество на веществото е молът. Съотношението на броя на молекулите на веществото към количеството вещество се нарича Константата на Авогадро: , N A =6,02∙10 23 mol -1.
Константата на Авогадро показва колко атома и молекули се съдържат в един мол вещество.
Моларна маса
- масата на един мол вещество, равна на отношението на масата на веществото към количеството на веществото: . Моларната маса се изразява в kg/mol. Познавайки моларната маса, можете да изчислите масата на една молекула: ![]() .
.
Масите на молекулите са много малки, например масата на водната молекула: m=29,9∙10 -27 кг, следователно е удобно да се използват относителни, а не абсолютни стойности на масата. Относителни атомни маси на всички химически елементипосочени в периодичната таблица. Използвайки физични методи, беше възможно да се определят масите на някои атоми в абсолютни единици. Ето как се появи единицата за атомна маса (a.m.u.), равна на 1/12 от масата на въглеродните атоми: 1 аму =1,66∙10 -2 7 .
Моларната маса е свързана с относителната молекулна маса г-н. Относително молекулно тегло- това е стойност, равна на съотношението на масата на молекула от дадено вещество към 1/12 от масата на въглероден атом. Ако е известно химична формулавещество, тогава неговата относителна маса може да се определи с помощта на периодичната таблица.
03.02.2015
Урок 39 (10. клас)
Предмет. Основни принципи на MCT структурата на материята и нейното експериментално обосноваване
1. Цели на курса Молекулярна физикаи МКТ; макро- и микротела
Първо, нека си спомним всички предишни раздели на физиката, които изучавахме, и разберем, че през цялото това време разглеждахме процесите, протичащи с макроскопични тела (или обекти на макрокосмоса). Сега ще проучим тяхната структура и процесите, протичащи в тях.
Определение. Макроскопично тяло- тяло, състоящо се от голямо числочастици. Например: кола, човек, планета, билярдна топка...
Микроскопично тяло -тяло, състоящо се от една или повече частици. Например: атом, молекула, електрон... (фиг. 1)

Ориз. 1. Примери съответно за микро- и макрообекти
След като по този начин определихме предмета на изучаване на курса MCT, сега трябва да говорим за основните цели, които курсът MCT си поставя, а именно:
1. Изследване на процеси, протичащи вътре в макроскопично тяло (движение и взаимодействие на частици)
2. Свойства на телата (плътност, маса, налягане (за газове)…)
3. Изследване на топлинни явления (нагряване-охлаждане, промени агрегатни състояниятяло)
Проучването на тези въпроси, което ще се проведе в цялата тема, сега ще започне с факта, че ще формулираме така наречените основни положения на ИКТ, тоест някои твърдения, чиято истина отдавна е извън съмнение, и, започвайки от което ще бъде изграден целият по-нататъшен курс.
Нека ги разгледаме един по един:
2. Първото основно положение на ИКТ; молекули, атоми
Всички вещества се състоят от голям брой частици - молекули и атоми.
Определение. атом- най-малката частица от химичен елемент. Размерите на атомите (техният диаметър) са от порядъка на см. Струва си да се отбележи, че за разлика от молекулите има относително малко различни видове атоми. Всички техни разновидности, които в момента са известни на човека, са събрани в така наречената периодична таблица (виж фиг. 2)

Ориз. 2. Периодичната таблицахимични елементи (по същество разновидности на атоми) Д. И. Менделеев
Молекула– структурна единица на материята, състояща се от атоми. За разлика от атомите, те са по-големи и по-тежки и най-важното е, че имат огромно разнообразие.
Нарича се вещество, чиито молекули се състоят от един атом атомен, от Повече ▼ – молекулярно. Например: кислород, вода, готварска сол () – молекулярни; хелий сребро (He, Ag) – атом. 
Освен това трябва да се разбере, че свойствата на макроскопичните тела ще зависят не само от количествени характеристикитехния микроскопичен състав, но и върху тяхното качество.
Ако в структурата на атомите дадено вещество има определена геометрия ( кристална решетка ), или, напротив, не, тогава тези тела ще имат различни свойства. Например аморфните тела нямат строга точка на топене. Повечето известен пример– аморфен графит и кристален диамант. И двете вещества са изградени от въглеродни атоми.


Ориз. 3. Графит и съответно диамант
Така „от колко, в кои относителна позицияи от какви атоми и молекули се състои веществото?“ - първият въпрос, отговорът на който ще ни доближи до разбирането на свойствата на телата.
3. Втората основна разпоредба на ИКТ
Всички частици са в непрекъснато топлинно хаотично движение.
Точно както в примерите, разгледани по-горе, важно е да се разберат не само количествените аспекти на това движение, но и качествените за различни вещества.
Молекулите и атомите на твърдите тела претърпяват само леки вибрации спрямо постоянното им положение; течност - също вибрират, но поради големия размер на междумолекулното пространство понякога сменят местата си един с друг; Частиците газ от своя страна се движат свободно в пространството, без практически да се сблъскват.
4. Третата основна разпоредба на ИКТ
Частиците взаимодействат една с друга.
Това взаимодействие е електромагнитно по природа (взаимодействие между ядрата и електроните на атома) и действа в двете посоки (както привличане, така и отблъскване).
Тук: д– разстояние между частиците; а– размер на частиците (диаметър).

За първи път беше въведено понятието "атом". древногръцки философи естественият учен Демокрит (фиг. 4). В по-късен период руският учен Ломоносов активно се чуди за структурата на микросвета (фиг. 5).


Ориз. 4. Демокрит Фиг. 5. Ломоносов
5. Различни варианти за обосновка на разпоредбите на ILC
Като начало, нека си припомним основните разпоредби на ИКТ, а именно:
1. Всички тела се състоят от малки частици - молекули и атоми,
2. Тези частици са в постоянно хаотично движение,
3. Тези частици непрекъснато взаимодействат една с друга.
И така, как можем да получим експериментално потвърждение на тези твърдения? Всъщност всеки човек без изключение е запознат с един от методите. Това е дифузия или смесване, казано с прости думи.
Определение. дифузия– процес на взаимно проникване на молекули на едно вещество в пространството между молекулите на друго (фиг. 6).

Ориз. 6. Процесът на дифузия в газовете
Дифузия може да възникне в газове (можем да наблюдаваме този процес, като усетим разпространението на миризми), в течности (смесване на оцветена вода с различни цветове) и дори в твърди вещества (ако много гладки листове стъкло или метал се поставят един върху друг за дълго време е невъзможно да се различи къде свършва един лист и къде започва друг). Освен това има и смесена дифузия, тоест проникване на газови молекули в твърди и течни тела (в противен случай рибите във водата не биха могли да дишат) и т.н. (фиг. 7)


Ориз. 7. Различни примери за дифузия
Наистина, ако приемем, че материята е някаква непрекъсната структура, става напълно неясно как да обясним всички гореспоменати явления.
Въпреки това, основният аргумент при обяснението на основните положения на MKT е Брауновото движение.
6. Описание на експеримента на Браун
Определение. Брауново движение – непрекъснато топлинно хаотично движение на молекулите на материята (фиг. 8).
Този термин се използва, след като през 1827 г. шотландският ботаник Робърт Браун, смесвайки прашеца на плувците с вода и изследвайки капка от сместа под микроскоп, наблюдава гореспоменатото движение.

Ориз. 8. Траектория на частиците по време на Брауново движение
7. Обяснение на опита на Браун
Но тъй като Браун можеше да изследва поленовите частици само през микроскоп, той тълкува откритието си неправилно (мислеше, че прашецът е жив). Брауновото движение може да се обясни само въз основа на молекулярно-кинетична теория.
Причината за брауновото движение на частица е, че ударите на течните молекули върху частицата не се компенсират взаимно.
Фигура 8.4 схематично показва позицията на една браунова частица и най-близките до нея молекули. Когато молекулите се движат произволно, импулсите, които предават на Браунова частица, например наляво и надясно, не са еднакви. Следователно резултантната сила на натиск на течните молекули върху браунова частица е различна от нула. Тази сила предизвиква промяна в движението на частицата.
 Ориз. 9. Браунова поленова частица във вода
Ориз. 9. Браунова поленова частица във вода
Средното налягане има определена стойност както в газ, така и в течност. Но винаги има малки случайни отклонения от тази средна стойност. Колкото по-малка е повърхността на тялото, толкова по-забележими са относителните промени в силата на натиск, действаща върху тази област. Така например, ако зоната има размер от порядъка на няколко диаметъра на молекулата, тогава силата на натиск, действаща върху нея, се променя рязко от нула до определена стойност, когато молекулата удари тази област.
Изграждането на теорията за Брауновото движение и нейното експериментално потвърждение от френския физик Ж. Перин окончателно завърши победата на молекулярно-кинетичната теория. Почти век по-късно немският физик Алберт Айнщайн (1879-1955) осъзнава, че голяма частица цветен прашец просто се избутва от много по-малки водни молекули, които самите вече се движат хаотично (фиг. 9).
Подобни наблюдения могат да бъдат направени по много други начини: капнете боя във вода и погледнете сместа под микроскоп, наблюдавайте отделна прашинка, която се движи във вашия апартамент...
8. Доказателство на основните положения
По този начин наличието на брауново движение напълно потвърждава въведените разпоредби на MKT. Самият факт на движение на полените ги потвърждава. Тъй като прашецът се движи, това означава, че върху него действат сили. Единствената възможна причина за възникването на тези сили е сблъсък на някакви малки тела. Следователно вече не е възможно да се поставят под съмнение първите две разпоредби. И тъй като поленовата частица променя посоката си, това означава, че в различни моменти броят на ударите върху прашеца от определена страна е различен, което означава, че няма съмнение, че водните молекули взаимодействат помежду си.
Брауновото движение е топлинно движение и то не може да спре. С повишаване на температурата интензивността му се увеличава. Фигура 8.3 показва диаграма на движението на брауновите частици. Позициите на частиците, отбелязани с точки, се определят на равни интервали от 30 s. Тези точки са свързани с прави линии. В действителност траекторията на частиците е много по-сложна.
Брауново движение може да се наблюдава и в газа. Причинява се от частици прах или дим във въздуха. Немският физик Р. Пол (1884-1976) колоритно описва Брауновото движение: „Малко явления са способни да пленят наблюдателя толкова, колкото Брауновото движение. Тук на наблюдателя е позволено да погледне зад кулисите

какво се случва в природата. Пред него се разкрива нов свят - непрекъсната суета от огромен брой частици. Най-малките частици бързо летят през зрителното поле на микроскопа, като почти моментално променят посоката на движение. По-големите частици се движат по-бавно, но също така постоянно променят посоката на движение. Големите частици практически се смачкват на място. Техните издатини ясно показват въртенето на частиците около оста си, което постоянно променя посоката си в пространството. Никъде няма следа от система или ред. Доминирането на сляпата случайност – това е силното, непреодолимо впечатление, което тази картина прави на наблюдателя.” В момента концепцията Брауново движениеизползвани в повече в широк смисъл. Например Брауновото движение е вибрацията на стрелките на чувствителните измервателни уреди, която възниква поради топлинното движение на атомите на частите на инструмента и околната среда.
Експериментите на Перин.Идеята на експериментите на Перин е следната.
Известно е, че концентрацията на газови молекули в атмосферата намалява с надморската височина. Ако нямаше топлинно движение, тогава всички молекули щяха да паднат на Земята и атмосферата щеше да изчезне. Но ако нямаше привличане към Земята, тогава поради топлинно движение молекулите биха напуснали Земята, тъй като газът е способен на неограничено разширяване. В резултат на действието на тези противоположни фактори се установява определено разпределение на молекулите по височина, както беше споменато по-горе, т.е. концентрацията на молекулите намалява доста бързо с височината. Освен това, колкото по-голяма е масата на молекулите, толкова по-бързо тяхната концентрация намалява с височината.
Брауновите частици участват в топлинно движение. Тъй като тяхното взаимодействие е пренебрежимо малко, събирането на тези частици в газ или течност може да се разглежда като идеален газ от много тежки молекули. Следователно концентрацията на брауновите частици в газ или течност в гравитационното поле на Земята трябва да намалява по същия закон като концентрацията на газовите молекули. Този закон е известен.
Перин, използвайки микроскоп с голямо увеличение и малка дълбочина на полето (плитка дълбочина на полето), наблюдава браунови частици в много тънки слоеве течност. Изчислявайки концентрацията на частици на различни височини, той установи, че тази концентрация намалява с височината по същия закон като концентрацията на газовите молекули. Разликата е, че поради голямата маса на брауновите частици, намаляването става много бързо.
Освен това, преброяването на брауновите частици на различни височини позволи на Перин да определи константата на Авогадро, използвайки напълно нов метод. Стойността на тази константа съвпада с известната.
Всички тези факти показват правилността на теорията за Брауновото движение и съответно, че Брауновите частици участват в топлинното движение на молекулите.
Молекулярно-кинетичната теория е клон на физиката, който изучава свойствата на различни състояния на материята, въз основа на идеята за съществуването на молекули и атоми като най-малките частици материя. ИКТ се основават на три основни принципа:
1. Всички вещества се състоят от малки частици: молекули, атоми или йони.
2. Тези частици са в непрекъснато хаотично движение, чиято скорост определя температурата на веществото.
3. Между частиците съществуват сили на привличане и отблъскване, чийто характер зависи от разстоянието между тях.
Основните положения на ИКТ се потвърждават от много експериментални факти. Съществуването на молекули, атоми и йони е доказано експериментално, молекулите са достатъчно проучени и дори фотографирани с помощта на електронни микроскопи. Способността на газовете да се разширяват и заемат за неопределено време всичкоосигуреният от него обем се обяснява с непрекъснатото хаотично движение на молекулите. Еластичност газове,твърди вещества и течности, способността на течностите
овлажняването на някои твърди вещества, процесите на оцветяване, слепване, поддържане на формата от твърди вещества и много други показват съществуването на сили на привличане и отблъскване между молекулите. Феноменът на дифузия - способността на молекулите на едно вещество да проникват в пространствата между молекулите на друго - също потвърждава основните положения на MCT. Феноменът на дифузията обяснява например разпространението на миризми, смесването на различни течности, процеса на разтваряне на твърди вещества в течности и заваряването на метали чрез стопяване или чрез натиск. Потвърждение за непрекъснатото хаотично движение на молекулите е и брауновото движение - непрекъснатото хаотично движение на микроскопични частици, неразтворими в течност.
Движението на брауновите частици се обяснява с хаотичното движение на течни частици, които се сблъскват с микроскопични частици и ги привеждат в движение. Експериментално е доказано, че скоростта на брауновите частици зависи от температурата на течността. Теорията за брауновото движение е разработена от А. Айнщайн. Законите за движението на частиците са статистически и вероятностни по природа. Има само един известен начин за намаляване на интензивността на Брауновото движение - намаляване на температурата. Наличието на Брауново движение убедително потвърждава движението на молекулите.
Следователно всяко вещество се състои от частици количество веществосе счита за пропорционален на броя на частиците, т.е. структурните елементи, съдържащи се в тялото, v.
Единицата за количество на веществото е къртица.Къртица- това е количеството вещество, съдържащо същия брой структурни елементи на всяко вещество, колкото има атоми в 12 g въглерод C 12. Съотношението на броя на молекулите на веществото към количеството вещество се нарича Константата на Авогадро:
n a= N/ v. na = 6,02 10 23 къртица -1 .
Константата на Авогадро показва колко атома и молекули се съдържат в един мол вещество. Моларна масае количество, равно на съотношението на масата на веществото към количеството вещество:
M = m/ v.
Моларната маса се изразява в kg/mol. Познавайки моларната маса, можете да изчислите масата на една молекула:
m 0 = m/N = m/vN A= М/ N A
Обикновено се определя средната молекулна маса химични методи, константата на Авогадро е определена с висока точност чрез няколко физични метода. Масите на молекулите и атомите се определят със значителна степен на точност с помощта на масспектрограф.
Масите на молекулите са много малки. Например масата на водната молекула: t = 29,9 10 -27 кг.
Моларната маса е свързана с относителната молекулна маса на Mr. Относителната моларна маса е стойност, равна на съотношението на масата на молекула на дадено вещество към 1/12 от масата на въглеродния атом С12. Ако химическата формула на веществото е известна, тогава с помощта на периодичната таблица може да се определи неговата относителна маса, която, изразена в килограми, показва моларната маса на това вещество.
Молекулярно-кинетичната теория е клон на физиката, който изучава свойствата на различни състояния на материята, въз основа на идеята за съществуването на молекули и атоми като най-малките частици материя. ИКТ се основават на три основни принципа: 1. Всички вещества са изградени от малки частици: молекули, атоми или йони. 2. Тези частици са в непрекъснато хаотично движение, чиято скорост определя температурата на веществото.3. Между частиците съществуват сили на привличане и отблъскване, чиято природа зависи от разстоянието между тях. Основните положения на ИКТ се потвърждават от много експериментални факти. Съществуването на молекули, атоми и йони е доказано експериментално, молекулите са достатъчно проучени и дори фотографирани с помощта на електронни микроскопи. Способността на газовете да се разширяват и заемат за неопределено време всичкоосигуреният от него обем се обяснява с непрекъснатото хаотично движение на молекулите. Еластичност газове,твърди вещества и течности, способността на течностите
овлажняването на някои твърди вещества, процесите на оцветяване, слепване, поддържане на формата от твърди вещества и много други показват съществуването на сили на привличане и отблъскване между молекулите. Феноменът на дифузия - способността на молекулите на едно вещество да проникват в пространствата между молекулите на друго - също потвърждава основните положения на MCT. Феноменът на дифузията обяснява например разпространението на миризми, смесването на различни течности, процеса на разтваряне на твърди вещества в течности и заваряването на метали чрез стопяване или чрез натиск. Потвърждение за непрекъснатото хаотично движение на молекулите е и брауновото движение - непрекъснатото хаотично движение на микроскопични частици, неразтворими в течност.
Движението на брауновите частици се обяснява с хаотичното движение на течни частици, които се сблъскват с микроскопични частици и ги привеждат в движение. Експериментално е доказано, че скоростта на брауновите частици зависи от температурата на течността. Теорията за брауновото движение е разработена от А. Айнщайн. Законите за движението на частиците са статистически и вероятностни по природа. Има само един известен начин за намаляване на интензивността на Брауновото движение - намаляване на температурата. Наличието на Брауново движение убедително потвърждава движението на молекулите.
Следователно всяко вещество се състои от частици количество веществосе счита за пропорционален на броя на частиците, т.е. структурните елементи, съдържащи се в тялото, v.
Единицата за количество на веществото е къртица.Къртица- това е количеството вещество, съдържащо същия брой структурни елементи на всяко вещество, колкото има атоми в 12 g въглерод C 12. Съотношението на броя на молекулите на веществото към количеството вещество се нарича Константата на Авогадро:
n a = N/v. na = 6,02 10 23 mol -1.
Константата на Авогадро показва колко атома и молекули се съдържат в един мол вещество. Моларната маса се наричастойност, равна на съотношението на масата на веществото към количеството вещество:
Моларната маса се изразява в kg/mol. Познавайки моларната маса, можете да изчислите масата на една молекула:
m 0 = m/N = m/vN A = M/N A
Средната маса на молекулите обикновено се определя чрез химични методи; константата на Авогадро се определя с висока точност чрез няколко физични метода. Масите на молекулите и атомите се определят със значителна степен на точност с помощта на масов спектрограф.Масите на молекулите са много малки. Например масата на водната молекула: t = 29,9 10 -27 кг.
Моларната маса е свързана с относителната молекулна маса на Mr. Относителната моларна маса е стойност, равна на съотношението на масата на молекула на дадено вещество към 1/12 от масата на въглеродния атом С12. Ако химическата формула на веществото е известна, тогава с помощта на периодичната таблица може да се определи неговата относителна маса, която, изразена в килограми, показва моларната маса на това вещество.
2) Осцилаторно движениемолекули в природата и технологията. Хармонични вибрации. Амплитуда, период, честота и фаза на трептенията. Определете експериментално честотата на предложената трептителна система.
Механични вибрацииса движения на тела, които се повтарят точно или приблизително еднакво през равни интервали от време. Силите, действащи между телата в разглежданата система от тела, се наричат вътрешни сили. Силите, действащи върху телата на системата от други тела, се наричат външни сили. Безплатни вибрациинаречени вибрации, възникнали под въздействието на вътрешни сили, например махало върху низ. Вибрациите под въздействието на външни сили са принудени трептения, например бутало в двигател. Общи признациВсички видове трептения са повторяемостта на процеса на движение след определен интервал от време. Трептенията, описани от уравнението, се наричат хармонични. По-специално, колебанията, които възникват в система с една възстановяваща сила, пропорционална на деформацията, са хармонични. Минималният интервал, през който се повтаря движението на тялото, се нарича период на трептене T. Физическо количество, обратното на периода на трептене и характеризиращо броя на трептенията за единица време, се нарича честота. Честотата се измерва в херци, 1 Hz = 1 s -1. Използва се и концепцията за циклична честота, която определя броя на трептенията за 2p секунди. Големината на максималното изместване от равновесното положение се нарича амплитуда. Стойността под знака за косинус е фазата на трептене, j 0 е началната фаза на трептене. Производните също се променят хармонично, а общата механична енергия за произволно отклонение х(ъгъл, координата и т.н.) е равно на, където АИ IN– константи, определени от параметрите на системата. Чрез разграничаване на този израз и като се вземе предвид липсата на външни сили, е възможно да се запише това, от което идва.
12. Основни положения на молекулярно-кинетичната теория и тяхното експериментално обосноваване. Маса и размер на молекулите
Теория, която обяснява структурата и свойствата на телата въз основа на законите за движение и взаимодействие на частиците, които изграждат телата, се нарича молекулярна кинетика.
Основните принципи на молекулярно-кинетичната теория (MKT) са формулирани, както следва:
Всяко вещество има дискретна (прекъсната) структура. Състои се от отделни частици (молекули, атоми, йони), разделени с интервали.
Частиците са в състояние на непрекъснато хаотично движение, наречено топлинно движение.
Частиците взаимодействат една с друга. В процеса на тяхното взаимодействие възникват сили на привличане и отблъскване.
Валидността на ИКТ се потвърждава от множество наблюдения и факти.
Наличието на пропускливост, свиваемост и разтворимост в веществата показва, че те не са непрекъснати, а се състоят от отделни частици, разделени с интервали. С помощта на съвременни методи на изследване (електронни и йонни микроскопи) са получени изображения на най-големите молекули.
Брауновото движение и дифузията показват, че частиците са в непрекъснато движение.
Наличието на якост и еластичност на телата, явлението намокряне, повърхностно напрежение в течности и др. доказват съществуването на сили на взаимодействие между молекулите.
Маса и размер на молекулите.
Размерът на молекулите е относителна величина. Оценява се по следния начин. Между молекулите, наред със силите на привличане, действат и сили на отблъскване, така че молекулите могат да се приближават една до друга само на определено разстояние. Разстоянието на максимално приближаване между центровете на молекулите се нарича ефективен диаметър на молекулата.(В този случай конвенционално се приема, че молекулите имат сферична форма.)
Използвайки многобройни методи за определяне на масите и размерите на молекулите, е установено, че с изключение на молекулите на органичните вещества, съдържащи много голям брой атоми, повечето молекули, по ред на величина, имат диаметър от 1·10 - 10 m и маса 1·10 - 26 kg.
Относително молекулно тегло.
Относителна молекулна (или атомна) масаГ-н (или A r ) те наричат стойност, равна на съотношението на масата на молекула (или атом) m o от това вещество към 1/12 от масата на въглероден атом m o C, т.е.
Относителната молекулна (атомна) маса е безразмерна величина.
Количество вещество. Моларна маса. Молекулна маса.
Количеството вещество ν е стойност, равна на отношението на броя на молекулите (или атомите) N в дадено тяло към броя на атомите N A в 0,012 kg въглерод, т.е. ν = N/ N A (N A е числото на Авогадро).
Моларната маса M на дадено вещество е масата на 1 мол от това вещество.
Следователно масата на една молекула (атом) може да се определи от връзката
13. Идеален газ. Основно уравнение μmt на идеален газ
Идеален газ е такъв газ, при описанието на свойствата на който се правят следните предположения: те не отчитат вътрешния размер на газовите молекули и не отчитат силите на взаимодействие между тях.
По този начин моделът на идеален газ е набор от хаотично движещи се материални точки, които взаимодействат помежду си и със стените на контейнер, съдържащ газ, само при пряк сблъсък.