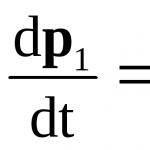Силиций (Si) –стои в период 3, група IV от главната подгрупа на периодичната система. Физични свойства:Силицият съществува в две модификации: аморфен и кристален. Аморфният силиций е кафяв прах с плътност 2,33 g/cm3, разтворим в метални стопилки. Кристалният силиций представлява тъмносиви кристали със стоманен блясък, твърди и крехки, с плътност 2,4 g/cm3. Силицият се състои от три изотопа: Si (28), Si (29), Si (30).
Химични свойства:електронна конфигурация: 1s22s22p63 s23p2 . Силицият е неметал. На външно енергийно ниво силицийът има 4 електрона, което определя неговите степени на окисление: +4, -4, -2. Валентност – 2.4 Аморфният силиций има по-голяма реактивност от кристалния силиций. При нормални условия той взаимодейства с флуор: Si + 2F2 = SiF4. При 1000 °C Si реагира с неметали: CL2, N2, C, S.
От киселините силицият реагира само със смес от азотна и флуороводородна киселина:
Той се държи различно по отношение на металите: в разтопен Zn, Al, Sn, Pb се разтваря добре, но не реагира с тях; Силицият взаимодейства с други метални стопилки - с Mg, Cu, Fe - за образуване на силициди: Si + 2Mg = Mg2Si. Силицият гори в кислород: Si + O2 = SiO2 (пясък).
Силициев диоксид или силициев диоксид– стабилна връзка Si, широко разпространени в природата. Реагира чрез сливане с основи и основни оксиди, образувайки соли на силициева киселина - силикати. Касова бележка:в промишлеността силицийът в неговата чиста форма се получава чрез редуциране на силициев диоксид с кокс в електрически пещи: SiO2 + 2C = Si + 2CO?.
В лабораторията силицийът се получава чрез калциниране на бял пясък с магнезий или алуминий:
SiO2 + 2Mg = 2MgO + Si.
3SiO2 + 4Al = Al2O3 + 3Si.
Силицият образува киселини: H2 SiO3 – мета-силициева киселина; H2 Si2O5 е диметасилициева киселина.
Намиране в природата:кварцов минерал – SiO2. Кварцовите кристали са с форма на шестоъгълна призма, безцветни и прозрачни и се наричат планински кристал. Аметистът е планински кристал, оцветен в лилаво с примеси; опушеният топаз е кафеникав на цвят; ахатът и ясписът са кристални разновидности на кварца. Аморфният силициев диоксид е по-рядко срещан и съществува под формата на опалния минерал – SiO2 nH2O. Диатомит, триполи или диатомит (диатомит) са земни форми на аморфен силиций.
42. Концепцията за колоидни разтвори
Колоидни разтвори– високодисперсни двуфазни системи, състоящи се от дисперсна среда и дисперсна фаза. Размерите на частиците са междинни между истинските разтвори, суспензии и емулсии. U колоидни частицимолекулярен или йонен състав.
Има три вида вътрешна структурапървични частици.
1. Суспензоиди (или необратими колоиди)– хетерогенни системи, чиито свойства могат да се определят от развитата междуфазна повърхност. В сравнение със суспензиите, те са по-силно диспергирани. Те не могат да съществуват дълго време без стабилизатор на дисперсия. Те се наричат необратими колоидипоради факта, че техните утайки не образуват отново золи след изпаряване. Концентрацията им е ниска - 0,1%. Те се различават леко от вискозитета на дисперсната среда.
Суспензоидите могат да бъдат получени:
1) методи на дисперсия (раздробяване на големи тела);
2) методи на кондензация (производство на неразтворими съединения чрез обменни реакции, хидролиза и др.).
Спонтанното намаляване на дисперсността в суспензиите зависи от свободната повърхностна енергия. За да се получи дълготрайна суспензия, са необходими условия за нейното стабилизиране.
Стабилни дисперсни системи:
1) дисперсионна среда;
2) дисперсна фаза;
3) стабилизатор на дисперсната система.
Стабилизаторът може да бъде йонен, молекулярен, но най-често високомолекулен.
Защитни колоиди– високомолекулни съединения, които се добавят за стабилизиране (протеини, пептиди, поливинилалкохол и др.).
2. Асоциативни (или мицеларни колоиди) –полуколоиди, които възникват, когато има достатъчна концентрация на молекули, състоящи се от въглеводородни радикали (дифилни молекули) на вещества с ниско молекулно тегло, когато те се свързват в агрегати от молекули (мицели). Мицелисе образуват във водни разтвори на детергенти (сапуни), органични багрила.
3. Молекулярни колоиди (обратими или лиофилни колоиди) –естествени и синтетични високомолекулни вещества с високо молекулно тегло. Техните молекули имат размер на колоидни частици (макромолекули).
Разредените разтвори на колоиди на съединения с високо молекулно тегло са хомогенни разтвори. Когато са силно разредени, тези разтвори се подчиняват на законите за разредените разтвори.
Неполярните макромолекули се разтварят във въглеводороди, полярните - в полярни разтворители.
Обратими колоиди– вещества, чийто сух остатък при добавяне на нова част от разтворителя се връща обратно в разтвора.
Описание и свойства на силиция
Силиций - елемент, четвърта група, третият период в таблицата на елементите. Атомен номер 14. Силициева формула- 3s2 3p2. Дефиниран е като елемент през 1811 г., а през 1834 г. получава руското име "силиций", вместо предишното "сицилия". Топи се при 1414º C, кипи при 2349º C.
Молекулярна структураприлича, но му отстъпва по твърдост. Доста крехък, при нагряване (поне 800º C) става пластичен. Полупрозрачен с инфрачервено лъчение. Монокристалният силиций има полупроводникови свойства. Според някои характеристики силициев атомподобно на атомната структура на въглерода. Силициеви електрониимат същото валентно число като при въглеродната структура.
работници свойства на силициязависят от съдържанието на определено съдържание в него. Силицият има различни видове проводимост. По-специално, това са типовете „дупки“ и „електронни“. За да се получи първият, към силиций се добавя бор. Ако добавите фосфор, силицийпридобива втория тип проводимост. Ако силицийът се нагрява заедно с други метали, се образуват специфични съединения, наречени „силициди“, например при реакцията „ магнезиев силиций«.
Силицият, използван за нуждите на електрониката, се оценява предимно по характеристиките на горните му слоеве. Ето защо е необходимо да се обърне специално внимание на тяхното качество, тъй като то пряко влияе върху цялостното представяне. От тях зависи работата на произведеното устройство. За да се получат най-приемливите характеристики на горните слоеве силиций, те се третират с различни чрез химически средстваили изложени на радиация.
Съединение "сяра-силиций"образува силициев сулфид, който лесно взаимодейства с вода и кислород. При реакция с кислород, при температурни условия над 400º C, се оказва силициев диоксид.При същата температура стават възможни реакции с хлор и йод, както и бром, по време на които се образуват летливи вещества - тетрахалогениди.

Няма да е възможно да се комбинират силиций и водород чрез директен контакт; за това има индиректни методи. При 1000º C е възможна реакция с азот и бор, което води до силициев нитрид и борид. При същата температура, чрез комбиниране на силиций с въглерод, е възможно да се произведе силициев карбид, така нареченият „карборунд“. Този състав има солидна структура, химическата активност е бавна. Използва се като абразив.
Във връзка с желязо, силицийобразува специална смес, което позволява топенето на тези елементи, което произвежда феросиликонова керамика. Освен това точката му на топене е много по-ниска, отколкото ако се стопят отделно. При температурни условиянад 1200º C образуването започва от елемента силициев оксид, също при определени условия се оказва силициев хидроксид. При ецване на силиций се използват алкални разтвори на водна основа. Температурата им трябва да бъде поне 60ºC.
Силициеви находища и добив
Елементът е вторият най-разпространен на планетата вещество. Силицийсъставлява почти една трета от обема земната кора. Само кислородът е по-често срещан. Той се изразява предимно от силициев диоксид, съединение, което основно съдържа силициев диоксид. Основните производни на силициевия диоксид са кремък, различни пясъци, кварц и полеви . След тях идват силикатните съединения на силиция. Родността е рядко срещано явление за силиция.
Силиконови приложения
Силиций, химични свойствакоето определя обхвата на неговото приложение, се разделя на няколко вида. По-малко чистият силиций се използва за металургични нужди: например за добавки в алуминий, силицийактивно променя свойствата си, дезоксиданти и др. Той активно променя свойствата на металите, като ги добавя към съединение. Силицийги сплавява, променяйки работните характеристики, силицийМного малко количество е достатъчно.

Също така от суров силиций се произвеждат по-висококачествени производни, по-специално моно и поликристален силиций, както и органичен силиций - това са силикони и различни органични масла. Намира приложение и в производството на цимент и стъкларската промишленост. Не заобиколи производството на тухли, фабриките за производство на порцелан също не могат без него.
Силицият е част от добре познатото силикатно лепило, което се използва за ремонтни дейности, а преди това се използваше за офис нужди, докато не се появиха по-практични заместители. Някои пиротехнически продукти също съдържат силиций. Водородът може да се произвежда от него и неговите железни сплави на открито.

За какво се използва по-добро качество? силиций? ПлочиСлънчевите батерии също съдържат силиций, естествено нетехнически. За тези нужди е необходим силиций с идеална чистота или поне технически силиций най-висока степенпочистване.
Т.нар "електронен силиций"който съдържа почти 100% силиций, има много по-добра производителност. Поради това е предпочитан при производството на свръхпрецизни електронни устройства и сложни микросхеми. Производството им изисква висококачествена продукция верига, силиконза които трябва да отиде само най-висока категория. Работата на тези устройства зависи от това колко съдържа силицийнежелани примеси.

Силицият заема важно място в природата и повечето живи същества постоянно се нуждаят от него. За тях това е един вид градивен състав, защото е изключително важен за здравето на опорно-двигателния апарат. Всеки ден човек усвоява до 1гр силициеви съединения.
Може ли силицият да бъде вреден?
Да, поради причината, че силициевият диоксид е изключително предразположен към образуване на прах. Той има дразнещ ефект върху лигавиците на тялото и може активно да се натрупва в белите дробове, причинявайки силикоза. За тази цел в производството, свързано с обработката на силициеви елементи, използването на респиратори е задължително. Тяхното присъствие е особено важно, когато става дума за силициев оксид.
Цена на силиций
Както знаете, всички модерни електронно оборудване, вариращ от телекомуникации до компютърни технологии, се основава на използването на силиций, използвайки неговите полупроводникови свойства. Другите му аналози се използват в много по-малка степен. Уникалните свойства на силиция и неговите производни все още са ненадминати за много години напред. Въпреки спада на цените през 2001г силиций, продажбибързо се върна към нормалното. И още през 2003 г. търговският оборот възлиза на 24 хиляди тона годишно.
За най-новите технологии, изискващи почти кристална чистота на силиций, неговите технически аналози не са подходящи. И благодарение на него сложна системацената на почистване съответно се увеличава значително. Поликристалният тип силиций е по-често срещан, неговият монокристален прототип е малко по-малко търсен. В същото време делът на силиция, използван за полупроводници, заема лъвския дял от търговския оборот.

Цените на продуктите варират в зависимост от чистотата и предназначението силиций, купикоято може да започне от 10 цента на кг сурови суровини и до $10 и повече за „електронен“ силиций.
Намиращ се в основна подгрупа IV група, в трети период. Това е аналог на въглерода. Електронна конфигурацияелектронни слоеве на силициевия атом ls 2 2s 2 2p 6 3s 2 3p 2 . Структура на външния електронен слой
Структурата на външния електронен слой е подобна на структурата на въглеродния атом.
Среща се под формата на две алотропни модификации - аморфна и кристална.
Аморфен - кафеникав прах с малко по-голяма химическа активност от кристалния. При нормална температура реагира с флуор:
Si + 2F2 = SiF4 при 400° - с кислород
Si + O2 = SiO2
в стопи - с метали:
2Mg + Si = Mg2Si
Силицият е
Кристалният силиций е твърдо, крехко вещество с метален блясък. Има добра топло- и електропроводимост и лесно се разтваря в разтопени метали, образувайки. Сплав от силиций с алуминий се нарича силумин, сплав от силиций с желязо се нарича феросилиций. Плътността на силиция е 2,4. Точка на топене 1415°, точка на кипене 2360°. Кристалният силиций е доста инертно вещество и химична реакциявлиза трудно. Въпреки ясно видимите си метални свойства, силицият не реагира с киселини, но реагира с основи, образувайки соли на силициева киселина и:
Si + 2KOH + H2O = K2SiO2 + 2H2
■ 36. Какви са приликите и разликите между електронните структури на силициевите и въглеродните атоми?
37. Как да обясним с термини електронна структурасилициев атом, защо металните свойства са по-характерни за силиция, отколкото за въглерода?
38. Избройте химичните свойства на силиция.
Силицият в природата. Силициев диоксид
В природата силицият е много разпространен. Приблизително 25% от земната кора се състои от силиций. Значителна част от естествения силиций е представен от силициев диоксид SiO2. В много чисто кристално състояние силициевият диоксид се среща като минерал, наречен планински кристал. Силициев диоксид и въглероден диоксид химичен съставса аналози, но въглеродният диоксид е газ, а силициевият диоксид е газ твърдо. За разлика от молекулярната кристална решетка на CO2, силициевият диоксид SiO2 кристализира под формата на атомна кристална решетка, всяка клетка от която е тетраедър със силициев атом в центъра и кислородни атоми в ъглите. Това се обяснява с факта, че силициевият атом има по-голям радиус от въглеродния атом и около него могат да се поставят не 2, а 4 кислородни атома. Разликата в структурата на кристалната решетка обяснява разликата в свойствата на тези вещества. На фиг. 69 показва външния вид на естествен кварцов кристал, състоящ се от чист силициев диоксид и неговата структурна формула.

Ориз. 60. Структурна формуласилициев диоксид (а) и естествени кварцови кристали (б)
Кристалният силициев диоксид най-често се среща под формата на пясък, който е бял, освен ако не е замърсен с примеси от жълта глина. Освен пясък, силициевият диоксид често се среща под формата на много твърд минерал, силициев диоксид (хидратиран силициев диоксид). Кристалният силициев диоксид, оцветен с различни примеси, образува скъпоценни и полускъпоценни камъни - ахат, аметист, яспис. Почти чистият силициев диоксид също се среща под формата на кварц и кварцит. Свободният силициев диоксид в земната кора е 12%, в състава на различни скали - около 43%. Общо повече от 50% от земната кора е изградена от силициев диоксид.
Силицият е част от голямо разнообразие от скали и минерали - глина, гранити, сиенити, слюда, фелдшпати и др.
Твърдият въглероден диоксид, без да се топи, сублимира при -78,5°. Точката на топене на силициевия диоксид е около 1,713°. Тя е доста огнеупорна. Плътност 2,65. Коефициентът на разширение на силициевия диоксид е много малък. Това има много голямо значениекогато използвате съдове от кварцово стъкло. Силициевият диоксид не се разтваря във вода и не реагира с нея, въпреки факта, че е киселинен оксид и съответстващата му силициева киселина е H2SiO3. Известно е, че въглеродният диоксид е разтворим във вода. Силициевият диоксид не реагира с киселини, с изключение на флуороводородна киселина HF, и дава соли с основи.

Ориз. 69. Структурна формула на силициев диоксид (а) и естествени кварцови кристали (б).
Когато силициевият диоксид се нагрява с въглища, силицийът се редуцира и след това се комбинира с въглерод и се образува карборунд според уравнението:
SiO2 + 2C = SiC + CO2. Карборундът има висока твърдост, устойчив е на киселини и се разрушава от основи.
■ 39. По какви свойства на силициевия диоксид може да се съди за неговата кристална решетка?
40. В какви минерали се среща силициев диоксид в природата?
41. Какво е карборунд?
Силициева киселина. Силикати
Силициевата киселина H2SiO3 е много слаба и нестабилна киселина. При нагряване постепенно се разлага на вода и силициев диоксид:
H2SiO3 = H2O + SiO2
Силициевата киселина е практически неразтворима във вода, но може лесно да се даде.
Силициевата киселина образува соли, наречени силикати. широко разпространени в природата. Естествените са доста сложни. Техният състав обикновено се изобразява като комбинация от няколко оксида. Ако естествените силикати съдържат алуминиев оксид, те се наричат алумосиликати. Това са бяла глина, (каолин) Al2O3 2SiO2 2H2O, фелдшпат K2O Al2O3 6SiO2, слюда
К2O · Al2O3 · 6SiO2 · 2Н2O. Много естествени камъни в тяхната чиста форма са скъпоценни камъни, като аквамарин, изумруд и др.
От изкуствените силикати трябва да се отбележи натриевият силикат Na2SiO3 - един от малкото силикати, разтворими във вода. Нарича се разтворимо стъкло, а разтворът се нарича течно стъкло.
Силикатите се използват широко в технологиите. Разтворимото стъкло се използва за импрегниране на тъкани и дърво, за да ги предпази от пожар. Течността се включва в огнеупорни шпакловки за лепене на стъкло, порцелан и камък. Силикатите са в основата на производството на стъкло, порцелан, фаянс, цимент, бетон, тухли и различни керамични изделия. В разтвор силикатите лесно се хидролизират.
■ 42. Какво е ? Как се различават от силикатите?
43. Какво е течност и за какви цели се използва?
Стъклена чаша
Суровините за производството на стъкло са Na2CO3 сода, CaCO3 варовик и SiO2 пясък. Всички компоненти на стъкления заряд се почистват старателно, смесват се и се стопяват при температура около 1400°. По време на процеса на синтез протичат следните реакции:
Na2CO3 + SiO2= Na2SiO3 + CO2
CaCO3 + SiO2 = CaSiO 3+ CO2
Всъщност стъклото съдържа натриеви и калциеви силикати, както и излишък от SO2, така че съставът на обикновеното прозоречно стъкло е: Na2O · CaO · 6SiO2. Стъклената смес се нагрява при температура 1500° до пълното отстраняване на въглеродния диоксид. След това се охлажда до температура 1200°, при която става вискозен. Като всяко аморфно вещество, стъклото омеква и се втвърдява постепенно, така че е добър пластичен материал. Вискозната стъклена маса преминава през процепа, което води до стъклен лист. Горещият стъклен лист се издърпва с ролки, довежда се до определен размер и постепенно се охлажда от въздушен поток. След това се подрязва по краищата и се нарязва на листове с определен формат.
■ 44. Дайте уравненията за реакциите, протичащи по време на производството на стъкло и състава на стъклото за прозорци.
Стъклена чаша- веществото е аморфно, прозрачно, практически неразтворимо във вода, но ако се натроши на фин прах и се смеси с малко количество вода, в получената смес може да се открие алкал с помощта на фенолфталеин. При дългосрочно съхранение на алкали в стъклени съдове, излишният SiO2 в стъклото реагира много бавно с алкалите и стъклото постепенно губи своята прозрачност.
Стъклото става известно на хората преди повече от 3000 г. пр.н.е. В древни времена стъклото се е получавало с почти същия състав като днешния, но древните майстори са се ръководели само от собствената си интуиция. През 1750 г. М. В. успява да разработи научната основа за производството на стъкло. В продължение на 4 години М. В. събира много рецепти за приготвяне на различни чаши, особено цветни. Построената от него стъкларска фабрика произвежда голям брой стъклени образци, които са оцелели и до днес. В момента се използват стъкла с различни състави с различни свойства.
Кварцовото стъкло се състои от почти чист силициев диоксид и се разтопява от планински кристал. Много е важна характеристикае, че коефициентът му на разширение е незначителен, почти 15 пъти по-малък от този на обикновеното стъкло. Съдовете, направени от такова стъкло, могат да се нагреят до червено в пламъка на горелка и след това да се спуснат в студена вода; в този случай няма да настъпят промени в стъклото. Кварцовото стъкло не блокира ултравиолетовите лъчи и ако го боядисате в черно с никелови соли, то ще блокира всички видими лъчи от спектъра, но ще остане прозрачно за ултравиолетовите лъчи.
Кварцовото стъкло не се влияе от киселини и алкали, но алкалите забележимо го корозират. Кварцовото стъкло е по-крехко от обикновеното стъкло. Лабораторното стъкло съдържа около 70% SiO2, 9% Na2O, 5% K2O, 8% CaO, 5% Al2O3, 3% B2O3 (съставът на стъклата не е даден с цел запаметяване).
Йенско и пирексово стъкло се използват в промишлеността. Йенското стъкло съдържа около 65% Si02, 15% B2O3, 12% BaO, 4% ZnO, 4% Al2O3. Той е издръжлив, устойчив на механични натоварвания, има нисък коефициент на разширение и е устойчив на основи.
Стъклото Pyrex съдържа 81% SiO2, 12% B2O3, 4% Na2O, 2% Al2O3, 0,5% As2O3, 0,2% K2O, 0,3% CaO. Има същите свойства като йенското стъкло, но в още по-голяма степен, особено след темпериране, но е по-малко устойчиво на алкали. Стъклото Pyrex се използва за направата на битови предмети, които са изложени на топлина, както и части от някои промишлени инсталации, които работят при ниски и високи температури.
Някои добавки придават различни качества на стъклото. Например примесите на ванадиевите оксиди произвеждат стъкло, което напълно блокира ултравиолетовите лъчи.
Получава се и боядисано в различни цветове стъкло. M.V. също произвежда няколко хиляди проби от цветно стъкло с различни цветове и нюанси за своите мозаечни картини. Понастоящем методите за боядисване на стъкло са разработени подробно. Мангановите съединения оцветяват стъклото във виолетово, а кобалтовите - синьо. , разпръснати в стъклената маса под формата на колоидни частици, придават рубинен цвят и др. Оловните съединения придават на стъклото блясък, подобен на този на планинския кристал, поради което се нарича кристал. Този тип стъкло може лесно да се обработва и реже. Продуктите от него пречупват светлината много красиво. Чрез оцветяване на това стъкло с различни добавки се получава цветно кристално стъкло.
Ако разтопеното стъкло се смеси с вещества, които при разлагане образуват голямо количество газове, последните, когато се отделят, разпенват стъклото, образувайки пеностъкло. Това стъкло е много леко, може да се обработва добре и е отличен електрически и топлоизолатор. За първи път е получен от проф. И. И. Китайгородски.
Чрез издърпване на нишки от стъкло можете да получите така нареченото фибростъкло. Ако импрегнирате фибростъкло, положено на слоеве със синтетични смоли, получавате много издръжливо, устойчиво на гниене, идеално работещо строителни материали, т. нар. фибростъкло. Интересното е, че колкото по-тънък е фибростъклото, толкова по-висока е неговата здравина. Фибростъклото се използва и за направата на работно облекло.
Стъклената вата е ценен материал, през който могат да се филтрират силни киселини и основи, които не могат да се филтрират през хартия. Освен това стъклената вата е добър топлоизолатор.
■ 44. Какво определя свойствата на различните видове стъкло?
Керамика
От алумосиликатите особено значение има бялата глина - каолин, която е в основата на производството на порцелан и фаянс. Производството на порцелан е изключително древна индустрия. Родното място на порцелана е Китай. В Русия порцеланът е произведен за първи път през 18 век. Д, И. Виноградов.
Суровините за производството на порцелан и фаянс, в допълнение към каолина, са пясък и. Смес от каолин, пясък и вода се подлага на щателно фино смилане в топкови мелници, след което излишната вода се филтрира и добре смесената пластмасова маса се изпраща за формоване на продукти. След формоването продуктите се сушат и изпичат в непрекъснати тунелни пещи, където първо се нагряват, след това се изпичат и накрая се охлаждат. След това изделията се подлагат на допълнителна обработка - остъкляване и боядисване с керамични бои. След всеки етап продуктите се изпичат. Резултатът е порцелан, който е бял, гладък и лъскав. На тънки слоеве прозира. Фаянсът е порест и не прозира.
От червена глина се оформят тухли, керемиди, керамика, керамични пръстени за опаковане в абсорбционни и миещи кули от различни видове. химическо производство, саксии. Те също се изпичат, за да не омекнат от водата и да станат механично здрави.
Цимент. Бетон
Силициевите съединения служат като основа за производството на цимент, незаменим свързващ материал в строителството. Суровините за производство на цимент са глина и варовик. Тази смес се изпича в огромна наклонена тръбна ротационна пещ, в която непрекъснато се подават суровини. След изпичане при 1200-1300°, от дупка, разположена в другия край на пещта, непрекъснато излиза синтерована маса - клинкер. След смилане клинкерът се превръща в. Съставът на цимента се състои главно от силикати. Ако се смеси с вода, за да се образува гъста суспензия и след това се остави на въздух за известно време, тя ще реагира с циментови вещества, образувайки кристални хидрати и други твърди съединения, което води до втвърдяване („втвърдяване“) на цимента. Такива
ОПРЕДЕЛЕНИЕ
Силиций- четиринадесети елемент периодичната таблица. Обозначение - Si от латинското "силиций". Намира се в трети период, група IVA. Отнася се за неметали. Ядреният заряд е 14.
Силицият е един от най-често срещаните елементи в земната кора. Той представлява 27% (тегл.) от частта от земната кора, достъпна за нашето изследване, като се нарежда на второ място по изобилие след кислорода. В природата силицият се среща само в съединения: под формата на силициев диоксид SiO 2, наречен силициев анхидрид или силициев диоксид, под формата на соли на силициеви киселини (силикати). Най-разпространени в природата са алумосиликатите, т.е. силикати, съдържащи алуминий. Те включват фелдшпати, слюда, каолин и др.
Като въглерод, като част от всичко органична материя, силицият е най-важният елемент от растителното и животинско царство.
При нормални условия силицият е тъмносиво вещество (фиг. 1). от външен видприлича на метал. Огнеупорен - точката на топене е 1415 o C. Характеризира се с висока твърдост.
Ориз. 1. Силиций. Външен вид.
Атомно и молекулно тегло на силиций
Относителната молекулна маса на вещество (M r) е число, показващо колко пъти масата на дадена молекула е по-голяма от 1/12 масата на въглероден атом, а относителната атомна маса на елемент (A r) е колко пъти средната маса на атомите на даден химичен елемент е по-голяма от 1/12 маса на въглероден атом.
Тъй като в свободно състояние силицийът съществува под формата на моноатомни Si молекули, стойностите на неговите атомни и молекулно теглосъвпада. Те са равни на 28,084.
Алотропия и алотропни модификации на силиций
Силицият може да съществува под формата на две алотропни модификации: подобна на диамант (кубична) (стабилна) и подобна на графит (нестабилна). Диамантеноподобният силиций се намира в твърдо вещество агрегатно състояние, а графитоподобните - в аморфните. Те също се различават по външен вид и химическа активност.
Кристалният силиций е тъмно сиво вещество с метален блясък, а аморфният силиций е кафяв прах. Втората модификация е по-реактивна от първата.
Изотопи на силиций
Известно е, че в природата силицият се среща под формата на три стабилни изотопа 28 Si, 29 Si и 30 Si. Техните масови числа са съответно 28, 29 и 30. Ядрото на един атом на силициевия изотоп 28 Si съдържа четиринадесет протона и четиринадесет неутрона, а изотопите 29 Si и 30 Si съдържат същия брой протони, съответно петнадесет и шестнадесет неутрона.
Съществуват изкуствени изотопи на силиций с масови числа от 22 до 44, сред които най-дълголетният е 32 Si с период на полуразпад 170 години.
Силициеви йони
На външното енергийно ниво на силициевия атом има четири електрона, които са валентни:
1s 2 2s 2 2p 6 3s 2 3p 2 .
Като резултат химично взаимодействиесилицият може да отдаде своите валентни електрони, т.е. да бъде техен донор и да се превърне в положително зареден йон, или да приеме електрони от друг атом, т.е. е акцептор и се превръща в отрицателно зареден йон:
Si 0 -4e → Si 4+ ;
Si 0 +4e → Si 4- .
Молекула и атом на силиций
В свободно състояние силицийът съществува под формата на едноатомни Si молекули. Ето някои свойства, характеризиращи атома и молекулата на силиция:
Силициеви сплави
Силицият се използва в металургията. Той служи интегрална частмного сплави. Най-важните от тях са сплавите на основата на желязо, мед и алуминий.
Примери за решаване на проблеми
ПРИМЕР 1
| Упражнение | Колко силициев (IV) оксид, съдържащ 0,2 масови примеси, е необходим за получаване на 6,1 g натриев силикат. |
| Решение | Нека напишем уравнението на реакцията за получаване на натриев силикат от силициев (IV) оксид: SiO 2 + 2NaOH = Na 2 SiO 3 + H 2 O. Нека намерим количеството натриев силикат: n(Na 2 SiO 3) = m (Na 2 SiO 3) / M(Na 2 SiO 3); n(Na 2 SiO 3) = 6,1 / 122 = 0,05 mol. Според уравнението на реакцията n(Na 2 SiO 3) : n(SiO 2) = 1:1, т.е. n(Na 2 SiO 3) = n(SiO 2) = 0,05 mol. Масата на силициев (IV) оксид (без примеси) ще бъде равна на: M(SiO 2) = Ar(Si) + 2×Ar(O) = 28 + 2×16 = 28 + 32 = 60 g/mol. m чист (SiO 2) = n(SiO 2) × M(SiO 2) = 0,05 × 60 = 3 g. Тогава масата на силициевия (IV) оксид, необходима за реакцията, ще бъде равна на: m(SiO 2) = m чист (SiO 2)/w примеси = 3 / 0,2 = 15 g. |
| Отговор | 15 гр |
ПРИМЕР 2
| Упражнение | Каква маса натриев силикат може да се получи чрез сливане на силициев (IV) оксид с 64,2 g сода, масова частпримеси, в които е 5%? |
| Решение | Нека напишем уравнението на реакцията за получаване на натриев силикат чрез сливане на сода и силициев (IV) оксид: SiO 2 + Na 2 CO 3 = Na 2 SiO 3 + CO 2 -. Нека да определим теоретичната маса на содата (изчислена чрез уравнението на реакцията): n(Na 2 CO 3) = 1 mol. M(Na 2 CO 3) = 2×Ar(Na) + Ar(C) + 3×Ar(O) = 2×23 + 12 + 3×16 = 106 g/mol. m(Na 2 CO 3) = n(Na 2 CO 3) × M(Na 2 CO 3) = 1 × 106 = 106g. Нека намерим практическата маса на содата: w чист (Na 2 CO 3) = 100% - w примес = 100% - 5% = 95% = 0,95. m чист (Na 2 CO 3) = m (Na 2 CO 3) × w чист (Na 2 CO 3); m чист (Na 2 CO 3) = 64,2 × 0,95 = 61 g. Нека изчислим теоретичната маса на натриевия силикат: n(Na 2 SiO 3) = 1 mol. M(Na 2 SiO 3) = 2×Ar(Na) + Ar(Si) + 3×Ar(O) = 2×23 + 28 + 3×16 = 122 g/mol. m(Na 2 SiO 3) = n(Na 2 SiO 3) × M(Na 2 SiO 3) = 1 × 122 = 122g. Позволявам практическо теглонатриев силикат е равен на x g. Нека направим пропорцията: 61 g Na 2 CO 3 - x g Na 2 SiO 3; 106 g Na 2 CO 3 - 122 g Na 2 SiO 3. Следователно x ще бъде равно на: x = 122 × 61 / 106 = 70,2 g. Това означава, че масата на освободения натриев силикат е 70,2 g. |
| Отговор | 70,2 g |
Силицият е твърд неметал, който е част от скалите. При нормални условия е инертен, но при нагряване проявява окислителни и редуциращи свойства. Химични свойстваСилицият се използва от силикатната индустрия за производство на стъкло, огледала, електроника и строителни материали.
Общо описание на елемента
Силицият се намира в четвърта група и трети период на периодичната система. Ядрото на силициевия атом има положителен заряд +14. Около ядрото се движат 14 отрицателно заредени електрона.
Атомът може да премине във възбудено състояние поради свободно d-подниво. Следователно елементът проявява две положителни степени на окисление (+2 и +4) и една отрицателна (-4). Електронната конфигурация е 1s 2 2s 2 2p 6 3s 2 3p 2.

Ориз. 1. Строеж на силициевия атом.
Силицият е чуплив полупроводник с високи температуридъска и се вари. Сравнително лек неметал: плътността е 2,33 g/cm 3 .
Силицият не се среща в чиста форма. Влиза в състава на пясък, кварц, ахат, аметист и други скали.

Ориз. 2. Ахат.
Реакции с неметали
При взаимодействие с неметали силицийът проявява редуциращи свойства - отдава електрони. Реакциите са възможни само при висока температура. При нормални условиясилицият реагира само с флуор. Реакциите с основни неметали са дадени в таблицата.
Силициев хидрид - силан (SiH 4) - може да се получи чрез разлагане на силициди с киселина. Например, Mg 2 Si + 2H 2 SO 4 → SiH 4 - + 2MgSO 4.
Взаимодействие с метали
Силицият проявява окислителни свойства само при реакции с метали. При сливане се образуват соли - силициди:
- Si + 2Mg → Mg 2 Si;
- Si + 2Ca → Ca 2 Si;
- Si + Na → NaSi;
- 2Si + Fe → FeSi 2 .
Силицидите се използват индустриално за производство на сплави и материали. Ванадиевият силицид (V 3 Si) се използва като свръхпроводник, рениевият силицид (ReSi) се използва като полупроводник.
Реакции със сложни вещества
Освен това прости веществасилицият реагира със сложни съединения - киселини и основи. Основните реакции са описани в таблицата.
При 1200°C силицият реагира с диоксид, образувайки монооксид: Si + SiO 2 → SiO.

Ориз. 3. Приложение на силиций.
Какво научихме?
Силицият е крехък неметал, който реагира с метали, неметали и сложни вещества. При реакции с метали проявява свойствата на окислител, а с неметалите - на редуциращ агент. При нормални условия той реагира само с флуор, флуороводородна киселина (включително азотна киселина) и основи. Други реакции протичат при повишени температури.
Тест по темата
Оценка на доклада
Среден рейтинг: 4.6. Общо получени оценки: 204.