Първият закон на термодинамиката, изразяващ закона за запазване и трансформация на енергията, не ни позволява да установим посоката на потока термодинамични процеси. Освен това е възможно да си представим много процеси, които не противоречат на първия принцип, при които енергията се запазва, но в природата те не се срещат. Появата на втория закон на термодинамиката - необходимостта да се отговори на въпроса кои процеси в природата са възможни и кои не - определя посоката на развитие на процесите.
Използвайки концепцията за ентропия и неравенството на Клаузиус, втори закон на термодинамикатаможе да се формулира като закон за нарастване на ентропиятазатворена система с необратими процеси: всеки необратим процес в затворена система възниква по такъв начин, че ентропията на системата се увеличава.
Можем да дадем най-кратката формулировка на втория закон на термодинамиката: в процесите, протичащи в затворена система, ентропията не намалява. Важното тук е това ние говорим заО затворени системи, тъй като в отворените системи ентропията може да се държи по всякакъв начин (намалява, увеличава, остава постоянна). Освен това отново отбелязваме, че ентропията остава постоянна в затворена система по време на обратими процеси. При необратими процеси в затворена система ентропията винаги нараства.
2.10 Топлинни двигатели и хладилни машини.
Цикъл на Карно и неговата ефективност
за идеален газ.
От втория закон на термодинамиката на Келвин следва, че вечни двигатели от втори вид– периодично работещ двигател, който извършва работа чрез охлаждане на един източник на топлина, е невъзможен. За да илюстрираме тази точка, разгледайте работата на топлинен двигател.
Принципът на работа на топлинния двигател е показан на фиг. 63. От термостат с повече висока температура T 1, наречен нагревателна цикъл се отнема количеството топлина Q 1 и термостатът с по-ниска температура T 2, т.нар. хладилник, количеството топлина Q 2 се пренася за цикъл, докато се извършва работа A=Q 1 –Q 2.
За да бъде топлинният коефициент на полезно действие на една топлинна машина h =1, трябва да е изпълнено условието Q 2 =0, т.е. един топлинен двигател трябва да има един източник на топлина, но това е невъзможно. Така френският физик и инженер N. L. S. Carnot показа, че за да работи топлинен двигател, са необходими поне два източника на топлина с различни температури, в противен случай това би противоречило на втория закон на термодинамиката.
Ориз. 2.10.1 Фиг. 2.10.2
Процесът, обратен на това, което се случва в топлинния двигател, се използва в хладилна машина, чийто принцип на работа е представен в
ориз. 2.10.2.
По време на цикъл системата отнема количеството топлина Q 2 от термостата с по-ниска температура T 2 и отдава количеството топлина Q 1 на термостата с по-висока температура T 1 . За кръгов процес Q=A, но по условие Q=Q 2 –Q 1<0, поэтому А<0 и Q 2 –Q 1 = -А, или Q 1 =Q 2 +А, т.е. количество теплоты Q 1 , отданное системой источнику теплоты при более высокой температуре T 1 , больше количества теплоты Q 2 , полученного от источника теплоты при более низкой температуре Т 2 , на величину работы, совершенной над системой. Следовательно, без совершения работы нельзя отбирать теплоту от менее нагретого тела и отдавать ее более нагретому. Это утверждение есть не что
различен от втория закон на термодинамиката, както е формулиран от Клаузиус.
Вторият закон на термодинамиката обаче не трябва да се представя по такъв начин, че напълно да забранява предаването на топлина от по-малко нагрято тяло към по-нагрято. В края на краищата точно такъв преход се извършва в хладилната машина. Но трябва да помним, че външните сили действат върху системата, т.е. този преход не е единственият резултат от процеса.
Въз основа на втория закон на термодинамиката, Карно извежда теоремата, която сега носи неговото име: от всички периодично работещи топлинни двигатели, които имат еднакви температури на нагреватели (T 1) и хладилници (T 2 ), Реверсивните машини имат най-голяма ефективност; в този случай ефективността на обратимите машини, работещи при еднакви температури на нагреватели (T 1) и хладилници (T 2), са равни помежду си и не зависят от естеството на работния флуид.
Карно теоретично анализира обратимия най-икономичен цикъл, състоящ се от две изотерми и две адиабати, и нарече
Цикъл на Карно. Нека разгледаме директен цикъл на Карно, при който като работна течност се използва идеален газ, затворен в съд с подвижно бутало.
При изотермичен процес U=const, следователно количеството топлина Q 1, получено от газа от нагревателя, е равно на работата на разширение A 12, извършена от газа по време на прехода от състояние 1 към състояние 2:
 . (2.10.1)
. (2.10.1)
По време на адиабатно разширение 2-3 топлообмен с заобикаляща средаотсъства и работата на разширение A 23 се извършва поради промяна на вътрешната енергия:
![]() .
.
2.3.1. Обратими и кръгови процеси
Обратим процесе процес, който може да се извърши в обратна посокапо такъв начин, че системата ще премине през същите термодинамични състояния, както при директния процес, но в обратен ред. Само равновесен процес може да бъде обратим.
Обратимият процес има следното свойство: ако по време на ход напред в някаква елементарна секция системата получава топлина dQ и извършва работа dA, тогава по време на обратен ход в същата секция системата отделя топлина dQ" = dQ и над неясе извършва работа dA" = dA. Поради тази причина след протичане на обратимия процес в една и след това в обратна посока и системата се върне в първоначалното си състояние, не трябва да настъпват промени в телата около системата.
Кръгов процес (цикъл)е процес, при който системата след поредица от промени се връща в първоначалното си състояние. На графиката цикълът е изобразен като затворена крива (фиг. 2.3.1).
Ориз. 2.3.1. Кръгов термодинамичен процес
Работата, извършена в кръгов процес, е числено равна на площта, покрита от кривата. Наистина, работата в раздел 1-2 е положителна и е числено равна на площта, отбелязана с щриховката, наклонена надясно. Работата в зона 2-1 е отрицателна и е числено равна на зоната, маркирана с щриховка, наклонена наляво. Следователно работата за цикъл е числено равна на площта, покрита от кривата.
След завършване на цикъла системата се връща в първоначалното си състояние.
2.3.2. Коефициент на ефективност
действие на топлинен двигател
Всеки двигател е система, която многократно изпълнява някакъв кръгов процес (цикъл). Да предположим, че по време на цикъла работното вещество (например газ) първо се разширява до обем V 2 и след това отново се свива до първоначалния обем V 1 (фиг. 2.3.2).

Ориз. 2.3.2. Да се изчисли ефективността на топлинен двигател
За да бъде работата на цикъл по-голяма от нула, налягането (и следователно температурата) по време на процеса на разширение трябва да бъде по-голямо, отколкото по време на компресия. За да направите това, топлината трябва да бъде добавена към работното вещество по време на разширение и топлината трябва да бъде отнета от него по време на компресия.
Нека напишем първия закон на термодинамиката за двете части на цикъла. По време на разширението вътрешната енергия се променя от стойността U 1 на U 2, докато системата получава топлина Q 1 и извършва работа A 1. Следователно се изпълнява:
По време на компресията системата извършва работа A 2 и отделя топлина Q 2, което е еквивалентно на получаване на топлина Q 2. следователно
Добавяйки уравнения (2.3.1) и (2.3.2), получаваме:
Тъй като A 1 + A 2 е общата работа A, извършена от системата за цикъл, можем да запишем:
Нарича се периодично работещ двигател, който извършва работа, използвайки топлина, получена отвън топлинен двигател.
Първият закон на термодинамиката понякога се формулира по следния начин: периодично работещ вечен двигател (perpetuum mobile) от първи вид, извършващ работа в по-големи количества, отколкото получава енергия отвън, невъзможен.
Както следва от (2.3.4), не цялата топлина Q 1, получена отвън, се използва за производство на полезна работа. За да може двигателят да работи в цикли, част от топлината Q 2 трябва да се върне във външната среда и следователно не се използва по предназначение. Очевидно е, че колкото по-пълно един топлинен двигател преобразува получената отвън топлина Q 1 в полезна работа A, толкова по-печеливша е тази машина. Следователно, топлинният двигател обикновено се характеризира с неговия коефициент на ефективност (КПД), който се определя като съотношението на извършената работа за цикъл към количеството топлина, получено за цикъл Q 1:
От определението за ефективност следва, че тя не може да бъде по-голяма от единица.
2.3.3. Втори закон на термодинамиката
Вторият закон на термодинамиката, подобно на първия, може да бъде формулиран по няколко начина. В своята най-очевидна формулировка вторият закон гласи, че:
Спонтанното предаване на топлина от по-слабо нагрято тяло към по-силно нагрято тяло е невъзможно. По-точно, невъзможни са такива процеси, чийто единствен краен резултат би бил преносът на топлина от по-малко нагрято тяло към по-нагрято тяло.
Друга формулировка: невъзможни са такива процеси, единственият краен резултат от които би бил отнемането на определено количество топлина от определено тяло и пълното превръщане на тази топлина в работа.
Работата може напълно да се превърне в топлина, например чрез триене, обратното не е вярно.
2.3.4. Цикъл на Карно
Да приемем, че всяко тяло може да влезе в топлообмен с два топлинни резервоара с температури T 1 и T 2 и безкрайно голям топлинен капацитет. Това означава, че получаването или отделянето на ограничено количество топлина от тези резервоари не променя тяхната температура. Нека разберем какъв обратим цикъл може да извърши тялото при такива условия.
Разглежданият цикъл може да се състои както от процеси, по време на които тялото обменя топлина с резервоари, така и процеси, които не са придружени от топлообмен с околната среда, т.е. протичащи адиабатно.
Процес, придружен от обмен на топлина с резервоари, може да бъде обратим само ако по време на този процес телесната температура е равна на температурата на съответния резервоар. Това е изотермичен процес, протичащ при температура на резервоара.
Обратим цикъл, извършван от тяло (или система), влизащо в топлообмен с два топлинни резервоара с безкрайно голям капацитет, ще се състои от две изотери (при температурите на резервоарите) и две адиабати. Това - Цикъл на Карно.
Нека разгледаме как може да се осъществи цикълът на Карно с газ като работно вещество. Нека поставим газа в цилиндър, затворен с плътно прилепнало бутало. Нека стените и буталото са направени от материали, които не са топлопроводими, а дъното на цилиндъра, напротив, е направено от материал с висока топлопроводимост. Топлинният капацитет на цилиндъра и буталото се счита за безкрайно малък.
Нека буталото първоначално заеме позиция, съответстваща на обема V 1 и температурата на газа T 1 . Нека поставим цилиндъра върху резервоар с температура T 1 и оставим газа да се разшири много бавно до обем V 2 . В този случай газът ще получи топлина Q 1 от резервоара (фиг. 2.3.3).

Ориз. 2.3.3. Топлинна машина, работеща по цикъла на Карно
След това изваждаме цилиндъра от резервоара, затваряме дъното с топлоизолационен капак и оставяме газа да се разширява адиабатично, докато температурата му падне до стойността T 2. В резултат на това обемът на газа ще стане равен на V3. След като отстраним топлоизолационния капак, поставяме цилиндъра върху резервоар с температура T 2 и компресираме газа изотермично до такъв обем V 4, че при последващо адиабатно компресиране, когато се достигне температурата T 1, обемът получава стойността V 1 (в противен случай цикълът няма да се затвори). Накрая изваждаме цилиндъра от резервоара, затваряме дъното с топлоизолационен капак и, компресирайки газа адиабатно, го довеждаме до първоначалното му състояние (температура T 1, обем V 1).
Ако газът е идеален, съответният цикъл на (p-V) диаграмата има формата, показана на фиг. 2.3.4.

Ориз. 2.3.4. (p-V) Диаграма на цикъла на Карно
2.3.5. Ефективност на цикъла на Карно за идеален газ
Помислете за цикъла на Карно за идеален газ. Ефективността на топлинния двигател е:
където Q 1 е топлината, получена за цикъл от нагревателя, Q 2 е топлината, отдадена на хладилника за цикъл.
При изотермичен процес вътрешната енергия на идеален газ остава постоянна. Следователно количеството топлина Q1, получено от газа, е равно на работата A12, извършена от газа по време на прехода от състояние 1 към състояние 2 (фиг. 2.3.4). Тази работа може да се изчисли, както следва:
Използвайки уравнението на Клапейрон-Менделеев, получаваме:
където m е масата на идеален газ в топлинна машина.
Количеството топлина Q 2, отдадено на хладилника, е равно на работата A 34, изразходвана за компресиране на газа при прехвърлянето му от състояние 3 в състояние 4. Тази работа е равна на:
За да бъде затворен цикълът, състояния 4 и 1 трябва да лежат на една и съща адиабата. От тук, използвайки (2.1.68), можем да получим:
По подобен начин, тъй като състояния 2 и 3 лежат на една и съща адиабата, важи следното:
Разделяйки (2.3.11) на (2.3.10), стигаме до условието за затворен цикъл:
Накрая, като вземем предвид условието (2.3.12), за ефективността на топлинен двигател, работещ съгласно цикъла на Карно за идеален газ, получаваме:
Следователно ефективността на цикъла на Карно за идеален газ се оказва, че зависи само от температурата на нагревателя и хладилника.
Дори за най-добрата топлинна машина, работеща според цикъла на Карно, ефективността винаги е значително по-малка от единица. Ако, например, температурата на нагревателя T 1 = 373 K (точка на кипене на водата) и температурата на хладилника T 2 = 293 K (стайна температура), тогава η = 22%. И тази ефективност е горната (и недостижима) граница. В реални машини, например на парни локомотиви, той рядко надвишава 10%.
2.3.6. Ентропия
Нека обърнем внимание на промените, които работният флуид претърпя по време на кръговия цикъл на Карно. От първоначалното състояние 1 (налягане p 1, температура T 1) работният флуид чрез последователни изотермични и адиабатни разширения преминава в състояние 3, когато поема температурата на хладилника T 2. Тази промяна в състоянието се дължи на топлината Q 1, доставена на работния флуид от нагревателя. Обратният преход на работната течност от състояние 3 в изходно състояние 1 се осъществява чрез две последователни изотермични и адиабатни компресии на тялото. Количеството топлина, отделено по време на това връщане към първоначалното състояние, е равно на Q 2 и Q 2< Q 1 . Таким образом, оказывается, что обратимый переход одного и того же тела из состояния 1 → 3 и обратный переход 3 → 1 сопровождаются неодинаковыми количествами поглощенного и выделенного тепла. Очевидно, что это связано с тем, что оба перехода были проведены различными путями: в одном случае (1 → 3) процесс расширения происходил при давлении более высоком, чем процессы сжатия в другом (3 → 1). Ясно, что если бы мы осуществили переход 3 → 1 тем же путем, что и прямой, т.е. по кривой 3 → 2 → 1, а не по кривой 3 → 4 → 1 (), то количество тепла, затраченного при прямом переходе, в точности равнялось бы количеству тепла, выделившемуся при обратном переходе.
От това следва важен извод: количеството топлина, което трябва да се достави на тялото или да се отнеме от него по време на прехода от едно състояние в друго, не се определя еднозначно от началното и крайното състояние, а значително зависи от начина на пренасяне. извън този преход.
Въпреки това, въпреки че самите количества топлина - Q 1, доставени на работното тяло от нагревателя при температура T 1, и Q 2, предадени от работното тяло на хладилника при температура T 2 - не са равни помежду си, както следва от сравнение на формули (), () и (), съотношенията на тези топлина към температурите, при които са били абсорбирани или освободени, са числено равни една на друга (но имат противоположни знаци):
Отношението се нарича, следвайки Лоренц, намалена топлина. От (2.3.15) следва, че получените и предадени от работния флуид намалени топлина по време на кръгов процес са равни една на друга.
Нека обобщим този резултат. В общия случай всяка промяна в състоянието на тяло или система от тела може да се представи като резултат от безкрайно голям брой безкрайно малки промени. За всяка такава безкрайно малка промяна системата или абсорбира, или освобождава безкрайно малко количество топлина dQ (ако процесът не е адиабатен). Нека dQ > 0, когато системата абсорбира топлина. където dQ е количеството топлина, отведено от тялото M при температура T, dQ" е количеството топлина, прехвърлено към резервоара при температура T 1.
Ако Т 1< T, резервуар играет роль холодильника, а тело М - нагревателя, и наоборот.
След като тялото M завърши кръговия процес, общото количество топлина, загубено от тялото, както следва от (2.3.17), трябва да бъде равно на . Тъй като топлинният капацитет на резервоара е голям и температурата му остава постоянна, тази стойност ще бъде равна на: .
Процесът, извършван от тялото, е кръгов. Следователно в крайна сметка не претърпя никакви промени. Ако интегралът (2.3.16) се окаже положителен, това би означавало, че количеството топлина, загубено от тялото, е изцяло преобразувано в работа, докато тялото M не е променило състоянието си. Това обаче противоречи на втория закон на термодинамиката. Това означава, че предположението, че . По същия начин може да се покаже, че посоченият интеграл не може да бъде отрицателен. Но ако тя не може да бъде нито положителна, нито отрицателна, тогава това означава, че за обратимите кръгови процеси е валидно следното:
Ентропията на изолирана система може само да се увеличи (ако в системата протича необратим процес) или да остане постоянна в случай на обратим процес.
Нернст доказа теорема (понякога наричана трети закон на термодинамиката), според която, тъй като абсолютната температура клони към нула, ентропията на всяко тяло също клони към нула:
Тогава ентропията на състоянието на тялото при температура T може да се изчисли по следния начин.
Втори закон на термодинамиката– топлината не може спонтанно да премине от по-малко нагрято тяло към по-нагрято тяло. Топлината се отнася до вътрешната енергия на тялото.
Помислете за система, способна да контактува с два термални резервоара. Температури на резервоара (нагревател)И (хладилник).. В първоначалното състояние (точка 1) температурата на системата е . Нека го поставим в термичен контакт с нагревателя и, като квазистатично намалим налягането, увеличим обема.
Системата премина в състояние със същата температура, но с по-голям обем и по-ниско налягане (позиция 2). В същото време системата извършва работа и нагревателят прехвърля количество топлина към нея. След това премахваме нагревателя и квазистатично адиабатно прехвърляме системата в състояние с температура (т. 3). В този случай системата ще извърши работата. След това привеждаме системата в контакт с хладилника и статично намаляваме обема на системата. Количеството топлина, което ще отдели системата, ще бъде погълнато от хладилника - температурата му ще остане същата.В системата е извършена работа (или системата е извършила отрицателна работа – ). Състоянието на системата (точка 4) е избрано така, че да е възможно адиабатно връщане на системата в нейното първоначално състояние (точка 1). В този случай системата ще извърши отрицателна работа. системата се върна в първоначалното си състояние, тогава вътрешната енергия след цикъла остана същата, но работата беше извършена от системата. От това следва, че промените в енергията по време на работа са компенсирани от нагревателя и хладилника. Средства ![]() , е количеството топлина, изразходвано за извършване на работата. Ефективност
(ефективност) се определя по формулата:
, е количеството топлина, изразходвано за извършване на работата. Ефективност
(ефективност) се определя по формулата:
![]() .
.
Следва, че .
Теорема на Карно
гласи че Коефициентът на полезно действие на топлинна машина, работеща по цикъла на Карно, зависи само от температурите както на нагревателя, така и на хладилника, но не зависи от конструкцията на машината, както и от вида на работното вещество.
Втората теорема на Карно гласи: коефициентът на полезно действие на която и да е топлинна машина не може да надвишава коефициента на полезно действие на идеална машина, работеща по цикъла на Карно с еднакви температури на нагревателя и хладилника.
Неравенство на Клаузиус:
Това показва, че количеството топлина, което системата е получила по време на кръгов процес, свързано с абсолютната температура, при която се е случил процесът, е неположителна величина. Ако процесът е квазистатичен, тогава неравенството се превръща в равенство:
Това означава, че намаленото количество топлина, получено от системата по време на всеки квазистатичен кръгов процес, е равно на нула .
– елементарно намалено количество топлина, получено в безкрайност
малък процес.
– елементарно намалено количество топлина, получено във финала
процес.
Ентропия на системата Има функция на неговото състояние, дефинирана с точност до произволна константа.
Ентропийна разлика
в две равновесни състояния и, по дефиниция, е равно на намаленото количество топлина, което трябва да бъде предадено на системата, за да се прехвърли от състояние в състояние по който и да е квазистатичен път.
Ентропията се изразява чрез функцията:
.
 Да приемем, че системата преминава от състояние на равновесие към състояние на равновесие по пътя и преходът е необратим (защрихована линия). Една квазистатична система може да бъде върната в първоначалното си състояние по друг път. Въз основа на неравенството на Клаузиус можем да напишем:
Да приемем, че системата преминава от състояние на равновесие към състояние на равновесие по пътя и преходът е необратим (защрихована линия). Една квазистатична система може да бъде върната в първоначалното си състояние по друг път. Въз основа на неравенството на Клаузиус можем да напишем:
 Равновесно състояниетермодинамичната система се определя от постоянството на стойностите на макроскопичните количества, характеризиращи това състояние. Обратим се нарича термодинамичен процес A→B, който, когато се извършва в обратна посока, връща системата в първоначалното й състояние, преминавайки през същите междинни състояния в обратен ред, докато състоянието на телата извън термодинамичната система остава непроменено. P A Обратим B V A B Квазистатичен - процес, при който системата остава в състояние на равновесие през цялото време. Циркуляр D C
Равновесно състояниетермодинамичната система се определя от постоянството на стойностите на макроскопичните количества, характеризиращи това състояние. Обратим се нарича термодинамичен процес A→B, който, когато се извършва в обратна посока, връща системата в първоначалното й състояние, преминавайки през същите междинни състояния в обратен ред, докато състоянието на телата извън термодинамичната система остава непроменено. P A Обратим B V A B Квазистатичен - процес, при който системата остава в състояние на равновесие през цялото време. Циркуляр D C
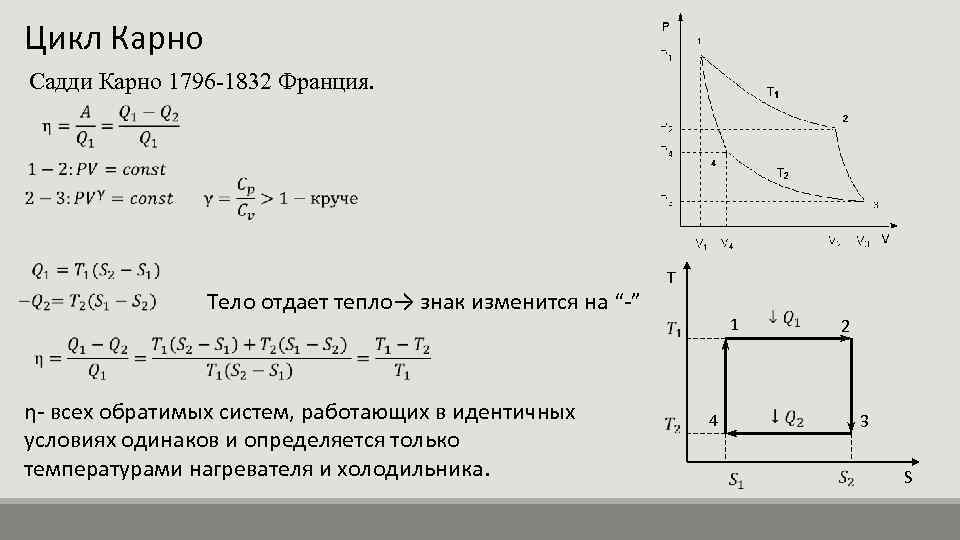 Цикъл на Карно Сади Карно 1796 -1832 Франция. Тялото отделя топлина → знакът ще се промени на “-” η- всички обратими системи, работещи при еднакви условия, са еднакви и се определят само от температурите на нагревателя и хладилника. T 1 4 2 3 S
Цикъл на Карно Сади Карно 1796 -1832 Франция. Тялото отделя топлина → знакът ще се промени на “-” η- всички обратими системи, работещи при еднакви условия, са еднакви и се определят само от температурите на нагревателя и хладилника. T 1 4 2 3 S
 При необратим адиабатичен процес увеличението на ентропията η на всяка необратима машина винаги е по-малко от η на обратима машина, работеща при същите условия. Термична машина. 1 2 4 3
При необратим адиабатичен процес увеличението на ентропията η на всяка необратима машина винаги е по-малко от η на обратима машина, работеща при същите условия. Термична машина. 1 2 4 3
 Предвестници на 2-ри закон на термодинамиката. Възможно ли е да се изгради периодично работещ топлинен двигател без хладилник? . Q 2=0 => такава машина би преобразувала цялата топлина, заета от нагревателя, в работа. Тук не се нарушава законът за запазване на енергията. Тогава става възможно да се създаде перпетуум мобиле от 2-ри вид (perpetuum mobile от 2-ри вид) => Заемаме топлина от „неограничен“ източник (от океана, атмосферата, недрата на Земята) и го въртим в работата. ...топлинна и вечен двигател => Вилхелм Оствалд (1853 -1932)
Предвестници на 2-ри закон на термодинамиката. Възможно ли е да се изгради периодично работещ топлинен двигател без хладилник? . Q 2=0 => такава машина би преобразувала цялата топлина, заета от нагревателя, в работа. Тук не се нарушава законът за запазване на енергията. Тогава става възможно да се създаде перпетуум мобиле от 2-ри вид (perpetuum mobile от 2-ри вид) => Заемаме топлина от „неограничен“ източник (от океана, атмосферата, недрата на Земята) и го въртим в работата. ...топлинна и вечен двигател => Вилхелм Оствалд (1853 -1932)
 Способността за извършване на работа от топлинни двигатели се дължи на преноса на топлина от по-нагрято тяло към по-малко нагрято тяло.
Способността за извършване на работа от топлинни двигатели се дължи на преноса на топлина от по-нагрято тяло към по-малко нагрято тяло.




 Ентропията и за -намалена топлина е Но съотношението е функция на състоянието на системата - ентропия, където S е параметър на състоянието (както и P, V, T) В затворена или изолирана система, по време на възникването на всеки обратим процес ентропията остава непроменена
Ентропията и за -намалена топлина е Но съотношението е функция на състоянието на системата - ентропия, където S е параметър на състоянието (както и P, V, T) В затворена или изолирана система, по време на възникването на всеки обратим процес ентропията остава непроменена
 Когато в затворена термодинамична система протича необратим процес, ентропията на системата нараства, достигайки своя максимум в състоянието на равновесие на системата. Ако, тогава всякакви промени в системата без външно влияние са невъзможни. - за обратим процес - за необратим процес Ентропията е мярка за отклонението на реален процес от идеален.
Когато в затворена термодинамична система протича необратим процес, ентропията на системата нараства, достигайки своя максимум в състоянието на равновесие на системата. Ако, тогава всякакви промени в системата без външно влияние са невъзможни. - за обратим процес - за необратим процес Ентропията е мярка за отклонението на реален процес от идеален.
 I-начало: II-начало: В затворена или изолирана система, по време на необратим процес, ентропията на системата нараства, достигайки своя максимум в състоянието на равновесие на системата. Ако системата е в състояние на равновесие, тогава всякакви промени в системата без външно влияние са невъзможни. Ентропията на една затворена система може само да нараства. 1. Установява наличието на фундаментална асиметрия в природата – еднопосочността на всички спонтанно протичащи в природата процеси. 2. Количеството енергия в затворените системи се запазва, но разпределението на енергията се променя необратимо. III-начало: Ако T→ 0, тогава S→ 0, т.е. невъзможно е веществото да се охлади до температурата на абсолютната нула.
I-начало: II-начало: В затворена или изолирана система, по време на необратим процес, ентропията на системата нараства, достигайки своя максимум в състоянието на равновесие на системата. Ако системата е в състояние на равновесие, тогава всякакви промени в системата без външно влияние са невъзможни. Ентропията на една затворена система може само да нараства. 1. Установява наличието на фундаментална асиметрия в природата – еднопосочността на всички спонтанно протичащи в природата процеси. 2. Количеството енергия в затворените системи се запазва, но разпределението на енергията се променя необратимо. III-начало: Ако T→ 0, тогава S→ 0, т.е. невъзможно е веществото да се охлади до температурата на абсолютната нула.

 - МАЛЦИНА! Истинските
- МАЛЦИНА! Истинските
 2. Клаузиус (1822 – 1888) през 1850 г. „Топлината не може спонтанно да премине от по-малко нагрято тяло към по-нагрято тяло. „Като цяло „тя“ е възможна. Но това е невъзможно при условие, че не са настъпили промени във всички други органи. Хладилник, но процесът не е спонтанен, а е придружен от работата на електрически двигател. 3. Твърдението на Нернст: ентропията на всяко тяло клони към нула при T → 0. Обратим процес е процес, при който системата преминава от състояние A в B и е възможно да се върне поне по един начин в първоначалното състояние А и освен това по такъв начин, че във всички останали тела не са претърпели никакви промени.
2. Клаузиус (1822 – 1888) през 1850 г. „Топлината не може спонтанно да премине от по-малко нагрято тяло към по-нагрято тяло. „Като цяло „тя“ е възможна. Но това е невъзможно при условие, че не са настъпили промени във всички други органи. Хладилник, но процесът не е спонтанен, а е придружен от работата на електрически двигател. 3. Твърдението на Нернст: ентропията на всяко тяло клони към нула при T → 0. Обратим процес е процес, при който системата преминава от състояние A в B и е възможно да се върне поне по един начин в първоначалното състояние А и освен това по такъв начин, че във всички останали тела не са претърпели никакви промени.
 Втори закон на термодинамиката. Посоката на термодинамичните процеси в изолирана система → към състояния, чиято вероятност е максимална: --Пренос на топлина => изравняване на температурата. --Дифузия => хомогенен газ не може да се събере в едната половина на съда. Ентропия. Статистическо тегло - броят на различните микросъстояния, чрез които се реализира дадено макросъстояние w; Всички макросъстояния са в равновесие => вероятността за макросъстояние е пропорционална на статистическата му тежест. – ентропия – характеризира вероятността за състоянието на дадена термодинамична система.
Втори закон на термодинамиката. Посоката на термодинамичните процеси в изолирана система → към състояния, чиято вероятност е максимална: --Пренос на топлина => изравняване на температурата. --Дифузия => хомогенен газ не може да се събере в едната половина на съда. Ентропия. Статистическо тегло - броят на различните микросъстояния, чрез които се реализира дадено макросъстояние w; Всички макросъстояния са в равновесие => вероятността за макросъстояние е пропорционална на статистическата му тежест. – ентропия – характеризира вероятността за състоянието на дадена термодинамична система.
 Невъзможност за вечен двигател от 2-ри вид. Самите молекули се събират в ½ част от съда и след това, поради подадената топлина, разширявайки се изотермично, те вършат работа: всичко изглежда наред, ако молекулите действително циклично се събират спонтанно в ½ част от обема на съда. Но ентропията на топлинния двигател се увеличава! но от тогава
Невъзможност за вечен двигател от 2-ри вид. Самите молекули се събират в ½ част от съда и след това, поради подадената топлина, разширявайки се изотермично, те вършат работа: всичко изглежда наред, ако молекулите действително циклично се събират спонтанно в ½ част от обема на съда. Но ентропията на топлинния двигател се увеличава! но от тогава
 Връзка между ентропия и вероятност. Всеки процес в природата протича по такъв начин, че системата преминава в състояние, чиято вероятност е по-голяма. Ако системата е в състояние с дадена ентропия, тогава с голяма вероятност трябва да се очаква, че тя ще премине в състояние с по-висока ентропия, т.е. че най-вероятната промяна в ентропията е нейното увеличаване. Но са възможни и процеси с намаляване на ентропията - флуктуации на ω в средния растеж.
Връзка между ентропия и вероятност. Всеки процес в природата протича по такъв начин, че системата преминава в състояние, чиято вероятност е по-голяма. Ако системата е в състояние с дадена ентропия, тогава с голяма вероятност трябва да се очаква, че тя ще премине в състояние с по-висока ентропия, т.е. че най-вероятната промяна в ентропията е нейното увеличаване. Но са възможни и процеси с намаляване на ентропията - флуктуации на ω в средния растеж.
В термодинамиката Цикъл на Карноили Процес на Карное обратим кръгов процес, състоящ се от два адиабатични и два изотермични процеса. В процеса на Карно термодинамична система извършва механична работа и обменя топлина с два термични резервоара, които имат постоянни, но различни температури. Резервоар с по-висока температура се нарича нагревател, а този с по-ниска температура се нарича хладилник.
Цикълът на Карно е кръстен на френския учен и инженер Сади Карно, който за първи път го описва в есето си „За движеща силаогън и за машини, способни да развият тази сила“ през 1824 г
Тъй като обратимите процеси могат да протичат само при безкрайно малка скорост, мощността на топлинния двигател в цикъла на Карно е нула. Мощността на реалните топлинни двигатели не може да бъде равна на нула, следователно реалните процеси могат да се доближат до идеалния обратим процес на Карно само с по-голяма или по-малка степен на точност. В цикъла на Карно топлинният двигател преобразува топлината в работа с възможно най-високата ефективност от всички топлинни двигатели, чиито максимални и минимални температури в работния цикъл съвпадат съответно с температурите на нагревателя и охладителя в цикъла на Карно.
Описание на цикъла на Карно
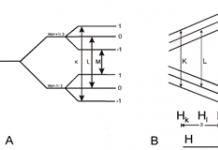
Цикъл на Карно в координати Т-С
Нека топлинният двигател се състои от нагревател с температура , хладилник с температура и работен флуид.
Цикълът на Карно се състои от четири обратими етапа, два от които протичат при постоянна температура (изотермични) и два при постоянна ентропия (адиабатични). Следователно е удобно да се представи цикълът на Карно в координати T(температура) и С(ентропия).
1. Изотермично разширение(на фиг. 1 - процес A→B). В началото на процеса работната течност има температура, т.е. температурата на нагревателя. След това тялото влиза в контакт с нагревател, който пренася количество топлина към него изотермично (при постоянна температура). В същото време обемът на работната течност се увеличава, тя извършва механична работа и нейната ентропия нараства.
2. Адиабатно разширение(на фиг. 1 - процес B→C). Работната течност е изключена от нагревателя и продължава да се разширява без топлообмен с околната среда. В този случай температурата на тялото намалява до температурата на хладилника, тялото извършва механична работа и ентропията остава постоянна.
3. Изотермична компресия(на фиг. 1 - процес B→G). Работната течност, която има температура , влиза в контакт с хладилника и започва да се компресира изотермично под въздействието на външна сила, отдавайки количество топлина на хладилника. Върху тялото се работи, ентропията му намалява.
4. Адиабатна компресия(на фиг. 1 - процес G→A). Работната течност се отделя от хладилника и се компресира под въздействието на външна сила без топлообмен с околната среда. В същото време температурата му се повишава до температурата на нагревателя, върху тялото се извършва работа, ентропията му остава постоянна.
Ефективност на топлинна машина на Карно
Количеството топлина, получено от работния флуид от нагревателя по време на изотермично разширение, е равно на
По същия начин, по време на изотермично компресиране работният флуид се освобождава в хладилника
Следователно коефициентът на полезно действие на топлинната машина на Карно е равен на
![]() .
.