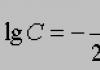Урок № 9 клас дата: _____
Тема на урока. Хлороводород: получаване и свойства.
Тип урок: комбиниран урок.
Целта на урока: разгледайте методите за производство и свойствата на хлороводорода; научете да свързвате областите на приложение на хлороводорода с неговите свойства.
Цели на урока:
Образователни: запознайте учениците с химичната формула и структурата на молекулата на хлороводорода, физични и химични свойства, получаване и използване на хлороводород.
Методи и техники:
Оборудване: учебник “Химия 9 клас” Рудзитис Г.Е., Фелдман Ф.Г.; периодичната таблица химически елементи DI. Менделеев; карти с индивидуални задачи, листовки.
ПО ВРЕМЕ НА ЗАНЯТИЯТА
Организиране на времето.
Проверка на домашните.
Фронтален разговор.
- Разкажете ни за физичните свойства на хлора (хлорът е газ, жълто-зелен на цвят, има остра, задушлива миризма. Отровен за всички живи организми. 2,5 пъти по-тежък от въздуха. Кипи при температура +15 ºС).
Как се променя химическата активност на халогените от флуор към йод? (флуорът е химически най-активен, а йодът е най-малко активен).
Как се променя активността на изместване на халогените в разтвори на техните соли? (по-активните халогени изместват по-малко активните халогени от техните съединения).
С какви прости вещества реагира хлорът? (с метали и водород).
Опишете взаимодействието на хлора с водата, разкривайки същността на реакцията (кл 2 + з 2 О = НС1 + HClO. Обменната реакция води до образуването на две киселини: солна и хипохлорна; OVR).
- Разкажете ни за възможни случаи на реакция на хлор с водород, механизма и същността на реакцията (хлорът реагира с водород на светлина, както и при нагряване; експлодира при облъчване, образувайки хлороводород).
Как се разтваря хлороводородът във вода и какъв е неговият разтвор? (разтваря се много добре във вода, образува солна киселина).
Писмено домашно. (Това се прави на дъската от учениците, докато учениците изпълняват задачи на дъската, учителят провежда фронтален разговор с класа).
MnO 2 ) с муринова киселина."
Този газ е хлор. Когато хлорът взаимодейства с водорода, се образува хлороводород, воден разтвор на "муринова киселина" - солна киселина. Когато минералът пиролузит се нагрява със солна киселина, се образува хлор съгласно реакцията:
4HCl + MnO 2 = MnCl 2 +Cl 2 + 2H 2 О
Учене на нов материал.
Химичната формула на хлороводорода еНС1. Химическата връзка е полярна ковалентна.
В промишлеността хлороводородът се получава чрез взаимодействие на хлор с водород.
кл 2 + з 2 = 2 НС1
В лабораторията се приготвя чрез нагряване на натриев хлорид с концентрирана сярна киселина. При такива условия, в отсъствието на вода, се отделя газ хлороводород, който след това се разтваря във вода, за да се образува солна киселина.
2NaCl + Н 2 ТАКА 4 = Na 2 ТАКА 4 + 2HCl (см. ориз. 13 §14).
Хлороводородът е безцветен газ, малко по-тежък от въздуха, с остра миризма и дими във влажен въздух. Най-характерното свойство на хлороводорода е високата му разтворимост във вода (при 0 ºС в един обем вода се разтварят около 500 обема газ).
Възможно ли е да се получи хлороводород с разтвор на готварска сол? (не, защото всички вещества в разтвора са силни електролити).
Химични свойства: хлороводородът не реагира с метали или основни оксиди(за разлика от солната киселина). Не забравяйте, че солната киселина и хлороводорода не са едно и също вещество, въпреки че се описват с една и съща формула. Тези вещества имат различни физични и химични свойства.
Решаване на проблемни въпроси.
Установено е, че речните води в близост до вулкани съдържат солна киселина. Направете предположение за произхода на това явление (хлороводородът е един от компонентите на отровните вулканични газове).
Въпроси - съвети: какво е стомашен сок? Помните ли състава на стомашния сок? Каква е ролята на солната киселина в храносмилането? При какви храносмилателни разстройства се предписва силно разреден разтвор на солна киселина?
Домашна работа . Научете материала § 14, пълен № 1-2 стр. 55.
Индивидуална задача.
Анализирайте текста, идентифицирайте веществата и запишете уравненията за описаните реакции:
„По време на Първата световна война (1915 г.) за първи път е използван отровен газ близо до град Ипър в Западна Фландрия. Тази газова атака отне живота на 5 хиляди войници и обезвреди около 15 хиляди. Взаимодействието на този газ с водорода може да възникне експлозивно; воден разтвор на продукта от тази реакция преди това е бил наричан „муринова киселина“. Един от откривателите на отровния газ е шведският химик и фармацевт Карл Шееле, който го получава чрез нагряване на минерала пиролузит ( MnO 2 ) с муринова киселина."
Решаване на проблемни въпроси.
Известно е, че хлороводородът и солната киселина са токсични вещества, които имат токсичен ефект върху човешкото тяло. В същото време при някои стомашни заболявания лекарите предписват солна киселина като лекарство.
Проблемен въпрос: „Какво обяснява действията на лекар, който предписва токсично вещество на пациент като лекарство?“
Решаване на проблемни въпроси.
Установено е, че речните води в близост до вулкани съдържат солна киселина. Направете предположение за произхода на това явление.
Известно е, че хлороводородът и солната киселина са токсични вещества, които имат токсичен ефект върху човешкото тяло. В същото време при някои стомашни заболявания лекарите предписват солна киселина като лекарство.
Проблемен въпрос: „Какво обяснява действията на лекар, който предписва токсично вещество на пациент като лекарство?“
Решаване на проблемни въпроси.
Установено е, че речните води в близост до вулкани съдържат солна киселина. Направете предположение за произхода на това явление.
Известно е, че хлороводородът и солната киселина са токсични вещества, които имат токсичен ефект върху човешкото тяло. В същото време при някои стомашни заболявания лекарите предписват солна киселина като лекарство.
Проблемен въпрос: „Какво обяснява действията на лекар, който предписва токсично вещество на пациент като лекарство?“
Решаване на проблемни въпроси.
Установено е, че речните води в близост до вулкани съдържат солна киселина. Направете предположение за произхода на това явление.
Известно е, че хлороводородът и солната киселина са токсични вещества, които имат токсичен ефект върху човешкото тяло. В същото време при някои стомашни заболявания лекарите предписват солна киселина като лекарство.
Проблемен въпрос: „Какво обяснява действията на лекар, който предписва токсично вещество на пациент като лекарство?“
Урок № 9 клас дата: _____
Тема на урока. Солна киселина и нейните соли.
Тип урок: комбиниран урок.
Целта на урока: обобщете знанията за свойствата на солната киселина, въведете качествени реакции към халогенни йони.
Цели на урока:
Образователни: разгледайте емпиричната формула на солна киселина и хлориди, проучете значението на качествените реакции, проведете химичен експеримент за разпознаване на най-важните неорганични вещества, разпознайте хлориди, съставете уравнения на реакции, характерни за солната киселина.
Образователни: покажете единството на материалния свят.
Развитие: придобиване на умения за самостоятелна работа.
Методи и техники: фронтален разговор, индивидуална, самостоятелна работа.
Оборудване: учебник “Химия 9 клас” Рудзитис Г.Е., Фелдман Ф.Г.; периодична таблица на химичните елементи D.I. Менделеев; карти с индивидуални задачи, раздатъчни материали, набор от реактиви: разтвор на солна киселина, цинк, сребърен нитрат.
ПО ВРЕМЕ НА ЗАНЯТИЯТА
Организиране на времето.
Подготовка за възприемане на нов материал.
Инструкции за безопасност при работа с киселини.
Въпроси по изучаваната тема.
Докажете, че солната киселина съдържа водород (реакция на солна киселина с цинк; наблюдение на газ).
Zn + 2 НС1 = ZnCl 2 + з 2
Докажете, че солната киселина съдържа хлор (извършване на качествена реакция на солна киселина и нейните соли - реакция със сребърен нитратAgNO 3 ; наблюдение на утаяването на бяла утайка от сребърен хлорид).
AgNO 3 + НС1 = AgCl↓ + HNO 3
Как да извършите трансформацията, отразена в диаграмата:
CuO → CuCl 2 → AgCl
CuO + 2HCl = CuCl 2 +H 2 О
CuCl 2 + 2AgNO 3 = 2AgCl↓ + Cu(NO 3 ) 2
Учене на нов материал.
Провеждане на изследователска задача.
Описвам физични свойствасолна киселина, използвайки вашите наблюдения и данни от учебника, стр. 56 (безцветна течност с остра миризма).
Прочетете статията от учебника стр. 56 за методите за производство на солна киселина в лабораторията и промишлеността.
2. Изследване на химичните свойства на солната киселина.
Съставяне на диаграма, отразяваща химичните свойства на солната киселина, общи с други киселини и специфични свойства.
Изпълнение на задача No2 стр.58.
Соли на солна киселина.
NaCl– готварска сол – е постоянен спътник на човек през целия му живот, както красноречиво свидетелства историята на човечеството.
Какъв е смисълът на известната поговорка „Ял безсолно“?
Какви според вас са предпоставките за възникването на древните градове на Русия - Соликамск, Солигорск, Солвычегорск и др.?
Постановка проблемен въпрос: „Какво обяснява това отношение на хората към една обикновена субстанция, позната на всички ни? Защо готварската сол винаги и навсякъде се смята за основен продукт?“ (Обикновена сол като хранителна добавкае най-важният източник на образуване на солна киселина в организма, която е необходим компонент на стомашния сок. Приемът на натриев хлорид в тялото се поддържа постоянен химичен съставкръв).
Затвърдяване на изучения материал.
Извършване на самостоятелна работа.
Запишете уравнения за възможни реакции:
1 вариант
NaOH + НС1 →
NaCl + AgNO 3 →
NaCl + KNO 3 →
Na 2 CO 3 + НС1 →
Вариант 2
ок( ОХ) 2 + НС1 →
KCl + AgNO 3 →
НС1 + AgNO 3 →
К 2 CO 3 + НС1 →
Вариант 3
Ба( ОХ) 2 + НС1 →
BaCl 2 + AgNO 3 →
KCl + AgNO 3 →
BaCO 3 + НС1 →
Домашна работа . Научете материала § 15, пълен № 3, 5 стр. 58. Индивидуална задача * No 4 Стр. 58.
1 вариант
NaOH + НС1 →
NaCl + AgNO 3 →
NaCl + KNO 3 →
Na 2 CO 3 + НС1 →
Вариант 2
ок( ОХ) 2 + НС1 →
KCl + AgNO 3 →
HCl + AgNO 3 →
К 2 CO 3 + HCl →
3 опция
Ba(OH) 2 + HCl →
BaCl 2 + AgNO 3 →
KCl + AgNO 3 →
BaCO 3 + НС1 →
хлор– елемент от 3-ти период и VII A-група на Периодичната система, пореден номер 17. Електронна формула на атома [ 10 Ne]3s 2 3p 5, характерни степени на окисление 0, -I, +I, +V и +VII . Най-стабилното състояние е Cl-I. Скала на степента на окисление на хлора:
Хлорът има висока електроотрицателност (2,83), експонати неметални свойства. Влиза в състава на много вещества - оксиди, киселини, соли, бинарни съединения.
В природата - дванадесетиелемент по химично изобилие (пети сред неметалите). Намира се само в химически свързана форма. Третият най-разпространен елемент в естествените води (след O и H), има особено много хлор в морската вода (до 2% от теглото). Жизнен елемент за всички организми.
Хлор Cl2.Просто вещество. Жълто-зелен газ с остър задушлив мирис. Молекулата Cl 2 е неполярна и съдържа връзка CI–Cl σ. Термично стабилен, незапалим на въздух; смес с водород експлодира на светлина (водородът гори в хлор):
Той е силно разтворим във вода, претърпява 50% дисмутация в нея и напълно в алкален разтвор:
Разтвор на хлор във вода се нарича хлорна вода,на светлина киселината HClO се разлага на HCl и атомен кислород O 0, така че „хлорната вода“ трябва да се съхранява в тъмна бутилка. Наличието на киселина HClO в „хлорна вода“ и образуването на атомарен кислород обясняват нейните силни окислителни свойства: например много багрила се обезцветяват във влажен хлор.
Хлорът е много силен окислител към метали и неметали:
Реакции със съединения на други халогени:
а) Cl 2 + 2KBr (p) = 2KCl + Br 2 (кипящ)
б) Cl 2 (седмица) + 2KI (p) = 2КCl + I 2 ↓
3Cl 2 (g) + ZN 2 O + KI = 6НCl + KIO 3 (80 °C)
Качествена реакция– взаимодействие на дефицит на Cl 2 с KI (виж по-горе) и откриване на йод чрез син цвят след добавяне на разтвор на нишесте.
Касова бележкахлор в индустрия:
и в лаборатории:
4HCl (конц.) + MnO 2 = кл 2 + MnCl 2 + 2H 2 O
(подобно с участието на други окислители; за повече подробности вижте реакциите за HCl и NaCl).
Хлорът е един от основните продукти химическо производство, използвани за производство на бром и йод, хлориди и кислородсъдържащи производни, за избелване на хартия, като дезинфектант за питейна вода. Отровни.
Хлороводород HCl.Аноксична киселина. Безцветен газ с остра миризма, по-тежък от въздуха. Молекулата съдържа ковалентна σ-връзка H – Cl. Термично стабилен. Силно разтворим във вода; се наричат разредени разтвори солна киселина,и димящ концентриран разтвор (35–38%) - солна киселина(името е дадено от алхимиците). Силна киселина в разтвор, неутрализирана от основи и амонячен хидрат. Силен редуциращ агент в концентриран разтвор (поради Cl-I), слаб окислител в разреден разтвор (поради H I). Компонент"царска водка"
Качествена реакция към Cl-йон е образуването на бели утайки AgCl и Hg 2 Cl 2, които не се прехвърлят в разтвор чрез действието на разредена азотна киселина.
Хлороводородът служи като суровина при производството на хлориди, хлорорганични продукти и се използва (под формата на разтвор) при ецване на метали и разлагане на минерали и руди.
Уравнения на най-важните реакции:
HCl (разредена) + NaOH (разредена) = NaCl + H2O
HCl (разреден) + NH3H2O = NH4Cl + H2O
4HCl (конц., хоризонтално) + MO 2 = MCl 2 + Cl 2 + 2H 2 O (M = Mn, Pb)
16HCl (конц., хоризонтален) + 2KMnO 4 (t) = 2MnCl 2 + 5Cl 2 + 8H 2 O + 2KCl
14HCl (конц.) + K 2 Cr 2 O 7 (t) = 2CrCl 3 + 3Cl 2 + 7H 2 O + 2KCl
6HCl (конц.) + KClO 3 (t) = KCl + 3Cl 2 + 3H 2 O (50–80 °C)
4HCl (конц.) + Ca(ClO) 2(t) = CaCl 2 + 2Cl 2 | + 2Н 2 О
2HCl (разреден) + M = MCl 2 + H 2 (M = Fe, Zn)
2HCl (разреден) + MSO 3 = MCl 2 + CO 2 + H 2 O (M = Ca, Ba)
HCl (разреден) + AgNO 3 = HNO 3 + AgCl↓
Касова бележка HCl в промишлеността - изгаряне на H 2 в Cl 2 (виж), в лабораторията - изместване от хлориди със сярна киселина:
NaCl (t) + H2SO4 (конц.) = NaHSO4+ НС1(50°C)
2NaCl (t) + H 2 SO 4 (конц.) = Na 2 SO 4 + 2HCl(120°C)
20. Хлор. Хлороводород и солна киселина
Хлор (Cl) –стои в 3 период, в VII група основна подгрупа периодичната таблица, сериен номер 17, атомна маса 35,453; се отнася до халогени.
Физични свойства:жълто-зелен газ с остра миризма. Плътност 3.214 g/l; точка на топене -101 °C; точка на кипене -33,97 °C, при нормална температура лесно се втечнява под налягане от 0,6 MPa. Разтваряйки се във вода, образува жълтеникава хлорна вода. Той е силно разтворим в органични разтворители, особено хексан (C6H14) и въглероден тетрахлорид.
Химични свойства на хлора:електронна конфигурация: 1s22s22p63s22p5. Във външното ниво има 7 електрона. За да завършите нивото, имате нужда от 1 електрон, който хлорът приема, проявявайки степен на окисление -1. Съществуват и положителни степени на окисление на хлора до + 7. Известни са следните хлорни оксиди: Cl2O, ClO2, Cl2O6 и Cl2O7. Всички те са нестабилни. Хлорът е силен окислител. Реагира директно с метали и неметали:
Реагира с водород. При нормални условия реакцията протича бавно, при силно нагряване или запалване - с експлозия, по верижен механизъм:
Хлорът взаимодейства с алкални разтвори, образувайки соли - хипохлорити и хлориди:
При преминаване на хлор в алкален разтвор се образува смес от хлоридни и хипохлоритни разтвори:
Хлорът е редуциращ агент: Cl2 + 3F2 = 2ClF3.
Взаимодействие с вода:
Хлорът не реагира директно с въглерод, азот и кислород.
Касова бележка: 2NaCl + F2 = 2NaF + Cl2.
Електролиза: 2NaCl + 2H2O = Cl2 + H2 + 2NaOH.
Намиране в природата:съдържа се в следните минерали: халит (каменна сол), силвит, бишофит; морска водасъдържа хлориди на натрий, калий, магнезий и други елементи.
Хлороводород HCl. Физични свойства:безцветен газ, по-тежък от въздуха, силно разтворим във вода за образуване на солна киселина.
Хлороводород - какво е това? Хлороводородът е безцветен газ с остра миризма. Лесно се разтваря във вода, образувайки солна киселина. Химичната формула на хлороводорода е HCl. Състои се от водороден и хлорен атом, свързани с ковалентен атом полярна връзка. Хлороводородът лесно се дисоциира в полярни разтворители, което осигурява добро киселинни свойствана тази връзка. Дължината на връзката е 127,4 nm.
Физични свойства
Както беше посочено по-горе, в в добро състояниеХлороводородът е газ. Той е малко по-тежък от въздуха и също така има хигроскопичност, тоест привлича водни пари директно от въздуха, образувайки гъст облак от пари. Поради тази причина се казва, че хлороводородът „пуши“ във въздуха. Ако охладите този газ, тогава при около -85 °C той се втечнява, а при -114 °C става твърдо. При температура 1500 °C се разлага на прости вещества (въз основа на формулата на хлороводорода, на хлор и водород).
Разтвор на HCl във вода се нарича солна киселина. Това е безцветна, разяждаща течност. Понякога има жълтеникав оттенък поради примеси от хлор или желязо. Поради хигроскопичност, максималната концентрация при 20 °C е 37-38% от теглото. От него зависят и други физични свойства: плътност, вискозитет, точки на топене и кипене.
Химични свойства
Самият хлороводород обикновено не реагира. Само когато висока температура(повече от 650 °C) реагира със сулфиди, карбиди, нитриди и бориди, както и с оксиди на преходни метали. В присъствието на киселини на Луис може да реагира с борни, силициеви и германиеви хидриди. Но неговият воден разтвор е много по-химически активен. Според формулата си хлороводородът е киселина, така че има някои свойства на киселини:
- Взаимодействие с метали (които са в електрохимични сериинапрежение към водород):
Fe + 2HCl = FeCl 2 + H 2
- Взаимодействие с амфотерни и основни оксиди:
BaO + 2HCl = BaCl 2 + H 2 O
- Взаимодействие с основи:
NaOH + HCl = NaCl + H2O

Взаимодействие с някои соли:
Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2
- При взаимодействие с амоняк се образува сол на амониев хлорид:
NH3 + HCl = NH4Cl
Но солната киселина не реагира с оловото поради пасивация. Това се дължи на образуването на слой от оловен хлорид върху повърхността на метала, който е неразтворим във вода. По този начин този слой предпазва метала от по-нататъшно взаимодействие със солна киселина.
IN органични реакцииможе да се свърже чрез множество връзки (реакция на хидрохалогениране). Може да реагира и с протеини или амини, образувайки органични соли - хидрохлориди. Изкуствените влакна, като хартията, се разрушават при взаимодействие със солна киселина. При редокс реакции със силни окислители хлороводородът се редуцира до хлор.
Смес от концентрирана солна и азотна киселина (3 към 1 по обем) се нарича "царска вода". Той е изключително силен окислител. Поради образуването на свободен хлор и нитрозил в тази смес, царската вода може дори да разтвори златото и платината.
Касова бележка
Преди това в промишлеността солната киселина се получаваше чрез взаимодействие на натриев хлорид с киселини, обикновено сярна киселина:
2NaCl + H 2 SO 4 = 2HCl + Na 2 SO 4
Но този метод не е достатъчно ефективен и чистотата на получения продукт е ниска. Сега се използва друг метод за получаване (от прости вещества) хлороводород по формулата:
H2 + Cl2 = 2HCl

За прилагането на този метод има специални инсталации, при които двата газа се подават в непрекъснат поток към пламъка, в който се осъществява взаимодействието. Водородът се доставя в лек излишък, така че целият хлор да реагира и да не замърсява получения продукт. След това хлороводородът се разтваря във вода, за да се образува солна киселина.
В лабораторията са възможни по-разнообразни методи за получаване, например хидролиза на фосфорни халиди:
PCl5 + H2O = POCI3 + 2HC1
Солната киселина може да се получи и чрез хидролиза на кристални хидрати на някои метални хлориди при повишени температури:
AlCl 3 6H 2 O = Al(OH) 3 + 3HCl + 3H 2 O
Хлороводородът също е страничен продукт от реакциите на хлориране на много органични съединения.
Приложение
Самият хлороводород не се използва на практика, тъй като много бързо абсорбира вода от въздуха. Почти целият произведен хлороводород отива в производството на солна киселина.

Използва се в металургията за почистване на повърхността на металите, както и за получаване на чисти метали от техните руди. Това става чрез превръщането им в хлориди, които лесно се редуцират. Получават се например титан и цирконий. Киселината се използва широко в органичния синтез (реакции на хидрохалогениране). Чистият хлор също понякога се получава от солна киселина.
Използва се и в медицината като лекарство, смесено с пепсин. Приема се при недостатъчна стомашна киселинност. Солната киселина се използва в Хранително-вкусовата промишленосткато добавка Е507 (регулатор на киселинността).
Мерки за безопасност
При високи концентрации солната киселина е разяждащо вещество. При контакт с кожата причинява химически изгаряния. Вдишването на хлороводород предизвиква кашлица, задушаване и в тежки случаи дори белодробен оток, което може да доведе до смърт.

Според GOST има втори клас на опасност. Хлороводородът е класифициран като трета от четири категории на опасност според NFPA 704. Краткосрочното излагане може да доведе до сериозни временни или умерени остатъчни ефекти.
Първа помощ
Ако солната киселина попадне върху кожата, раната трябва да се измие обилно с вода и слаб разтвор на основа или нейната сол (например сода).
Ако парите на хлороводорода попаднат в дихателните пътища, жертвата трябва да се изведе на чист въздух и да се вдиша с кислород. След това направете гаргара, измийте очите и носа с 2% разтвор на натриев бикарбонат. Ако солната киселина попадне в очите ви, тогава трябва да ги капете с разтвор на новокаин и дикаин с адреналин.
|
солна киселина, формула на хлороводород
Хлороводород, хлороводород(HCl) е безцветен, термично стабилен газ (при нормални условия) с остра миризма, изпарява във влажен въздух, лесно се разтваря във вода (до 500 обема газ на обем вода), за да образува солна (солна) киселина. При –85,1 °C той кондензира в безцветна подвижна течност. При -114,22 °C HCl преминава в твърдо състояние. В твърдо състояние хлороводородът съществува под формата на две кристални модификации: орторомбична, стабилна под -174,75 °C и кубична.
- 1 Имоти
- 2 Разписка
- 3 Приложение
- 4 Сигурност
- 5 бележки
- 6 Литература
- 7 връзки
Имоти
Воден разтвор на хлороводород се нарича солна киселина. При разтваряне във вода протичат следните процеси:
Процесът на разтваряне е силно екзотермичен. С вода HCl образува азеотропна смес, съдържаща 20,24% HCl.
Солната киселина е силна едноосновна киселина; тя взаимодейства енергично с всички метали в серията на напрежение вляво от водорода, с основни и амфотерни оксиди, основи и соли, образуващи соли - хлориди:
Хлоридите са изключително разпространени в природата и имат най-широко приложение (халит, силвит). Повечето от тях са силно разтворими във вода и напълно се дисоциират на йони. Слабо разтворими са оловен хлорид (PbCl2), сребърен хлорид (AgCl), живачен (I) хлорид (Hg2Cl2, каломел) и меден (I) хлорид (CuCl).
Когато е изложен на силни окислители или по време на електролиза, хлороводородът проявява редуциращи свойства:
При нагряване хлороводородът се окислява от кислород (катализатор - меден (II) хлорид CuCl2):
Концентрираната солна киселина реагира с медта, за да образува едновалентен меден комплекс:
Смес от 3 обемни части концентрирана солна киселина и 1 обемна част концентрирана азотна киселина се нарича "царска вода". Aqua regia може дори да разтвори злато и платина. Високата окислителна активност на царската вода се дължи на наличието в нея на нитрозил хлорид и хлор, които са в равновесие с изходните вещества:
Поради високата концентрация на хлоридни йони в разтвора, металът се свързва в хлориден комплекс, който насърчава неговото разтваряне:
Добавя се към серен анхидрид, за да образува хлорсулфонова киселина HSO3Cl:
Хлороводородът също се характеризира с реакции на присъединяване към множествени връзки (електрофилно присъединяване):
Касова бележка
IN лабораторни условияХлороводородът се получава чрез взаимодействие на концентрирана сярна киселина с натриев хлорид (трапезна сол) при ниска топлина:
HCl може също да се получи чрез хидролиза на ковалентни халиди като фосфорен (V) хлорид, тионил хлорид (SOCl2) и хидролиза на хлориди на карбоксилни киселини:
В промишлеността хлороводородът преди това се получава главно по сулфатен метод (метод на Leblanc), базиран на взаимодействието на натриев хлорид с концентрирана сярна киселина. Понастоящем обикновено се използва директен синтез от прости вещества за получаване на хлороводород:
При производствени условия синтезът се извършва в специални инсталации, в които водородът непрекъснато гори с равномерен пламък в поток от хлор, смесвайки се с него директно в факела на горелката. Това гарантира спокойна (без експлозия) реакция. Водородът се доставя в излишък (5 - 10%), което прави възможно пълното използване на по-ценния хлор и получаване на незамърсена с хлор солна киселина.
Солната киселина се получава чрез разтваряне на газ хлороводород във вода.
Приложение
Водният разтвор се използва широко за производството на хлориди, за ецване на метали, почистване на повърхността на съдове и кладенци от карбонати, обработка на руди, при производството на каучук, натриев глутамат, сода, хлор и други продукти. Използва се и в органичния синтез. Разтворът на солна киселина е широко разпространен в производството на дребни бетонни и гипсови изделия: тротоарни плочи, стоманобетонни изделия и др.
Безопасност
Вдишването на хлороводород може да доведе до кашлица, задушаване, възпаление на носа, гърлото и горните дихателни пътища, а в тежки случаи до белодробен оток, нарушение на кръвоносната система и дори смърт. Контактът с кожата може да причини зачервяване, болка и сериозни изгаряния. Хлороводородът може да причини сериозни изгаряния на очите и трайно увреждане.
Използва се като отрова по време на войни.
Бележки
- Хлороводород на уебсайта HiMiK.ru
- Солната киселина понякога се нарича хлороводород.
- А. А. Дроздов, В. П. Зломанов, Ф. М. Спиридонов. Неорганична химия(в 3 тома). Т.2. - М.: Издателски център "Академия", 2004 г.
Литература
- Левински M.I., Мазанко A.F., Новиков I.N. „Хлороводород и солна киселина“ М.: Химия 1985 г.
Връзки
- Хлороводород: химични и физични свойства
P·or·r Хлорсъдържащи неорганични киселини
хлороводород, хлороводород Уикипедия, молекула хлороводород, формула на хлороводород, хлороводород химия клас 9, солна киселина, солна киселина