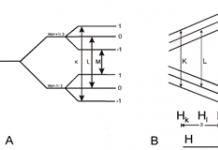
№1
Колко и какви елементарни частици образуват атома 19F?
А) 9 неутрона и 9 електрона;
Б) 9 неутрона, 10 протона и 19 електрона;
В) 9 протона и 19 електрона;
Г) 19 протона и 19 електрона;
Д) 9 протона, 10 неутрона и 9 електрона.
№2
Атом на алкален метал образува йон с електронна конфигурация Is*2s22p63s23p6. Това е конфигурацията
А) рубидий;
Б) калий;
В) натрий;
Г) литий;
Д) цезий.
№3
Какви са валентността и степента на окисление на азота в азотната киселина?
А) IV; +5;
Б) III; -3;
В) V; +5;
Г) IV; +4;
E) V; +3.
№4
През кой век Е. Ръдърфорд открива ядрото на атома?
А) през 20 век;
Б) през 19 век;
В) през 16 век;
Г) през 21 век;
Д) през 18 век.
№5
Атомите са съставени от...
А) протони и неутрони;
Б) молекули;
В) атомни ядра и електрони;
Г) нуклони;
Д) протони и електрони.
№6
Зарядът на атома е...
А) нула;
Б) поредният номер на елемента;
В) брой електрони;
Г) ядрен заряд;
Д) брой протони.
№7
Кой от наборите от квантови числа n, I, mi на електрон в атом е разрешен?
А) 3, 1, -1;
Б) 3, 1,2;
В) 4, -2, 1;
0)7,0, 1;
Д) -3,1,1.
№8
Кой елемент има девет d електрона в третото си енергийно ниво?
A) K, Z=19;
B) Co, Z=27;
C) Cr, Z=24;
D) Cu, Z=29;
E) Ca, Z=20.
№9
Изчислете максималния възможен брой електрони на третото енергийно ниво:
А) 8;
Б) 14;
В) 18;
0) 32;
Б) 24.
№10
Орбитално квантово число L = 2. Какъв е максималният капацитет на съответното енергийно подниво?
А) 8;
Б) 10;
В) 6;
Г) 12;
Д) 32.
№11
Орбиталното квантово число определя...
А) енергийно ниво;
Б) магнитни свойства;
В) форми на електронни облаци;
Г) орбитален;
Д) въртене.
№12
Колко електрона има в 4d-noflypOBHe хафниевия атом (Z=72)? А) 1;
Б) 2;
В) 4;
0)10;
Д) 8.
Г) № 13
Поднивата Zp, 3d, 4s, 4p в атомите се попълват в последователността...
A) Zr, 4s, 3d, 4p;
B) 3d, Zr, 4s, 4p;
В) 4s, Зр, 3d, 4р;
D) Зр, 3d, 4р, 4s;
E) Zr, 3d, 4s, 6p.
№14
Структурата на валентния електронен слой на атома се изразява с формулата... 5s25p4. Какъв е серийният номер на елемента?
А) 48;
Б) 36;
В) 52;
0)58;
Д) 61;
№15
Кое подниво се запълва в атом с електрони след запълване на подниво 4p? A) 4d;
B) 3d;
В) 4s;
D) 4f;
E) 5s.
Г) № 16
Периодичният закон е отражение...
А) увеличаване на заряда на ядрото (елементи);
Б) в зависимост от серийния номер;
В) пълнене на електронни обвивки;
Г) увеличаване на атомната маса;
Д) увеличаване на атомните радиуси.
№17
Какъв е максималният брой електрони в 33-та орбитала?
А) 1;
Б) 2;
В) 6;
Г) 8;
E)4;
№18
Главното квантово число N приема следните стойности: А) -1/2,+1/2;
Б) 0,1,2,3,4,5,...;
В) 1,2,3,4,5,6,7...;
D)-1,0,1,2,3,...;
E) -1, -2, -3, -4,...
Г) № 19
Към какъв тип елементи принадлежи Курчатов ii (Z=104)?
А) s-елементи;
Б) p-елементи;
В) d-елементи;
Г) f-елементи;
Д) q-елементи.
№20
Атом на кой елемент в невъзбудено състояние има електронна конфигурация: 1 s2 2s2 2p6 3s2 3рб 4s1?
A) Na(Z=ll);
B) K(Z=19);
C) Ca (Z=20);
D) Ba (Z=56);
E) Rb (Z=37).
№21
Колко електрона има в 4d подниво на молибденов атом? А)3;
Б) 4;
В) 5;
Г) 6;
Д) 2.
Г) № 22
Коя двойка елементи са d-елементи?
А) Al, Mg;
B) Ti, Ge;
В) Та, Мо;
D) Pb, Au;
E) Ba, Pt.
№23
Главното квантово число n=4. Какви стойности приема орбиталното квантово число?
А) 1,2,3,4;
B) 0,1,2,3;
C) -4, -3, -2,0;
Г) 1,2,3,4,5;
Д) 0,1,2,3,4.
№24
От изброените по-долу елементи от третия период най-силно изразени неметални свойства са: А) алуминий;
Б) силиций;
В) сяра;
Г) хлор;
Д) магнезий.
№25
Къде се намират елементи с метални свойства в периодичната таблица?
А) елементи от групи 1 и 2 на основните подгрупи;
Б) елементи от група 7 на главната подгрупа;
В) елементи на главните подгрупи от група 4 до група 7;
Г) елементи от групи 1 и 2 на второстепенни подгрупи;
Д) елементи от периоди 1 и 2.
№26
Колко квантови числа описват една електронна орбитала?
А) (н)
B) (n,l)
C) (n, l, ml, ms)
D) (l, m)
E)(n, l, ml)
№27
Основното квантово число описва...
А) обща енергия на електрони;
Б) молекулна орбитала;
В) ориентация на орбиталата в пространството;
Г) броят на електроните в атома;
Д) спин на електрони.
№28
Колко електрона има в поднивото 2p в основното състояние на азота (Z=7)?
А) 5;
Б) 4;
В) 2;
0)3;
Д) 6.
Г) № 29
Какво определя валентността на атома?
А) номер на периода;
Б) номер на групата;
В) броят на водородните атоми при образуването на хидрид;
D) (8 - N), където N е номерът на групата в таблицата D.I. Менделеев;
Д) броят на несдвоените електрони в основно състояние и същият брой във възбудено състояние.
№30
От дадените по-долу термодинамични функции посочете тази, която показва възможността за спонтанно протичане на процеси:
А) ∆G=0
B) ∆H C) ∆S>0;
D) ∆H>0
E)∆G № 31
Първото следствие от закона на Хес е следното:
А) топлинният ефект на реакцията не зависи от метода на нейното осъществяване, а зависи само от началното и крайното състояние
вещества;
Б) количеството енергия, освободено или погълнато от системата по време на реакция, е топлинният ефект на реакцията;
В) топлинният ефект на реакцията е равен на разликата между сумите на топлините на образуване на реакционните продукти и изходните вещества;
Г) топлинният ефект на реакцията е равен на разликата в топлините на образуване на реакционните продукти и изходните вещества;
Д) топлинният ефект на реакцията е равен на сумата от топлините на образуване на реакционните продукти и изходните материали.
№32
А) H2O2;
B) H2SO4
В) О2
Г) H2O
E) NH3
№33
За кое вещество енталпията на образуване е равна на нула?
А) CO2
B) CO
В) С
D) SO3
E) SO2
№34
Какво се разбира под химическа връзка?
А) способността на атомите да се свързват с други атоми в определени пропорции;
Б) набор от взаимодействия на частици;
В) редът на свързване на атомите в молекулите;
Г) взаимодействие между електрони;
E) това е прикрепването на други атоми към даден атом, придружено от сближаването на тези атоми до няколко ангстрьома (10-10 m),
освобождаването на енергия и правилната ориентация на тези атоми един спрямо друг, като се вземат предвид околните атоми.
№35
Какво е йонна връзка?
№36
Какво се нарича ковалентна връзка?
А) връзка, образувана от електронни двойки;
Б) комуникация между йони поради електростатично взаимодействие;
В) връзка, образувана от водороден йон, когато той е включен в по-електроотрицателен атом;
Г) връзка, образувана от двойка електрони, принадлежащи на един атом, и празна клетка на друг атом;
Д) връзката между атоми и йони, разположени в местата на решетката, задържани от бързо движещи се електрони.
№37
Какво е полярна ковалентна връзка?
А) връзка, образувана от електронни двойки;
Б) комуникация между йони поради електростатично взаимодействие;
В) връзка, образувана от водороден йон, когато той е включен в по-електроотрицателен атом;
Г) връзка, образувана от двойка електрони, принадлежащи на един атом, и празна клетка на друг атом;
Д) свързване между различни неметални атоми, при което електронният облак, образуван от обща двойка електрони, се оказва
несиметричен и изместен към най-електроотрицателния атом на елемента.
№38
Как се нарича донорно-акцепторна връзка?
А) връзка, образувана от електронни двойки;
Б) комуникация между йони поради електростатично взаимодействие;
В) връзка, образувана от водороден йон, когато той е включен в по-електроотрицателен атом;
Г) връзка, образувана от двойка електрони, принадлежащи на един атом, и празна клетка на друг атом;
Д) връзката между атоми и йони, разположени в местата на решетката, задържани от бързо движещи се електрони.
№39
В представените по-долу оксиди на елементи от третия период на периодичната таблица: Na2O, MgO, A12O3, SiO2, P2O5, SO3,
C12O7-в периода...
А) основната функция се увеличава;
Б) киселинната функция се повишава;
В) амфотерната функция се увеличава;
Г) не е възможно да се направи заключение относно промените в химичната природа на оксидите;
Д) киселинната функция намалява.
Каква формула може да се използва за определяне на максималния брой електрони в подниво?
А) 21+1;
Б) 2(21+1);
C)N2;
D) 2N2;
E) m+ 1.
№41
Кой от следните елементи има най-нисък йонизационен потенциал?
A)Na,Z=ll;
B) Mg, Z=12;
C) K, Z=19;
D) Ca, Z=20;
E)Cs, Z=55.
Д) № 42
В серията N2O3, P2O3, As2O3, Sb2O3, Bi2O3:
А) металните свойства се увеличават от N до Bi;
Б) металните свойства намаляват от N до Bi;
В) амфотерните свойства намаляват от Bi до N;
Г) неметалните свойства се увеличават от N до Bi;
Д) неметалните свойства са намалени.
№43
Каква е конфигурацията на валентните електрони в основното състояние във волфрамов атом (Z=74)?
A)...5d16s2p3;
B)...5d55f"46s2;
В)...5d46s2;
D)...6s2p4;
E)...5d°6s2.
№44
Посочете елемента, който отговаря на електронната конфигурация на атома
А) калий (Z= 19);
B) ванадий (Z=23);
В) калций (Z=20);
D) скандий (Z=21);
E) хром (Z=24).
№45
Най-висока валентност сред изброените метали има...
A) Be (Z=4);
B) Mg (Z=12);
C) Al (Z=13);
D) Ti (Z=22);
E)Sc(Z=21)
Д) № 46
Електроотрицателността е...
А) енергия на отвличане на електрони;
Б) енергия, освободена при добавяне на електрон;
В) половината от сумата на йонизационната енергия и електронен афинитет;
Г) способността за отблъскване на електронна плътност;
Д) способността да отдава валентни електрони.
№47
Какво е водородна връзка?
А) връзка, образувана от електронни двойки;
Б) комуникация между йони поради електростатично взаимодействие;
В) това е вътрешно- или междумолекулна връзка, образувана от водороден йон и един от електроотрицателните атоми (флуор,
кислород, азот);
Г) връзка, образувана от двойка електрони, принадлежащи на един атом, и празна клетка на друг атом;
Д) връзката между атоми и йони, разположени в местата на решетката, задържани от бързо движещи се електрони.
№48
Кой от следните елементи от четвъртия период на периодичната таблица проявява еднакви стойности на валентност в своето водородно съединение и в своя висш оксид?
А) бром;
Б) германий;
В) арсен;
Г) селен;
Д) желязо,
№49
Как се променят металните свойства на d-елементите за определен период?
А) увеличение;
Б) намаляване;
В) комплексна зависимост;
Г) намаляване и след това увеличаване;
Д) увеличаване и след това намаляване.
№50
Електронната конфигурация на Zn2+ йона съответства на формулата...
A)ls22s22p4;
B) Is22s22p63s23p6;
C)ls22s22p63s23p63d10;
D)ls22s22p63s23p63d104s2;
E)ls22s22p63s23p64s23d10.
В тестовете има само 26 въпроса. Даден е въпросът и верният отговор.
Тестове за училищната програма по химия
|
Течен метал? (Живак) |
||
|
Как се наричат веществата, състоящи се от атоми от един и същи вид? (Просто) |
||
|
Цвят на фенолфталеин в алкали? (пурпурно) |
||
|
Горивен газ? (кислород) |
||
|
Как се нарича най-малката частица от веществото, която определя свойствата му? (молекула) |
||
|
Обем на един мол газ? (22,4л) |
||
|
Кой откри закона за запазване на масата на веществата? (Ломоносов) |
||
|
Газ, използван за рязане и заваряване на метали? (кислород) |
||
|
Най-малката неделима частица от елементи? (Атом) |
||
|
Кой е най-изобилният елемент на Земята? (кислород) |
||
|
Как се наричат солите на сярната киселина? (сулфати) |
||
|
Кой откри периодичния закон? (Менделеев) |
||
|
Какъв газ е най-изобилен в земната атмосфера? (азот) |
||
|
Коя киселина е по-солена, сярната киселина или въглеродната киселина? (сярен) |
||
|
Състав на водна молекула (водна формула)? (H2O) |
||
|
Каква е валентността на кислорода? (2) |
||
|
Формула на азотна киселина? ( HNO-3) |
||
|
Най-лекият газ? (водород) |
||
|
Как се нарича числото, което се записва пред формулите? (Коефициент) |
||
|
Посочете безкиселинната киселина: сярна, солна, азотна. (Сол) |
||
|
Вещества, които променят скоростта на химичните реакции? (Катализатори) |
||
|
Колко агрегатни състояния има водата? (Три) |
||
|
Единица за измерване на количеството вещество? (Къртица) |
||
|
При каква температура кипи чистата вода? (100) |
||
|
Необходим газ за дишане? (кислород) |
||
|
Формула на кислорода? (О-2) |
Тест по химия
аз Разкрийте същността на периодичния закон на Д. И. Менделеев в светлината на теорията за структурата на атома.
1. Посочете името на елемента, образуващ амфотерни съединения:
в) натрий.
2. Посочете елемента, който е част от основната подгрупа:
а) калций,
б) желязо,
3. Определете броя на електроните, които могат да се съдържат в f – подниво на електронната обвивка:
4. Установете съответствие между броя на електроните във външното енергийно ниво и името на химичния елемент:
а) 1, 1. калий,
б) 2, 2. хлор,
в) 3, 3. фосфор,
г) 5. 4. алуминий,
5. Установете последователността на увеличаване на заряда на ядрото на елементите:
б) натрий,
в) рубидий,
г) морска анемона.
6. Свържете символа на елемента и името му:
а) Al, 1. магнезий,
б) Na, 2. азот (азот),
в) N, 3. живак,
г) Hg. 4. алуминий,
5. натрий.
7. Посочете елементите, които могат да проявят валентност II:
а) натрий,
б) калций,
в) алуминий.
г) магнезий,
г) багрий,
г) желязо.
8. Обозначете елемента от втората група:
б) въглерод (въглерод),
в) алуминий,
9. Определете молекулното тегло на съединението CaCo3:
10. Изберете характеристика на състава на молекула на просто вещество:
а) се състои от атоми от същия тип,
б) се състои от атоми от различни видове,
в) съдържа само два атома.
г) съдържа само един атом.
11. Посочете броя на протоните в ядрото на атом с номер 20:
II Метан. Опишете структурата на молекулите, свойствата и приложенията.
1. Посочете валентността на въглерода в органичните съединения:
в четири,
2. Посочете хомоложната разлика в хомоложната серия от алкани:
3. Посочете молекулната формула на метана:
4. Посочете възможните продукти от изгаряне на метан:
а) кислород,
в) въглероден диоксид,
5. Посочете свойствата, характерни за метана:
а) газообразен,
б) течност,
в) опасност от експлозия,
г) по-лек от въздуха,
д) добра разтворимост във вода.
6. Посочете възможните продукти при разлагането на метана:
а) молекулярен водород,
б) атомен водород,
7. Характерната реакция на метана е:
а) замествания,
б) присъединяване,
в) обмен.
г) полимеризация.
8. Според молекулярната структура метанът е:
а) алкин,
б) алкен,
в) алкан,
г) циклани.
9. Посочете общата молекулна формула на хомоложната серия от алкани:
б) Сu H2n – 2bb
г) Сu H2n – 4.
10. Маркирайте съединенията, с които метанът реагира:
11. Метанът се използва като суровина в процеси:
а) окисление,
б) възстановяване,
в) полимеризация,
г) синтез на нови вещества,
Краен тест по неорганична химия
Окончателният тест съдържа задачи по основните теми от училищния курс по химия: „Структура на атома“, „Периодичен закон и периодичната система на химичните елементи D.I. Менделеев”, „Структура на материята”, „Химични реакции”, „Основни закономерности на химичните реакции”, „Разтвори. Теория на електролитната дисоциация”, „Редокс реакции”, „Класификация на веществата”, „Основни класове неорганични и органични съединения”.
Задачите се оценяват с 1 точка. Максималният резултат е 20.
Точките, получени за правилно изпълнени задачи, се превръщат в традиционни оценки по скалата:
"5" - 18-20 точки,
"4" - 15-17 точки,
"3" - 12-14 точки,
“2” - 11 точки или по-малко.
Опция 1
A1.Броят на електроните, съдържащи се във въглеродния атом, е: 1) 6; 2) 12; 3) 8
A2.Електронната формула на атома е 1s 2 2s 2 2p 6 3s 2 3p 2. Химичен символ на този елемент: 1) C; 2) О; 3) Си
A3.Радиусите на атомите на химичните елементи в серията: хлор, фосфор, алуминий, натрий: 1) нарастват; 2) намаляване; 3) не се променят.
A4.Химична връзка във водна молекула: 1) йонна; 2) ковалентен полярен; 3) ковалентен неполярен.
A5.Формули на киселинни оксиди: 1) CO 2 и CaO; 2) CO 2 и SO 3; 3) K 2 O и Al 2 O 3
A6.Формула на хидросулфидна киселина: 1) H 2 S; 2) H2SO4; 3) H2SO3
A7.Обменните реакции включват:
1) CaO + H 2 О Ca(OH) 2 ; 2) СЪС u(OH) 2 CuO+H 2 О; 3) KOH + HNO 3 KNO 3 +H 2 О
A8.Електролитите, при дисоциация на които се образуват метални катиони и аниони на киселинния остатък, се наричат: 1) киселини; 2) соли; 3) причини.
A9. Съкратено йонно уравнение за реакцията H+ + ОХ - H 2 O съответства на взаимодействието в разтвор: 1) калиев хидроксид и солна киселина; 2) меден хидроксид (II) и солна киселина; 3) меден хидроксид (II) и силициева киселина
A10.Утайката се образува при взаимодействието в разтвор на железен (II) хлорид и: 1) солна киселина; 2) калиев хидроксид; 3) меден (II) нитрат.
A11.Наличието на киселина в разтвор може да се докаже с помощта на: 1) лакмус; 2) фенолфталеин; 3) алкални.
A12.Коефициентът пред формулата на редуктора в уравнението за реакцията на алуминия с кислорода е: 1) 5; 2) 8; 3) 4.
A13.Разтварянето на креда в солна киселина ще се забави с: 1) увеличаване на концентрацията на киселината; 2) креда за смилане; 3) разреждане на киселината.
A14.Химично равновесие в системата FeO (s) + H 2 (g)<==>Fe (s) + H 2 O (l) + Q ще се измести към образуването на реакционни продукти с: 1) нарастващо налягане; 2) повишаване на температурата; 3) намаляване на налягането.
A15.Разтвор на солна киселина не може да реагира: 1) с натриев хидроксид; 2) с въглероден диоксид; 3) с калций.
A16.Серният оксид (IV) реагира: 1) с вода; 2) с въглена киселина; 3) с калций.
A17.Фосфорната киселина не реагира: 1) с калиев хидроксид; 2) с магнезий; 3) с водород.
A18.Въглеродната киселина реагира: 1) с калциев оксид; 2) с натриев нитрат; 3) със силициев оксид (IV)
A19.Сумата от всички коефициенти в уравнението за реакцията на калций с фосфорна киселина е равна на: 1) 5; 2) 7; 3) 9.
A20.След изпаряване на 40 g разтвор до сухо остават 10 g сол. Масовата част на солта в първоначалния разтвор е равна на: 1) 5%, 2) 15%; 3) 25%.
вариант 2
A1.Броят на неутроните, съдържащи се в кислородния атом, е: 1) 6; 2) 12; 3) 8.
A2.Формулата на най-високия оксид на елемент, чиято електронна формула е 1s 2 2s 2 2p 6 3s 2 3p 3: 1) N 2 O 5; 2) P2O5; 3) B 2 O 3 .
A3.Най-силно изразени неметални свойства проявяват: 1) фосфор; 2) сяра; 3) силиций.
A4.Формула на вещество с ковалентна полярна връзка: 1) H 2 O; 2) O 2; 3) CaCl 2
A5.Формулата на основата и киселината, съответно: 1) Ca (OH) 2 и Be (OH) 2;
2) NaOH и KHSO4; 3) Al(OH)3 и HNO3
A6.Формула на натриев сулфит: 1) Na 2 SO 4; 2) Na2S03; 3) Na2S
A7. Реакциите на заместване включват: 1)ок + з 2 ТАКА 4 CaSO 4 + з 2 ;
2) СЪС u(OH) 2 CuO+H 2 О; 3) KOH + HNO 3 KNO 3 +H 2 О
A8.Електролитите, дисоциацията на които произвежда метални катиони и хидроксидни йони, се наричат: 1) соли; 2) киселини; 3) причини.
A9. Съкратено уравнение на йонна реакцияБа 2+ + ТАКА 4 2- BaSO 4 съответства на взаимодействието в разтвор: 1) бариев карбонат и натриев сулфат; 2) бариев нитрат и сярна киселина; 3) бариев хидроксид и серен оксид (VI).
A10.Водата се образува при взаимодействието в разтвор на солна киселина и: 1) калциев хидроксид; 2) калций; 3) калциев силикат.
A11.Наличието на алкали в разтвор може да се докаже с помощта на: 1) лакмус; 2) фенолфталеин; 3) киселини.
A12.Коефициентът пред формулата на окислителя в уравнението за реакция на алуминий със сяра е равен на: 1) 8; 2) 2; 3) 3.
A13.Разтварянето на цинка в солна киселина ще се ускори с: 1) увеличаване на концентрацията на киселината; 2) при охлаждане на реагентите; 3) при добавяне на вода.
A14.Химично равновесие в системата CO 2 (g) + C (t)<==>2 CO (g) - Q ще се измести към образуването на реакционния продукт с: 1) нарастващо налягане; 2) повишаване на температурата; 3) понижаване на температурата
A15.Разтвор на солна киселина може да взаимодейства: 1) с мед; 2) с въглероден диоксид; 3) с магнезий.
A16.Сярната киселина реагира: 1) с вода; 2) с калциев оксид; 3) с въглероден диоксид.
A17.Фосфорният оксид (V) не реагира: 1) с меден хидроксид (II); 2) с вода; 3) с калиев хидроксид.
A18.Силициевата киселина се образува при взаимодействието на: 1) силиций с вода; 2) силициев оксид (IV) с вода; 3) натриев силикат със солна киселина.
A19.В уравнението за реакцията на желязото с хлора за образуване на железен (III) хлорид коефициентът пред формулата на солта е равен на: 1) 1; 2) 2; 3) 3.
A20. 20 грама сол се разтварят в 30 грама вода. Масовата част на солта в разтвора е: 1) 40%; 2) 50%; 3) 60%.
вариант 3
A1.Броят на протоните, съдържащи се в азотния атом, е: 1) 14; 2) 7; 3) 5.
A2.Електронна формула за външното енергийно ниво на въглероден атом:
1) 2s 2 2p 6 3s 2; 2) 2s 2 2p 6 3s 2 3p 2 ; 3) 2s 2 2p 2 .
A3.Най-изразени метални свойства проявяват: 1) магнезий;
2) калций; 3) барий.
A4.Химична връзка в молекулата на кислорода: 1) йонна; 2) ковалентен полярен;
3) ковалентен неполярен.
A5.Формули на основните оксиди: 1) CO 2 и SO 3; 2) K 2 O и CaO; 3) CO 2 и Al 2 O 3.
A6.Формула на железен (III) хидроксид: 1) Fe (OH) 2; 2) Fe(OH)3; 3) Fe 2 O 3.
A7. Реакциите на съединението включват: 1)KOH + HNO 3 KNO 3 + з 2 О;
2) СЪС u(OH) 2 CuO+H 2 О; 3) CaO + H 2 О Ca(OH) 2
A8.По време на дисоциацията на веществото във воден разтвор се образуват K +, H + и CO 3 2- йони. Това вещество е: 1) кисела сол; 2) средна сол; 3) алкални.
A9. Съкратено йонно уравнение за реакция 2з + + SiO 3 2- H 2 SiO 3 съответства на взаимодействието в разтвор: 1) въглена киселина и алуминиев силикат; 2) солна киселина и калиев силикат; 3) силициева киселина и калциев карбонат.
A10.Газът се образува при взаимодействието в разтвор на сярна киселина и:
1) цинк; 2) цинков оксид; 3) цинков хидроксид
A11.Наличието на въглероден диоксид може да се докаже с помощта на: 1) фенолфталеин;
2) варовита вода; 3) солна киселина.
A12.Коефициентът пред формулата на редуктора в уравнението за реакцията на алуминий със сярна киселина е равен на: 1) 4; 2) 6; 3) 2.
A13.Разтварянето на магнезий в солна киселина ще се ускори, когато:
1) добавяне на катализатор; 2) добавяне на вода; 3) добавяне на инхибитор.
A14. Химично равновесие в система 2ТАКА 2(g) + О 2(ж) 2 ТАКА 3(g) + Qще се измести към образуването на реакционния продукт с: 1) повишаване на температурата; 2) понижаване на температурата; 3) намаляване на налягането.
A15.Разтвор на солна киселина може да реагира с: 1) сярна киселина; 2) въглероден окис; 3) натрий.
A16.Серният оксид (VI) реагира с: 1) водород; 2) калиев хидроксид; 3) азот.
A17.Азотната киселина реагира с: 1) азот; 2) вода; 3) натрий.
A18.При преминаване на въглероден диоксид през варовита вода се получава следното: 1) помътняване на разтвора; 2) образуване на газ; 3) промяна на цвета.
A19.Сумата от всички коефициенти в уравнението за реакцията на калий с вода е равна на: 1) 3; 2) 5; 3) 7.
A20.За да приготвите 400 грама 2% разтвор на сол, трябва да вземете сол, чиято маса е равна на: 1) 6 g; 2) 8 g 3) 10 g.
ОТГОВОРИ
Опция 1
вариант 2
вариант 3
A1
A2
A3
A4
A5
A6
A7
A8
A9
A10
A11
A12
A13
A14
A15
A16
A17
A18
A19
A20
Списък на използваната литература
Габриелян О.С. Химия: учебник. за студенти проф. учебник заведения / О.С. Габриелян, И.Г. Остроумов. – М., 2005.
Габриелян О.С. Химията в тестове, задачи, упражнения: учеб. помощ за студенти ср. проф. образователни институции / O.S. Габриелян, Г.Г. Лисова - М., 2006.
Ерохин Ю.М., Фролов В.И. Сборник задачи и упражнения по химия (с дидактически материал): учеб. надбавка за студенти ср. проф. мениджър – М., 2004.
Опция 1
ЧАСТ А
Изберете верният отговор.
A1. В серията има само сложни вещества:
1) желязо и хлороводород, 2) меден сулфат и меден оксид,
3) сероводород и графит, 4) графит и диамант.
A2. Веществото KNS0 3 е
1) сол 2) киселина 3) основа 4) оксид.
A3. Броят на електроните във външния електронен слой на силициев атом
1) 3 2) 14 3) 28 4) 4
A4. При добавяне на солна киселина към разтвора се образува утайка.
киселини:
1) бариев хидроксид 2) сребърен нитрат
3) калиев нитрат 4) калиев карбонат
A5. Уравнение Mg + H 2 S0 4 = H 2 + MgS0 4
Съответства на реакцията на 1) свързване, 2) заместване, 3) разлагане, 4) обмен.
A6. 500 g разтвор съдържа 15 g калциев нитрат, докато масата
делът на солта е (в%)
1) 3 2) 10 3) 20 4) 30
A7. 0,2 mol въглероден оксид (P) (CO) заема обем... l (n.s.)
1) 0,2 2) 5,6 3) 4,48 4) 28
A8. 16 g кислород (0 2 ) са... бенка
1) 0,5 2) 1 3) 16 4) 6,02-10 23
A9. Дясната страна на уравнението за реакцията между калциев хидроксид и
въглероден диоксид с коеф
1) CaCO 3 + 2H 2 0 2) CaCO 3 + H 2 0
3) CaC0 3 + H 2 4) CaO + H 2 C0 3
A10. Във връзка К 2 Mn0 4 степен на окисление на манган
1)+2. 2)+3 3)+6 4)+7
A11. В вещество със състав E 2 0 7 елемент E е
1) P 2) C1 3) F 4) S
A12. В дадено вещество възниква ковалентна полярна връзка
1) S 8 2) K 5 S 3) K 4) H 2 S0 4
A13. Железен (I) сулфат реагира в разтвор с
1) Si 2) Si 3) Ag 4) Mg
A14. Калциевият оксид реагира с всяко от веществата
1)CON и HC1 2) S0 2 и H 2 0
3) MgO и C0 2 4) NO и HI
A15 В уравнението на реакцията между алуминий и бромоводород
вещества са съответно равни
1)1:3 2) 3: 1 3) 2: 3 4) 1: 6
A16. Фосфорът не се използва за
- правене на кибрит
- получаване на фосфорен (v) оксид при производството на фосфорна киселина
- образуване на димни екрани по време на горене
- правене на надписи, които светят в тъмното
A17. Скорост на реакция на Zn с H 2 S0 4 ще намалее при
- въвеждане на катализатор
- отопление
- разреждане на сярна киселина с вода
- смилане на цинк
A18. Основните оксиди са
3)Li 2 0 и H 2 0 4) C0 2 и Si0 2
5) CaO и BeO
A19. При пълна дисоциация на 2 мола се образуват 6 мола йони
l)Fe(N0 3 ) 2 2)FeS0 4 3) Fe(N0 3 ) 3 4) Fe 2 (S0 4 ) 3
1) 1,12 2) 11,2 3) 22,4 4)44,8
ЧАСТ Б
В 1. Частица, която приема електрони по време на химическа реакция, е...
Q2 Установете съответствие между класа на неорганичните съединения и формулата на веществото. В строго съответствие с последователността на числата в лявата колона, запишете буквите на избраните отговори от дясната колона. Прехвърлете получената последователностПИСМА във формата за отговор (без цифри, запетаи и интервали). Например GABV.
VZ. Ядрото на атом на химичен елемент съдържа 12 протона и 12 неутрона...
НА 4. Броят на електроните в един меден атом е...
НА 5. Подредете елементите в ред на увеличаване на металните свойства, като запишете номерата на веществата без интервали или запетаи l)Ga 2)C 3) Si 4)Ge
НА 6. Подредете веществата по ред на нарастване на степента на окисление на бромните атоми, като запишете номерата на веществата без интервали или запетаи
- Br 2 2) NaBr0 3 3) NaBr 4) NaBrO
НА 7. При изливане на разтвори, съдържащи 2 mol калциев нитрат и 3 mol калиев карбонат, се образува ... g утайка.
НА 8. Кислород може да се получи в лабораторията
- разлагане на калиев перманганат Б) дестилация на течен въздух
- разлагане на натриев нитрат D) разлагане на магнезиев оксид E) разлагане на мрамор
Отговор: .
(Запишете съответните букви по азбучен ред и ги прехвърлете във формата за отговори без интервали и запетаи).
ЗАКЛЮЧИТЕЛНА РАБОТА ПО КУРСА ПО НЕОРГАНИЧНА ХИМИЯ 9 КЛ.
Вариант №2
ЧАСТ А
Изберете верният отговор.
A1. В серията има както сложни, така и прости вещества:
1) азот и хлор, 2) амоняк и диамант, 3) сероводород и въглероден диоксид, 4) бромоводород и вода.
A2. Веществото KNS0 3 е
1) сол 2) киселина 3) основа 4) оксид
A3. Броят на електроните във външния слой на серен атом
1) 4 2) 6 3) 16 4) 32
A4. 1000 g разтвор съдържа 250 g сярна киселина, докато
масовата част на киселината е (в%)
1) 25 2) 30 3) 40 4) 75
A5. 0,1 mol неон (Ne) заема обем... l (n.s.)
1) 0,1 2) 2,24 3) 22,4 4) 20
A6. 4 g водород (H 2 ) са... бенка (н.с.)
1) 0,5 2) 2 3) 12,04-10 23 4) 4
A7. Дясната страна на уравнението на реакцията между магнезий и сярна киселина с коефициенти
1) MgS0 4 + H 2 0 2) MgS0 4 + H 2
3) MgS0 4 + 2H 2 0 4) MgS0 3 + H 2
A8. Брой молове NaOH, необходими за реакция с 1 мол FeCl 2 е равно
1)1 2)2 3)3 4)4
A9. Във връзка NS10 4 степен на окисление на хлора
1) +2 2) +3 3) +6 4) +7
A10. Във вещество със състав EO елементът Е е
1) Na 2) Be 3) B 4) F
A11. В дадено вещество възниква ковалентна неполярна връзка
1) P 4 2) P 2 0 5 3) Ca 4) Ca 3 P 2
A12. Медният (P) сулфат реагира в разтвор с
1) Ag 2) Hg " 3) Zn 4) S
A13. В уравнението на реакцията между алуминиев оксид и бромоводород
киселина, съотношението на коефициентите преди формулите на реагентите
вещества са съответно равни
1)6:1 2) 1:6 3) 1:3 4)2:3
A14. Не се използва алуминий
- като катализатор при производството на сярна киселина
- за възстановяване на метали от оксиди
- за производство на електрически кабели
- за производство на авиационни сплави
A15. В реакцията 2NaI + Br 2 = 2NaBr + I 2
броят на електроните, приети от един атом на окислителя, е равен на
1) 1 2) 2 3) 3 4) 4
A16. Основните оксиди са
1) A1 2 0 3 и C0 2 2) BaO и Cu 2 0
3) Li 2 0 и H 2 0 4) C0 2 и Si0 2
A17. Количеството фосфорно вещество, което може да реагира с 11,2 литра (n.s.) кислород съгласно уравнението
4P + 50 2 = 2P 2 0 5 ,
е... бенка
1) 0,4 2) 12,4 3) 8,96 4) 4
A18. При пълна дисоциация на 1 мол се образуват 5 мола йони
l)Fe(N0 3 ) 2 2)A1 2 (S0 4 ) 3 3) Fe(N0 3 ) 3 4) MgS0 4
A19. Не се среща в природата
1)A1 2 0 3 2)A1 3)CaC0 3 4) NaCl
A20. При смесване на разтвори, съдържащи 1 mol натриев карбонат и
1 мол солна киселина ще се отдели газ с обем... l (н.с.)
1) 1,12 2) 11,2 3)22,4 4) 44,8
ЧАСТ Б
В 1. Веществата, които се разпадат на йони в разтвори или стопилки са...
НА 2. Установете съответствие между класа на неорганичните съединения и формулата на веществото. В строго съответствие с последователността на числата в лявата колона, запишете буквите на избраните отговори от дясната колона. Прехвърлете получената последователност D) Ba(OH) 2
НА 3. Ядрото на атом на химичен елемент съдържа 17 протона и 18 неутрона...
НА 4. Броят на електроните в калциевия атом е...
НА 5. Подредете елементите в ред на нарастване на неметалните свойства, като запишете номерата на веществата без интервали или запетаи: 1) As 2) S 3) Se 4) Ge
НА 6. Подредете веществата по степен на нарастване на степента на окисление
фосфорни атоми, записвайки числата на веществата без интервали или запетаи
1) P 4 2) Mg 3 P 2 3) PCl 5 4) P 2 0 3
НА 7. При сливане на разтвори, съдържащи 2 mol железен (II) хлорид и 1 mol натриев сулфид, се образува ... g утайка.
НА 8. Може да се получи серен (IV) оксид
- действието на разредената сярна киселина върху магнезия
Б) изгаряне на сяра
- изгаряне на сероводород в излишък на въздух
Г) действието на концентрирана сярна киселина върху медта
Г) действието на разредена сярна киселина върху натриев сулфид
Отговор: .
(Запишете съответните букви по азбучен ред и ги прехвърлете във формата за отговори без интервали и запетаи).
ПЕРМСКА ДЪРЖАВНА ФАРМАЦЕВТИЧНА АКАДЕМИЯ
КАТЕДРА ПО НЕОРГАНИЧНА ХИМИЯ
ТЕСТОВЕ ПО ОБЩА И НЕОРГАНИЧНА ХИМИЯ
за самоконтрол и подготовка за изпити
(предназначено за студенти 1-ва година
факултети за редовно и дистанционно обучение)
Перм – 2004 г
2 -
Тестовете са съставени от екип от преподаватели от катедрата по неорганична химия: ръководител на катедрата, доцент М. С. Гайсинович, доцент Т. И. Береснева, старши учител И. В. Федорова, асистенти Г. И. Гущина, Л. А. Гребенюк.
Рецензент - доцент от катедрата по физическа и колоидна химия Т. Е. Рюмина.
Отговорен за освобождаването –
Заместник-ректорът по учебната дейност проф. Потемкин К.Д.
ВЪВЕДЕНИЕ
Общата и неорганичната химия във фармацевтичните университети е основен предмет, който до голяма степен определя успешното развитие на други химични и специални дисциплини.
Най-важната задача на обучението е да осигури надеждна и ефективна методология за наблюдение и самоконтрол на качеството на усвояване на учебния материал. Наред с традиционно използваните в химията техники за контрол (текущи въпроси, самостоятелни и контролни работи, устни и писмени изпити), все по-широко се използват тестове, т.е. стандартизирани, обикновено ограничени във времето тестове за проверка на знания, умения и способности.
Безспорното предимство на тестовата методика е нейната ефективност, която позволява както на учителя, така и на ученика да правят корекции в учебния процес. Ползата от тестовете се увеличава многократно само ако работата по тях ви принуждава не само да възпроизвеждате предоставената информация, но и активно да я обобщавате, обработвате и стимулирате логическото мислене. Затова работата с тестове никога не трябва да се превръща в игра на отгатване.
Тестовете са структурирани еднакво: за всеки въпрос има четири възможни отговора, от които само един е верен (или най-пълният). Когато започвате да работите върху тестове, първо изучавайте съответния материал от учебници, конспекти и лабораторни тетрадки. Използвайте необходимите справочни материали: периодична таблица на елементите, таблици на разтворимостта, редукционни потенциали, електроотрицателност на елементи, константи на дисоциация на електролити.
Структурата на атома. Периодичен закон. Химическа връзка.
1. В какви изрази става дума за простото вещество кислород, а не за химичен елемент?
а) кислородът е част от водата;
б) кислородът е слабо разтворим във вода:
в) в медния оксид масовата част на кислорода е 20%;
г) кислородът е част от всички жизненоважни органични вещества.
2. В какви изрази става дума за химичния елемент хлор, а не за просто вещество?
9 -
г) относителна електроотрицателност.
79. Какви свойства на атомите на елементите намаляват при движение отляво надясно през период?
в) радиус; г) брой валентни електрони.
80. Какви свойства на атомите на елементите се увеличават при движение отляво надясно през период?
а) радиус; б) метални свойства;
в) брой енергийни нива; г) относителна електроотрицателност
81. Какви свойства на атомите на елементите се увеличават, когато се движат отгоре надолу по основната подгрупа?
а) йонизационна енергия; б) енергия на електронен афинитет;
в) атомен радиус; г) относителна електроотрицателност
82. Какви свойства на атомите на елементите се увеличават, когато се движат отгоре надолу в група?
а) йонизационна енергия; б) брой валентни електрони;
в) радиус; г) най-висока степен на окисление.
83. Какви свойства на атомите на елементите намаляват, когато се движат отгоре надолу в група?
а) радиус; б) неметални свойства;
в) брой валентни електрони; г) най-висока степен на окисление.
84. Какви атомни параметри са периодично зависими от заряда на ядрото?
а) броя на електроните в атома; б) атомна маса;
в) радиус; г) брой енергийни нива.
85. Какви атомни параметри са периодично зависими от заряда на ядрото?
а) брой неутрони; б) брой на атомните орбитали;
в) атомна маса; г) йонизационна енергия.
86. Какви атомни параметри са периодично зависими от заряда на ядрото?
а) относителна електроотрицателност;
б) брой енергийни нива;
в) общ брой електрони;
г) брой протони.
87. Какви атомни параметри са периодично зависими от заряда на ядрото?
а) атомна маса; б) енергия на електронен афинитет;
в) брой енергийни нива; г) общ брой електрони.
88. Посочете физическото значение на числото на периода:
а) показва броя на енергийните нива в атома;
10 -
б) равен на броя на валентните електрони;
в) равен на броя на електроните във външното енергийно ниво;
г) равен на общия брой електрони в атома.
89. В този случай естеството на промяната в групата на атомния радиус (r), йонизационния потенциал (I), енергията на електронен афинитет (E), електроотрицателността (EO) е правилно посочена:
а) всички тези параметри се увеличават;
б) r – нараства, I, E, EO – намалява;
в) r – намалява, I, E, EO – нараства;
г) всички тези параметри намаляват.
90. Атомите на елементи с еднакъв брой валентни електрони са разположени:
а) в една група във вторична подгрупа на периодичната система;
в) в една група основната подгрупа на периодичната система;
г) в една група от периодичната система.
91. Знаейки номера на периода, в който се намира елементът, можете да предвидите за него:
а) общият брой електрони в атома;
б) броя на енергийните нива в атома;
в) общия брой електрони в атома;
г) формула на най-високия оксид на елемента.
92. Знаейки номера на групата, в която се намира елементът от главната подгрупа, можете да предскажете за него:
а) броя на енергийните нива в атома;
б) брой валентни електрони;
в) общ брой електрони;
г) ядрен заряд.
93. В коя част на периодичната таблица са разположени елементите с най-висока електроотрицателност?
а) долу вляво; б) горе вдясно; в) долу вдясно; г) горе вляво.
94. Енергията, дадена в уравнението, е:
Cl (r) Cl (r) + + 1е - 1254 kJ е за хлорния атом:
а) енергия на химичната връзка; б) електрон афинитет;
в) електроотрицателност; г) йонизационна енергия.
95. В коя част на периодичната таблица са разположени елементите с най-голям атомен радиус?
а) горе вляво; б) долу вдясно; в) долу вляво; г) горе вдясно.
96. В коя серия от елементи се увеличава радиусът на атомите:
а) Si, Al, Mg, Na; б) N, O, F, Ne;
в) Al, Si, P, S; г) Sr, Ca, Mg, Be.
97. В коя серия от елементи се увеличава относителната електроотрицателност на атомите:
11 -
а) Mg, Ca, Cr, Ba; б) O, S, Se, Te;
в) B, Al, Ga, In; г) B, C, N, O.
98. В кои серии от елементи относителната електроотрицателност на атомите намалява:
а) Sn Ge Si C; б) I Br Cl F;
в) Mg Ca Sr Ba; г) Te Se S O.
99. В коя серия от елементи се увеличава йонизационната енергия на атомите:
а) Bi Sb As P; б) Cl S P Si;
в) O S Se Te; г) Si Al Mg Na.
100. Химичният елемент (E) е в 5 период, формулата на неговото летливо водородно съединение е EN 3. Назовете елемента.
а) В; б) Sb; в) Nb; г) V.
101. Водородното съединение на някои неметали има формула EN 4. Каква е формулата на висшия му оксид?
а) E2O; б) ЕО; в) ЕО 4; г) EO 2.
102. Елементът е в 4-ти период. Неговият висш оксид има формула EO 3, а летливото й водородно съединение EN 2. Какъв елемент е това?
а) Cr; б) Se; в) Ni; г) Ge/
103. Водородното съединение на някои неметали има формула EN 3. Каква е формулата на висшия му оксид?
а) E 2 O 5; b) E2O3; в) ЕО 2; г) EO 3.
104. Елементът се намира в 5-ти период. Неговият висш оксид има формула E 2 O 7. Елементът не образува летливо водородно съединение. Какъв елемент е това?
а) Nb; б) Sb; в) аз; g Tc.
105. Висшият оксид на определен неметал има формула E 2 O 7. Каква е формулата на неговото водородно съединение?
а) EN; б) EN 7; в) EN 2; г) EN 3.
106. Каква е формулата на висшия оксид на елемент от третия период, чийто атом в основното състояние съдържа три несдвоени електрона?
а) E 2 O 3; б) ЕО 2; c) E2O5; г) E 2 O 7.
107. Формулата на по-висока кислородсъдържаща киселина, образувана от определен елемент, е H 3 EO 4. Каква конфигурация от валентни електрони може да има този елемент в основното си състояние?
а) 3s 2 3p 4 ; б) 3d 4 4s 2 ; в) 5s 2 5p 3 ; г) 3d 2 4s 2.
108. Формула на най-високия оксид на елемента E 2 O 5. Дайте формулата за електронната конфигурация на валентните електрони на атом на елемент:
а) ns 2 np 1 ; b) ns 2 np 3 ; в) ns 2 np 4; г) ns 2 np 2 .
109. Видове химични връзки в съединението Na 2 SO 4:
а) йонни и ковалентни полярни;
б) йонни и ковалентни неполярни;
- 12 -
в) ковалентен неполярен и водороден;
г) ковалентен полярен и водороден.
110. Колко електрони участват в образуването на химични връзки в молекулата на N 2:
а) 4; б) 2; в 10 часа; г) 6.
111. Колко електрони участват в образуването на химични връзки в молекулата C 2 H 6?
а) 14; б) 8; на 12; г) 10.
112. Максимална фракция на йонна връзка в молекула:
а) MgCl2; b) CaCl2; c) SrCl2; г) BaCl 2.
113. Максимална фракция на ковалентна връзка в молекула:
а) H2S; b) AlH3; c) NaH; г) PH 3.
114. Изберете двойка молекули, в които всички връзки са йонни:
а) NaCl, Cs2O; б) CO 2, CaF 2; c) PC15, KI; d) CHCL3, N2O3.
115. Посочете формулата на молекула, в която всички връзки са -тип:
а) SO 2; b) H2O2; в) CO 2; г) NOCl.
116. Посочете формулата на молекула, в която всички връзки са -тип:
а) такива молекули не могат да съществуват; b) SO 3;
c) Cl2O7; г) N 2.
117. Посочете формулата на молекула, в която всички връзки са -тип:
а) SO 3; b) PCl 5; c) NOCI; г) SOCl 2.
118. Посочете формулата на молекула, в която има еднакъв брой - и -връзки:
а) POCI3; б) СО 2; в) СС14; г) H2.
119. Посочете формулата на молекула, в която броят на -връзките е два пъти по-голям от броя на -връзките:
а) такава молекула не може да съществува; b) HCN;
c) COCI2; г) N 2.
120. Електронната формула mn: съответства на структурата на молекулата:
а) SO 2; б) НЕ 2; в) CO 2; г) H2O.
121. Коя от следните молекули има две несподелени двойки валентни електрони?
а) NH3; б) СН4; в) Н20; г) H2.
122. Молекулата на амоняка и амониевият йон се различават един от друг:
а) степента на окисление на азотния атом; б) общия брой електрони;
в) общият брой на протоните; г) заряд на ядрото на азотния атом.
123. Дайте формулата на молекула с несдвоен електрон:
а) НЕ; б) СО; в) ZnO; г) MgO.
124. Колко електрони участват в образуването на химични връзки в молекулата C 2 H 6:
а) 7; б) 14; на 8; г) 6.
- 13 -
125. Колко електрони участват в образуването на химични връзки в молекулата PCl 5:
а) 12; б) 5; на 6; г) 10.
126. Изберете двойка молекули, в които всички връзки са ковалентни:
а) NH4CL, NO; b) CaS, HCl; c) P2O5, CCL 4; г) CaBr 2, LiI.
127. Изберете двойка молекули, едната от които има ковалентни връзки, а другата има йонни връзки:
а) CsF, BaF 2; б) BCL 3, BaO; c) SCI4, SiH4; г) K2O, MgS.
128. С коя частица молекулата на амоняк може да образува химическа връзка, използвайки донорно-акцепторния механизъм:
а) Н+; б) СН4; в) Н2; г) Н - .
129. Донорът на електронна двойка е:
а) NH3; b) BH 3; c) NH4+; г) СН 4.
130. Акцепторът на електронна двойка е:
а) BF 3; b) NH4+; в) BF 4 - ; г) NH3.
131. Кое твърдение е грешно:
а) единичната връзка винаги е -тип;
б) двойните и тройните връзки винаги включват връзка;
в) колкото по-голяма е кратността на връзката, толкова по-слаба е тя;
г) колкото по-висока е кратността на връзката, толкова по-къса е нейната дължина.
132. Посочете позицията, която противоречи на теорията за хибридизацията:
а) общият брой орбитали преди и след хибридизацията не се променя;
б) хибридните орбитали имат различни енергии;
в) всички хибридни орбитали имат еднаква форма;
г) по време на процеса на хибридизация се променя пространствената ориентация на орбиталите.
133. Фосфорният атом в молекулата PCl 3 е в sp 3 хибридизация. В хибридизацията участват едноелектронни облаци и несподелена електронна двойка. Каква форма има молекулата?
а) тетраедърен; б) пирамидален; в) линейни; г) ъгъл.
134. Серният атом в молекулата SOCl 2 е в sp 3 хибридизация. В хибридизацията участват едноелектронни облаци и несподелена електронна двойка. Каква форма има молекулата?
а) пирамидален; б) тетраедърен; в) ъгъл; г) линейни.
135. Кислородният атом във водна молекула е в sp 3 хибридизация. В хибридизацията участват едноелектронни облаци и две несподелени двойки електрони. Каква форма има молекулата?
а) пирамидален; б) тетраедърен; в) линейни; г) ъгъл.
136. Въглеродният атом в молекулата на HCN е sp-хибридизиран. В хибридизацията участват само едноелектронни облаци. Каква форма има молекулата?
а) ъгъл; б) пирамидален; в) линейни; г) тетраедърен.
14 -
137. Молекулата е неполярна:
а) тетраедричен CCl 4; б) пирамидален NH3;
в) ъглова H 2 Se; г) линеен HCl.
138. В коя от молекулите ъгълът елемент-въглерод-елемент е най-малък:
а) CO 2; b) COCl2; в) CCL 4; г) HCN.
139. В коя серия и трите молекули са полярни:
а) CO 2, COCl 2, NH 3; b) CC14, CHCI3, N20;
c) BCI3, SO2, SO3; г) NH3, SO2, H2O.
140. Диполният момент е нула в молекулата:
а) H 2 O (ъглова); б) SO 2 (ъглова);
в) CO 2 (линеен); г) NH3 (пирамидален).
141. Въз основа на естеството на молекулните връзки, определете в коя серия температурата на кипене на веществата се увеличава:
а) BaCl 2 – HF – He; б) He – BaCl 2 – HF;
в) HF – He – BaCl 2; г) He – HF – BaCl 2.
142. В серията халогеноводороди HF HCl HBr HI
необичайно висока температура. кип., o C 19.5 -85.1 -66.8 -35.4
HF обясни:
а) малки молекулни размери;
б) наличието на водородни връзки между молекулите;
в) висока полярност на молекулата;
г) висока химична активност на молекулата.
143. Редица вещества: калиев нитрат, силиций, йод - съответстват на последователността от имена на видове кристални решетки:
а) йонни, метални, атомни;
б) йонни, молекулярни, молекулярни;
в) йонни, атомни, молекулни;
г) йонен, атомен, атомен.
144. Терминът "молекула" не може да се използва при характеризиране на структурата в твърдо състояние:
а) фосфорен хлорид (V) 1; б) бариев оксид;
в) сяра; г) въглероден диоксид.
145. Какви частици се намират в местата на йодната кристална решетка?
а) 1 o атома; б) йони I + и I -;
в) I 2 молекули; г) I + йони и свободни електрони.
146. Какви частици се намират в местата на кристалната решетка на калциевия оксид?
а) Ca и O атоми; б) Ca 2+ и O 2- йони;
в) СаО молекули; г) Ca 2+ йони и O 2 молекули.
147. Елемент с каква електронна конфигурация на атома образува кристална решетка от метален тип:
а) 3s 2 3p 2 ; б) 1s 1; в) 3s 2 3p 6 3d 5 4s 1 ; г) 1s 2.
- 15 -
148. Просто вещество, чиито атоми имат електронна формула:
а) 1s 2 2s 2 2p 4 ; b) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 9 4s 1 ;
в) 1s 2 2s 2 ; г) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 7 4s 2.
149. Кое свойство не е типично за веществата с молекулна кристална решетка:
а) в твърдо състояние са изолатори;
б) имат високи точки на топене;
в) имат ниска твърдост;
г) в разтворено състояние, като правило, те не провеждат ток.
150. Кое свойство не е характерно за веществата с атомна кристална решетка:
а) висока твърдост; б) висока точка на топене;
в) добра електропроводимост; г) ниска волатилност.
151. Атомната кристална решетка се образува от атоми, чиято електронна формула е:
а) 1s 2 2s 2 2p 6 3s 2 3p 4 ; b) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 8 4s 2 ;
в) 1s 2 2s 2 2p 2 ; г) 1s 2 2s 2 2p 6 3s 1 .
152. Високата твърдост, крехкостта, високата точка на топене и липсата на електропроводимост са характерни за веществата, които имат ..... кристална решетка.
а) атомен; б) молекулярни; в) метал; г) йонни.
153. Кое свойство не е характерно за вещества с йонна кристална решетка:
а) добра разтворимост в полярни разтворители;
б) висока точка на топене;
в) крехкост;
г) добра електропроводимост в твърдо състояние.