Въглероден диоксид, въглероден оксид, въглероден диоксид - всичко това са имена на едно вещество, известно ни като въглероден диоксид. И така, какви свойства има този газ и какви са неговите области на приложение?
Въглероден диоксид и неговите физични свойства
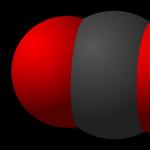
Въглеродният диоксид се състои от въглерод и кислород. Формулата за въглероден диоксид изглежда така – CO₂. В природата се образува при изгаряне или гниене на органични вещества. Съдържанието на газ във въздуха и минералните извори също е доста високо. В допълнение, хората и животните също отделят въглероден диоксид, когато издишват.

Ориз. 1. Молекула въглероден диоксид.
Въглеродният диоксид е напълно безцветен газ и не може да се види. Освен това няма мирис. Въпреки това, при високи концентрации, човек може да развие хиперкапния, тоест задушаване. Липсата на въглероден диоксид също може да причини здравословни проблеми. В резултат на липсата на този газ може да се развие обратното на задушаване състояние - хипокапния.
Ако поставите въглероден диоксид в условия на ниска температура, тогава при -72 градуса той кристализира и става като сняг. Следователно въглеродният диоксид в твърдо състояние се нарича "сух сняг".

Ориз. 2. Сух сняг – въглероден диоксид.
Въглеродният диоксид е 1,5 пъти по-плътен от въздуха. Плътността му е 1,98 kg/m³ Химическата връзка в молекулата на въглеродния диоксид е полярна ковалентна. Той е полярен поради факта, че кислородът има по-висока стойност на електроотрицателност.
Важна концепция в изучаването на веществата е молекулната и моларната маса. Моларната маса на въглеродния диоксид е 44. Това число се образува от сумата на относителните атомни маси на атомите, които изграждат молекулата. Стойностите на относителните атомни маси са взети от таблицата на D.I. Менделеев и са закръглени до цели числа. Съответно, моларната маса на CO₂ = 12+2*16.
За да се изчислят масовите дялове на елементите във въглеродния диоксид, е необходимо да се следва формулата за изчисляване на масовите дялове на всеки химичен елемент в дадено вещество.
н– брой атоми или молекули.
А r– относителна атомна маса на химичен елемент.
г-н– относителна молекулна маса на веществото.
Нека изчислим относителната молекулна маса на въглеродния диоксид.
Mr(CO₂) = 14 + 16 * 2 = 44 w(C) = 1 * 12 / 44 = 0,27 или 27% Тъй като формулата на въглеродния диоксид включва два кислородни атома, тогава n = 2 w(O) = 2 * 16 / 44 = 0,73 или 73%
Отговор: w(C) = 0,27 или 27%; w(O) = 0,73 или 73%
Химични и биологични свойства на въглеродния диоксид
Въглеродният диоксид има киселинни свойства, тъй като е киселинен оксид и когато се разтвори във вода, образува въглеродна киселина:
CO₂+H2O=H2CO3
Реагира с алкали, което води до образуване на карбонати и бикарбонати. Този газ не гори. Само някои активни метали, като магнезий, горят в него.
При нагряване въглеродният диоксид се разпада на въглероден оксид и кислород:
2CO3=2CO+O3.
Подобно на други киселинни оксиди, този газ лесно реагира с други оксиди:
СaO+Co₃=CaCO₃.
Въглеродният диоксид е част от всички органични вещества. Циркулацията на този газ в природата се осъществява с помощта на производители, консуматори и разложители. В процеса на живот човек произвежда приблизително 1 kg въглероден диоксид на ден. Когато вдишваме, получаваме кислород, но в този момент в алвеолите се образува въглероден диоксид. В този момент се извършва обмен: кислородът влиза в кръвта и въглеродният диоксид излиза.
Въглеродният диоксид се получава при производството на алкохол. Този газ също е страничен продукт при производството на азот, кислород и аргон. Използването на въглероден диоксид е необходимо в хранително-вкусовата промишленост, където въглеродният диоксид действа като консервант, а въглеродният диоксид в течна форма се намира в пожарогасителите.
, въглероден диоксид, свойства на въглеродния диоксид, производство на въглероден диоксид
Не е подходящ за поддържане на живота. Но именно с него се „хранят“ растенията, превръщайки го в органични вещества. В допълнение, това е един вид „одеяло“ за Земята. Ако този газ внезапно изчезне от атмосферата, Земята ще стане много по-хладна и дъждът на практика ще изчезне.
"Одеялото на земята"
(въглероден диоксид, въглероден диоксид, CO 2) се образува при свързване на два елемента: въглерод и кислород. Образува се при изгарянето на въглища или въглеводородни съединения, при ферментацията на течности, а също и като продукт на дишането на хора и животни. Намира се в малки количества и в атмосферата, откъдето се усвоява от растенията, които от своя страна произвеждат кислород.
Въглеродният диоксид е безцветен и по-тежък от въздуха. Замръзва при -78,5°C, образувайки сняг, състоящ се от въглероден диоксид. Във воден разтвор образува въглена киселина, но не е достатъчно стабилна, за да бъде лесно изолирана.
Въглеродният диоксид е одеялото на Земята. Той лесно пропуска ултравиолетовите лъчи, които нагряват нашата планета и отразява инфрачервените лъчи, излъчвани от нейната повърхност в открития космос. И ако въглеродният диоксид внезапно изчезне от атмосферата, това ще се отрази преди всичко на климата. На Земята ще стане много по-хладно и дъждът ще вали много рядко. Не е трудно да се отгатне докъде ще доведе това в крайна сметка.
Вярно е, че такава катастрофа все още не ни заплашва. Точно обратното. Изгарянето на органични вещества: нефт, въглища, природен газ, дърва - постепенно увеличава съдържанието на въглероден диоксид в атмосферата. Това означава, че с времето трябва да очакваме значително затопляне и овлажняване на климата на земята. Между другото, старите хора смятат, че вече е значително по-топло, отколкото в дните на тяхната младост...
Отделя се въглероден диоксид течност с ниска температура, течност под високо наляганеИ газообразен. Получава се от отпадъчни газове от производството на амоняк и алкохол, както и от изгаряне на специални горива и други индустрии. Газообразният въглероден диоксид е газ без цвят и мирис при температура 20 ° C и налягане 101,3 kPa (760 mm Hg), плътност - 1,839 kg / m 3. Течният въглероден диоксид е просто безцветна течност без мирис.
Нетоксичен и неексплозивен. При концентрации над 5% (92 g/m3) въглеродният диоксид има вредно въздействие върху човешкото здраве - той е по-тежък от въздуха и може да се натрупа в лошо проветриви помещения близо до пода. Това намалява обемната част на кислорода във въздуха, което може да причини недостиг на кислород и задушаване.
Произвеждане на въглероден диоксид
В промишлеността въглеродният диоксид се получава от пещни газове, от продукти на разлагане на природни карбонати(варовик, доломит). Сместа от газове се промива с разтвор на калиев карбонат, който абсорбира въглероден диоксид, превръщайки се в бикарбонат. При нагряване разтворът на бикарбонат се разлага, освобождавайки въглероден диоксид. По време на промишленото производство газът се изпомпва в бутилки.
В лабораторни условия се получават малки количества взаимодействие на карбонати и бикарбонати с киселини, например мрамор със солна киселина.
"Сух лед" и други полезни свойства на въглеродния диоксид
Въглеродният диоксид се използва доста широко в ежедневната практика. Например, газирана водас добавка на ароматни есенции - чудесна освежаваща напитка. IN Хранително-вкусовата промишленоствъглеродният диоксид се използва и като консервант - посочен е на опаковката под кода E290, а също и като набухвател на тестото.
Пожарогасители с въглероден диоксидизползвани при пожари. Това са установили биохимиците наторяване... на въздуха с въглероден диоксидмного ефективно средство за увеличаване на добива на различни култури. Може би този тор има един единствен, но значителен недостатък: може да се използва само в оранжерии. В заводите, които произвеждат въглероден диоксид, втечненият газ се пакетира в стоманени бутилки и се изпраща до потребителите. Ако отворите клапана, снегът излиза със свистене. Що за чудо?
Всичко е обяснено просто. Работата, изразходвана за компресиране на газа, е значително по-малка от тази, необходима за разширяването му. И за да компенсира по някакъв начин получения дефицит, въглеродният диоксид рязко се охлажда, превръщайки се в "сух лед". Той се използва широко за консервиране на храна и има значителни предимства пред обикновения лед: първо, неговият „охлаждащ капацитет“ е два пъти по-висок на единица тегло; второ, изпарява се без следа.
Въглеродният диоксид се използва като активна среда в заваряване на тел, тъй като при температура на дъгата въглеродният диоксид се разлага на въглероден оксид CO и кислород, който от своя страна взаимодейства с течния метал, окислявайки го.
Въглеродният диоксид в кутии се използва в въздушни пушкии като източник на енергия за двигателив авиомоделизма.
Въглеродният диоксид (въглероден диоксид, въглероден диоксид, CO 2) се образува от взаимодействието на два елемента - кислород и въглерод. Въглеродният диоксид се получава при изгаряне на въглеводородни съединения или въглища, в резултат на ферментация на течности, а също и като продукт на дишането на животни и хора. Намира се в атмосферата в малки количества. Растенията абсорбират въглероден диоксид от атмосферата и го превръщат в органични компоненти. Когато този газ изчезне от атмосферата, на Земята практически няма да има дъжд и тя ще стане значително по-хладна.
Свойства на въглеродния диоксид
Въглеродният диоксид е по-тежък от въздуха. Замръзва при -78 °C. Когато въглеродният диоксид замръзне, той образува сняг. В разтвор въглеродният диоксид образува въглеродна киселина. Поради определени свойства въглеродният диоксид понякога се нарича „одеялото“ на Земята. Лесно пропуска ултравиолетовите лъчи. Инфрачервените лъчи се излъчват от повърхността на въглеродния диоксид в космоса.
Въглеродният диоксид се отделя в течна форма при ниска температура, течна форма при високо налягане и газообразна форма. Газообразната форма на въглеродния диоксид се получава от отпадъчни газове при производството на алкохоли, амоняк, а също и в резултат на изгаряне на гориво. Въглеродният диоксид е нетоксичен и неексплозивен газ, без мирис и цвят. В течна форма въглеродният диоксид е безцветна течност без мирис. Когато съдържанието е повече от 5%, въглеродният диоксид се натрупва в площта на пода в лошо вентилирани помещения. Намаляването на обемната част на кислорода във въздуха може да доведе до недостиг на кислород и задушаване. Ембриолозите са установили, че човешките и животинските клетки се нуждаят от около 7% въглероден диоксид и само 2% от кислород. Въглеродният диоксид е успокоител на нервната система и отличен анестетик. Газът в човешкото тяло участва в синтеза на аминокиселини и има съдоразширяващ ефект. Липсата на въглероден диоксид в кръвта води до спазъм на кръвоносните съдове и гладката мускулатура на всички органи, до увеличаване на секрецията в носните проходи, бронхите и до развитие на полипи и аденоиди, както и до удебеляване на мембраните поради отлагане на холестерол. .
Производство на въглероден диоксид
Има няколко начина за производство на въглероден диоксид. В промишлеността въглеродният диоксид се получава от доломит, варовик - продукти от разлагането на естествени карбонати, както и от пещни газове. Газовата смес се промива с разтвор на калиев карбонат. Сместа абсорбира въглероден диоксид и се превръща в бикарбонат. Разтворът на бикарбонат се нагрява и се разлага, освобождавайки въглероден диоксид. При промишления метод на производство въглеродният диоксид се изпомпва в цилиндри.
В лабораториите производството на въглероден диоксид се основава на взаимодействието на бикарбонати и карбонати с киселини.
Приложения на въглероден диоксид
В ежедневната практика въглеродният диоксид се използва доста често. В хранително-вкусовата промишленост въглеродният диоксид се използва като набухвател за тесто, а също и като консервант. Посочен е на опаковката на продукта под код E290. Свойствата на въглеродния диоксид се използват и при производството на газирана вода.
 Биохимиците са установили, че за увеличаване на добива на различни култури е много ефективно да се наторява въздухът с въглероден диоксид. Този метод на торене обаче може да се използва само в оранжерии. В селското стопанство газът се използва за създаване на изкуствен дъжд. Когато неутрализира алкална среда, въглеродният диоксид замества мощните минерални киселини. В съоръженията за съхранение на зеленчуци въглеродният диоксид се използва за създаване на газова среда.
Биохимиците са установили, че за увеличаване на добива на различни култури е много ефективно да се наторява въздухът с въглероден диоксид. Този метод на торене обаче може да се използва само в оранжерии. В селското стопанство газът се използва за създаване на изкуствен дъжд. Когато неутрализира алкална среда, въглеродният диоксид замества мощните минерални киселини. В съоръженията за съхранение на зеленчуци въглеродният диоксид се използва за създаване на газова среда.
В парфюмерийната индустрия въглеродният диоксид се използва при производството на парфюми. В медицината въглеродният диоксид се използва за антисептични ефекти по време на открити операции.
Когато се охлади, въглеродният диоксид се превръща в „сух лед“. Втечненият въглероден диоксид се пакетира в бутилки и се изпраща до потребителите. Въглеродният диоксид под формата на "сух лед" се използва за консервиране на храна. При нагряване такъв лед се изпарява, без да оставя остатък.
Въглеродният диоксид се използва като активна среда при заваряване на тел. При заваряване въглеродният диоксид се разлага на кислород и въглероден оксид. Кислородът взаимодейства с течния метал и го окислява.
В авиомоделирането въглеродният диоксид се използва като източник на енергия за двигателите. Контейнери с въглероден диоксид се използват във въздушни оръжия.
В промишлеността основните методи за производство на въглероден диоксид CO2 са неговото производство като страничен продукт от реакцията на превръщане на метан CH4 във водород H2, реакции на изгаряне (окисление) на въглеводороди, реакция на разлагане на варовик CaCO3 във вар CaO и вода H20.
CO2 като страничен продукт от парното преобразуване на CH4 и други въглеводороди във водород H2
Водородът H2 се изисква от промишлеността, предимно за използването му в процеса на производство на амоняк NH3 (процес на Хабер, каталитична реакция на водород и азот); Амонякът е необходим за производството на минерални торове и азотна киселина. Водородът може да се произвежда по различни начини, включително електролизата на водата, която е обичана от еколозите - но, за съжаление, в момента всички методи за производство на водород, с изключение на реформирането на въглеводороди, са абсолютно икономически неоправдани в мащаба на големи мащаби. производство - освен ако няма излишък на "безплатни" материали в производството.електричество. Следователно основният метод за производство на водород, при който се отделя и въглероден диоксид, е парният реформинг на метан: при температура около 700...1100°C и налягане 3...25 bar, в присъствието на катализатор, водната пара H2O реагира с метан CH4 с освобождаване на синтезен газ (процесът е ендотермичен, т.е. протича с абсорбцията на топлина):
CH4 + H2O (+ топлина) → CO + 3H2
Пропанът може да бъде реформиран с пара по подобен начин:
С3H8 + 3H2O (+ топлина) → 2CO + 7H2
А също и етанол (етилов алкохол):
C2H5OH + H2O (+ топлина) → 2CO + 4H2
Дори бензинът може да бъде реформиран с пара. Бензинът съдържа повече от 100 различни химични съединения, реакциите на парно реформиране на изооктан и толуен са показани по-долу:
C8H18 + 8H2O (+ топлина) → 8CO + 17H2
C7H8 + 7H2O (+ топлина) → 7CO + 11H2
И така, в процеса на парно реформиране на едно или друго въглеводородно гориво се получават водород и въглероден оксид CO (въглероден оксид). В следващата стъпка от процеса на производство на водород въглеродният окис, в присъствието на катализатор, претърпява реакцията на преместване на кислороден атом O от вода към газ = CO се окислява до CO2 и водородът H2 се освобождава в свободна форма. Реакцията е екзотермична, отделяйки около 40,4 kJ/mol топлина:
CO + H2O → CO2 + H2 (+ топлина)
В индустриални условия въглеродният диоксид CO2, освободен по време на парното реформиране на въглеводороди, може лесно да бъде изолиран и събран. Въпреки това CO2 в този случай е нежелан страничен продукт, който просто се освобождава свободно в атмосферата, въпреки че сега преобладаващият начин за премахване на CO2 е нежелан от гледна точка на околната среда и някои предприятия практикуват по-„напреднали“ методи , като например изпомпване на CO2 в намаляващи нефтени полета или инжектиране в океана.
Производство на CO2 от пълно изгаряне на въглеводородни горива
При изгаряне, тоест окисляване с достатъчно количество кислород, се образуват въглеводороди като метан, пропан, бензин, керосин, дизелово гориво и др., въглероден диоксид и обикновено вода. Например, реакцията на изгаряне на метан CH4 изглежда така:
CH 4 + 2O 2 → CO 2 + 2H 2 O
CO2 като страничен продукт от производството на H2 чрез частично окисление на гориво
Около 95% от промишлено произведения в света водород се произвежда чрез гореописания метод на парно преобразуване на въглеводородни горива, основно CH4 метан, съдържащ се в природния газ. В допълнение към парното реформиране, водородът може да бъде произведен от въглеводородно гориво с доста висока ефективност чрез метода на частично окисление, когато метанът и другите въглеводороди реагират с количество кислород, което е недостатъчно за пълно изгаряне на горивото (не забравяйте, че в процеса на пълно изгаряне изгаряне на гориво, описано накратко малко по-горе, се получава въглероден диоксид CO2 газ и H20 вода). Когато се подава по-малко от стехиометрично количество кислород, реакционните продукти са предимно водород H2 и въглероден оксид, известен също като въглероден оксид CO; въглероден диоксид CO2 и някои други вещества се произвеждат в малки количества. Тъй като обикновено на практика този процес се извършва не с пречистен кислород, а с въздух, то и на входа, и на изхода на процеса има азот, който не участва в реакцията.
Частичното окисление е екзотермичен процес, което означава, че реакцията произвежда топлина. Частичното окисляване обикновено протича много по-бързо от реформирането с пара и изисква по-малък обем на реактора. Както може да се види от реакциите по-долу, частичното окисление първоначално произвежда по-малко водород на единица гориво, отколкото се получава от процеса на парно реформиране.
Реакция на частично окисление на метан CH4:
CH 4 + ½O 2 → CO + H 2 (+ топлина)
Пропан C3H8:
C 3 H 8 + 1½O 2 → 3CO + 4H 2 (+ топлина)
Етилов алкохол C2H5OH:
C 2 H 5 OH + ½ O 2 → 2CO + 3H 2 (+ топлина)
Частично окисление на бензин, използвайки примера на изооктан и толуен, от повече от сто химически съединения, присъстващи в бензина:
C 8 H 18 + 4O 2 → 8CO + 9H 2 (+ топлина)
C 7 H 18 + 3½O 2 → 7CO + 4H 2 (+ топлина)
За превръщането на CO във въглероден диоксид и производството на допълнителен водород се използва реакцията на преместване на кислорода вода→газ, вече спомената в описанието на процеса на парно реформиране:
CO + H 2 O → CO 2 + H 2 (+ малко количество топлина)
CO2 от ферментация на захар
При производството на алкохолни напитки и хлебни изделия от тесто с мая се използва процесът на ферментация на захари - глюкоза, фруктоза, захароза и др., С образуването на етилов алкохол C2H5OH и въглероден диоксид CO2. Например реакцията на ферментация на глюкоза C6H12O6 е:
C 6 H 12 O 6 → 2C 2 H 5 OH + 2CO 2
А ферментацията на фруктоза C12H22O11 изглежда така:
C 12 H 22 O 11 + H 2 O → 4C 2 H 5 OH + 4CO 2
Оборудване за производство на CO2 на Wittemann
При производството на алкохолни напитки полученият алкохол е желан и дори, може да се каже, необходим продукт от реакцията на ферментация. Въглеродният диоксид понякога се отделя в атмосферата, а понякога се оставя в напитката, за да я карбонизира. При печенето на хляб се случва обратното: CO2 е необходим за образуването на мехурчета, които карат тестото да втаса, а етиловият алкохол се изпарява почти напълно по време на печенето.
Много предприятия, предимно дестилерии, за които CO 2 е напълно ненужен страничен продукт, са установили неговото събиране и продажба. Газът от ферментационните резервоари се подава през алкохолни уловители към цеха за въглероден диоксид, където CO2 се пречиства, втечнява и бутилира. Всъщност именно дестилериите са основните доставчици на въглероден диоксид в много региони - и за много от тях продажбата на въглероден диоксид съвсем не е последният източник на доходи.
Съществува цяла индустрия в производството на оборудване за отделяне на чист въглероден диоксид в пивоварни и фабрики за алкохол (Huppmann/GEA Brewery, Wittemann и др.), както и директното му производство от въглеводородни горива. Доставчици на газ като Air Products и Air Liquide също инсталират станции за отделяне на CO2, след което го пречистват и втечняват, преди да го напълнят в бутилки.
CO2 при производството на негасена вар CaO от CaCO3
Процесът за производство на широко използваната негасена вар, CaO, също има въглероден диоксид като страничен продукт от реакцията. Реакцията на разлагане на варовика CaCO3 е ендотермична, изисква температура около +850°C и изглежда така:
CaCO3 → CaO + CO2
Ако варовик (или друг метален карбонат) реагира с киселина, въглеродният диоксид H2CO3 се освобождава като един от реакционните продукти. Например солната киселина HCl реагира с варовик (калциев карбонат) CaCO3, както следва:
2HCl + CaCO 3 → CaCl 2 + H 2 CO 3
Въглеродната киселина е много нестабилна и при атмосферни условия бързо се разлага на CO2 и вода H2O.
Въглеродният диоксид е безцветен газ с едва доловима миризма, нетоксичен, по-тежък от въздуха. Въглеродният диоксид е широко разпространен в природата. Разтваря се във вода, образува въглена киселина H 2 CO 3, което му придава кисел вкус. Въздухът съдържа около 0,03% въглероден диоксид. Плътността е 1,524 пъти по-голяма от плътността на въздуха и е равна на 0,001976 g / cm 3 (при нулева температура и налягане 101,3 kPa). Йонизационен потенциал 14.3V. Химична формула - CO 2.
В заваръчното производство се използва терминът "въглероден двуокис"см. . В „Правилата за устройство и безопасна експлоатация на съдове под налягане“ терминът "въглероден двуокис", а в - срок "въглероден двуокис".
Има много начини за производство на въглероден диоксид, основните са разгледани в статията.
Плътността на въглеродния диоксид зависи от налягането, температурата и агрегатното състояние, в което се намира. При атмосферно налягане и температура от -78,5 ° C въглеродният диоксид, заобикаляйки течното състояние, се превръща в бяла снежна маса "сух лед".
Под налягане от 528 kPa и при температура от -56,6 ° C въглеродният диоксид може да бъде във всичките три състояния (така наречената тройна точка).
Въглеродният диоксид е термично стабилен, разпада се на въглероден оксид само при температури над 2000°C.
Въглеродният диоксид е първият газ, описан като дискретно вещество. През седемнадесети век фламандски химик Ян Баптист ван Хелмонт (Ян Баптист ван Хелмонт) забеляза, че след изгаряне на въглища в затворен съд масата на пепелта е много по-малка от масата на изгорените въглища. Той обясни това, като каза, че въглищата се трансформират в невидима маса, която той нарече „газ“.
Свойствата на въглеродния диоксид са изследвани много по-късно през 1750 г. шотландски физик Джоузеф Блек (Джоузеф Блек).
Той открива, че варовикът (калциев карбонат CaCO 3), когато се нагрява или реагира с киселини, освобождава газ, който той нарича „свързан въздух“. Оказа се, че „свързаният въздух“ е по-плътен от въздуха и не поддържа горене.
CaCO3 + 2HCl = CO2 + CaCl2 + H2O
Чрез преминаване на „свързан въздух“, т.е. въглероден диоксид CO 2 чрез воден разтвор на вар Ca(OH) 2 калциев карбонат CaCO 3 се отлага на дъното. Джоузеф Блек използва този експеримент, за да докаже, че въглеродният диоксид се отделя чрез дишането на животните.
CaO + H 2 O = Ca(OH) 2
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O
Течният въглероден диоксид е безцветна течност без мирис, чиято плътност варира значително в зависимост от температурата. Съществува при стайна температура само при налягане над 5,85 MPa. Плътността на течния въглероден диоксид е 0,771 g/cm3 (20°C). При температури под +11°C е по-тежък от водата, а над +11°C е по-лек.
Специфичното тегло на течния въглероден диоксид варира значително в зависимост от температурата, следователно количеството въглероден диоксид се определя и продава по тегло. Разтворимостта на вода в течен въглероден диоксид в температурния диапазон 5,8-22,9°C е не повече от 0,05%.
Течният въглероден диоксид се превръща в газ, когато към него се подава топлина. При нормални условия (20°C и 101,3 kPa) Когато 1 kg течен въглероден диоксид се изпари, се образуват 509 литра въглероден диоксид. Когато газът се изтегли твърде бързо, налягането в цилиндъра намалява и подаването на топлина е недостатъчно, въглеродният диоксид се охлажда, скоростта на изпарението му намалява и когато достигне „тройната точка“, се превръща в сух лед, който запушва дупката в редуктора и по-нататъшното извличане на газ спира. При нагряване сухият лед директно се превръща във въглероден диоксид, заобикаляйки течното състояние. За да се изпари сух лед, е необходимо да се достави значително повече топлина, отколкото да се изпари течният въглероден диоксид - следователно, ако в цилиндъра се е образувал сух лед, той се изпарява бавно.
Течният въглероден диоксид е произведен за първи път през 1823 г. Хъмфри Дейви(Хъмфри Дейви) и Майкъл Фарадей(Майкъл Фарадей).
Твърдият въглероден диоксид "сух лед" прилича на сняг и лед на външен вид. Съдържанието на въглероден диоксид, получен от брикетите със сух лед е високо - 99,93-99,99%. Съдържанието на влага е в диапазона 0,06-0,13%. Сухият лед, намиращ се на открито, се изпарява бързо, така че контейнерите се използват за неговото съхранение и транспортиране. Въглеродният диоксид се произвежда от сух лед в специални изпарители. Твърд въглероден диоксид (сух лед), доставен в съответствие с GOST 12162.
Най-често се използва въглероден диоксид:
- за създаване на защитна среда за металите;
- в производството на газирани напитки;
- Охлаждане, замразяване и съхранение на хранителни продукти;
- за пожарогасителни системи;
- за почистване на повърхности със сух лед.
Плътността на въглеродния диоксид е доста висока, което позволява да се защити реакционното пространство на дъгата от контакт с въздушни газове и предотвратява азотирането при относително ниска консумация на въглероден диоксид в струята. Въглеродният диоксид по време на процеса на заваряване взаимодейства със заваръчния метал и има окисляващ, а също и карбуризиращ ефект върху метала на заваръчната вана.
Преди това съществуват пречки пред използването на въглероден диоксид като защитна средав шевовете. Порите са причинени от кипене на втвърдяващия се метал на заваръчната вана от отделянето на въглероден оксид (CO) поради недостатъчното му дезоксидиране.
При високи температури въглеродният диоксид се дисоциира, за да образува високоактивен свободен, моноатомен кислород:
Окисляването на заваръчния метал, освободен от въглероден диоксид по време на заваряване, се неутрализира чрез съдържанието на допълнително количество легиращи елементи с висок афинитет към кислорода, най-често силиций и манган (повече от количеството, необходимо за легиране на заваръчния метал) или потоци, въведени в зоната на заваряване (заваряване).
Както въглеродният диоксид, така и въглеродният оксид са практически неразтворими в твърд и разтопен метал. Свободният актив окислява елементите, присъстващи в заваръчната вана, в зависимост от техния кислороден афинитет и концентрация съгласно уравнението:
Me + O = MeO
където Me е метал (манган, алуминий и др.).
В допълнение, самият въглероден диоксид реагира с тези елементи.
В резултат на тези реакции при заваряване във въглероден диоксид се наблюдава значително изгаряне на алуминий, титан и цирконий и по-малко интензивно изгаряне на силиций, манган, хром, ванадий и др.
Окисляването на примесите протича особено енергично при. Това се дължи на факта, че при заваряване с консумативен електрод взаимодействието на разтопения метал с газа се получава, когато в края на електрода и в заваръчната вана остане капка, а при заваряване с неконсумативен електрод, среща се само в басейна. Както е известно, взаимодействието на газ с метал в дъгова междина се осъществява много по-интензивно поради високата температура и по-голямата контактна повърхност на метала с газа.
Поради химическата активност на въглеродния диоксид по отношение на волфрама, заваряването в този газ се извършва само с консумативен електрод.
Въглеродният диоксид е нетоксичен и неексплозивен. При концентрации над 5% (92 g/m3) въглеродният диоксид има вредно въздействие върху човешкото здраве, тъй като е по-тежък от въздуха и може да се натрупа в лошо вентилирани помещения близо до пода. Това намалява обемната част на кислорода във въздуха, което може да причини недостиг на кислород и задушаване. Помещенията, където се извършва заваряване с въглероден диоксид, трябва да бъдат оборудвани с обща захранваща и смукателна вентилация. Максимално допустимата концентрация на въглероден диоксид във въздуха на работната зона е 9,2 g/m 3 (0,5%).
Въглеродният диоксид се доставя от. За получаване на висококачествени шевове се използва газообразен и втечнен въглероден диоксид от най-висок и първи клас.
Въглеродният диоксид се транспортира и съхранява в стоманени цилиндри или резервоари с голям капацитет в течно състояние, последвано от газификация в завода, с централизирано захранване към заваръчните станции чрез рампи. Стандартен с воден капацитет 40 литра се пълни с 25 kg течен въглероден диоксид, който при нормално налягане заема 67,5% от обема на цилиндъра и произвежда 12,5 m 3 въглероден диоксид при изпаряване. Въздухът се натрупва в горната част на цилиндъра заедно с въглеродния диоксид. Водата, която е по-тежка от течния въглероден диоксид, се събира на дъното на цилиндъра.
За да се намали влажността на въглеродния диоксид, се препоръчва цилиндърът да се монтира с клапана надолу и след утаяване за 10...15 минути внимателно отворете клапана и изпуснете влагата от цилиндъра. Преди заваряване е необходимо да се освободи малко количество газ от нормално монтиран цилиндър, за да се отстрани въздухът, уловен в цилиндъра. Част от влагата се задържа във въглероден диоксид под формата на водна пара, което влошава заваряването на шева.
Когато газът се отделя от цилиндъра, поради дроселиращия ефект и поглъщането на топлина по време на изпаряването на течния въглероден диоксид, газът се охлажда значително. При интензивно извличане на газ редукторът може да се запуши със замръзнала влага, съдържаща се във въглероден диоксид, както и сух лед. За да се избегне това, при извличане на въглероден диоксид пред редуктора се монтира газов нагревател. Окончателното отстраняване на влагата след скоростната кутия се извършва със специален десикант, напълнен със стъклена вата и калциев хлорид, силикагел, меден сулфат или други абсорбери на влага
Цилиндърът с въглероден диоксид е боядисан в черно, с надпис „ВЪГЛЕДНА КИСЕЛИНА“ с жълти букви..