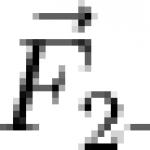Теми на кодификатора на Единния държавен изпит: Ковалентна химическа връзка, нейните разновидности и механизми на образуване. Характеристики на ковалентните връзки (полярност и енергия на връзката). Йонна връзка. Метална връзка. Водородна връзка
Вътремолекулни химични връзки
Първо, нека да разгледаме връзките, които възникват между частиците в молекулите. Такива връзки се наричат вътрешномолекулен.
Химическа връзка между атомите химически елементиима електростатичен характер и се образува поради взаимодействие на външни (валентни) електрони, в по-голяма или по-малка степен задържани от положително заредени ядрасвързани атоми.
Ключовата концепция тук е ЕЛЕКТРООТРИЦАТЕЛНОСТ. Именно тя определя вида химическа връзкамежду атомите и свойствата на тази връзка.
е способността на атома да привлича (задържа) външен(валентност) електрони. Електроотрицателността се определя от степента на привличане на външните електрони към ядрото и зависи главно от радиуса на атома и заряда на ядрото.
Електроотрицателността е трудно да се определи недвусмислено. Л. Полинг състави таблица на относителната електроотрицателност (на базата на енергиите на връзката двуатомни молекули). Най-електроотрицателният елемент е флуорсъс смисъл 4 .
Важно е да се отбележи, че в различни източници можете да намерите различни скали и таблици на стойностите на електроотрицателността. Това не трябва да се тревожи, тъй като образуването на химична връзка играе роля атоми и е приблизително еднакъв във всяка система.
Ако един от атомите в химическата връзка A:B привлича по-силно електрони, тогава електронната двойка се придвижва към него. Колкото повече разлика в електроотрицателносттаатоми, толкова повече се измества електронната двойка.
Ако стойностите на електроотрицателността на взаимодействащите атоми са равни или приблизително равни: EO(A)≈EO(B), тогава общата електронна двойка не се измества към нито един от атомите: А: Б. Тази връзка се нарича ковалентен неполярен.
Ако електроотрицателностите на взаимодействащите атоми се различават, но не много (разликата в електроотрицателността е приблизително от 0,4 до 2: 0,4<ΔЭО<2 ), тогава електронната двойка се измества към един от атомите. Тази връзка се нарича ковалентен полярен .
Ако електроотрицателностите на взаимодействащите атоми се различават значително (разликата в електроотрицателността е по-голяма от 2: ΔEO>2), тогава един от електроните почти изцяло се прехвърля към друг атом с образуването йони. Тази връзка се нарича йонни.
Основни видове химични връзки − ковалентен, йонниИ металкомуникации. Нека ги разгледаме по-отблизо.
Ковалентна химична връзка
Ковалентна връзка – това е химическа връзка , образувано поради образуване на обща електронна двойка A:B . Освен това два атома припокриванеатомни орбитали. Ковалентната връзка се образува от взаимодействието на атоми с малка разлика в електроотрицателността (обикновено между два неметала) или атоми на един елемент.
Основни свойства на ковалентните връзки
- фокус,
- наситеност,
- полярност,
- поляризуемост.
Тези свързващи свойства влияят върху химичните и физичните свойства на веществата.
Комуникационна посока характеризира химичния строеж и формата на веществата. Ъглите между две връзки се наричат ъгли на връзката. Например в молекулата на водата ъгълът на връзката H-O-H е 104,45 o, следователно молекулата на водата е полярна, а в молекулата на метана ъгълът на връзката H-C-H е 108 o 28′.
Насищаемост е способността на атомите да образуват ограничен брой ковалентни химични връзки. Броят на връзките, които един атом може да образува, се нарича.
Полярностсвързването възниква поради неравномерното разпределение на електронната плътност между два атома с различна електроотрицателност. Ковалентните връзки се делят на полярни и неполярни.
Поляризираемост връзките са способността на електроните на връзката да се изместват под въздействието на външно електрическо поле(по-специално електрическото поле на друга частица). Поляризуемостта зависи от подвижността на електроните. Колкото по-далеч е електронът от ядрото, толкова по-подвижен е той и съответно молекулата е по-поляризирана.
Ковалентна неполярна химична връзка
Има 2 вида ковалентно свързване – ПОЛЯРЕНИ НЕПОЛЯРЕН .
Пример . Нека разгледаме структурата на водородната молекула H2. Всеки водороден атом на своето външно енергийно ниво носи 1 несдвоен електрон. За да покажем атом, използваме структурата на Луис - това е диаграма на структурата на външното енергийно ниво на атом, когато електроните са обозначени с точки. Моделите на точковата структура на Луис са много полезни при работа с елементи от втория период.
з. + . H = H:H
По този начин молекулата на водорода има една споделена електронна двойка и една H–H химична връзка. Тази електронна двойка не се измества към нито един от водородните атоми, т.к Водородните атоми имат същата електроотрицателност. Тази връзка се нарича ковалентен неполярен .
Ковалентна неполярна (симетрична) връзка е ковалентна връзка, образувана от атоми с еднаква електроотрицателност (обикновено едни и същи неметали) и следователно с равномерно разпределение на електронната плътност между ядрата на атомите.
Диполният момент на неполярните връзки е 0.
Примери: H 2 (H-H), O 2 (O=O), S 8.
Ковалентна полярна химична връзка
Ковалентна полярна връзка е ковалентна връзка, която възниква между атоми с различна електроотрицателност (обикновено различни неметали) и се характеризира денивелациясподелена електронна двойка към по-електроотрицателен атом (поляризация).
Електронната плътност се измества към по-електроотрицателния атом - следователно върху него се появява частичен отрицателен заряд (δ-), а върху по-малко електроотрицателния атом се появява частичен положителен заряд (δ+, делта +).
Колкото по-голяма е разликата в електроотрицателността на атомите, толкова по-висока е полярноствръзки и др диполен момент . Между съседни молекули и заряди с противоположен знак действат допълнителни сили на привличане, които нарастват силакомуникации.
Полярността на връзката влияе върху физичните и химичните свойства на съединенията. Реакционните механизми и дори реактивността на съседните връзки зависят от полярността на връзката. Полярността на връзката често определя полярност на молекулатаи по този начин пряко засяга такива физични свойства като точка на кипене и точка на топене, разтворимост в полярни разтворители.
Примери: HCl, CO2, NH3.
Механизми на образуване на ковалентна връзка
Ковалентните химични връзки могат да възникнат по 2 механизма:
1. Обменен механизъм образуването на ковалентна химична връзка е, когато всяка частица осигурява един несдвоен електрон за образуване на обща електронна двойка:
А . + . B= A:B
2. Образуването на ковалентна връзка е механизъм, при който една от частиците осигурява несподелена двойка електрони, а другата частица осигурява свободна орбитала за тази електронна двойка:
A: + B= A:B
В този случай един от атомите осигурява несподелена двойка електрони ( донор), а другият атом осигурява свободна орбитала за тази двойка ( акцептор). В резултат на образуването на двете връзки енергията на електроните намалява, т.е. това е полезно за атомите.
Ковалентна връзка, образувана от донорно-акцепторен механизъм не е по-различнов свойства от други ковалентни връзки, образувани от обменния механизъм. Образуването на ковалентна връзка по донорно-акцепторния механизъм е типично за атоми или с голям брой електрони на външно енергийно ниво (донори на електрони), или, обратно, с много малък брой електрони (акцептори на електрони). Валентните способности на атомите са разгледани по-подробно в съответния раздел.
Ковалентната връзка се образува чрез донорно-акцепторен механизъм:
- в молекула въглероден окис CO(връзката в молекулата е тройна, 2 връзки се образуват по обменния механизъм, една по донорно-акцепторния): C≡O;
- В амониев йон NH 4 +, в йони органични амининапример в метиламониевия йон CH3-NH2+;
- В комплексни съединенияхимическа връзка между централния атом и лигандни групи, например в натриев тетрахидроксоалуминат Na връзка между алуминий и хидроксидни йони;
- В азотна киселина и нейните соли- нитрати: HNO 3, NaNO 3, в някои други азотни съединения;
- в молекула озон O3.
Основни характеристики на ковалентните връзки
Ковалентните връзки обикновено се образуват между неметални атоми. Основните характеристики на ковалентната връзка са дължина, енергия, множественост и насоченост.
Множество химична връзка
Множество химична връзка - Това брой споделени електронни двойки между два атома в съединение. Множеството на връзката може да се определи доста лесно от стойностите на атомите, които образуват молекулата.
например , в молекулата на водорода H 2 множествеността на връзката е 1, т.к Всеки водород има само 1 несдвоен електрон на своето външно енергийно ниво, следователно се образува една споделена електронна двойка.
В молекулата на кислорода O 2 множествеността на връзката е 2, тъй като Всеки атом на външно енергийно ниво има 2 несдвоени електрона: O=O.
В молекулата на азота N2 множествеността на връзката е 3, т.к Между всеки атом има 3 несдвоени електрона на външно енергийно ниво и атомите образуват 3 общи електронни двойки N≡N.
Дължина на ковалентната връзка
Дължина на химичната връзка
е разстоянието между центровете на ядрата на атомите, образуващи връзката. Определя се чрез експериментални физични методи. Дължината на връзката може да се оцени приблизително с помощта на правилото за адитивност, според което дължината на връзката в молекулата AB е приблизително равна на половината от сумата от дължините на връзката в молекулите A 2 и B 2: 
Дължината на химическата връзка може да бъде грубо оценена по атомни радиусиобразуване на връзка, или чрез комуникационна множественост, ако радиусите на атомите не са много различни.
Тъй като радиусите на атомите, образуващи връзка, се увеличават, дължината на връзката ще се увеличава.
например
Тъй като множеството връзки между атомите се увеличава (чиито атомни радиуси не се различават или се различават леко), дължината на връзката ще намалее.
например . В сериите: C–C, C=C, C≡C дължината на връзката намалява.
Комуникационна енергия
Мярка за силата на химическата връзка е енергията на връзката. Комуникационна енергия определя се от енергията, необходима за разкъсване на връзка и отстраняване на атомите, образуващи тази връзка, на безкрайно голямо разстояние един от друг.
Ковалентната връзка е много издръжлив.Енергията му варира от няколко десетки до няколкостотин kJ/mol. Колкото по-висока е енергията на връзката, толкова по-голяма е силата на връзката и обратно.
Силата на химическата връзка зависи от дължината на връзката, полярността на връзката и множествеността на връзката. Колкото по-дълга е химичната връзка, толкова по-лесно се разрушава и колкото по-ниска е енергията на връзката, толкова по-малка е нейната сила. Колкото по-къса е химичната връзка, толкова по-силна е тя и толкова по-голяма е енергията на връзката.
например, в поредицата от съединения HF, HCl, HBr отляво надясно, силата на химичната връзка намалява, защото Дължината на връзката се увеличава.
Йонна химична връзка
Йонна връзка е химическа връзка, основана на електростатично привличане на йони.
йонисе образуват в процеса на приемане или отдаване на електрони от атомите. Например, атомите на всички метали слабо задържат електрони от външното енергийно ниво. Следователно металните атоми се характеризират с възстановителни свойства- способност да дарява електрони.
Пример. Натриевият атом съдържа 1 електрон на енергийно ниво 3. Като лесно го предава, натриевият атом образува много по-стабилния Na + йон с електронната конфигурация на благородния газ неон Ne. Натриевият йон съдържа 11 протона и само 10 електрона, така че общият заряд на йона е -10+11 = +1:
+11Na) 2 ) 8 ) 1 - 1e = +11 Na +) 2 ) 8
Пример. Атомът на хлора във външното си енергийно ниво съдържа 7 електрона. За да придобие конфигурацията на стабилен инертен аргонов атом Ar, хлорът трябва да спечели 1 електрон. След добавяне на електрон се образува стабилен хлорен йон, състоящ се от електрони. Общият заряд на йона е -1:
+17кл) 2 ) 8 ) 7 + 1e = +17 кл — ) 2 ) 8 ) 8
Моля, обърнете внимание:
- Свойствата на йоните са различни от свойствата на атомите!
- Стабилни йони могат да образуват не само атоми, но също така групи от атоми. Например: амониев йон NH 4 +, сулфатен йон SO 4 2- и др. Химичните връзки, образувани от такива йони, също се считат за йонни;
- Йонните връзки обикновено се образуват помежду си металиИ неметали(групи неметали);
Получените йони се привличат поради електрическо привличане: Na + Cl -, Na 2 + SO 4 2-.
Нека визуално обобщим разлика между ковалентни и йонни видове връзки:
Метална химична връзка
Метална връзка е връзка, която се формира относително свободни електронимежду метални йони, образувайки кристална решетка.
Металните атоми обикновено са разположени на външно енергийно ниво един до три електрона. Радиусите на металните атоми като правило са големи - следователно металните атоми, за разлика от неметалите, доста лесно се отказват от външните си електрони, т.е. са силни редуциращи агенти
Междумолекулни взаимодействия
Отделно си струва да се разгледат взаимодействията, които възникват между отделните молекули в дадено вещество - междумолекулни взаимодействия . Междумолекулните взаимодействия са вид взаимодействие между неутрални атоми, при което не се появяват нови ковалентни връзки. Силите на взаимодействие между молекулите са открити от Ван дер Ваалс през 1869 г. и са кръстени на него Силите на Ван Дар Ваалс. Силите на Ван дер Ваалс се делят на ориентация, индукция И дисперсионно . Енергията на междумолекулните взаимодействия е много по-малка от енергията на химичните връзки.
Ориентационни сили на привличане възникват между полярни молекули (дипол-диполно взаимодействие). Тези сили възникват между полярните молекули. Индуктивни взаимодействия е взаимодействието между полярна молекула и неполярна. Неполярната молекула е поляризирана поради действието на полярна, което генерира допълнително електростатично привличане.
Специален вид междумолекулно взаимодействие са водородните връзки. - това са междумолекулни (или вътрешномолекулни) химични връзки, които възникват между молекули, които имат силно полярни ковалентни връзки - H-F, H-O или H-N. Ако има такива връзки в една молекула, тогава между молекулите ще има такива допълнителни притегателни сили .
Образователен механизъм водородната връзка е отчасти електростатична и отчасти донорно-акцепторна. В този случай донорът на електронната двойка е атом на силно електроотрицателен елемент (F, O, N), а акцепторът е водородните атоми, свързани с тези атоми. Водородните връзки се характеризират с фокус в космоса и насищане
Водородните връзки могат да бъдат обозначени с точки: H ··· O. Колкото по-голяма е електроотрицателността на атома, свързан с водорода, и колкото по-малък е неговият размер, толкова по-силна е водородната връзка. Характерно е преди всичко за връзките флуор с водород , както и към кислород и водород , в по-малка степен азот с водород .
Водородните връзки възникват между следните вещества:
— флуороводород HF(газ, разтвор на флуороводород във вода - флуороводородна киселина), вода H2O (пара, лед, течна вода):
— разтвор на амоняк и органични амини- между амоняк и водни молекули;
— органични съединения, в които O-H или N-H връзки: алкохоли, карбоксилни киселини, амини, аминокиселини, феноли, анилин и неговите производни, протеини, разтвори на въглехидрати - монозахариди и дизахариди.
Водородната връзка влияе върху физичните и химичните свойства на веществата. По този начин допълнителното привличане между молекулите затруднява кипенето на веществата. Веществата с водородни връзки показват необичайно повишаване на точката на кипене.
например Като правило, с увеличаване на молекулното тегло се наблюдава повишаване на точката на кипене на веществата. Въпреки това, в редица вещества H 2 O-H 2 S-H 2 Se-H 2 Teне наблюдаваме линейна промяна в температурите на кипене.
А именно при точката на кипене на водата е необичайно висока - не по-малко от -61 o C, както ни показва правата линия, но много повече, +100 o C. Тази аномалия се обяснява с наличието на водородни връзки между водните молекули. Следователно при нормални условия (0-20 o C) водата е течностпо фазово състояние.
Метод на валентната връзка (локализирани електронни двойки)предполага, че всяка двойка атоми в една молекула се държи заедно от една или повече споделени двойки електрони. Следователно химичната връзка изглежда двуелектронна и двуцентрова, т.е. локализиран между два атома. В структурните формули на съединенията се обозначава с тире:
H-Cl, H-H, H-O-H
Да разгледаме на светло VS метод, такива комуникационни характеристики като насищане, насоченост и поляризуемост.
Валентностатом - определя се от броя на несдвоените (валентни) електрони, които могат да участват в образуването на химична връзка. Валентността се изразява в малки цели числа и е равна на броя на ковалентните връзки. Често се нарича валентността на елементите, проявяваща се в ковалентни съединения ковалентност. Някои атоми имат променлива валентност, например въглеродът в основно състояние има 2 несдвоени електрона и ще има две валенции. Когато един атом е възбуден, е възможно да се изпарят другите два сдвоени електрона и тогава въглеродният атом ще стане четиривалентен:
Възбуждането на атома до ново валентно състояние изисква разход на енергия, който се компенсира от енергията, освободена при образуването на връзки.
Посока на ковалентната връзка
Припокриването на облаците може да се случи по различни начини поради различните им форми. Разграничете σ-, π- и δ- връзки.
Сигма - комуникациисе образуват, когато облаците се припокриват по линия, минаваща през ядрата на атомите. Pi връзките възникват, когато облаците се припокриват от двете страни на линията, свързваща ядрата на атомите. Делта - връзките се осъществяват, когато всичките четири остриета на d - електронни облаци, разположени в успоредни равнини, се припокриват.

σ– връзкаможе да възникне при припокриване по линия, свързваща ядрата на атомите в следните орбитали: s— s -, s— r-, r– п-, d— d-орбитали, както и d— s-, d— r– орбитали. σ– връзкаима свойствата на локализирана двуцентрова връзка, което е.
π– връзкаможе да се образува чрез припокриване от двете страни на линията, свързваща атомните ядра на следните орбитали: r—r-, r—d-, d—d-, f—стр-, f—d- И f—f— орбитали.
така че s- елементите могат да се образуват само σ– връзки, r- елементи - σ– и π– връзки, d- елементи - σ–, π– и δ‑ връзки, А f- елементи - σ–, π–, δ връзки. Когато π- и σ-връзките се образуват заедно, се получава двойна връзка. Ако две възникнат едновременно π– и σ-връзка, тогава се образува тройна връзка. Броят на връзките, образувани между атомите, се нарича множественост на връзките.
При формиране на връзка с помощта на s— орбитали, поради сферичната им форма, няма предпочитана посока в пространството за най-благоприятно образуване на ковалентни връзки. В случай r– орбитали, електронната плътност е разпределена неравномерно, така че има определена посока, в която е най-вероятно да се образува ковалентна връзка.
Хибридизация на атомни орбитали
Нека разгледаме един пример. Нека си представим, че четири водородни атома се комбинират с въглероден атом, за да образуват молекула метан, CH4.

Картината показва какво се случва, но не обяснява как се държат s— И r— орбитали по време на образуването на такива съединения. въпреки че r- една орбитала има две части, завъртяни една спрямо друга, но може да образува само една връзка. В резултат на това можем да приемем, че в молекулата на метана един водороден атом се добавя към 2 s— въглеродни орбитали, останалите - до 2 r— орбитали. Тогава всеки водороден атом ще бъде под ъгъл от 90° спрямо другия, но това не е така. Електроните се отблъскват един от друг и се раздалечават на по-голямо разстояние. Какво наистина се случва?
В резултат на това всички орбитали се комбинират, пренареждат и образуват 4 еквивалента хибридорбитали, които са насочени към върховете на тетраедъра. Всяка от хибридните орбитали съдържа определен принос 2 s— орбитали и някои приноси 2 r— орбитали. Тъй като 4 хибридни орбитали се образуват от една 2 s— и три 2 r- орбитали, тогава този метод на хибридизация се нарича sp 3 -хибридизация.
 sp 3 -хибридизация на орбиталите в молекулата на метана
sp 3 -хибридизация на орбиталите в молекулата на метана Както може да се види от фигурата, конфигурацията на хибридните орбитали позволява на четири водородни атома да образуват ковалентни връзки с въглероден атом, а орбиталите ще бъдат разположени под ъгъл от 109,5 ° една спрямо друга.
Същият тип хибридизация присъства в молекули като NH 3, H 2 O. На една от sp 3 -хибридорбитали, в молекулата на NH 3 има несподелена електронна двойка, а останалите три орбитали се използват за свързване с водородни атоми. В молекулата на H 2 O две хибридни орбитали на кислородния атом са заети от несподелени електронни двойки, а другите две се използват за свързване с водородни атоми.

Броят на хибридните орбитали се определя от броя на единичните връзки, както и от броя на несподелените електронни двойки в молекулата. Тези електрони са в хибридни орбитали. Когато нехибридните орбитали на два атома се припокриват, се образува множествена връзка. Например в молекула на етилен връзката се осъществява по следния начин:
 sp 2 -хибридизация на етиленови атоми
sp 2 -хибридизация на етиленови атоми Плоското разположение на три връзки около всеки въглероден атом предполага, че в този случай sp 2 -хибридизация (хибридните орбитали се формират от едно 2 s— и две 2 r- орбитали ). В същото време едно 2 r— орбиталата остава неизползвана (нехибридна). Орбиталите ще бъдат разположени под ъгъл от 120° една спрямо друга.
По същия начин се образува тройна връзка в молекулата на ацетилена. В този случай се случва sp-хибридизацияатоми, т.е. хибридните орбитали се формират от едно 2 s— и едно 2 r- орбитали и две 2 r— орбиталите са нехибридни. Орбиталите са разположени под ъгъл 180° една спрямо друга

По-долу са дадени примери за геометричната подредба на хибридни орбитали.
| Набор от атомни орбитали | Набор от хибридни орбитали | Геометрично разположение на хибридни орбитали | Примери |
| s,p | sp | Линеен (ъгъл 180°) | Be(CH 3) 2, HgCl 2 MgBr 2, CaH 2, BaF 2, C 2 H 2 |
| s,p,p | sp 2 | Плосък триъгълник (ъгъл 120°) | BF 3, GaCl 3, InBr 3, TeI 3, C 2 H 4 |
| s,p,p,p | sp 3 | Тетраедър (ъгъл 109,5°) | CH 4, AsCl 4 -, TiCl 4, SiCl 4, GeF 4 |
| s,p,p,d | sp 2 d | Плосък квадрат (ъгъл 90°) | Ni(CO) 4 , 2 — |
| s,p,p,p,d | sp 3 d | Тригонално-бипирамидален (ъгли 120° и 90°) | PF 5, PCl 5, AsF 5 |
| s,p,p,p,d,d | sp 3 d 2 | Октаедър (ъгъл 90°) | SF 6, Fe(CN) 6 3-, CoF 6 3- |
 Категории,
Категории, Електронна конфигурация на основното състояние на въглеродния атом l s 2 2s 2 2стр 2:
Може да се очаква, че такъв въглероден атом ще образува СН2 съединение с два водородни атома. Но в метана въглеродът е свързан с четири водородни атома. За да си представим образуването на молекула CH 4, е необходимо да се обърнем към нейното възбудено електронно състояние.

Сега бихме очаквали въглеродният атом да образува четири връзки с водородни атоми, но тези връзки не са равни: три връзки се образуват с помощта на r-орбитали, една - използване s-орбитали. Това противоречи на добре известния факт: всички връзки в метана са еквивалентни.
След това се извършва хибридизация на орбиталите. Различни комбинации от едно s- и три r-орбитали. Хибридните орбитали с най-голяма степен на насоченост („най-добри“ орбитали) водят до по-голямо припокриване, водещо до връзки (1) по-силен отколкото нехибридизирани s- или r-орбитали. Четири „най-добри“ хибридни орбитали (2) еквивалент . Те са насочени към върховете на правилен тетраедър, ъгълът между двете орбитали е 109,5 градуса. Тази геометрия осигурява (3) минимално отблъскване между тях .

Нека допълним картината на строежа на една молекула метан: всеки от четирите sp 3 -орбиталите на въглеродния атом се припокриват с 1 s-орбитала на водородния атом. Образуват се четири - връзки.
За максимално покритие sp 3 -въглеродни орбитали и 1 п-на водородните орбитали, четири водородни атома трябва да лежат на осите sp 3 -орбитали. Следователно ъгълът между всеки две C–H връзки е 109,5 o.
Експерименталните данни потвърждават изчислението: метанът има тетраедрична структура. Всички въглерод-водородни връзки имат еднаква дължина 10,9·10 -2 nm, ъгълът между всеки две връзки е тетраедричен и равен на 109,5 o. За да се разруши една от връзките в метана, са необходими 427·10 3 J/mol.
1.3. Етанова структура
Ще конструираме следващия хомолог на редица алкани - етан H 3 C–CH 3 по подобен начин. Както е в случая с метана , C–H връзките възникват поради припокриване sp 3 -орбитали на въглеродния атом с 1s-орбитали на водородни атоми, въглерод-въглеродна връзка се образува в резултат на припокриването на две sp 3 -орбитали на въглеродни атоми.

Молекулата на етана съдържа шест въглерод-водород -връзки и една въглерод-въглерод -връзка. -Връзките имат цилиндрична симетрия . Оста на симетрия на електронния облак на -връзката е линията, свързваща атомите. Електронният облак на връзката въглерод-въглерод , който има цилиндрична симетрия, може да бъде изобразен по следния начин:

1.4. Въртене около проста връзка въглерод-въглерод. Конформации
В молекулата на етана въртенето на една метилова група спрямо друга става почти свободно.
|
Различни подредби на групи и атоми в пространството, произтичащи от въртенето на един атом спрямо друг по линията на свързване, свързваща тези атоми, се наричатконформации . |
|||
|
|
| ||
|
|
| ||
|
Затъмнена конформация на етан (I) |
Инхибирана конформация на етан (II) | ||
Но въртенето на една метилова група спрямо друга не е напълно свободно. Потенциалната енергия на молекулата е минимална за инхибираната конформация II, тя нараства и достига максимум за затъмнената конформация I. Излишната енергия на затъмнената конформация в сравнение с инхибираната се нарича енергия; напрежение на усукване . За една молекула етан тази енергия е равна на 13·10 3 J/mol (фиг. 1.1).
Смята се, че излишната енергия се появява поради отблъскването на електронните облаци от въглерод-водородни връзки в момента, когато преминават един през друг. Тъй като при стайна температура енергията на някои молекулярни сблъсъци може да достигне 86·10 3 J/mol, бариерата от 13·10 3 J/mol се преодолява лесно. Въртенето в етан се счита за свободно.

ориз. 1.1. енергияпрофилгрупова ротацияCH 3 в молекула етан около въглерод-въглерод връзка
Нар. конформации, съответстващи на енергийните минимуми конформационни изомери или конформери . В по-сложните молекули броят на конформерите може да бъде доста голям.
ОПРЕДЕЛЕНИЕ
Метан- най-простият представител на класа наситени въглеводороди (структурата на молекулата е показана на фиг. 1). Това е безцветен, лек, запалим газ, без мирис и почти неразтворим във вода.
Точката на кипене е -161,5 o C, температурата на втвърдяване е -182,5 o C. Смес от метан с въздух е изключително експлозивна (особено в съотношение 1:10).
ориз. 1. Структурата на молекулата на метана.
Производство на метан
Метанът е доста често срещан в природата. Той е основният компонент на природния газ от газови находища (до 97%) и се намира в значителни количества в съпътстващия петролен газ (емитиран по време на производството на нефт), както и в коксовия газ. Отделя се от дъното на блата, езера и застояли води, където се образува при разлагане на растителни остатъци без достъп на въздух, поради което метанът се нарича още блатен газ. И накрая, метанът постоянно се натрупва във въглищните мини, където се нарича дим.
Синтетичните методи за производство на метан показват връзката между неорганичните вещества и органичните. Можем да разграничим промишлени (1, 2, 3) и лабораторни (4, 5) методи за неговото производство:
C + 2H 2 → CH 4 (kat = Ni, t 0) (1);
CO + 3H 2 → CH 4 + H 2 O (kat = Ni, t = 200 - 300 o C) (2);
CO 2 + 4H 2 → CH 4 + 2H 2 O (kat, t 0) (3);
Al 4 C 3 + 12H 2 O → CH 4 + 4Al(OH) 3 (4);
CH 3 COONa + NaOH → CH 4 + Na 2 CO 3 (5).
Химични свойства на метана
Метанът е ниско реактивно органично съединение. Така при нормални условия той не реагира с концентрирани киселини, разтопени и концентрирани алкали, алкални метали, халогени (с изключение на флуор), калиев перманганат и калиев дихромат в кисела среда.
Всички химични трансформации, характерни за метана, се случват с разцепването на C-H връзките:
- халогениране (SR)
CH 4 + Cl 2 → CH 3 Cl + HCl ( hν);
- нитриране (SR)
CH 4 + HONO 2 (разреден) → CH 3 -NO 2 + H 2 O (t 0);
- сулфохлориране (SR)
CH 4 + SO 2 + Cl 2 → CH 3 -SO 2 Cl + HCl ( hν);
Има каталитично (като катализатори се използват медни и манганови соли) (1, 2, 3) и пълно (изгаряне) (4) окисление на метан:
2CH 4 + O 2 → 2CH 3 OH (p, t 0) (1);
CH 4 + O 2 → HC(O)H + H 2 O (NO, t 0) (2);
2CH 4 + 3O 2 → 2HCOOH + 2H 2 O (kat = Pt, t 0) (3);
CH 4 + 2O 2 →CO 2 + 2H 2 O + Q (4).
Превръщането на метан с водна пара и въглероден диоксид също може да се класифицира като метод за неговото окисляване:
CH 4 + H 2 O → CO + 3H 2 (kat = Ni, t = 800 o C);
CH 4 + CO 2 → 2CO + 2H 2.
Метановият крекинг е най-важният метод за химическа обработка на нефт и неговите фракции с цел получаване на продукти с по-ниско молекулно тегло - смазочни масла, моторни горива и др., както и суровини за химическата и нефтохимическата промишленост:
2CH 4 → HC≡CH + 3H 2 (t = 1500 o C).
Приложение на метан
Метанът формира суровинната основа за най-важните химически промишлени процеси за производство на въглерод и водород, ацетилен, кислородсъдържащи органични съединения - алкохоли, алдехиди, киселини.
Примери за решаване на проблеми
ПРИМЕР 1
ПРИМЕР 2
| Упражнение | Изчислете обемите хлор и метан, приведени до нормални условия, които ще са необходими за получаване на въглероден тетрахлорид с тегло 38,5 g. |
| Решение | Нека напишем уравнението за реакцията на хлориране на метан до въглероден тетрахлорид (реакцията протича под въздействието на UV радиация): CH4 + 4Cl2 = CCl4 + 4HCl. Нека изчислим количеството вещество въглероден тетрахлорид (моларната маса е - 154 g/mol): n(CC14) = m(CC14)/M (CC14); n(CCl 4) = 38.5 / 154 = 0.25 mol. Съгласно уравнението на реакцията n(CCl 4) : n(CH 4) = 1:1, т.е. n(CCl4) = n(CH4) = 0.25 mol. Тогава обемът на метана ще бъде равен на: V(CH4) = n(CH4) × Vm; V(CH 4) = 0,25 × 22,4 = 5,6 l. Използвайки уравнението на реакцията, намираме количеството хлор. n(CCl 4) : n(Cl 2) = 1:4, т.е. n(Cl 2) = 4 × n(CCl 4) = 4 × 0,25 = 1 мол. Тогава обемът на хлора ще бъде равен на: V(Cl 2) = n(Cl 2) × V m; V(Cl 2) = 1 × 22,4 = 22,4 l. |
| отговор | Обемите на хлора и метана са съответно 22,4 и 5,6 литра. |
Принадлежността на веществата към групата на наситените въглеводороди се определя от характера на тяхната структура. Нека разгледаме структурата на най-простия въглеводород - метан.
Метанът CH 4 е газ без цвят и мирис, почти два пъти по-лек от въздуха. Образува се в природата в резултат на разлагане без достъп на въздух на останки от растителни и животински организми. Следователно може да се намери например в блатисти резервоари и въглищни мини. Метанът се съдържа в значителни количества в природния газ, който сега се използва широко като гориво в бита и промишлеността.
В молекулата на метана химичните връзки на водородните атоми с въглеродните атоми са ковалентни по природа. Ако припокриващите се двойки електронни облаци по време на образуването на връзки са обозначени с две точки или валентна линия, структурата на метана може да бъде изразена с формулите:
или
Когато изследването на пространствената структура на молекулите започна да се развива в органичната химия, беше установено, че молекулата на метана всъщност има тетраедрична форма, а не плоска, както изобразяваме на хартия.
Нека да разберем защо молекулата на метана е тетраедър. Очевидно трябва да започнем от структурата на въглеродния атом. Но тук се сблъскваме с противоречие. Въглеродните атоми имат четири валентни електрона, два от които са сдвоени s електрони и не могат да образуват химични връзки с водородни атоми. Химичните връзки могат да се установят само чрез два несдвоени р-електрона. Но тогава молекулата на метана трябва да има формулата не СН4, а СН2, което не е вярно. Това противоречие се елиминира чрез следното тълкуване на образуването на химични връзки.
Когато въглероден атом взаимодейства с водородни атоми, s-електроните на външния слой в него се изпаряват, един от тях заема празното място на третия p-електрон и по време на движението си образува облак под формата на обемна осмица , перпендикулярно на облаците на другите два p-електрона . В този случай атомът преминава, както се казва, във възбудено състояние. Сега и четирите валентни електрона са станали несдвоени, те могат да образуват четири химични връзки. Но възниква ново противоречие.
 Три p-електрона трябва да образуват три химични връзки с водородни атоми във взаимно перпендикулярни посоки, т.е. под ъгъл от 90°, а четвъртият водороден атом може да се съедини в произволна посока, тъй като s-електронният облак има сферична форма и тези облигации, Очевидно те ще се различават по свойства. Междувременно е известно, че всички C-H връзки в молекулата на метана са идентични и разположени под ъгъл от 109 ° 28". Идеята за хибридизация на електронни облаци помага да се разреши това противоречие.
Три p-електрона трябва да образуват три химични връзки с водородни атоми във взаимно перпендикулярни посоки, т.е. под ъгъл от 90°, а четвъртият водороден атом може да се съедини в произволна посока, тъй като s-електронният облак има сферична форма и тези облигации, Очевидно те ще се различават по свойства. Междувременно е известно, че всички C-H връзки в молекулата на метана са идентични и разположени под ъгъл от 109 ° 28". Идеята за хибридизация на електронни облаци помага да се разреши това противоречие.
По време на образуването на химични връзки облаците от всички валентни електрони на въглероден атом (един s-електрон и три p-електрона) се подреждат и стават идентични. В същото време те приемат формата на асиметрични, обемни осмици, удължени към върховете на тетраедъра (асиметричното разпределение на електронната плътност означава, че вероятността да се намери електрон от едната страна на ядрото е по-голяма, отколкото от другата).