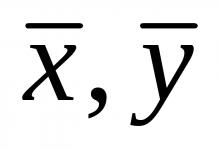Класификация на неорганични вещества с примери за съединения
Сега нека анализираме по-подробно схемата за класификация, представена по-горе.
Както виждаме, на първо място, всички неорганични вещества са разделени на простоИ комплекс:
Прости вещества Това са вещества, които са образувани от атоми само на един химичен елемент. Например прости вещества са водород H2, кислород O2, желязо Fe, въглерод C и др.
Сред простите вещества има метали, неметалиИ благородни газове:
Металиобразувани от химически елементи, разположени под диагонала бор-астат, както и всички елементи, разположени в странични групи.
Благородни газовеобразувани от химични елементи от група VIIIA.
Неметалиобразувани съответно от химични елементи, разположени над диагонала бор-астат, с изключение на всички елементи от вторичните подгрупи и благородни газоверазположени в група VIIIA:
Имената на простите вещества най-често съвпадат с имената на химичните елементи, от чиито атоми са образувани. Но за много химични елементи явлението алотропия е широко разпространено. Алотропията е явлението, когато един химичен елемент е способен да образува няколко прости вещества. Например в случая на химичния елемент кислород е възможно съществуването на молекулни съединения с формули O 2 и O 3 . Първото вещество обикновено се нарича кислород по същия начин като химическия елемент, чиито атоми се образува, а второто вещество (O 3) обикновено се нарича озон. Простото вещество въглерод може да означава всяка негова алотропна модификация, например диамант, графит или фулерени. Простото вещество фосфор може да се разбира като неговите алотропни модификации, като бял фосфор, червен фосфор, черен фосфор.
Сложни вещества
Сложни вещества са вещества, образувани от атоми на два или повече химични елемента.
Например сложни вещества са амоняк NH 3, сярна киселина H 2 SO 4, гасена вар Ca(OH) 2 и безброй други.
Сред трудните неорганични веществаИма 5 основни класа, а именно оксиди, основи, амфотерни хидроксиди, киселини и соли:
Оксиди - сложни вещества, образувани от два химични елемента, единият от които е кислород в степен на окисление -2.
Общата формула на оксидите може да бъде записана като E x O y, където E е символът на химичен елемент.
Номенклатура на оксидите
Името на оксида на химичен елемент се основава на принципа:
Например:
Fe 2 O 3 - железен (III) оксид; CuO—меден(II) оксид; N 2 O 5 - азотен оксид (V)
Често можете да намерите информация, че валентността на даден елемент е посочена в скоби, но това не е така. Така например степента на окисление на азота N 2 O 5 е +5, а валентността, колкото и да е странно, е четири.
Ако даден химичен елемент има едно положително състояние на окисление в съединенията, тогава степента на окисление не е посочена. Например:
Na 2 O - натриев оксид; H 2 O - водороден оксид; ZnO - цинков оксид.
Класификация на оксидите
Оксидите, според способността им да образуват соли при взаимодействие с киселини или основи, се разделят съответно на солеобразуващиИ несолеобразуващи.
Има малко несолеобразуващи оксиди; всички те са образувани от неметали в степен на окисление +1 и +2. Трябва да се помни списъкът на не-солеобразуващите оксиди: CO, SiO, N 2 O, NO.
Солеобразуващите оксиди от своя страна се делят на основен, киселиненИ амфотерни.
Основни оксидиТова са оксиди, които при взаимодействие с киселини (или киселинни оксиди) образуват соли. Основните оксиди включват метални оксиди в степен на окисление +1 и +2, с изключение на оксидите BeO, ZnO, SnO, PbO.
Киселинни оксидиТова са оксиди, които при взаимодействие с основи (или основни оксиди) образуват соли. Киселинните оксиди са почти всички оксиди на неметали с изключение на несолеобразуващите CO, NO, N 2 O, SiO, както и всички метални оксиди във високи степени на окисление (+5, +6 и +7).
Амфотерни оксидисе наричат оксиди, които могат да реагират както с киселини, така и с основи и в резултат на тези реакции образуват соли. Такива оксиди проявяват двойна киселинно-алкална природа, тоест те могат да проявяват свойствата както на киселинни, така и на основни оксиди. Амфотерните оксиди включват метални оксиди в степени на окисление +3, +4, както и оксидите BeO, ZnO, SnO и PbO като изключение.
Някои метали могат да образуват и трите вида солеобразуващи оксиди. Например, хромът образува основния оксид CrO, амфотерния оксид Cr 2 O 3 и киселинния оксид CrO 3.
Както можете да видите, киселинно-алкалните свойства на металните оксиди директно зависят от степента на окисление на метала в оксида: колкото по-висока е степента на окисление, толкова по-изразено киселинни свойства.
Основания
Основания - съединения с формула Me(OH) x, където хнай-често е равно на 1 или 2.
Изключения: Be(OH) 2, Zn(OH) 2, Sn(OH) 2 и Pb(OH) 2 не са основи, въпреки степента на окисление на метала +2. Тези съединения са амфотерни хидроксиди, които ще бъдат разгледани по-подробно в тази глава.
Класификация на основите
Базите се класифицират според броя на хидроксилните групи в една структурна единица.
Основи с една хидроксо група, т.е. тип MeOH се нарича монокиселинни основи,с две хидроксо групи, т.е. тип Me(OH) 2, съответно, дикиселинаи т.н.
Основите също се делят на разтворими (алкали) и неразтворими.
Алкалите включват изключително хидроксиди на алкални и алкалоземни метали, както и талиев хидроксид TlOH.
Номенклатура на базите
Името на фондацията се основава на следния принцип:
Например:
Fe(OH) 2 - железен (II) хидроксид,
Cu(OH) 2 - меден (II) хидроксид.
В случаите, когато металът в сложните вещества има постоянно състояние на окисление, не е необходимо да го посочвате. Например:
NaOH - натриев хидроксид,
Ca(OH) 2 - калциев хидроксид и др.
Киселини
Киселини - сложни вещества, чиито молекули съдържат водородни атоми, които могат да бъдат заменени с метал.
Общата формула на киселините може да бъде написана като H x A, където H са водородни атоми, които могат да бъдат заменени с метал, а A е киселинният остатък.
Например киселините включват съединения като H2SO4, HCl, HNO3, HNO2 и др.
Класификация на киселините
Според броя на водородните атоми, които могат да бъдат заменени с метал, киселините се делят на:
- О основни киселини: HF, HCI, HBr, HI, HNO3;
- д основни киселини: H2SO4, H2SO3, H2CO3;
- T рехобазни киселини: H3PO4, H3BO3.
Трябва да се отбележи, че броят на водородните атоми в случая на органичните киселини най-често не отразява тяхната основност. Например оцетната киселина с формула CH 3 COOH, въпреки наличието на 4 водородни атома в молекулата, не е четириосновна, а едноосновна. Основността на органичните киселини се определя от броя на карбоксилните групи (-СООН) в молекулата.
Също така, въз основа на наличието на кислород в молекулите, киселините се разделят на безкислородни (HF, HCl, HBr и др.) И съдържащи кислород (H 2 SO 4, HNO 3, H 3 PO 4 и др.) . Кислородсъдържащите киселини се наричат още оксокиселини.
Можете да прочетете повече за класификацията на киселините.
Номенклатура на киселини и киселинни остатъци
Следният списък с имена и формули на киселини и киселинни остатъци трябва да се научи.
В някои случаи някои от следните правила могат да улеснят запаметяването.
Както може да се види от таблицата по-горе, конструкцията на систематичните имена на безкислородни киселини е както следва:
Например:
HF—флуороводородна киселина;
HCl - солна киселина;
H2S е хидросулфидна киселина.
Имената на киселинните остатъци на безкислородните киселини се основават на принципа:
Например Cl - - хлорид, Br - - бромид.
Имената на кислородсъдържащите киселини се получават чрез добавяне на киселинообразуващия елемент към името различни суфиксии окончания. Например, ако киселинно образуващият елемент в кислородсъдържаща киселина има най-висока степенокисляване, тогава името на такава киселина се конструира, както следва:
Например сярна киселина H 2 S +6 O 4, хромова киселина H 2 Cr +6 O 4.
Всички кислородсъдържащи киселини също могат да бъдат класифицирани като киселинни хидроксиди, тъй като съдържат хидроксилни групи (ОН). Например, това може да се види от следните графични формули на някои кислородсъдържащи киселини:
Така сярната киселина иначе може да се нарече серен (VI) хидроксид, азотната киселина - азотен (V) хидроксид, фосфорната киселина - фосфорен (V) хидроксид и т.н. В този случай числото в скоби характеризира степента на окисляване на киселинно образуващия елемент. Този вариант на имената на кислородсъдържащи киселини може да изглежда изключително необичаен за мнозина, но понякога такива имена могат да бъдат намерени в реални Единен държавен изпит KIMahпо химия в задачи по класификация на неорганични вещества.
Амфотерни хидроксиди
Амфотерни хидроксиди - метални хидроксиди, проявяващи двойна природа, т.е. способен да проявява както свойствата на киселини, така и свойствата на основи.
Металните хидроксиди в степени на окисление +3 и +4 са амфотерни (както и оксидите).
Също така, като изключение, амфотерните хидроксиди включват съединенията Be (OH) 2, Zn (OH) 2, Sn (OH) 2 и Pb (OH) 2, въпреки степента на окисление на метала в тях +2.
За амфотерни хидроксиди на три- и четиривалентни метали е възможно съществуването на орто- и мета-форми, които се различават една от друга с една водна молекула. Например алуминиевият(III) хидроксид може да съществува в ортоформата Al(OH)3 или метаформата AlO(OH) (метахидроксид).
Тъй като, както вече беше споменато, амфотерните хидроксиди проявяват както свойствата на киселините, така и свойствата на основите, тяхната формула и име също могат да бъдат написани по различен начин: или като основа, или като киселина. Например:
соли
соли - това са сложни вещества, които съдържат метални катиони и аниони на киселинни остатъци.
Например, солите включват съединения като KCl, Ca(NO 3) 2, NaHCO 3 и др.
Дефиницията, представена по-горе, описва състава на повечето соли, но има соли, които не попадат в нея. Например, вместо метални катиони, солта може да съдържа амониеви катиони или негови органични производни. Тези. соли включват съединения като например (NH4)2SO4 (амониев сулфат), + Cl-(метиламониев хлорид) и др.
Също така противоречи на определението за соли по-горе е класът на така наречените комплексни соли, които ще бъдат обсъдени в края на тази тема.
Класификация на солите
От друга страна, солите могат да се разглеждат като продукти на заместване на водородни катиони H + в киселина с други катиони или като продукти на заместване на хидроксидни йони в основи (или амфотерни хидроксиди) с други аниони.
При пълна подмяна, т.нар средно аритметичноили нормалносол. Например, при пълно заместване на водородните катиони в сярна киселина с натриеви катиони се образува средна (нормална) сол Na 2 SO 4 и при пълно заместване на хидроксидните йони в основата Ca (OH) 2 с киселинни остатъци от нитратни йони се образува средна (нормална) сол Ca(NO3)2.
Солите, получени чрез непълно заместване на водородни катиони в двуосновна (или повече) киселина с метални катиони, се наричат кисели. Така, когато водородните катиони в сярната киселина са непълно заменени с натриеви катиони, се образува киселинната сол NaHSO 4.
Соли, които се образуват чрез непълно заместване на хидроксидни йони в двукиселинни (или повече) основи, се наричат основи. Осилни соли. Например, при непълно заместване на хидроксидните йони в основата Ca (OH) 2 с нитратни йони се образува основа Обистра сол Ca(OH)NO3.
Соли, състоящи се от катиони на два различни метала и аниони на киселинни остатъци само на една киселина, се наричат двойни соли. Така например двойните соли са KNaCO 3, KMgCl 3 и т.н.
Ако една сол се образува от един вид катиони и два вида киселинни остатъци, такива соли се наричат смесени. Например смесени соли са съединенията Ca(OCl)Cl, CuBrCl и др.
Има соли, които не попадат в дефиницията на соли като продукти на заместване на водородни катиони в киселини с метални катиони или продукти на заместване на хидроксидни йони в основи с аниони на киселинни остатъци. Това са комплексни соли. Например комплексни соли са натриев тетрахидроксоцинкат и тетрахидроксоалуминат с формули съответно Na 2 и Na. Комплексните соли най-често могат да бъдат разпознати сред другите по наличието на квадратни скоби във формулата. Трябва обаче да разберете, че за да може едно вещество да бъде класифицирано като сол, то трябва да съдържа някои катиони, различни от (или вместо) H +, а анионите трябва да съдържат някои аниони, различни от (или вместо) OH - . Например съединението Н2 не принадлежи към класа на комплексните соли, тъй като когато се дисоциира от катиони, в разтвора присъстват само водородни катиони Н+. Въз основа на вида на дисоциацията, това вещество по-скоро трябва да се класифицира като безкислородна комплексна киселина. По същия начин OH съединението не принадлежи към солите, т.к това съединение се състои от катиони + и хидроксидни йони ОН -, т.е. трябва да се счита за цялостна основа.
Номенклатура на солите
Номенклатура на средни и киселинни соли
Името на средните и киселинните соли се основава на принципа:
Ако степента на окисление на метал в сложни вещества е постоянна, тогава тя не е посочена.
Имената на киселинните остатъци бяха дадени по-горе при разглеждане на номенклатурата на киселините.
Например,
Na 2 SO 4 - натриев сулфат;
NaHSO 4 - натриев хидроген сулфат;
CaCO 3 - калциев карбонат;
Ca(HCO 3) 2 - калциев бикарбонат и др.
Номенклатура на основните соли
Имената на основните соли се основават на принципа:
Например:
(CuOH) 2 CO 3 - меден (II) хидроксикарбонат;
Fe(OH) 2 NO 3 - железен (III) дихидроксонитрат.
Номенклатура на комплексните соли
Номенклатурата на комплексните съединения е много по-сложна и за полагане на Единния държавен изпитНе е нужно да знаете много за номенклатурата на комплексните соли.
Трябва да можете да назовавате комплексни соли, получени при взаимодействие на алкални разтвори с амфотерни хидроксиди. Например:
*Същите цветове във формулата и името обозначават съответните елементи на формулата и името.
Тривиални имена на неорганични вещества
Под тривиални имена разбираме имената на вещества, които не са свързани или слабо свързани с техния състав и структура. Като правило се определят и тривиални имена исторически причиниили физичните или химичните свойства на тези съединения.
Списък с тривиални имена на неорганични вещества, които трябва да знаете:
| На 3 | криолит |
| SiO2 | кварц, силициев диоксид |
| FeS 2 | пирит, железен пирит |
| CaSO 4 ∙2H 2 O | гипс |
| CaC2 | калциев карбид |
| Al 4 C 3 | алуминиев карбид |
| KOH | каустичен калий |
| NaOH | сода каустик, сода каустик |
| H2O2 | водороден прекис |
| CuSO 4 ∙5H 2 O | меден сулфат |
| NH4CI | амоняк |
| CaCO3 | креда, мрамор, варовик |
| N2O | смехотворен газ |
| НЕ 2 | кафяв газ |
| NaHC03 | сода бикарбонат (питейна). |
| Fe3O4 | желязна скала |
| NH 3 ∙H 2 O (NH 4 OH) | амоняк |
| CO | въглероден окис |
| CO2 | въглероден двуокис |
| SiC | карборунд (силициев карбид) |
| PH 3 | фосфин |
| NH 3 | амоняк |
| KClO3 | Бертолетова сол(калиев хлорат) |
| (CuOH)2CO3 | малахит |
| CaO | негасена вар |
| Ca(OH)2 | гасена вар |
| прозрачен воден разтвор на Ca(OH) 2 | варна вода |
| суспензия на твърд Са(ОН)2 в неговия воден разтвор | варно мляко |
| K2CO3 | поташ |
| Na 2 CO 3 | калцинирана сода |
| Na 2 CO 3 ∙10H 2 O | кристална сода |
| MgO | магнезия |
За елементи, включени в периодичната таблица (PS) на елементите D.I. Менделеев има право да използва следните имена на групи, които по правило отразяват общи свойстваелементи и прости вещества. За елементи основни подгрупив краткосрочната PS версия
или 1-2 и 13-18 групив дългосрочната (модерна) версия на PS

- алкаленметали (1-ва или IA група): (H), Li, Na, K, Rb, Cs, Fr;
- алкалоземни(с изключение на Mg) метали (2-ра или IIAg група): Be, Mg, Ca, Sr, Ba, Ra;
- елементи борни подгрупи(13-та или IIIA група), метали (борна кърма), нямат специално наименование: B, Al, Ga, In, Ti;
- елементи въглеродни подгрупи(14-ти или IVA група) или кристалогени: C, Si, Ge, Sn, Pb;
- елементи азотни подгрупи(15-та или VA група),остаряло име пникогении нейното производно -пниктиди: N, P, As, Sb, Bi;
- елементи кислородни подгрупи(16 или група VIA) илихалкогени ,
- халогени(17-та или VIIA група),
- благороденили инертенгазове (18-та или VIIIA група)
За елементи странични подгрупи:
- лантаниди(Ла – Лу),
- актиниди(Ac – Lr) (наименованията лантаниди и актиниди не се препоръчват);
- редкоземни метали(3-та или IIIB група, с изключение на актинидите);
- желязно семейство(Fe, Co, Ni);
- семейство платина или платинени метали(Ru, Rh, Pd, Os, Ir, Pt);
- скъпоценни метали(Au, Ag + платина: Ru, Rh, Pd, Os, Ir, Pt)
- преходни елементи(d и f-елементи, т.е. всички елементи на странични подгрупи).
Простите вещества обикновено се наричат по същия начин като съответните елементи. Имат само собствени имена алотропни модификациивъглерод (диамант, графит, карбин, фулерени) и втората модификация на кислорода (озон). При именуване на алотропни модификации на други елементи обикновено се посочва тяхното кратко име. физически характеристики(бял, червен, черен фосфор, кристална и пластична сяра, сив и бял калай и др.).
Елементите кислород, азот, въглерод и сяра в съединения с метали или с по-малко електроотрицателни неметали могат да образуват аниони не само в техните характерни отрицателни степени на окисление ($O^(2-), S^(2-), N^( 3- ), C^(4-)$, но също и йони, при които степента на окисление на елемента зависи от броя на атомите в "мостовите" структури. Степента на окисление на въглерода в органичните съединения се определя по специални методи ( вижте темата „Определяне на степента на окисление на въглерода“). Например, елементът кислород може да образува пероксидни и супероксидни йони, в които кислородните атоми образуват „кислородни мостове" -O-O- или -O-O-O-. Такива аниони имат свои собствени имена : $(O_2)^(2-)$ - пероксид; $ (O_2)^-$ - супероксид; $(O_3)^-$ - озонид; $(N_3)^-$ - азид; $(C_2)^( 2-)$ - ацетиленид; $(S_2)^(2- )$ - дисулфид; $(Sn)^(2-)$ - полисулфид.
Имената на някои стабилни аниони, състоящи се от атоми на повече от един елемент, традиционно също имат окончание -ide: $(OH)^-$ - хидроксид; $(CN)^-$ - цианид; $(CN_2)^(2-)$ - цианамид; $(NH_2)^-$ - амид; $(NH)^(2-)$ - имид; $(SCN)^-$ - тиоцианат.
КЛАСИФИКАЦИЯ НА НЕОРГАНИЧНИТЕ ВЕЩЕСТВА
Общите принципи на класификация на неорганичните вещества са представени на диаграмата. Въз основа на тази класификация всички неорганични вещества могат да бъдат разделени на прости и сложни.
Определение
Прости веществасе състоят от атоми на еднакви елементи и се делят на метали, неметали и инертни газове.
Сложни веществасе състоят от атоми на различни елементи, химически свързани помежду си.
От своя страна, въз основа на общите свойства, сложните неорганични вещества могат да бъдат разделени на четири основни класа: бинарни съединения, оксиди, хидроксиди и соли.
Класификацията и номенклатурата на бинарните съединения е разгледана подробно в темата "Бинарни съединения".

КЛАСИФИКАЦИЯ И ХАРАКТЕРИСТИКИ НА СВОЙСТВАТА НА ОКСИДИТЕ
Определение
Оксидисе наричат бинарни химични съединения, състоящи се от метални или неметални елементи и кислород. Или, с други думи, оксидите са сложни вещества, състоящи се от два елемента, единият от които е кислород.
Класификацията на оксидите се основава на химичните свойства на съединенията, дължащи се на химическа структура(тоест вида на формираните връзки и типа кристална решетка, структура и електронни характеристики на елементите).
Оксидите се различават по физични свойства агрегатно състояние, точки на топене и кипене, цвят, мирис, разтворимост във вода.
от агрегатно състояниеоксидите са:
- твърди (всички метални оксиди, силициев оксид, фосфорен оксид),
- течност (вода $H_2O$),
- газообразни (почти всички други неметални оксиди).
Въз основа на техните химични свойства оксидите се делят на несолеобразуващи и солеобразуващи.
Определение
Солеобразуващиса оксиди, способни да образуват хидроксиди, когато се комбинират с вода.
Последните от своя страна могат да проявяват свойствата на киселини, основи или да имат амфотерни свойства. Следователно солеобразуващите оксиди обикновено се разделят на основни, киселинни и амфотерни.

КЛАСИФИКАЦИЯ на киселини и основи
от начален курсВ химията сте запознати със следната дефиниция на киселини и основи:
Определение
Киселини- това са сложни вещества, състоящи се от водородни атоми, които могат да бъдат заменени с метални атоми и киселинни остатъци. Общата формула на киселините е: $H_x(Ac)^(-n)$, където Ac е киселинният остатък (acid - англ. acid), x е броят на водородните атоми, n е степента на окисление на киселинния остатък. В киселини x=n.
Определение
Основания(хидроксиди) са сложни вещества, състоящи се от метални атоми и една или повече хидроксилни групи (-OH). Общата формула на базите е: $M^(+n)(OH)_x$, където n е степента на окисление на метала, x е броят на хидроксилните групи. n=x.
Трябва да се отбележи, че и основите, и киселините принадлежат към класа на хидроксидите, тъй като съдържат хидроксо групи (-ОН). Следователно киселините се наричат още киселинни хидроксиди, а основите - основни хидроксиди.
Киселинно-базовите взаимодействия са изключително често срещани в природата и се използват широко в научната и промишлена практика. Теорията за киселините и основите е набор от фундаментални физични и химични концепции, които описват природата и свойствата на киселините и основите. В допълнение към обичайното определение за 8 клас има и други теории:
| Теория | Съдържание | Примери |
|---|---|---|
| Теория на Арениус за електролитната дисоциация |
Киселини- това са вещества, които образуват йони във воден разтвор - хидратирани водородни катиони $H^+$ (хидрониеви йони $H_3O$) и аниони на киселинния остатък или с други думи това са електролити, които се дисоциират на водородни катиони и аниони на киселинният остатък. Основания- сложни електролитни вещества, които се дисоциират, за да образуват хидроксиден йон и метален катион. |
$NaOH \Leftrightarrow Na^+ + OH^-$ база $HNO_3 \Leftrightarrow H^+ + NO_3^-$ киселина |
| Протолитичната теория на Бронстед |
Киселини- това са сложни вещества, които в резултат на хетеролитично разкъсване освобождават частица с положителен заряд - водороден протон (киселина на Брьонстед) Базае химично съединение, способно да образува ковалентна връзка с протон (база на Брьонстед) |
$HCl + NH_3 = NH_4^+ + Cl^-$ към главния към главния |
| Теория на Люис |
киселина- молекула или йон, които са празни електронни орбитали, който е акцептор на електронна двойка (киселина на Люис) Базае химично съединение, което може да образува ковалентна връзка със свободна орбитала на друго химично съединение |
|
Тази тема е описана по-подробно в раздела " Съвременни концепцииза структурата и свойствата на киселините и основите.
Класификация на киселините
се извършва съгласно следните формални характеристики:
1. по основност,това е броят на водородните атоми: един- ($HCl$), дву- ($H_2S$) и три-основни ($H_3PO_4$);
2. поради наличието на кислородни атоми: съдържащи кислород ($H_2CO_3$) и безкислородни (HCL);
3. по сила,тоест степени на дисоциация: силна ($HCl, HNO_3, H_2SO_4, HClO_4$ и т.н.), слаба ($H_2S, H_2CO_3, CH_3COOH$ и т.н.)
4. по отношение на стабилността:постоянен ($H_2SO_4$); нестабилен ($H_2CO_3$).
5. според класовете химични съединения:неорганични (HBr); органичен ($HCOOH,CH_3COOH$);
6.по волатилност: летливи ($HNO_3,H_2S, HCl$); енергонезависим ($H_2SO_4$);
7. чрез разтворимост във вода: разтворим ($H_2SO_4$); неразтворим ($H_2SiO_3$);
Класификация на основите
се извършва съгласно следните формални характеристики::
1. по киселинност(брой хидроксилни групи): монокиселина (NaOH), двукиселина ($Ca(OH)_2$), трикиселина ($Al(OH)_3$)
2. по разтворимост: алкали или разтворими основи ($KOH, NaOH$), неразтворими ($Mg(OH)_2, Cu(OH)_2$)
3. по сила(степени на дисоциация): силна (NaOH), слаба ($Cu(OH)_2$)
** Не бъркайте силата на основата с нейната разтворимост. Например калциевият хидроксид е силна основа, въпреки че разтворимостта му във вода не е висока. IN в такъв случайСилна основа (алкал) се счита за тази част от калциевия хидроксид, която е разтворена във вода.
АМФОТЕРНИ ХИДРОКСИДИ
Определение
Амфотерни хидроксиди- това са сложни вещества, които проявяват както свойствата на киселини, така и свойствата на основи.
Формулата на амфотерните хидроксиди може да бъде написана както в киселинна, така и в основна форма, например: алуминиевият хидроксид може да бъде написан в основна форма като $Al(OH)_3$. Ако преброите общия брой водородни и кислородни атоми, можете да напишете: $H_3ALO_3$ или най-простата формула - $HAlO_2$.
Амфотерните оксиди и хидроксиди се образуват от амфотерни елементи. Помня! Металоидните елементи проявяват амфотерни свойства: Al, Zn, B, Be, Fe(III), Cr (III)и някои други преходни елементи, които имат различни степени на окисление и са разположени на амфотерния диагонал в PS (вижте темата „Периодичната система като конвенционално обозначение на периодичния закон“). Металите от А-групата, които образуват амфотерния диагонал в периодичната таблица Be-Al-Ge-Sb-Po, както и металите в съседство с тях (Ga, In, Tl, Sn, Pb, Bi) не проявяват типични метални Имоти.

Проявата на двойствени (амфотерни) свойства, както метални (основни), така и неметални, се дължи на естеството на химическата връзка.
КЛАСИФИКАЦИЯ И ХАРАКТЕРИСТИКИ НА СВОЙСТВАТА НА СОЛТА
Определянето на соли, както и определянето на киселини и основи, има няколко възможности. В училищния курс за 8 клас дефиницията на солите е следната:
Определение
соли -това са сложни вещества, състоящи се от метални катиони (амониев йон) и аниони на киселинни остатъци. Общата формула на солите е: $M^(+n)_xAc^(m-)_y$, където n, m са степените на окисление на метала и киселинния остатък, x, y са броят на металните атоми и киселинен остатък, съответно. m=x и n=y
Това определение се отнася до междинни соли, които се образуват в резултат на реакция на неутрализация между киселина и основа, т.е. те могат да бъдат получени чрез взаимодействие на киселини и основи с освобождаване на вода. Следователно повече точно определениесредни соли:
Определение
Средни соли- това са продуктите на пълно заместване на водородни атоми в киселинна молекула с метални атоми или пълно заместване на хидроксо групи в основна молекула с киселинни остатъци.
От гледна точка на теорията на електролитната дисоциация (ЕД):
соли- това са сложни вещества, които се дисоциират във водни разтвори на метални катиони и аниони на киселинни остатъци.
Международният съюз за чиста и приложна химия (IUPAC) определя солите като химични съединения, състоящи се от катиони и аниони.
По този начин може да се извърши класификация на солите:
1.по разтворимост: разтворими, слабо разтворими и неразтворими (можете да определите към коя група принадлежи солта, като използвате таблицата за разтворимост)
2. по степен на заместване на водородни йони и хидроксилни групи: средно, кисело, основно, двойно, смесено. По-подробно темата е разгледана в раздела „Класификация и номенклатура на солите”.
Таблицата предоставя примери и дефиниции на киселинни и основни соли.
| средно аритметично | кисело | основен | двойно | |
|---|---|---|---|---|
| Продукт на пълно заместване на киселия водород с метал | Продукт на непълно заместване на киселинен водород с метал (известен само за многоосновни киселини) | Продукт на непълно заместване на хидроксилни групи на основа с киселинен остатък (известен само за поликиселинни основи) | Продукт на пълно заместване на водородните атоми на дву- или многоосновна киселина с два различни метала | |
|
Na$_2$SO$_4$ натриев сулфат CuCl$_2$ меден (II) хлорид $Ca_3(PO_4)_2$ калциев ортофосфат |
натриев хидроген сулфат CaHPO$_4$ калциев хидроген ортофосфат Ca(H$_2$PO$_4$)$_2$ калциев дихидроген ортофосфат |
меден (II) хидроксихлорид Ca$_5$(PO$_4$)$_3$(OH) калциев хидроксиортофосфат |
$NaKCO_3$ калиев натриев карбонат алуминиев калиев сулфат |
Отделен голям клас се състои от комплексни соли, които спадат към сложните съединения.
Определение
Сложни връзкиили координационни съединения- частици (неутрални молекули или йони), които се образуват в резултат на прикрепване към даден йон (или атом), т.нар. комплексообразуващ агент,неутрални молекули или други йони, наречени лиганди.
Вътрешна сферакомплексно съединение - централен атом със свързани лиганди, тоест всъщност сложна частица.
Външна сферакомплексно съединение - останалите частици, свързани с комплексната частица чрез йонни или междумолекулни връзки, включително водород.
Например, разгледайте структурата на комплексната сол $K_3$ - калиев хексацианоферат (III).

Вътрешната сфера е образувана от железен (III) йон, така че е комплексообразуващ агент със степен на окисление +3. Шест $CN^-$ йона са координирани около този йон. Това са лиганди, координационното число е шест. Общият заряд на вътрешната сфера е равен на: (+3)+ (-1)x6=(-3).
Външната сфера е образувана от калиеви катиони $K^+$. В съответствие със заряда на вътрешната сфера, равен на (-3), във външната сфера трябва да има 3 калиеви йона.
Комплексните соли, имащи външна сфера, напълно се дисоциират във воден разтвор в комплексен ниско дисоцииращ катион или анион.
Комплексните съединения без външна сфера са неразтворими във вода (например метални карбонили).
Всеки ден човек взаимодейства с голям брой обекти. Изработени са от различни материали и имат собствена структура и състав. Всичко, което заобикаля човек, може да бъде разделено на органично и неорганично. В статията ще разгледаме какви са тези вещества и ще дадем примери. Също така ще определим какви неорганични вещества се срещат в биологията.
Описание
Неорганичните вещества са тези вещества, които не съдържат въглерод. Те са обратното на органичните. Тази група включва също няколко въглеродсъдържащи съединения, например:
- цианиди;
- въглеродни оксиди;
- карбонати;
- карбиди и др.
- вода;
- различни киселини (солна, азотна, сярна);
- сол;
- амоняк;
- въглероден двуокис;
- метали и неметали.
Неорганичната група се отличава с липсата на въглероден скелет, който е характерен за органичните вещества. Според състава си те обикновено се делят на прости и сложни. Простите вещества съставляват малка група. Има общо около 400 от тях.
Прости неорганични съединения: метали
Металите са прости атоми, които се основават на метална връзка. Тези елементи имат характерни метални свойства: топлопроводимост, електропроводимост, пластичност, блясък и др. Общо в тази група има 96 елемента. Те включват:
- алкални метали: литий, натрий, калий;
- алкалоземни метали: магнезий, стронций, калций;
- мед, сребро, злато;
- леки метали: алуминий, калай, олово;
- полуметали: полоний, московий, нихоний;
- лантаниди и лантан: скандий, итрий;
- актиниди и актиний: уран, нептуний, плутоний.
Металите се намират в природата главно под формата на руди и съединения. За да се получи чист метал без примеси, той се пречиства. При необходимост е възможно да се извърши легиране или друга обработка. Това се прави от една специална наука – металургията. Разделя се на черни и цветни.

Прости неорганични съединения: неметали
неметали - химически елементи, които нямат метални свойства. Примери за неорганични вещества:
- вода;
- азот;
- сяра;
- кислород и други.
Неметалите са различни Голям бройелектрони към своя атом. Това определя някои свойства: способността за свързване на допълнителни електрони се увеличава и се появява по-висока окислителна активност.
В природата можете да намерите неметали в свободно състояние: кислород, хлор, както и твърди форми: йод, фосфор, силиций, селен.
Някои неметали имат отличително свойство - алотропия. Тоест те могат да съществуват в различни модификации и форми. Например:
- газообразният кислород има модификации: кислород и озон;
- твърдият въглерод може да съществува в следните форми: диамант, графит, стъкловъглерод и др.

Комплексни неорганични съединения
Тази група вещества е по-многобройна. Комплексните съединения се отличават с наличието на няколко химични елемента в веществото.
Нека разгледаме по-отблизо сложните неорганични вещества. Примери и тяхната класификация са представени по-долу в статията.
1. Оксидите са съединения, в които кислородът е един от елементите. Групата включва:
- не образуващи сол (например азот);
- солеобразуващи оксиди (например натриев оксид, цинков оксид).
2. Киселините са вещества, които съдържат водородни йони и киселинни остатъци. Например азотен сероводород.
3. Хидроксидите са съединения, които съдържат -ОН групата. Класификация:
- основи - разтворими и неразтворими алкали - меден хидроксид, натриев хидроксид;
- кислородсъдържащи киселини - дихидроген триоксокарбонат, водород триоксонитрат;
- амфотерни - хромен хидроксид, меден хидроксид.
4. Солите са вещества, които съдържат метални йони и киселинни остатъци. Класификация:
- среда: натриев хлорид, железен сулфид;
- киселинни: натриев бикарбонат, хидросулфати;
- основни: дихидроксохром нитрат, хидроксохром нитрат;
- комплекс: натриев тетрахидроксицинкат, калиев тетрахлороплатинат;
- двойно: калиева стипца;
- смесени: калиев алуминиев сулфат, калиев меден хлорид.
5. Бинарните съединения са вещества, състоящи се от два химични елемента:
- безкислородни киселини;
- безкислородни соли и други.

Неорганични съединения, съдържащи въглерод
Такива вещества традиционно принадлежат към групата на неорганичните. Примери за вещества:
- Карбонати - естери и соли на въглената киселина - калцит, доломит.
- Карбидите са съединения на неметали и метали с въглерод - берилиев карбид, калциев карбид.
- Цианиди - соли на циановодородната киселина - натриев цианид.
- Въглеродни оксиди - бинарно съединение на въглерод и кислород - въглероден оксид и въглероден двуокис.
- Цианатите са производни на циановата киселина - фулминова киселина, изоцианова киселина.
- Карбонилни метали - комплекс от метал и въглероден оксид - никелов карбонил.

Всички разглеждани вещества се различават по своите индивидуални химични и физични свойства. Най-общо могат да бъдат идентифицирани отличителните черти на всеки клас неорганични вещества:
1. Прости метали:
- висока топло- и електрическа проводимост;
- метален блясък;
- липса на прозрачност;
- здравина и пластичност;
- при стайна температура запазват твърдостта и формата си (с изключение на живака).
2. Прости неметали:
- прости неметалимогат да бъдат в газообразно състояние: водород, кислород, хлор;
- бромът се среща в течно състояние;
- твърдите неметали имат немолекулно състояние и могат да образуват кристали: диамант, силиций, графит.
3. Сложни вещества:
- оксиди: реагират с вода, киселини и киселинни оксиди;
- киселини: реагират с вода и основи;
- амфотерни оксиди: могат да реагират с киселинни оксиди и основи;
- хидроксиди: разтворими във вода, имат широк диапазон от точки на топене и могат да променят цвета си при взаимодействие с основи.

Клетката на всеки жив организъм се състои от много компоненти. Някои от тях са неорганични съединения:
- вода. Например, количеството вода в клетката варира от 65 до 95%. Той е необходим за осъществяването на химични реакции, движението на компонентите и процеса на терморегулация. Също така водата определя обема на клетката и степента на нейната еластичност.
- Минерални соли. Те могат да присъстват в тялото както в разтворена, така и в неразтворена форма. Важна роля в клетъчните процеси играят катиони: калий, натрий, калций, магнезий - и аниони: хлор, бикарбонати, суперфосфат. Минералите са необходими за поддържане на осмотичния баланс, регулиране на биохимичните и физически процеси, образуването на нервни импулси, поддържане нивото на съсирване на кръвта и много други реакции.
Не само неорганичните вещества на клетката са важни за поддържането на живота. Органичните компоненти заемат 20-30% от обема му.
Класификация:
- прости органични вещества: глюкоза, аминокиселини, мастни киселини;
- сложни органични вещества: протеини, нуклеинова киселина, липиди, полизахариди.
Органичните компоненти са необходими за изпълнение на защитната, енергийна функция на клетката, те служат като източник на енергия за клетъчната дейност и съхраняват хранителни вещества, извършват протеинов синтез, предават наследствена информация.
Статията разгледа същността и примерите за неорганични вещества, тяхната роля в състава на клетката. Можем да кажем, че съществуването на живи организми би било невъзможно без групи от органични и неорганични съединения. Те са важни във всяка сфера човешки живот, както и в съществуването на всеки организъм.
Класификацията на неорганичните вещества се основава на способността им да се разлагат. Простите вещества, състоящи се от атоми само на един химичен елемент (O 2, H 2, Mg), не се разпадат. Сложните вещества, състоящи се от атоми на два или повече елемента (CO 2, H 2 SO 4, NaOH, KCl), лесно се разлагат.
просто
Класификацията на класовете неорганични вещества включва:
- метали - елементи с топло- и електропроводимост, висока пластичност, ковкост и метален блясък;
- неметали - елементи, които са по-крехки от металите, нямат електропроводимост и проявяват окислителни свойства.

Ориз. 1. Схема за класификация на неорганичните вещества.
Металите са разположени в долния ляв ъгъл периодичната таблица, неметалите са в горния десен ъгъл и включват благородни газове.

Ориз. 2. Разположението на металите и неметалите в периодичната система.
Много прости химични елементи имат алотропия - свойството да образуват няколко прости вещества. Например, когато към кислорода се добави още един атом, се образува простото вещество озон (O 3), въглеродът, в зависимост от броя на атомите, образува графит, въглища или диамант.
Комплекс
Сложните вещества се класифицират в следните класове:
- оксиди - състоят се от два елемента, единият от които е кислород;
- киселини - състоят се от водородни атоми и киселинен остатък;
- основания - състоят се от метал и една или повече хидроксилни групи;
- сол - състоят се от метал и киселинен остатък.
Отделно се изолират амфотерни хидроксиди, които проявяват свойствата на киселини и основи. Това са твърди вещества, които са слаби електролити. Те включват метални хидроксиди със степени на окисление +3 и +4. Изключения са Be(OH)2, Zn(OH)2, Sn(OH)2, Pb(OH)2.
По-подробна класификация на сложните вещества е представена в таблицата с примери.
|
Преглед |
Номенклатура |
Пример |
|
|
Оксиди - E x O y |
Елемент оксид (степен на окисление) |
Има основни оксиди, които образуват соли при взаимодействие с киселини, и киселинни оксиди, които образуват киселини при взаимодействие с основи. Отделно се изолират амфотерни оксиди, които взаимодействат с киселини и основи (образува се сол) |
Na 2 O - натриев оксид, Fe 2 O 3 - железен (III) оксид, N 2 O 5 - азотен оксид (V) |
|
Основи - Me(OH) x |
Метален хидроксид (степен на окисление) |
В съответствие с разтворимостта се разграничават основи и неразтворими във вода основи. Алкалите реагират с неметали и киселинни оксиди. Неразтворимите основи реагират с киселини и могат да се разложат при високи температури |
Fe(OH) 2 - железен (II) хидроксид, Cu(OH) 2 - меден (II) хидроксид, NaOH - натриев хидроксид |
|
Киселини - H n Ac |
Прочетете в зависимост от киселинния остатък |
Те взаимодействат с метали отляво на водорода в серията активност, с оксиди и соли. Способен на разлагане при високи температури |
H 2 SO 4 - сярна киселина, HCl - солна киселина, HNO 3 - азотна киселина |
|
Соли - кожа x (Ac) y |
Киселинен остатък от метал (степен на окисление) |
Реагира с киселини, основи, метали и соли |
Na 2 SO 4 - натриев сулфат, CaCO 3 - калциев карбонат, KCl - калиев хлорид |

Ориз. 3. Списък с имена на киселини.
Генетичните връзки между класовете се основават на взаимната трансформация на веществата. По време на химични реакции атомите преминават от едно вещество в друго, образувайки генетични серии (серии от трансформации). Когато металът се добави към кислорода, той образува оксид, който при взаимодействие с вода се превръща в основа. Киселинният оксид се образува от неметал, който реагира с вода, за да образува киселина. Всяка генетична серия завършва със сол.
Какво научихме?
Неорганичните вещества включват прости и сложни съединения. Простите вещества са изградени от атоми на един и същи елемент. Те включват метали и неметали. Комплексните съединения включват вещества, състоящи се от няколко елемента. Те включват оксиди, киселини, основи, соли и амфотерни хидроксиди. Всички вещества са генетично свързани помежду си. От просто вещество можете да получите по-сложно вещество. Солите се считат за най-сложните вещества.
Тест по темата
Оценка на доклада
Среден рейтинг: 4.6. Общо получени оценки: 102.
"Класификация и номенклатура на неорганичните съединения"
Най-важните класове неорганични съединения са оксиди, киселини, основи и соли.
Оксидите са сложни вещества, състоящи се от два елемента, единият от които е кислород в степен на окисление (– 2).
Когато записвате формулата на оксид, символът на елемента, образуващ оксида, се поставя на първо място, а кислородът се поставя на второ място. Обща формула на оксидите: Eh Oy.
Специална група кислородни съединенияелементи са пероксиди. Обикновено се разглеждат като соли на водороден пероксид H2O2, който проявява слаби киселинни свойства. В пероксидите кислородните атоми са химически свързани не само с атоми на други елементи, но и един с друг (образувайки пероксидна група - O– O–). Например натриевият пероксид е Na2O2 (Na–O–O–Na), а натриевият оксид е Na2O (Na–O–Na). В пероксидите степента на окисление на кислорода е (–1). Така в бариевия пероксид BaO2 степента на окисление на бария е +2, а на кислорода е –1.
Имена на оксиди
Имената на оксидите, в съответствие с правилата на номенклатурата, се образуват от думата „оксид“ и името на оксидообразуващия елемент в родителния падеж, например CaO - калциев оксид, K2 O - калиев оксид.
В случай, че даден елемент има променлива степен на окисление и образува няколко оксида, след името на този елемент неговата степен на окисление се посочва с римска цифра в скоби или се прибягва до гръцки цифри (1-моно, 2-ди, 3- три, 4-тетра, 5-пента, 6-хекса, 7-хепта, 8-окта). Например,
VO – ванадиев (II) оксид или ванадиев моноксид;
V2 O3 – ванадиев (III) оксид или диванадиев триоксид; VO2 – ванадиев (IV) оксид или ванадиев диоксид; V2 O5 – ванадиев (V) оксид или диванадиев пентоксид.
Класификация на оксидите
Въз основа на тяхната реактивност оксидите могат да бъдат разделени на солеобразуващи и несолеобразуващи (индиферентни). От своя страна солеобразуващите оксиди се разделят на основни, киселинни и амфотерни.
Солеобразуващи оксиди |
Необразуващи соли |
|||
Основен |
киселинен |
Амфотерни |
Образувайте неметали с |
|
в малка степен |
||||
Форма метали |
Форма метали и |
Формувайте метали с |
||
окисляване |
||||
със степен на окисление |
неметали с |
междинен |
||
степен на окисление |
степен на окисление |
|||
Например NO, CO, N2 O, |
||||
Например, |
||||
Li2O, CaO |
Например, |
Например, |
||
Тази група оксиди |
||||
Mn2O7, CrO3 |
ZnO, Al2O3, SnO, BeO, |
|||
не показва никакви |
||||
As2O3, Fe2O3 |
||||
основни, без киселинни |
||||
свойства и не образуват |
||||
Основни оксиди. Получаване на основни оксиди и техните химични свойства
Основни оксиди са тези, които имат съответните основи. Например Na2O, CaO са основни оксиди, тъй като съответстват на основите NaOH, Ca(OH)2.
Получаване на основни оксиди
1. Взаимодействие на метал с кислород. Например: 4 Li + O 2 → 2 Li2 O.
2. Разлагане при нагряване на кислородни съединения: карбонати, нитрати, основи. Например:
MgCO3 ¾¾® MgO + CO2 - ;
2Cu(NO3 )2 ¾¾® 2CuO + 4NO2 - + O2 - ;
Ca(OH)2 ¾¾® CaO + H2 O.
Химични свойства на основните оксиди
1. Взаимодействие с вода. По отношение на водата основните оксиди се делят на разтворими и неразтворими. Разтворими са оксиди на алкални метали (Li2O, Na2O, K2O, Rb2O, Cs2O) и алкалоземни метали (CaO, SrO, BaO). Когато се разтворят във вода, оксидите на алкалните и алкалоземните метали образуват водоразтворими основи, наречени алкали. Оксидите на други метали са неразтворими във вода. Например:
Na2O + H2O → 2NaOH;
CaO + H2O → Ca(OH)2.
2. Основните оксиди реагират с киселини, за да образуват сол и вода. Например: CaO + H2 SO4 → CaSO4 + H2 O
3. Основните оксиди реагират с киселинните, образувайки сол. Например:
CaO + SO3 → CaSO4
Киселинни оксиди. Получаване на киселинни оксиди и техните химични свойства
Оксидите, които съответстват на киселини, се наричат киселинни. Например CO2, P2 O5, SO3 са киселинни оксиди, тъй като съответстват на киселините H2 CO3, H3 PO4, H2 SO4.
Получаване на киселинни оксиди
1. Неметално изгаряне. Например: S+O 2 → SO2;
2. Изгаряне на сложни вещества. Например: CH 4 + 2O2 → CO2 + 2 H2 O;
3. Разлагане при нагряване на кислородни съединения: карбонати, нитрати, хидроксиди. Например:
CaCO3 ¾¾® CaO + CO2 - ;
2AgNO3 ¾¾® 2Ag + 2NO2 - + O2 - .
Химични свойства на киселинните оксиди
1. Взаимодействие с вода. Повечето киселинни оксиди реагират директно с вода, за да образуват киселина. Единствените изключения са оксидите на силиций (SiO2), телур (TeO2, TeO3), молибден и волфрам (MoO3, WO3). Например:
CO2 + H2 O ↔ H2 CO3
2. Киселинните оксиди реагират с основи, за да образуват сол и вода. Например: SO3 + 2 NaOH → Na2 SO4 + H2 O
3. Киселинните оксиди реагират с основните, образувайки сол. Например: 3CaO + P2 O5 → Ca3 (PO4 )2
4. Летливите киселинни оксиди са способни да изместват по-летливите от техните соли. Например, нелетливият кисел силициев оксид (IV) измества летливия киселинен оксид CO2 от неговата сол CaCO3 + SiO2 → CaSiO3 + CO2 -.
Амфотерни оксиди
Амфотерните оксиди са тези, които в зависимост от условията проявяват основни или киселинни свойства, тоест имат двойни свойства.
1. Амфотерните оксиди не реагират с вода.
2. Амфотерните оксиди реагират с киселини. Например:
Al2O3 + 6 HCl → 2 AlCl3 + 3 H2 O
3. Амфотерните оксиди взаимодействат с основите. Например:
Al2 O3 + 2 NaOH ¾¾® 2 NaAlO2 + H2 O Al2 O3 + 2NaOH + 3H2 O ® 2Na
4. Амфотерните оксиди взаимодействат с основни и киселинни оксиди.
Al2 O3 + 3 SO3 ¾¾® Al2 (SO4 )3
Al2 O3 + Na2 O ¾¾® 2 NaAlO2
Хидроксидите са сложни многоелементни химични съединения, които съдържат атоми на даден елемент, кислород и водород. Химическият характер на хидроксидите се определя от свойствата на съответните им оксиди. Следователно хидроксидите се разделят на три големи групи:
1. Киселинните оксидни хидрати, наречени киселини, например Н 2 SO4.
2. Основни оксидни хидрати, наречени основи, например Ba(OH) 2 .
3. Хидрати на амфотерни оксиди, наречени амфотерни хидроксиди, например Be(OH) 2 .
Основи Основите са електролити, които се дисоциират във воден разтвор, за да се образуват
метален катион (или амониев йон NH4 +) и хидроксо група OH–. Имена на бази
Обща формула на основите: Me(OH)n. Според международната номенклатура имената на основите се състоят от думата хидроксид и името на метала. Например NaOH е натриев хидроксид, Ca(OH)2 е калциев хидроксид. Ако даден елемент образува няколко основи, тогава името показва степента на неговото окисление с римска цифра в скоби: Fe(OH)2 - железен (II) хидроксид, Fe(OH)3 - железен (III) хидроксид.
В допълнение към тези имена, други, предимно традиционни руски имена, се използват за някои от най-важните бази. Например натриевият хидроксид NaOH се нарича сода каустик, калциевият хидроксид Ca(OH)2 се нарича гасена вар, KOH се нарича калий каустик.
Броят на ОН- групите, съдържащи се в основната молекула, определя нейната киселинност. Въз основа на този критерий основите се делят на еднокиселинни (KOH), двукиселинни (Cu(OH)2), трикиселинни
(Cr(OH)3).
Хидроксидите, които са разтворими във вода, се наричат алкали. Това са алкални и алкални хидроксиди.
земни метали: NaOH, KOH, RbOH, CsOH, Ba(OH)2, Ca(OH)2, Sr(OH)2.
Методи за получаване на алкали и основи
1. Водоразтворимите основи (алкали) се получават при взаимодействие на алкални и алкалоземни метали с вода.
2Na + 2H2 O → 2NaOH + H2 -
2. Водоразтворимите основи (алкали) се получават при взаимодействие на оксиди на алкални и алкалоземни метали с вода.
Na2O + H2O → 2NaOH
3. Алкали могат да бъдат получени чрез електролиза на водни разтвори на съответните соли (Например, натриев хидроксид може да се получи чрез електролиза на разтвор на NaCl сол).
2 NaCl + 2 H2 O → 2 NaOH + H2 - + Cl2 - Катод: 2 H2 O + 2e– → H2 + 2 OH– Анод: 2 Cl– – 2e – → Cl2
4. Слабо разтворими или неразтворими във вода основи се получават чрез взаимодействие на разтвори на съответните соли с разтвори на основи. Например:
CuSO4 + 2 NaOH → Cu(OH)2 ¯ + Na2 SO4
Химични свойства на основите
Основанията в повечето случаи са твърди вещества. По отношение на водата те могат да се разделят на две групи: водоразтворими - алкали и водонеразтворими. Алкалните разтвори са сапунени на допир. Промяна на цвета на индикаторите: лакмус в Син цвят, фенолфталеин - в пурпурно, метилоранж - в жълто.
1. Електролитни свойства на основите. Едно от най-характерните свойства на основите е тяхната електролитна способност да се дисоциират в течно състояние. При дисоциация на основата се образува хидроксогрупа OH– и основният остатък е катион.
Дисоциацията на бази, съдържащи една хидроксогрупа OH–, се извършва в един етап:
KOH ↔ K+ + OH– .
Основите, съдържащи няколко хидроксогрупи в молекулата, се дисоциират стъпаловидно, с постепенно елиминиране на OH– йони.
Катионът, образуван след елиминирането на един или повече хидроксидни йони от хидроксидна молекула, се нарича основен остатък. Броят на основните остатъци, съответстващи на даден хидроксид, е равен на броя на OH– хидроксо групите в молекулата на хидроксида.
Името на основния остатък се образува от руското наименование на метала в остатъка с добавянето на думата „йон“. Ако остатъците съдържат една или две хидроксо групи, към името на метала се добавят префиксите "хидроксо" или "дихидроксо".
(сапуненост на допир, промяна в цвета на индикаторите, взаимодействие с киселини, киселинни оксиди, соли) се дължат на наличието на хидроксидни йони в техния състав.
2. Взаимодействие с киселини. Това е реакция на неутрализация, водеща до образуването на сол
и вода:
2 NaOH + H 2 SO4 → Na2 SO4 + H2 O.
3. Алкалите реагират с киселинни оксиди:
Ca(OH)2 + CO2 → CaCO3 + H2O.
4. Алкалите взаимодействат със солни разтвори. Това взаимодействие възниква, ако след реакцията се образуват слабо разтворими или слаби основи. Например:
2 KOH + CuSO 4 → Cu(OH)2 ¯ + K2 SO4.
5. При нагряване неразтворими основиразлагат се на оксид и вода. Например:
2 Fe(OH)3 ¾¾® Fe2 O3 + 3 H2 O.
Амфотерни хидроксиди
Амфотерността на хидроксидите се разбира като способността на слабо разтворимите метални хидроксиди да проявяват киселинни или основни свойства в зависимост от естеството на киселинно-алкалното взаимодействие. Следните хидроксиди са амфотерни: Al(OH)3, Zn(OH)2, Cr(OH)3, Be(OH)2, Ge(OH)2, Sn(OH)4, Pb(OH)2 и др.
Формулата на амфотерния хидроксид обикновено се записва с формулата на основата Me(OH)n, но може да бъде представена и като киселината Hn MeOm. Например Zn(OH)2 – цинков хидроксид или H2 ZnO2 – цинкова киселина; Al(OH)3 – алуминиев хидроксид или HAlO2 – мета-алуминиева киселина (H3 AlO3 – орто-алуминиева киселина).
Химични свойства на амфотерните хидроксиди
Поради своята двойственост амфотерните хидроксиди са способни да реагират както с киселини, така и с основи.
1. При взаимодействие със силни киселини се образуват сол и вода; в този случай амфотерният хидроксид проявява основни свойства.
2. При взаимодействие със силни основи (алкали) се образуват сол и вода; в този случай амфотерният хидроксид проявява киселинни свойства и неговата киселинна форма трябва да се използва в уравнението.
H2 ZnO2 + 2 NaOH → Na2 ZnO2 + 2 H2 O
натриев цинкат
НAlO2 + NaOH ¾¾® NaAlO2 + H2 O (синтез)
натриев метаалуминат 3. С водни разтвори на основи амфотерните хидроксиди образуват комплекс
връзки:
Zn(OH)2 + 2 NaOH → Na2
Амфотерните хидроксиди са неразтворими съединения. Получаването на амфотерни хидроксиди е възможно само индиректно - чрез взаимодействие на основи със соли на съответните метали.
Киселини Киселините са електролити, които се дисоциират във воден разтвор, за да образуват катион
водород Н+ и анион на киселинен остатък.
Имена на киселини
Като цяло киселинната формула се записва като Hm E или Hm EOn, където E е киселинно образуващият елемент.
от химичен състав, а именно според отсъствието или наличието на кислородни атоми в молекулите киселините се делят на кислородсъдържащи (H2SO4, HNO3) и безкислородни (H2S, HF, HCl).
Киселините имат традиционни и систематични имена, съставени съгласно номенклатурните правила на IUPAC за комплексни съединения.
Традиционното име на киселината се състои от две думи. Първата дума е прилагателно с корен от руското име на киселинообразуващ елемент, втората е думата „киселина“, например сярна киселина, азотна киселина. В имената на кислородсъдържащи киселини се използват следните суфикси за указване на степента на окисление на киселиннообразуващия елемент:
– n, – ov, – ev – (най-висока или която и да е отделна степен на окисление), като HClO4 – перхлорна киселина, H2 SO4 – сярна киселина, HMnO4 – манганова киселина; H2 SiO3 – метасилициева киселина.
– novat – (междинна степен на окисление +5), като HClO 3 – перхлорна киселина, HIO3 – йодна киселина, H2 MnO4 – перманганова киселина.
– ovist, – ist – (междинно състояние на окисление +3, +4), като H 3 AsO3 – ортоарсен
киселина; HClO2 – хлорид; HNO2 – азотен.
– новатист – (най-ниска положителна степен +1), като HClO – хипохлорист.
Ако даден елемент образува няколко кислородсъдържащи киселини в едно и също състояние на окисление, тогава префиксът "мета" се добавя към името на киселината с по-ниско съдържание на кислородни атоми, когато най-голямото число– префикс „орто”: HPO3 – метафосфорна киселина, H3 PO4 – ортофосфорна киселина (степента на окисление на фосфора е +5).
Имена на безкислородни киселини |
произлизат от името на неметал, завършващо на „о“ и |
|||||
добавяйки думата водород: |
||||||
HF – флуороводородна или флуороводородна киселина |
||||||
HCl – солна или солна киселина |
||||||
Наименования на киселини и киселинни остатъци |
||||||
Име на киселината |
Киселинен остатък |
Име |
||||
Азотни |
HNO2 |
NO2 – |
Нитритен йон |
|||
HNO3 |
NO3 – |
Нитратен йон |
||||
Ортоборни |
H3 BO3 |
BO3 3– |
Ортоборатен йон |
|||
Метасилиций |
H2 SiO3 |
SiO3 2– |
Метасиликатен йон |
|||
Манган |
HMnO4 |
MnO4 – |
Перманганатен йон |
|||
Ортоарсен |
H3AsO4 |
AsO4 3– |
Ортоарсенатен йон |
|||
Ортоарсенов |
H3 AsO3 |
AsO3 3– |
Ортоарсенит йон |
|||
H2SO4 |
SO4 2– |
Сулфатен йон |
||||
сяра |
H2SO3 |
SO3 2– |
Сулфитен йон |
|||
Водороден сулфид |
S 2– |
Сулфиден йон |
||||
Тиосяра |
H2 S2 O3 |
S2 O3 2– |
Тиосулфатен йон |
|||
Въглища |
H2 CO3 |
CO3 2– |
Карбонатен йон |
|||
Метафосфорен |
NRO3 |
PO3 – |
Метафосфатен йон |
|||
Ортофосфорен |
H3 PO4 |
PO4 3– |
Ортофосфатен йон |
|||
Дифосфор |
H4 P2 O7 |
P2 O7 4– |
Дифосфат |
|||
(пирофосфорен) |
(пирофосфат) |
|||||
Фосфорни |
H3 PO3 |
PO3 3– |
Фосфитен йон |
HClO4 |
ClO4 – |
Перхлоратен йон |
|
Хлорид |
HClO2 |
ClO2 – |
Хлоритен йон |
Chrome |
H2CrO4 |
CrO4 2– |
Хроматен йон |
Солна |
Cl– |
Хлориден йон |
|
Бромоводородна |
Br– |
Бромиден йон |
|
Хидройодид |
J– |
Йодиден йон |
|
Оцет |
СН3 СООН |
CH3 COO– |
Ацетатен йон |
Циановодород |
CN– |
Цианиден йон |
Методи за получаване на киселини
1. Взаимодействие киселинен оксидс вода. Например: SO2 + H2 O → H2 SO3
Изключение правят SiO2, TeO2, TeO3, MoO3, WO3, които не взаимодействат с водата. 2. Ако киселинният оксид е неразтворим във вода, тогава се получават съответните киселини
индиректно, а именно чрез действието на друга киселина върху съответната сол. Например:
Na2 SiO3 + H2 SO4 → Na2 SO4 + H2 SiO3 ↓
3. Безкислородните киселини се получават чрез взаимодействие на неметали с водород и след това разтваряне на продуктите във вода. Например:
H 2 (g) + Cl 2 (g) → 2 HCl (g)
Химични свойства на киселините
Киселините са течности (H2SO4, HNO3) или твърди вещества (H3PO4). Много киселини са силно разтворими във вода. Водните разтвори на киселини имат кисел вкус и променят цвета на индикаторите: лакмусът се оцветява в червено, метилоранжът се оцветява в розово.
1. Електролитни свойства на киселините. Според теорията на електролитната дисоциация киселините са вещества, които се дисоциират във водни разтвори, за да образуват водородни йони Н+, които определят всички общи свойства на киселините (кисел вкус на разтворите, оцветяване на лакмус в червено, взаимодействие с метали и др.).
Броят на водородните йони на киселина, които могат да бъдат заменени с метални катиони, определя основността на тази киселина и броя на етапите на дисоциация. Така HCl, H2SO4, H3PO4 са примери за моно-, ди- и триосновни киселини.
Дисоциацията на моноосновна солна киселина HCl става в една стъпка: HCl ↔ H+ + Cl–
Съответства на един киселинен остатък – хлоридния йон Cl–.
Въглеродната киселина, като двуосновна киселина, се дисоциира на два етапа с образуването на киселинни остатъци:
H2 CO3 |
↔ H+ |
HCO3 – |
бикарбонатен йон |
HCO3 – |
↔ H+ |
CO3 2– |
карбонатен йон |
Ортофосфорната киселина H3PO4 се дисоциира на три етапа, за да образува три киселинни киселини
баланси: |
|
H3 PO4 ↔ H+ + H2 PO4 – |
дихидроген ортофосфатен йон |
H2 PO4 – ↔ H+ + HPO4 2– |
хидроортофосфатен йон |
NPO4 2– ↔ H+ + PO4 3– |
ортофосфатен йон |
Ако киселинният остатък съдържа един водороден йон, тогава към името му се добавя префиксът "хидро", ако два водородни йона - "дихидро".
2. Взаимодействие с основи, в резултат на което се образуват сол и вода. HCl + NaOH → NaCl + H2O
3. Взаимодействие с основни оксиди.
2 HCl + CaO → CaCl 2 + H2 O
4. Взаимодействие със соли. Киселините реагират със соли, ако в резултат на това
образува се по-слабо киселинно, слабо разтворимо или летливо съединение.
H2 SO4 + BaCl2 → BaSO4 ↓ + 2 HCl
4. Взаимодействие на киселини с метали (с образуване на соли и отделяне на водород).
2 HCl + Fe → FeCl2 + H2 −
Метали със стандартен електроден потенциал, по-голям от водорода, не взаимодействат с киселини. Когато металите взаимодействат с концентрирана сярна киселина, концентрирана и разредена азотна киселина, водородът не се отделя.
Соли Солите са електролити, които се дисоциират във воден разтвор, за да образуват катиони
основни остатъци и аниони на киселинни остатъци. Формули и имена на соли
Съставът на солта се описва с формула, в която формулата на катиона е поставена на първо място, а формулата на аниона на второ място. Имената на солите се образуват от името на киселинния остатък (в именителен падеж) и името на основния остатък (в родителен падеж), които съставляват солта. Степента на окисление на метала, образуващ катиона, е посочена с римски цифри в скоби, ако е необходимо. Например K2S е калиев сулфид, FeSO4 е железен (II) сулфат, Fe2 (SO4 )3 е железен (III) сулфат.
Анионът на аноксичната киселина има окончание "ide". Например FeCl3 е железен (III) хлорид. Имената на киселинните соли се образуват по същия начин като средните, но към името на аниона се добавя префиксът "хидро", което показва наличието на водородни атоми, чийто брой е обозначен с гръцки цифри: di, три и т.н. Например: Fe(HSO4 )3 – водороден сулфат
желязо (III), NaH2 PO4 – натриев дихидроген фосфат.
Имената на основните соли се формират по същия начин като средните, но към името на катиона се добавя префиксът "хидроксо", което показва наличието на хидроксо групи, чийто брой е обозначен с гръцки цифри: di , три и т.н. Например: (CuOH)2 CO3 – хидроксимеден (II) карбонат, Fe(OH)2 Cl – дихидроксижелезен (III) хлорид.
Солите се делят на средни, киселинни и основни.
Средни (нормални) солине съдържат нито водородни атоми, нито хидроксо групи в молекулата. Те се дисоциират почти напълно (не поетапно), образувайки метални катиони и аниони на киселинния остатък:
K2 S ↔ 2 K+ + S2– AlCl3 ↔ Al3+ + 3 Cl–
Средните соли могат да бъдат получени чрез пълно заместване на водородни атоми в киселинни молекули с метални атоми или чрез пълно заместване на хидроксилни групи в основи с киселинни остатъци. Например:
Zn(OH)2 + H2 SO4 → ZnSO4 + 2 H2 O
Киселинните соли са соли, чийто киселинен остатък съдържа водород, например KHS, Fe(HSO4)3. Такива соли се дисоциират стъпаловидно. Първо (на етап I) солта е напълно дисоциирана на метални катиони и аниони на киселинния остатък:
KHS ↔ K+ + HS– (пълна дисоциация)
След това киселинният остатък се дисоциира в по-малка степен (частично), постепенно елиминирайки водородните катиони:
HS– ↔ H+ + S2– (частична дисоциация)
Според свойствата си киселинните соли са междинни съединения между междинните соли и киселините. Точно като киселините, те обикновено са силно разтворими във вода и способни да неутрализират реакции.
Киселинните соли се образуват само от многоосновни киселини в случай на непълно заместване на водородните атоми в киселината с метални атоми (излишна киселина). Например:
NaOH + H2 SO4 → NaHSO4 + H2 O
натриев хидроген сулфат
Едноосновните киселини (HCl, HNO3) не образуват киселинни соли.
Основните соли са соли, чиито катиони съдържат една или повече хидроксилни групи,
например (CuOH)2CO3, (FeOH)Cl2.
Основните соли, подобно на киселинните, се дисоциират стъпаловидно. В етап I има пълна дисоциация на катиони на основния остатък и аниони на киселинния остатък и след това има частична дисоциация на основния остатък. Например хидроксимедният (II) карбонат напълно се дисоциира в първия етап:
(CuOH)2 CO3 ↔ 2 CuOH+ + CO3 2– , (пълна дисоциация)
след това основният остатък частично се дисоциира като слаб електролит на йони: CuOH+ ↔ Cu2+ + OH– (частична дисоциация)
По правило основните соли са слабо разтворими и при нагряване се разлагат с отделяне на вода.
Основните соли се образуват само от поликиселинни основи в случай на непълно заместване на хидроксогрупите на основата с киселинни остатъци (излишна основа). Например: Mg(OH)2 + HCl → MgOHCl + H2O
хидроксомагнезиев хлорид
Получаване на соли
Средните соли могат да бъдат получени чрез взаимодействие на вещества:
1. метал с неметал. Например: Fe + S → FeS
2. метал с киселина. Например:
Zn + 2 HCl → ZnCl2 + H2 −
3 Zn + 4 H2 SO4 (конц.) → 3 ZnSO4 + S + 4 H2 O
3. основен оксид с киселина. Например: CuO + H2 SO4 → CuSO4 + H2 O
4. киселинен оксид с основи. Например: CO 2 + Ca(OH)2 → CaCO3 + H2O
5. основи с киселина (реакция на неутрализация). Например: Ca(OH) 2 + 2 HCl → CaCl2 + 2 H2 O
6. две различни соли. Например:
Na2 SO4 + BaCl2 → BaSO4 ↓ + 2 NaCl
7. алкали със соли. Например: 3 KOH + FeCl 3 → 3 KCl + Fe(OH)3 ↓
8. изместване на пасивен метал от разтвор на неговата сол от по-активен метал (в съответствие с редица метални напрежения). Например:
Fe + CuSO4 → FeSO4 + Cu
9. взаимодействие на киселинен оксид с основен. Например:
CaO + SiO2 → CaSiO3
Могат да се получат киселинни соли:
1. когато изкривяването реагира с излишък от киселина или киселинен оксид. Например: Pb(OH)2 + 2 H2 SO4 → Pb(HSO4 )2 + 2 H2 O
Ca(OH)2 + 2 CO2 → Ca(HCO3 )2
2. когато средна сол взаимодейства с киселина, чийто киселинен остатък е част от тази сол. Например:
PbSO4 + H2 SO4 → Pb(HSO4 )2
Основните соли се получават:
1. когато киселината реагира с излишък от основа. Например: HCl + Mg(OH) 2 → MgOHCl + H2O
2. когато средната сол взаимодейства с алкали:
Bi(NO3 )3 + 2 NaOH → Bi(OH)2 NO3 + 2 NaNO3
При хидролизата на средни соли се образуват киселинни или основни соли: Na2CO3 + H2O → NaHCO3 + NaOH
Al2 (SO4 )3 + H2 O → 2 AlOHSO4 + H2 SO4
Химични свойства на солите
1. В поредица от стандартни електродни потенциали всеки предишен метал измества следващите от разтвори на техните соли. Например:
Zn + Hg(NO3 )2 → Zn(NO3 )2 + Hg
2. Солите взаимодействат с алкали. Например:
CuSO4 + 2 NaOH → Cu(OH)2 ↓ + Na2 SO4
3. Солите реагират с киселини: CuSO 4 + H2 S → CuS↓ + H2 SO4
4. Много соли взаимодействат една с друга:
CaCl2 + Na2 CO3 → CaCO3 ↓ + 2 NaCl
При компилиране химични уравненияреакции, трябва да се помни, че реакция възниква, ако един от получените продукти се утаи, освободи се като газ или е леко дисоциирано съединение.
Превръщане на киселинни и основни соли в междинни
1. Взаимодействие на кисела сол с хидроксид на същия метал: KHSO4 + KOH → K2 SO4 + H2 O
2. Взаимодействие на кисела сол със сол на същия метал, но на различна киселина: KHSO4 + KСl → K2 SO4 + HCl
3. Термично разлагане на киселинни соли:
Ca(HCO3 )2 → CaCO3 + CO2 − + H2 O
4. Взаимодействие на основната сол със съответната киселина: 2 FeOHSO4 + H2 SO4 → Fe2 (SO4 )3 + 2 H2 O
Степен на окисление
При класифициране на различни вещества, съставяне на формули на химични съединения и описание на техните свойства се използва характеристика на състоянието на атомите на елементите - степента на окисление. Степента на окисление е количествена характеристикасъстояние на атом на елемент в съединение.
Степента на окисление е условният заряд на атом в молекула на химично съединение, изчислен при предположението, че всички молекули на химично съединение се състоят от йони, т.е. общите електронни двойки отиват към най-електроотрицателния елемент.
Окислителното число може да бъде отрицателно число, положително число или нула. Окислителното число се обозначава с арабски цифри със знак (+) или (–) пред числото и се записва над символа на елемента във формулата на химичното съединение.
Отрицателната стойност на степента на окисление се приписва на атома, който е привлякъл електрони към себе си, и неговата стойност, равно на числотопривлечените електрони се отбелязва със знак (–).
Положителна стойностСтепента на окисление се определя от броя на електроните, извлечени от даден атом, и се отбелязва със знак (+).
При изчисляване на степента на окисление на атомите се използва следният набор от правила:
1) в молекулите на простите вещества степента на окисление на атома е нула;
2) водородът в съединения с неметали има степен на окисление (+1), с изключение на хидридите, в които степента на окисление на водорода е(–1);
3) кислородът във всички комплексни съединения има степен на окисление(–2), с изключение на OF2 и различни пероксидни съединения.
4) флуорът, като най-електроотрицателният елемент, има степен на окисление във всички съединения(–1);
5) халогените в съединения с водород и метали проявяват отрицателна степен на окисление(–1), а при кислорода е положителен, с изключение на флуора.
6) всички метали в техните съединения се характеризират само с положителни степени на окисление, включително алкалните метали имат степен на окисление (+1) иалкалоземни –
7) сумата от степените на окисление на всички атоми в една молекула е равна на нула, сумата от степени на окисление на всички атоми в сложен йон е равна на заряда на този йон.