Цели на урока:
- задълбочават и обобщават знанията за агрегатните състояния на материята, изучават в какви състояния могат да съществуват веществата.
Цели на урока:
Образователни - формулирайте представа за свойствата на твърди вещества, газове, течности.
Развиващи - развитие на речеви умения на учениците, анализ, изводи върху преминатия и изучен материал.
Образователни - внушаване на умствена работа, създаване на всички условия за повишаване на интереса към изучавания предмет.
Ключови термини:
Агрегатно състояние- това е състояние на материята, което се характеризира с определени качествени свойства: - способност или невъзможност за запазване на форма и обем; - наличие или липса на близък и далечен ред; - от други.
Фиг.6. Агрегатно състояние на вещество при промяна на температурата.
Когато веществото премине от твърдо състояние в течно състояние, това се нарича топене; обратният процес се нарича кристализация. Когато дадено вещество преминава от течност в газ, този процес се нарича изпаряване, а в течност от газ - кондензация. И преходът директно към газ от твърдо вещество, заобикаляйки течността, е сублимация, обратният процес е десублимация.
1.Кристализация; 2. Топене; 3. Кондензация; 4. Изпаряване;
5. Сублимация; 6. Десублимация.
Постоянно виждаме тези примери за преходи в Ежедневието. Когато ледът се топи, той се превръща във вода, а водата от своя страна се изпарява, създавайки пара. Ако го погледнем в обратната посока, парата, кондензирайки, започва да се превръща обратно във вода, а водата от своя страна замръзва и се превръща в лед. Миризмата на всяко твърдо тяло е сублимация. Някои молекули излизат от тялото и се образува газ, който отделя миризмата. Пример обратен процес– това е вътре зимно времешарки върху стъкло, когато парата във въздуха замръзне и се утаи върху стъклото.
Видеото показва промяна в агрегатното състояние на дадено вещество.
Контролен блок.
1. След замръзване водата се превърна в лед. Промениха ли се водните молекули?
2.Медицинският етер се използва на закрито. И поради това там обикновено мирише силно на него. В какво състояние е етерът?
3.Какво се случва с формата на течността?
4.Лед. Какво състояние на водата е това?
5. Какво се случва, когато водата замръзне?
Домашна работа.
Отговори на въпросите:
1. Възможно ли е да се напълни половината обем на съд с газ? Защо?
2. Могат ли азотът и кислородът да съществуват в течно състояние при стайна температура?
3. Могат ли желязото и живакът да съществуват в газообразно състояние при стайна температура?
4. В един мразовит зимен ден над реката се образува мъгла. Какво състояние на материята е това?
Ние вярваме, че материята има три агрегатни състояния. Всъщност има най-малко петнадесет от тях и списъкът с тези състояния продължава да расте всеки ден. Това са: аморфно твърдо тяло, твърдо тяло, неутрониева, кварк-глуонна плазма, силно симетрична материя, слабо симетрична материя, фермионен кондензат, кондензат на Бозе-Айнщайн и странна материя.
Веществата могат да бъдат в различни агрегатни състояния: твърди, течни, газообразни. Молекулните сили в различните агрегатни състояния са различни: в твърдо състояние те са най-големи, в газообразно състояние са най-малки. Разликата в молекулярните сили обяснява свойства, които се появяват в различни състояния на агрегиране:
В твърдите тела разстоянието между молекулите е малко и силите на взаимодействие преобладават. Следователно твърдите тела имат свойството да поддържат форма и обем. Молекулите на твърдите вещества са вътре постоянно движение, но всяка молекула се движи около равновесното си положение.
В течностите разстоянието между молекулите е по-голямо, което означава, че силата на взаимодействие е по-малка. Поради това течността запазва обема си, но лесно променя формата си.
В газовете силите на взаимодействие са много малки, тъй като разстоянието между газовите молекули е няколко десетки пъти по-голямо от размера на молекулите. Следователно газът заема целия предоставен му обем.
Преходи от едно състояние на материята в друго

Определение
Топене на материята$-$ преминаване на вещество от твърдо в течно състояние.
Този фазов преход винаги е придружен от поглъщане на енергия, т.е. към веществото трябва да се подаде топлина. В същото време вътрешната енергия на веществото се увеличава. Топенето става само при определена температура, наречена точка на топене. Всяко вещество има своя точка на топене. Например ледът има $t_(pl)=0^0\textrm(C)$.
Докато се топи, температурата на веществото не се променя.
Какво трябва да се направи, за да се стопи вещество с маса $m$? Първо, трябва да го загреете до температурата на топене $t_(melt)$, давайки количеството топлина $c(\cdot)m(\cdot)(\Delta)T$, където $c$ $-$ е специфичен топлинен капацитет на веществото. След това е необходимо да добавите количеството топлина $(\lambda)(\cdot)m$, където $\lambda$ $-$ специфична топлинаразтопяване на вещество. Самото топене ще се случи при постоянна температура, равна на точката на топене.
Определение
Кристализация (втвърдяване) на вещество$-$ преминаване на веществото от течно в твърдо състояние.
Това е обратният процес на топенето. Кристализацията винаги е придружена от освобождаване на енергия, т.е. топлината трябва да бъде отстранена от веществото. В този случай вътрешната енергия на веществото намалява. Това се случва само при определена температура, съвпадаща с точката на топене.
Докато настъпва кристализация, температурата на веществото не се променя.
Какво трябва да се направи, за да кристализира вещество с маса $m$? Първо, трябва да го охладите до температурата на топене $t_(melt)$, като премахнете количеството топлина $c(\cdot)m(\cdot)(\Delta)T$, където $c$ $-$ е специфичен топлинен капацитет на веществото. След това е необходимо да се премахне количеството топлина $(\lambda)(\cdot)m$, където $\lambda$ $-$ е специфичната топлина на топене на веществото. Кристализацията ще настъпи при постоянна температура, равна на точката на топене.
Определение
Изпаряване на вещество$-$ преминаване на веществото от течно в газообразно състояние.
Този фазов преход винаги е придружен от поглъщане на енергия, т.е. към веществото трябва да се подаде топлина. В същото време вътрешната енергия на веществото се увеличава.
Има два вида изпаряване: изпаряване и кипене.
Определение
Изпарение$-$ изпаряване от повърхността на течност, настъпващо при всяка температура.
Скоростта на изпарение зависи от:
температура;
площ;
вид течност;
вятър.
Определение
кипене$-$ изпаряване в целия обем течност, което се случва само при определена температура, наречена точка на кипене.
Всяко вещество има своя собствена точка на кипене. Например водата има $t_(кипяща)=100^0\textrm(C)$. Докато кипи, температурата на веществото не се променя.
Какво трябва да се направи, за да изкипи вещество с маса $m$? Първо трябва да го загреете до точката на кипене $t_(кипене)$, давайки количеството топлина $c(\cdot)m(\cdot)(\Delta)T$, където $c$ $-$ е специфичната топлинен капацитет на веществото. След това е необходимо да добавите количеството топлина $(L)(\cdot)m$, където $L$ $-$ е специфичната топлина на изпаряване на веществото. Самото кипене ще се случи при постоянна температура, равна на точката на кипене.
Определение
Кондензация на материята$-$ преминаване на вещество от газообразно състояние в течно състояние.
Това е обратният процес на изпаряване. Кондензацията винаги е придружена от освобождаване на енергия, т.е. топлината трябва да бъде отстранена от веществото. В този случай вътрешната енергия на веществото намалява. Това се случва само при определена температура, съвпадаща с точката на кипене.
Докато се получава кондензация, температурата на веществото не се променя.
Какво трябва да се направи, за да кондензира вещество с маса $m$? Първо трябва да го охладите до точката на кипене $t_(кипене)$, като премахнете количеството топлина $c(\cdot)m(\cdot)(\Delta)T$, където $c$ $-$ е специфичното топлинен капацитет на веществото. След това е необходимо да се премахне количеството топлина $(L)(\cdot)m$, където $L$ $-$ е специфичната топлина на изпаряване на веществото. Кондензация ще настъпи при постоянна температура, равна на точката на кипене.
ОПРЕДЕЛЕНИЕ
веществое съвкупност от голям брой частици (атоми, молекули или йони).
Веществата имат сложна структура. Частиците в материята взаимодействат една с друга. Характерът на взаимодействието на частиците в дадено вещество определя неговото агрегатно състояние.
Видове агрегатни състояния
Различават се следните агрегатни състояния: твърдо, течно, газообразно, плазмено.
В твърдо състояние частиците обикновено се комбинират в правилна геометрична структура. Енергията на връзката на частиците е по-голяма от енергията на техните топлинни вибрации.
Ако температурата на тялото се повиши, енергията на топлинните вибрации на частиците се увеличава. При определена температура енергията на топлинните вибрации става по-голяма от енергията на връзките. При тази температура връзките между частиците се разкъсват и се образуват отново. В този случай частиците изпълняват различни видоведвижения (трептения, ротации, движения едно спрямо друго и др.). В същото време те все още са в контакт помежду си. Правилната геометрична структура е нарушена. Веществото е в течно състояние.
При по-нататъшно повишаване на температурата топлинните флуктуации се засилват, връзките между частиците стават още по-слаби и практически липсват. Веществото е в газообразно състояние. Най-простият модел на материята е идеален газ, при който се смята, че частиците се движат свободно във всяка посока, взаимодействат помежду си само в момента на сблъсък и законите на еластичния удар са изпълнени.
Можем да заключим, че с повишаване на температурата веществото преминава от подредена структура в неподредено състояние.
Плазмата е газообразно вещество, състоящ се от смес от неутрални частици от йони и електрони.
Температура и налягане в различни агрегатни състояния
Различните състояния на агрегиране на дадено вещество се определят от температурата и налягането. Ниско кръвно налягане и топлинаотговарят на газове. При ниски температури, веществото обикновено е в твърдо състояние. Междинните температури се отнасят за вещества в течно състояние. За характеризиране на агрегатните състояния на дадено вещество често се използва фазова диаграма. Това е диаграма, показваща зависимостта на агрегатното състояние от налягането и температурата.
Основната характеристика на газовете е тяхната способност за разширяване и свиваемост. Газовете нямат форма, те приемат формата на съда, в който са поставени. Обемът на газа определя обема на контейнера. Газовете могат да се смесват един с друг във всякакви пропорции.
Течностите нямат форма, но имат обем. Течностите не се компресират добре, само при високо налягане.
Твърдите тела имат форма и обем. В твърдо състояние може да има съединения с метални, йонни и ковалентни връзки.
Примери за решаване на проблеми
ПРИМЕР 1
| Упражнение | Начертайте фазова диаграма на състоянията за някакво абстрактно вещество. Обяснете значението му. |
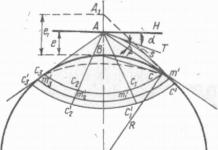
| Решение | Да направим рисунка. Диаграмата на състоянието е показана на фиг. 1. Състои се от три области, които съответстват на кристално (твърдо) състояние на материята, течно и газообразно състояние. Тези области са разделени от криви, които показват границите на взаимно обратни процеси: 01 - топене - кристализация; 02 - кипене - кондензация; 03 - сублимация - десублимация. Пресечната точка на всички криви (O) е тройна точка. В този момент едно вещество може да съществува в три агрегатни състояния. Ако температурата на веществото е над критичната температура () (точка 2), тогава кинетичната енергия на частиците е по-голяма от потенциалната енергия на тяхното взаимодействие; при такива температури веществото се превръща в газ при всяко налягане. От фазовата диаграма става ясно, че ако налягането е по-голямо от , то с повишаване на температурата твърдото вещество се топи. След топенето повишаването на налягането води до повишаване на точката на кипене. Ако налягането е по-малко от , тогава температурата се повишава твърдоводи до преминаването му директно в газообразно състояние (сублимация) (точка G). |
ПРИМЕР 2
| Упражнение | Обяснете какво отличава едно състояние на агрегиране от друго? |
| Решение | В различни състояния на агрегация атомите (молекулите) имат различно разположение. По този начин атомите (молекулите или йоните) на кристалните решетки са подредени по подреден начин и могат да извършват малки вибрации около равновесни позиции. Молекулите на газовете са в неподредено състояние и могат да се движат на значителни разстояния. Освен това вътрешната енергия на веществата в различни агрегатни състояния (за еднакви маси на веществото) при различни температури е различна. Процесите на преход от едно агрегатно състояние към друго са придружени от промяна на вътрешната енергия. Преходът: твърдо вещество - течност - газ означава увеличаване на вътрешната енергия, тъй като има увеличение на кинетичната енергия на движението на молекулите. |
: [в 30 тома] / гл. изд. А. М. Прохоров; 1969-1978, том 1).
Основи общо образование
линия UMKА. В. Перишкина. Физика (7-9)
Въведение: състояние на материята
Мистериозен Светътникога не спира да учудва. Кубче лед, хвърлено в чаша и оставено на стайна температура, ще се превърне в течност за няколко минути и ако оставите тази течност на перваза на прозореца за по-дълго време, тя напълно ще се изпари. Това е най-простият начин за наблюдение на преходи от едно състояние на материята в друго.Агрегатно състояние - състояние на вещество с определени свойства: способността да се поддържа форма и обем, да има ред на далечни или къси разстояния и други. Когато се промени състояние на материятаИма промяна във физическите свойства, както и плътността, ентропията и свободната енергия.
Как и защо се случват тези удивителни трансформации? За да разберете това, запомнете това всичко наоколо е съставено от. Атоми и молекули различни веществавзаимодействат помежду си и определящата е връзката между тях какво е агрегатното състояние на веществото?.
Има четири вида агрегатни вещества:
газообразен
Изглежда, че химията ни разкрива своите тайни в тези удивителни трансформации. Обаче не е така. Преходът от едно състояние на агрегиране в друго, както и дифузията, се отнася до физични явления, тъй като при тези превръщания не настъпват изменения в молекулите на веществото и се запазва химичният им състав.
Газообразно състояние
На молекулярно ниво газът се състои от хаотично движещи се молекули, които се сблъскват със стените на съда и една с друга, които практически не взаимодействат помежду си. Тъй като газовите молекули не са свързани помежду си, газът запълва целия предоставен му обем, взаимодействайки и променяйки посоката си само когато се удрят една в друга.
За съжаление е невъзможно да се видят газовите молекули с просто око или дори със светлинен микроскоп. Въпреки това можете да докоснете газта. Разбира се, ако просто се опитате да хванете летящи газови молекули в дланта на ръката си, тогава няма да успеете. Но вероятно всеки е виждал (или го е направил сам) как някой изпомпва въздух в автомобилна или велосипедна гума и от мека и набръчкана тя става напомпана и еластична. И очевидната „безтегловност“ на газовете ще бъде опровергана от опита, описан на страница 39 от учебника „Химия 7 клас“, редактиран от О.С. Габриелян.
Това се случва, защото в затворения ограничен обем на гумата навлизат голям брой молекули, които стават тесни и започват да се удрят по-често една в друга и в стените на гумата и в резултат на това общото въздействие на милиони молекули върху стените се възприема от нас като натиск.
Но ако газът заема целия предоставен му обем, защо тогава не лети в космоса и не се разпространява из цялата вселена, изпълвайки се междузвездно пространство? И така, нещо все още ли задържа и ограничава газовете в атмосферата на планетата?
Абсолютно прав. И този - сила земно притегляне . За да се откъснат от планетата и да отлетят, молекулите трябва да развият скорост, надвишаваща „скоростта на бягство“ или секунда евакуационна скорости по-голямата част от молекулите се движат много по-бавно.
Тогава възниква следващият въпрос: Защо молекулите на газа не падат на земята, а продължават да летят?Оказва се, благодарение на слънчева енергиявъздушните молекули имат значителен запас от кинетична енергия, което им позволява да се движат срещу силите на гравитацията.
Сборникът съдържа въпроси и задачи от различен тип: изчислителни, качествени и графични; технически, практически и исторически характер. Задачите са разпределени по теми в съответствие със структурата на учебника „Физика. 9 клас" от А. В. Перишкина, Е. М. Гутник и ви позволяват да изпълните изискванията, посочени от Федералния държавен образователен стандарт за метапредмет, предмет и лични резултатиобучение.
Течно състояние
Чрез повишаване на налягането и/или намаляване на температурата, газовете могат да бъдат превърнати в течно състояние. В зората на 19 век английският физик и химик Майкъл Фарадей успява да трансформира хлора и въглероден двуокис, като ги компресирате при много ниски температури. Някои от газовете обаче не се поддадоха на учените по това време и, както се оказа, проблемът не беше в недостатъчното налягане, а в невъзможността да се намали температурата до необходимия минимум.
Течността, за разлика от газа, заема определен обем, но също така приема формата на пълен контейнер под нивото на повърхността. Визуално течността може да бъде представена като кръгли мъниста или зърнени култури в буркан. Молекулите на течността са в тясно взаимодействие една с друга, но се движат свободно една спрямо друга.
Ако капка вода остане на повърхността, тя ще изчезне след известно време. Но помним, че благодарение на закона за запазване на масата-енергия нищо не изчезва или изчезва безследно. Течността ще се изпари, т.е. ще промени агрегатното си състояние на газообразно.
Изпарение - Това е процес на трансформиране на агрегатното състояние на вещество, при което молекули, чиято кинетична енергия надвишава потенциална енергиямеждумолекулно взаимодействие, издигане от повърхността на течност или твърдо вещество.
Изпарението от повърхността на твърдите тела се нарича сублимацияили сублимация. Повечето по прост начиннаблюдавайте сублимация е използването на нафталин за борба с молци. Ако помиришете течност или твърдо вещество, настъпва изпарение. В крайна сметка носът е това, което улавя ароматните молекули на веществото.
Течностите заобикалят хората навсякъде. Свойствата на течностите също са познати на всички - вискозитет и течливост. Когато става дума за формата на течността, много хора казват, че течността няма определена форма. Но това се случва само на Земята. Поради силата на гравитацията капка вода се деформира.
Мнозина обаче са виждали как астронавтите в условия на нулева гравитация хващат водни топки с различни размери. При липса на гравитация течността приема формата на сфера. И осигурява на течността сила със сферична форма повърхностно напрежение. Сапунените мехури са чудесен начин да се запознаете със силата на повърхностното напрежение на Земята.
Друго свойство на течността е вискозитетът. Вискозитетът зависи от налягането, химичен състави температура. Повечето течности се подчиняват на закона за вискозитета на Нютон, открит през 19 век. Съществуват обаче редица силно вискозни течности, които при определени условия започват да се държат като твърди вещества и не се подчиняват на закона на Нютон за вискозитета. Такива разтвори се наричат ненютонови течности. Най-простият пример за ненютонова течност е суспензия от нишесте във вода. Ако ненютонова течност бъде подложена на механични сили, течността ще започне да придобива свойствата на твърдите вещества и ще се държи като твърдо тяло.
В твърдо състояние
Ако в течност, за разлика от газ, молекулите вече не се движат хаотично, а около определени центрове, тогава в твърдо агрегатно състояниеатомите и молекулите имат ясна структура и изглеждат като войници на парад. И благодарение на кристалната решетка твърди веществазаемат определен обем и имат постоянна форма.
При определени условия веществата в агрегатно състояние на течност могат да се превърнат в твърди вещества, а твърдите вещества, напротив, при нагряване се стопяват и се превръщат в течност.
Това се случва, защото при нагряване вътрешната енергия се увеличава, съответно молекулите започват да се движат по-бързо и когато се достигне температурата на топене, кристалната решетка започва да се разпада и агрегатното състояние на веществото се променя. Повечето кристални телаобемът се увеличава по време на топене, но има изключения, например - лед, чугун.
В зависимост от вида на образуващите се частици кристална решеткатвърдо тяло, се отличава следната структура:
молекулярно,
метал.
За някои вещества промяна в агрегатните състояниявъзниква лесно, както например с вода; други вещества изискват специални условия (налягане, температура). Но в съвременна физикаУчените идентифицират друго независимо състояние на материята - плазмата.
плазма - йонизиран газ с еднаква плътност на положителни и отрицателни заряди. В живата природа плазмата се появява на слънце или по време на светкавица. Северното сияние и дори познатият огън, който ни топли с топлината си по време на излет сред природата, също принадлежат към плазмата.
Изкуствено създадената плазма добавя яркост към всеки град. Неоновите светлини са просто нискотемпературна плазма в стъклени тръби. Обичайните ни флуоресцентни лампи също са пълни с плазма.
Плазмата се дели на нискотемпературна - със степен на йонизация около 1% и температура до 100 хиляди градуса, и високотемпературна - йонизация около 100% и температура 100 милиона градуса (точно това е състоянието в които плазмата се намира в звездите).
Нискотемпературната плазма в обичайните ни флуоресцентни лампи се използва широко в ежедневието.
Високотемпературната плазма се използва в реакции на термоядрен синтез и учените не са загубили надежда да я използват като заместител атомна енергия, обаче контролът при тези реакции е много труден. И неконтролируема термоядрена реакциясе оказа оръжие с колосална мощ, когато СССР тества термоядрена бомба на 12 август 1953 г.
Купува
За да проверите разбирането на материала, предлагаме кратък тест.
1. Какво не се отнася за агрегатните състояния:
течност
светлина +
2. Вискозитетът на нютоновите течности се подчинява на:
Законът на Бойл-Мариот
Закон на Архимед
Законът на Нютон за вискозитета +
3. Защо земната атмосфера не излиза в открития космос:
защото газовите молекули не могат да достигнат скорост на бягство
тъй като молекулите на газа се влияят от силата на гравитацията +
и двата отговора са верни
4. Какво не се отнася за аморфните вещества:
- восък за запечатване
-
желязо +
5. При охлаждане обемът се увеличава при:
-
лед +