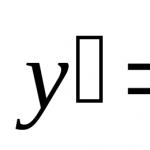Зависимостта на скоростта на химичната реакция от температурата се определя от правилото на Вант Хоф.
Холандският химик Вант Хоф Якоб Хендрик, основателят на стереохимията, стана първият носител на Нобелова награда за химия през 1901 г. Присъдена му е за откритието на законите на химичната динамика и осмотичното налягане. Вант Хоф въвежда идеи за пространствената структура на химичните вещества. Той беше убеден, че напредъкът във фундаменталните и приложните изследвания в химията може да бъде постигнат чрез физични и математически методи. Разработвайки теорията за скоростта на реакцията, той създава химическата кинетика.
Скорост на химична реакция

И така, кинетиката на химичните реакции е изследване на скоростта на протичане, какво химично взаимодействие възниква по време на реакционния процес и зависимостта на реакциите от различни фактори. Различните реакции имат различни скорости на възникване.
Скорост на химична реакцияпряко зависи от естеството на химикалите, влизащи в реакцията. Някои вещества, като NaOH и HCl, могат да реагират за части от секундата. А някои химични реакции продължават с години. Пример за такава реакция е ръждясването на желязото.
Скоростта на реакцията зависи и от концентрацията на реагентите. Колкото по-висока е концентрацията на реагентите, толкова по-висока е скоростта на реакцията. По време на реакцията концентрацията на реагентите намалява, следователно скоростта на реакцията се забавя. Тоест в началния момент скоростта винаги е по-висока, отколкото във всеки следващ момент.
V = (C край – от началото)/(t край – t начало)
Концентрациите на реагентите се определят на определени интервали от време.
Правилото на Вант Хоф

Важен фактор, от който зависи скоростта на реакциите, е температурата.
Всички молекули се сблъскват с други. Броят на ударите в секунда е много голям. Но въпреки това химичните реакции не протичат с голяма скорост. Това се случва, защото по време на реакцията молекулите трябва да се съберат в активиран комплекс. И само активни молекули, чиято кинетична енергия е достатъчна за това, могат да го образуват. При малък брой активни молекули реакцията протича бавно. С повишаване на температурата броят на активните молекули се увеличава. Следователно скоростта на реакция ще бъде по-висока.
Вант Хоф смята, че скоростта на химическата реакция е естествена промяна в концентрацията на реагиращите вещества за единица време. Но не винаги е еднообразна.
Правилото на Вант Хоф гласи това при всяко повишаване на температурата с 10° скоростта на химичната реакция се увеличава 2-4 пъти .
Математически правилото на Вант Хоф изглежда така:
![]()
Където V 2 t 2, А V 1 – скорост на реакция при температура t 1;
ɣ - температурен коефициент на скорост на реакцията. Този коефициент е съотношението на константите на скоростта при температура t+10И T.
Така че, ако ɣ = 3, а при 0 o C реакцията продължава 10 минути, тогава при 100 o C тя ще продължи само 0,01 секунди. Рязкото увеличаване на скоростта на химичната реакция се обяснява с увеличаване на броя на активните молекули с повишаване на температурата.
Правилото на Вант Хоф е приложимо само в температурния диапазон 10-400 o C. Реакциите, в които участват големи молекули, не се подчиняват на правилото на Вант Хоф.
приблизително правило, според което при повишаване на температурата с 10°C скоростта на химичната реакция се увеличава приблизително 2-4 пъти. Намерен от J. H. van't Hoff. Вижте Химическа кинетика.
- - правило, формулирано от Van't Hoff и допълнено от Арениус, което в биологична модификация гласи, че скоростта на метаболизма на организмите с повишаване на температурата с 10 ° може да бъде ...
Екологичен речник
- - индикатор, означен с "i", за увеличаване на броя на частиците на разтвореното вещество поради дисоциацията на молекулата на йони: i = 1 + α, където α е степента на дисоциация, k е броят на йони молекули, образувани по време на дисоциация...
Енциклопедичен речник по металургия
- - дървени кръгове, завързани за плащаниците. Работещият такелаж минава през дупките в тези кръгове и по този начин е защитен от триене в кожухите...
Морски речник
- - Якоб Хендрик, холандски химик, един от основателите на стереохимията, физическата химия. Формулира теория за пространственото разположение на атомите в молекулите...
Съвременна енциклопедия
- - Гофа, Хофа Алберт, немски хирург, ортопед. Автор на ръководства по ортопедична хирургия, фрактури и луксации, масажни техники, кинезитерапия, атлас на ортопедични превръзки и бандажи...
Голям енциклопедичен речник
- - "...опорен кабел: гъвкав носещ елемент на мостова система с въжени греди, предаващ сили от усилващата греда към пилона..." Източник: "SP 35.13330.2011. Кодекс на правилата. Мостове и тръби Актуализирано издание на SNiP 2.05...
Официална терминология
- - холандски учен; род. през 1852 г. в Ротердам; учи в Делфт, Лайден, Бон, Париж и Утрехт, първо беше професор в Утрехт, после в Амстердам, а след това поканен в Берлин...
- - хирург-ортопед; род. през 1859 г.; от 1897 г. професор във Вюрцбургския университет...
Енциклопедичен речник на Brockhaus и Euphron
- - хирург-ортопед, б. през 1859 г., от 1897 г. проф.
Енциклопедичен речник на Brockhaus и Euphron
- - Якоб Хендрик, холандски химик, един от основателите на съвременната физикохимия и стереохимия. През 1871 г. завършва Политехническото училище в Делфт, след което работи в Лайден, Бон и Париж...
- - осмотично налягане, определя налягането на молекулите на разтвореното вещество върху полупропускливата мембрана, която отделя разтвора от чистия разтворител и е непропусклива за разтвореното вещество...
Велика съветска енциклопедия
- - ...
Правописен речник-справочник
- - Vant-G"off, -a: zak"on Vant-G"...
Руски правописен речник
- - VANT * vente f. Разпродажба. Той Зола посочва техните купувачи като трима-четирима души: една графиня... клюкарка от провинцията, която се появява при всяка нова изява. Наблюдение 1883 12 1 224...
Исторически речник на галицизмите на руския език
- - Китайско заглавие, респ. на нашия "принц"...
- - Дървени блокове на търговски кораби, завързани за ванти...
Речник на чуждите думи на руския език
"Правилото на Вант Хоф" в книгите
Вант Хоф Якоб Хендрик (1852-1911) холандски физикохимик
От книгата Велики открития и хора автор Мартянова Людмила МихайловнаВан'т Хоф Якоб Хендрик (1852-1911) Холандски физикохимик Якоб Хендрик Ван'т Хоф е роден на 30 август 1852 г. в Ротердам (Холандия) в семейството на лекар и експерт по Шекспир Якоб Хендрик ван'т Хоф и Алида Якоба Колф, третото от седем деца. Мечтаеше за кариера на химик. въпреки това
Правило 13: Създайте отворено пространство. "Правилото на двете секунди"
От книгата 70 правила за защитно шофиране от Шалер РобъртПравило 13: Създайте отворено пространство. „Правилото на двете секунди“ Осигурете собствената си безопасност, като активно създавате свободно пространство около колата. Не им позволявайте да ограничават свободата ви на движение. Изобилието от свободно пространство дава допълнително време и
ЯКЪБ ХЕНРИК ВАНТ ХОФ (1852–1911)
От книгата Велики химици. В 2 тома Т. 2 автор Манолов КалоянДЖЕЙКОБ ХЕНРИК ВАНТ ХОФ (1852–1911) Беше топъл неделен ден, един от онези ясни пролетни дни, на които човек се радва толкова много след дълга, вече скучна зима. Пъпките на дърветата набъбнаха буквално пред очите ни, цветовете в градината магически се промениха. Дори сутрин паркът беше сив и неприветлив,
ДЖЕЙКЪБ ВАНТ ХОФ
От книгата 100 велики нобелови лауреати автор Муски Сергей АнатолиевичДЖЕЙКОБ ВАНТ ХОФ (1852-1911) Ван'т Хоф получава първата Нобелова награда за химия за откриването на законите на химичната динамика и осмотичното налягане. Тази висока награда отбеляза значението на една млада научна област - физичната химия.
Вант Хоф Джейкъб Хендрик
TSBзакон на Вант Хоф
От книгата Велика съветска енциклопедия (VA) на автора TSBПравилото на Вант Хоф
От книгата Велика съветска енциклопедия (VA) на автора TSBПравилото, като правило, както обикновено, както обикновено, както обикновено
От книгата Як говорим автор Антоненко-Давидович Борис ДмитровичБолест на Хоф
От книгата Голямо ръководство за масаж автор Васичкин Владимир ИвановичБолест на Хоф
От книгата Масаж. Уроци от велик майстор автор Васичкин Владимир ИвановичБолест на Hoffa. Хиперплазията на мастната тъкан под капачката на коляното се характеризира с лека болка по време на движение, болезненост при палпация и подуване отстрани на пателарния лигамент. Това заболяване най-често се наблюдава при спортисти. Впоследствие мастната тъкан се заменя
Правило за първо влизане и правило за родната държава
От книгата Как да пътуваме из Европа за 300 евро автор Ризо ЕленаПравилото за първо влизане и правилото на основната държава Колкото и мнения да има за така нареченото правило за първо влизане, когато пътувате през страните от Шенгенското пространство, все пак си струва да обърнете внимание на някои сериозни ограничения. И така, като получи Шенген
автор Александър Лопухин9. И те казват: "Кого иска да научи на знание? И кого да увещава с проповядване? Отбит от кърмата, отбит от майчините гърди? 10. Защото всичко е заповед върху заповед, заповед върху заповед, ред след ред, ред на линия, тук е малко, а там няма много." За изобличението на Исая
От книгата Обяснителната Библия. Том 5 автор Александър Лопухин13. И словото Господно стана към тях: заповед след заповед, заповед след заповед, ред след ред, ред след ред, тук малко, там малко, така че да отидат и да паднат назад и да бъдат счупени, и да бъдат уловен в мрежа и да бъде уловен. В словото на Господа – по-правилно: „със словото
Правило 100. Намерете ново правило всеки ден. Или поне го потърсете
От книгата Правилата на живота [Как да постигнем успех и да станем щастливи] от тамплиер РичардПравило 100. Намерете ново правило всеки ден. Или поне потърсете.Така се запознахме с 99 правила за успешен живот. Накрая. Не си мислете обаче, че това е всичко. Няма време за бездействане; за тези, които приемат тези правила, няма кафе паузи. Веднага след като вие
20. Видове фази в метални сплави. Фазово правило; правило за ливъридж
От книгата Материалознание. Детско легло автор Буслаева Елена Михайловна20. Видове фази в метални сплави. Фазово правило; правило на лоста Фазовата диаграма е графично представяне на състоянието на всяка сплав на изследваната система в зависимост от нейната концентрация и температура Изследването на всяка сплав започва с конструиране и анализ
Част I. Теория. обща химия
Разтвори и тяхното значение в жизнените процеси
1. Колигативни свойства на разредени разтвори на неелектролити. Закон на Раул: формулировки, формули за изчисление.
Неелектролитите са вещества, чиито водни разтвори и стопилки не провеждат електрически ток, тъй като техните молекули не се дисоциират на йони. Неелектролитите включват алкохоли, въглехидрати и др. В разреден разтвор на неелектролит броят на частиците съвпада с броя на молекулите. В този случай молекулите на разтвореното вещество практически не взаимодействат помежду си поради голямото разстояние между тях. Поведението на тези молекули в разтвор е подобно на поведението на молекулите на идеалния газ.Разредените разтвори на неелектролити, подобно на идеалните разредени разтвори, имат редица свойства (колигативни свойства), чието количествено изражение зависи само от броя на частиците на разтвореното вещество в разтвора и върху количеството разтворител.
Колигативните свойства на разтворите включват:
1) понижаване на налягането на наситените пари на разтворителя над разтвора,
2) понижаване на точката на замръзване и повишаване на точката на кипене на разтворите в сравнение с точките на замръзване и кипене на чистите разтворители.
3) осмотично налягане.
Закон на Раулописва връзката между налягането на наситените пари на разтворител над разтвор и концентрацията на разтвореното вещество . Парата, която е в равновесие с течността, се нарича наситена. Налягането на такава пара над чист разтворител (p 0) се нарича налягане на наситената пара или налягане на чист разтворител.
През 1886 (1887) Ф. М. Раулт формулира закона:
относителното намаление на налягането на наситените пари на разтворителя над разтвор на нелетливо вещество е равно на неговата молна част:
P o - налягане на наситените пари на разтворителя над разтворителя, P - налягане на наситените пари на разтворителя над разтвора, N - молна фракция на разтвореното вещество, n - количество на разтвореното вещество, n o - количество на разтворителя
2. Следствие от закона на Раул: намаляване на точката на замръзване на разтворите, повишаване на точката на кипене на разтворите.
Намаляването на точката на замръзване и повишаването на точката на кипене на разтворите в сравнение с тези за чист разтворител са пропорционални на моларната концентрация на разтвореното вещество:
където Δtкип – повишаване на температурата на кипене на разтвора, °C;
Δtzam – понижение на температурата на замръзване на разтвора, °C;
Ke – ебулиоскопска константа на разтворителя, (kg×°C)/mol; K e (H 2 O) = 0,52 kg∙K∙mol -1
Кк – криоскопична константа на разтворителя, (kg×°С)/mol; K k (H 2 O) = 1,86 kg∙K∙mol -1
b – молална концентрация, mol/kg;
ν(разтворители) – количество разтворено вещество, mol;
m(p-la) – маса на разтворителя, kg;
m(разтворено вещество) – масата на разтвореното вещество, g;
M(разтворено вещество) – моларна маса на разтвореното вещество, g/mol.
Познавайки точките на кипене и замръзване на чистите разтворители и Δt, можем да изчислим температурите на кипене и замръзване на разтворите:
tкип.(разтвор) = tкип.(разтвор) + Δtкип. tdet.(r-ra) = tdet.(r-l) – Δtdet.
Осмоза. Осмотичното налягане. Закон на Вант Хоф за неелектролитни разтвори.
Чрез осмозасе нарича еднопосочно проникване на молекули на разтворителя (дифузия) през полупропусклива мембрана от разтворител в разтвор или от разтвор с по-ниска концентрация към разтвор с по-висока концентрация. Осмозата е спонтанен процес.
Пример: Ако чаша с чист разтворител и чаша с разтвор на някакво нелетливо вещество се поставят в затворен стъклен съд (нивата на течностите в съдовете са еднакви), то след известно време нивото на течността в първата чаша ще намалее, а нивото на разтвора във втората чаша ще се увеличи. В този случай разтворителят преминава от първото стъкло към второто стъкло, което се дължи (според закона на Раулт) на по-ниското налягане на парите на разтворителя над разтвора, отколкото над чистия разтворител. В този случай въздушното пространство между разтворителя и разтвора действа като полупропусклива мембрана.
Осмотичното налягане- силата, която предизвиква осмоза. То е равно на външното налягане, при което осмозата очевидно спира.
Закон на Вант Хоф. Осмотичното налягане на разтвора е равно на налягането на газа, което би произвело разтвореното вещество, ако беше в газообразно състояние и заемаше обем, равен на обема на разтвора. Осмотичното налягане на разтвора е право пропорционално на моларната концентрация на разтвореното вещество.
където Rosm е осмотичното налягане, kPa;
с – моларна концентрация на разтвореното вещество, mol/l;
R – универсална газова константа, 8.314 J/(mol×K);
T – абсолютна температура, K;
V(разтвор) – обем на разтвора, l.
Законът за действието на масите установява връзката между масите на реагиращите вещества в химичните реакции в равновесие. Законът за масовото действие е формулиран през 1864-1867 г. К. Гулдберг и П. Вааге. Според този закон скоростта, с която веществата реагират едно с друго, зависи от тяхната концентрация. Законът за действието на масите се използва при различни изчисления на химични процеси. Позволява да се реши въпросът в каква посока е възможно спонтанното протичане на разглежданата реакция при дадено съотношение на концентрациите на реагиращите вещества, какъв добив на желания продукт може да се получи.
Въпрос 18. Правилото на Вант Хоф.
Правилото на Вант Хоф е емпирично правило, което позволява, като първо приближение, да се оцени влиянието на температурата върху скоростта на химичната реакция в малък температурен диапазон (обикновено от 0 °C до 100 °C). Вант Хоф, базирайки се на много експерименти, формулира следното правило: с всяко повишаване на температурата с 10 градуса константата на скоростта на хомогенна елементарна реакция се увеличава два до четири пъти. Уравнението, което описва това правило е:
V = V0 * Y(T2 − T1) / 10
където V е скоростта на реакцията при дадена температура (T2), V0 е скоростта на реакцията при температура T1, Y е температурният коефициент на реакцията (ако е равен на 2, например, тогава скоростта на реакцията ще се увеличи 2 пъти когато температурата се повиши с 10 градуса).
Трябва да се помни, че правилото на Вант Хоф има ограничен обхват на приложимост. Много реакции не му се подчиняват, например реакции, протичащи при високи температури, много бързи и много бавни реакции. Правилото на Вант Хоф също не се прилага за реакции, включващи обемисти молекули, като протеини в биологични системи. Температурната зависимост на скоростта на реакцията се описва по-правилно от уравнението на Арениус.
V = V0 * Y(T2 − T1) / 10
Въпрос 19. Енергия на активиране.
Активираща енергияв химията и биологията, минималното количество енергия, което трябва да се достави на системата (в химията, изразено в джаули на мол), за да настъпи реакция. Терминът е въведен от Сванте Август Арениус през 1889 г. Типично обозначение за реакционната енергия е Ea.
Енергията на активиране във физиката е минималното количество енергия, което трябва да получат електроните на донорен примес, за да влязат в зоната на проводимост.
В химичния модел, известен като Теорията на активните сблъсъци (TAC), има три условия, необходими за възникване на реакция:
Молекулите трябва да се сблъскат. Това е важно условие, но не е достатъчно, тъй като сблъсъкът не предизвиква непременно реакция.
Молекулите трябва да имат необходимата енергия (енергия на активиране). По време на химическа реакция взаимодействащите молекули трябва да преминат през междинно състояние, което може да има по-висока енергия. Тоест, молекулите трябва да преодолеят енергийна бариера; ако това не се случи, реакцията няма да започне.
Молекулите трябва да са правилно ориентирани една спрямо друга.
При ниска (за определена реакция) температура повечето молекули имат енергия по-малка от енергията на активиране и не са в състояние да преодолеят енергийната бариера. В едно вещество обаче винаги ще има отделни молекули, чиято енергия е значително по-висока от средната. Дори при ниски температури повечето реакции продължават да протичат. Повишаването на температурата ви позволява да увеличите дела на молекулите с достатъчна енергия за преодоляване на енергийната бариера. Това увеличава скоростта на реакцията.
Математическо описание
Уравнението на Арениус установява връзката между енергията на активиране и скоростта на реакцията:
k е константата на скоростта на реакцията, A е честотният фактор за реакцията, R е универсалната газова константа, T е температурата в келвини.
С повишаването на температурата вероятността за преодоляване на енергийната бариера се увеличава. Основно правило: повишаване на температурата с 10K удвоява скоростта на реакцията
Преходно състояние
Връзката между енергията на активиране (Ea) и енталпията (ентропията) на реакцията (ΔH) в присъствието и отсъствието на катализатор. Най-високата точка на енергия представлява енергийна бариера. В присъствието на катализатор е необходима по-малко енергия за започване на реакция.
Преходното състояние е състояние на система, в което разрушаването и създаването на връзка са балансирани. Системата е в преходно състояние за кратко време (10-15 s). Енергията, която трябва да бъде изразходвана, за да доведе системата в преходно състояние, се нарича енергия на активиране. При многоетапни реакции, които включват няколко преходни състояния, енергията на активиране съответства на най-високата енергийна стойност. След преодоляване на преходното състояние молекулите отново се разпръскват с разрушаване на стари връзки и образуване на нови или с трансформация на първоначалните връзки. И двата варианта са възможни, тъй като възникват с освобождаване на енергия (това се вижда ясно на фигурата, тъй като и двете позиции са енергийно по-ниски от енергията на активиране). Има вещества, които могат да намалят енергията на активиране на дадена реакция. Такива вещества се наричат катализатори. Биолозите наричат такива вещества ензими. Интересното е, че по този начин катализаторите ускоряват реакцията, без самите те да участват в нея.
Правилото на Вант Хоф.Почти всички химични реакции протичат по-бързо с повишаване на температурата. Зависимостта на скоростта на реакцията от температурата се описва с уравнението на Арениус:
к = Ад –Еа/ RT, Където к – константа на скоростта на реакцията, А – константа, независима от температурата (нарича се предекспоненциален фактор), дА – активираща енергия, Р – газова константа, T – абсолютна температура. В училищните учебници зависимостта на скоростта на реакцията от температурата се определя в съответствие с така нареченото „правило на Ван Хоф“, което през 19 век. формулиран от холандския химик Якоб ван'т Хоф. Това е чисто емпирично правило, т.е. правило, основано не на теория, а извлечено от експериментални данни. Според това правило повишаване на температурата с 10° води до увеличение на скоростта с 2 – 4 пъти. Математически тази връзка може да се изрази с уравнението v 2 v 1 = g ( T 2 – T 1)/10, където v 1 и v 2 – скорости на реакция при температури T 1 и T 2 ; количеството g се нарича температурен коефициент на реакцията. Например, ако g = 2, тогава кога T 2 – T 1 = 50 o v 2 /v 1 = 2 5 = 32, т.е. реакцията се ускори 32 пъти и това ускорение не зависи по никакъв начин от абсолютни стойности T 1 и T 2, но само по тяхната разлика.
От уравнението на Арениус обаче следва, че температурният коефициент на реакцията зависи както от енергията на активиране, така и от абсолютната температура. За дадена реакция с определена стойност ди ускорението с повишаване на температурата с 10° ще бъде по-голямо, колкото по-ниска е температурата. Това е почти очевидно дори без изчисления: повишаването на температурата от 0 до 10 ° C трябва да повлияе на скоростта на реакцията много повече от същото повишаване на температурата, например от 500 до 510 ° C.
От друга страна, за даден температурен диапазон, ускоряването на реакцията ще бъде толкова по-силно, колкото по-голяма е нейната енергия на активиране. Така че, ако енергията на активиране на реакцията е ниска, тогава такава реакция протича много бързо и с повишаване на температурата с 10 ° C нейната скорост почти не се променя. За такива реакции температурният коефициент е много по-малък от 2. За реакции с висока енергия на активиране, които протичат бавно при ниски температури, ускорението с повишаване на температурата с 10 ° C може значително да надвишава 4 пъти.
Например, реакцията на въглероден диоксид с алкален разтвор за образуване на бикарбонатен йон (CO 2 + OH® HCO 3 –) има енергия на активиране от 38,2 kJ/mol, следователно, когато температурата се повиши, например, от 50 на 60 °C, тази реакция ще се ускори само 1,5 пъти. В същото време реакцията на разлагане на етилбромид в етилен и бромоводород (C 2 H 5 Br ® C 2 H 4 + HBr) с енергия на активиране от 218 kJ/mol ще се ускори с повишаване на температурата от 100 до 110 o C с 6,3 пъти (въпреки че в този температурен диапазон реакцията протича много бавно). Кинетиката на реакцията на водородни атоми с етан H + C 2 H 6 ® H 2 + C 2 H 5 е изследвана в широк температурен диапазон - от 300 до 1100 K (27–827 ° C). За тази реакция д a = 40,6 kJ/mol. Следователно повишаването на температурата с 10 ° ще доведе до увеличаване на скоростта на реакцията с коефициент 1,7 в диапазона от 300–310 К и само с коефициент 1,04 в диапазона от 1090–1100 К. Така че при високи температури , скоростта на тази реакция практически не зависи от температурата. А за реакцията на добавяне на водороден атом към двойната връзка H + C 2 H 4 ® C 2 H 5 енергията на активиране е ниска ( д a = 3,4 kJ/mol, така че неговата скорост зависи слабо от температурата в широк температурен диапазон. И само при температури, много по-ниски от 0° C, наличието на активираща бариера започва да има ефект.
Има много подобни примери. Очевидно е, че правилото на Вант Хоф противоречи не само на уравнението на Арениус, но и на много експериментални данни. Откъде идва и защо често се изпълнява?
Ако в горния математически израз за правилото на Вант Хоф заместим вместо скорости v 1 и v 2 за дадена реакция на тяхната зависимост от температурата, в съответствие с уравнението на Арениус, тогава след намаляване на предекспоненциалните фактори получаваме следния израз: g = срещу Т+10/срещу Т= д –ЕА/ Р(T+10)/e –ЕА/ RT= e ( дА/ Р) . Вземането на логаритъм на това уравнение дава: lng = ( д A / Р), където да = Р lng T(T+ 10)/10 = 0,83 lng T(T+ 10). Енергията на активиране не е функция на температурата; тази зависимост е необходима само за удобство на последващия анализ. Последно уравнение – Това е уравнение на парабола, в което само положителните стойности имат физическо значение. Съответната диаграма е ограничена от два клона на параболата: за g = 2 получаваме да = 0,58 T(T+ 10), с g = 4 получаваме да = 1,16 T(T+ 10). Стигаме до същите формули, когато използваме десетични логаритми. Съответните графики на две параболи за стойности на g 2 и 4 са показани на фигурата. Техният физически смисъл е, че областта, в която е изпълнено правилото на Вант Хоф, съответства само на областта между параболите. По този начин съществуват само определени връзки между енергията на активиране на реакцията и нейната температура, при които правилото на Вант Хоф е изпълнено. Под долния клон температурният коефициент g< 2, тогда как выше верхней ветви g > 4.
Ако погледнете кои реакции се „вписват“ в посочената доста тясна област, се оказва, че всички тези реакции не протичат нито твърде бързо, нито твърде бавно, а с удобна за измерване скорост (при дадена температура). Скоростта на само такива реакции може да бъде изследвана от химиците по времето на Вант Хоф. Например, ако енергията на активиране е ниска (по-малко от 50 kJ/mol), тогава такава реакция при стайна температура е завършена за 1 – 2 секунди; следователно, за да се изследва неговата кинетика, беше необходимо значително да се понижи температурата, така че реакцията да се проведе не по-бързо от 10 – 20 минути. Само в този случай химиците от 19 век. имаха време да вземат проби по време на реакцията и да анализират промяната в концентрацията на реагентите в тях. По това време нямаше други начини за изследване на скоростта на реакция. Ако това не успее (например водният разтвор замръзне), тогава скоростта на такава реакция не е изследвана. Ако енергията на активиране на реакцията е висока и тя протича твърде бавно при стайна температура (много дни или дори седмици), тогава температурата се повишава, така че реакцията да протича със скорост, удобна за измерване. И тук имаше някои ограничения - например разтворът можеше да заври, т.е. във всеки случай, изследователите всъщност „приспособяват“ реакцията, която се изучава, към региона между двете параболи.
Сега химиците имат възможност, използвайки различни инструменти, да изследват експериментално както много бързи (протичащи в областта на микросекундата), така и много бавни реакции, за които температурният коефициент може да бъде значително по-малък от 2 или значително по-голям от 4. Следователно ванът Правилото на Хоф, което, за разлика от уравнението на Арениус, няма ясно физическо значение, е от чисто исторически интерес и не се използва в съвременната наука. В по-голямата част от учебниците и монографиите по химична кинетика, както и в 5-тома Химическа енциклопедиятова правило дори не се споменава. И въпреки това, ако изследваната реакция протича с удобна за измерване скорост, например, тя завършва след 30 – 40 минути и енергията му на активиране все още не е измерена, тогава за предварителна груба оценка на зависимостта на скоростта на такава реакция от температурата може да се използва правилото на Ван Хоф. Следователно това правило е дадено във всички училищни учебници по химия.
Иля Леенсън