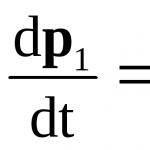Захарозата е дизахарид C 12 H 22 O 11. Това е нередуциращо вещество, което не реагира с течността за обпилване. Захарозата се хидролизира от ензима захараза (инвертаза). Реакцията включва добавяне на вода и образуване на молекули на глюкоза и фруктоза, които са редуциращи захари и могат да бъдат открити чрез реакция с фелингова течност.
C 12 H 22 O 11 + H 2 O = C 6 H 12 O 6 + C 6 H 12 O 6
захароза глюкоза фруктоза
Най-активната захароза се съдържа в клетките на дрождите, от които е лесно да се получи. Активността на захарозата може лесно да се следи чрез количеството продукти на хидролизата, образувани за определено време, които се откриват с помощта на течност за фелинг. Определянето се извършва чрез количеството хидролизиран разтвор, което трябва да се добави към течността за оплетване, така че да изпадне утайка от меден оксид.
Скоростта на хидролизата на захарозата зависи от външни условия(температура, катализатор, реакция на околната среда).
Оборудване:
епруветки
молив върху стъкло
мерителна пипета 1-2 мл
10 ml градуиран цилиндър
водна баня
лабораторен термометър за температурен диапазон 50 – 100 °C
пясъчен часовник за 10 минути или всеки друг часовник.
Напредък:
Подгответе таблица 5, за да запишете плана на експеримента и резултатите от експеримента. Подгответе и маркирайте три епруветки, налейте в тях 10 ml 20% разтвор на захароза.
Изсипете захароза в епруветки необходимо количествовода, 0,1 N разтвор на HCl или 0,1 N разтвор на NaOH.
Добавете необходимото количество ензим или неорганичен катализатор (солна киселина) към епруветките, разбъркайте добре и оставете епруветките за 40-50 минути.
Пригответе три епруветки с разтвор на фелинг течност (FL): налейте 2 ml FL и дестилирана вода във всяка от трите епруветки. След изтичане на времето се определя активността на сукраза или неорганичен катализатор, както следва: последователно се наливат капки течност от тестовите разтвори в три епруветки с разтвор на FF, загрят до кипене, докато разтворът на FF стане напълно червен. Въведете броя на капките от експерименталния разтвор в Таблица 5.
Сравнете резултатите за отделните експериментални варианти и направете заключения за влиянието на изследваните условия върху скоростта на хидролизата на захарозата.
Таблица 5.- Въздействие различни условияна скоростта на реакция
| Не. | опция | № относно етикетите * | Добавете към 10 ml захароза, ml | катализатор | Експериментални условия (t°C, pH) | Броят на капките от тестовия разтвор, които са реагирали с VF | |||
| вода | 0,1 n. НС1 | 0,1 n. NaOH | |||||||
| Ефект на температурата | ензим 1 мл | 18-20°С | |||||||
| ензим 1 мл | 40-45°С | ||||||||
| ензим 1 мл | 100°С | ||||||||
| Влияние на температурата върху неорганичен катализатор | HCl 2 капки | 18-20°С | |||||||
| HCl 2 капки | 40-45°С | ||||||||
| HCl 2 капки | 100°С | ||||||||
| Влияние на pH на средата | ензим 1 мл | 40-45°C (pH 4,5) | |||||||
| ензим 1 мл | 40-45°C (pH 6,5) | ||||||||
| ензим 1 мл | 40-45°C (pH 7,5) | ||||||||
| Ефект на количеството ензим | ензим 1 мл | 40-45°С | |||||||
| ензим 2мл | 40-45°С | ||||||||
| ензим 4 мл | 40-45°С | ||||||||
Контролни въпроси:
1. Как можете да откриете наличието на редуциращи захари?
2. Какво представлява ензимната хидролиза?
3. Какви условия ще повлияят на скоростта на хидролизата?
4. Количествено определяне на редуциращи захари.Ускорен метод за определяне на масовата част на общата захар
Методът се основава на окисляването на всички захари със сулфатен разтвор на калиев дихромат до въглероден диоксид и вода и колориметрията на получения Cr +3 йон, еквивалентен на количеството захар, което е реагирало.
Оборудване:
водна баня
лабораторна филтърна хартия
лабораторни везни с общо предназначение
мерителни колби
фотоелектрически колориметър
ексикатор
Напредък:
Приготвяне на сулфатен разтвор на калиев дихромат
49 g калиев дихромат се разтварят в 300 cm 3 дестилирана вода (първи разтвор). Отделно, 300 cm 3 концентрирана сярна киселина се добавя внимателно към 300 cm 3 дестилирана вода на малки порции при разбъркване и се охлажда (втори разтвор). Първо, първият и след това вторият разтвор внимателно се изсипват в мерителна колба от 1000 cm3, охлаждат се до стайна температура, регулират се до марката с дестилирана вода и се смесват.
Графиката за калибриране се изгражда не по-рано от 24 часа след приготвянето на реактива.
Приготвяне на стандартен разтвор на захароза
1,0 g захароза или рафинирана захар, предварително изсушени в ексикатор в продължение на 3 дни, се претеглят с грешка не повече от 0,001 g, разтварят се в дестилирана вода и се прехвърлят количествено в мерителна колба с вместимост 250 cm 3. Обемът на разтвора се довежда до марката с дестилирана вода и се разбърква старателно. Полученият разтвор трябва да съдържа 4 mg захароза на 1 cm3. Разтворът на захарозата се приготвя непосредствено преди употреба.
Изграждане на калибровъчна графика
В пет мерителни колби с вместимост 100 cm3 всяка, добавете 25 cm3 разтвор на сулфат на калиев дихромат, като използвате градуиран цилиндър, след което отпипетирайте 2, 4, 6, 8, 10 cm3 стандартен разтвор на захароза и 23, 21, 19 , 17, 15 cm дестилирана вода, така че обемът във всяка колба да достигне 50 cm 3. Колбите със съдържанието се поставят във вряща водна баня за 10 минути, охлаждат се до стайна температура, обемът се довежда до марката с дестилирана вода, разбърква се старателно и оптичната плътност се измерва на фотоелектроколориметър със светлинен филтър с максимална пропускане на светлина при λ = 630-670 μm (при FEK-56 и KFK-2 това съответства на червен филтър и 30 mm кювета).
Във всеки разтвор се измерва оптичната плътност най-малко 3 пъти и от получените данни се взема средно аритметичното.
Въз основа на получените данни се изгражда калибрираща графика, нанасяйки стойностите на оптичната плътност на ординатната ос и масата на захарозата в милиграми, съответстваща на тези стойности на абсцисната ос. За определяне на общата захар се използва калибровъчна графика.
Анализ на резултатите:
Проба от натрошения тестов продукт се претегля с грешка не повече от 0,001 g по такъв начин, че да има 0,004 g обща захар в 1 cm 3 разтвор.
Тегло на теглича (T) в грамове се определя по формулата:
m= 0.004V/P *100,
където 0,004 е оптималната концентрация на редуциращи вещества в разтвора на пробата, g/cm3;
V е капацитетът на мерителната колба, cm 3;
R -оценена масова част от общата захар в изследвания продукт, %.
В мерителна колба с вместимост 100 cm 3 добавете 25 cm 3 сулфатен разтвор на калиев бихромат, 10 cm 3 от филтрата на тестовия разтвор и 15 cm 3 дестилирана вода, като използвате градуиран цилиндър. Колбата се поставя в кипяща водна баня за 10 минути, охлажда се до стайна температура, регулира се обемът до марката с дестилирана вода, разбърква се старателно и се измерва оптичната плътност. Въз основа на стойността на оптичната плътност и калибровъчната графика се намира съответното количество обща захар, условно изразено в захароза.
Масова частобщата захар (X 1) като процент, изразена в захароза, се определя по формулата
X 1 =m 1 VK100/mV 1 1000,
където m - тегло на пробата от продукта, g;
m 1 - масата на захарозата, получена съгласно графиката за калибриране, mg;
V е капацитетът на мерителната колба, cm;
V 1 - обем на тестовия разтвор, взет за анализ, cm;
1000 е коефициентът на преобразуване от милиграми захароза в грамове;
ДА СЕ -корекционният коефициент, отчитащ окисляването на декстрини (за продукти, съдържащи меласа), се определя съгласно таблица 6.
Таблица 6. - Коефициент на корекция, отчитащ окисляването на декстрините
| Съотношение на съдържанието на меласа към общото съдържание на захар.% | Коефициент на корекция ДА СЕ |
| 2-5 6-10 11-15 16-20 21-30 | 0.96 0.94 0.92 0.90 0.88 |
Масовата част на общата захар (X 2) като процент, изчислена върху сухо вещество, се определя по формулата
X 2 = X 1 100/100-W,
Където W-масова част на влагата в изследвания продукт, %.
Крайният резултат от анализа се приема като средноаритметично от резултатите от две паралелни определения, допустимите разлики между които в една лаборатория не трябва да надвишават 0,5% по абсолютна стойност, а тези, извършени в различни лаборатории - 1,0%.
Граници на допустимите стойности на грешка при измерване ±1,0% с доверителна вероятност Р=0.95.
Резултатът от изчисленията се закръгля до първия знак след десетичната запетая.
Учените са доказали, че захарозата е част от всички растения, включително големи количестванамира се в потребителски продукти като захарно цвекло и тръстика. Ролята на захарозата в храненето на всеки човек е доста голяма.
Захарозата е дизахарид (част от класа олигозахариди), който под действието на ензима захароза или под въздействието на киселина се хидролизира до глюкоза (всички основни полизахариди се състоят от нея) и фруктоза (плодова захар), по-точно , молекулата на захарозата се състои от остатъци от D-фруктоза и D-глюкоза. Основният достъпен за всички продукт, който служи като източник на захароза, е обикновената захар.
В химията молекулата на захарозата се изписва със следната формула - C 12 H 22 O 11 и е изомер.
Хидролиза на захароза

C 12 H 22 O 11 + H 2 O → C 6 H 12 O 6 + C 6 H 12 O 6
Захарозата е най-важният от дизахаридите. Както се вижда от захарозата води до образуването на елементи като глюкоза и фруктоза. Техните молекулни формули са еднакви, но структурните им формули са напълно различни:
CH 2 (OH) - (CHOH) 4 - SON - глюкоза.
CH 2 - CH - CH - CH -C - CH 2 - фруктоза
Физични свойства на захарозата
- Захарозата е безцветен вкус, който се разтваря добре във вода.
- 160 °C е температурната характеристика на топенето на захарозата.
- Карамелът е аморфна прозрачна маса, която се образува при втвърдяване на разтопената захароза.
Химични свойства на захарозата

- Захарозата не е алдехид.
- Захарозата е най-важният дизахарид.
- Когато се нагрява с разтвор на амоняк, Ag 2 O не произвежда така нареченото "сребърно огледало", точно както при нагряване с Cu (OH) 2 не образува червен меден оксид.
- Ако кипнете разтвор на захароза с 2-3 капки сярна киселина или след това го неутрализирате с алкали и след това загреете получения разтвор с Cu (OH) 2, ще се образува червена утайка.
Състав на захароза
Молекулата на захарозата, както е известно, се състои от остатъци от фруктоза и глюкоза, които са тясно свързани помежду си. Сред изомерите, които имат молекулна формула C 12 H 22 O 11, се разграничават следните: и, разбира се,
Храни, които са богати на захароза

Ефектът на захарозата върху човешкото тяло
Захарозата осигурява на човешкото тяло енергията, необходима за пълното му функциониране. Освен това подобрява мозъчната дейност на човека и стимулира защитните функции на черния дроб от въздействието на токсични вещества. Подпомага поддържането на живота на набраздените мускули и нервните клетки. Ето защо захарозата е едно от най-важните вещества, съдържащи се в почти всички продукти за човешка консумация.
При липса на захароза човек изпитва следните състояния: депресия, раздразнителност, апатия, липса на енергия, липса на сила. Това състояние може постоянно да се влошава, ако съдържанието на захароза в тялото не се нормализира навреме. Излишъкът от захароза води до: кариес, прекомерна пълнота, пародонтоза, възпалителни заболявания на устната кухина, възможно развитие на кандидоза и сърбеж на половите органи, съществува риск от развитие на диабет.
Нуждата от захароза се увеличава в случаите, когато човешкият мозък е претоварен в резултат на интензивна дейност и (или) когато човешкото тяло е изложено на тежки токсични ефекти. Нуждата от консумация на захароза рязко намалява, ако човек има диабет или наднормено тегло.
Ефектът на фруктозата и глюкозата върху човешкото тяло

Както се оказа по-рано, в резултат на взаимодействието "захароза - вода" се образуват елементи като фруктоза и глюкоза. Нека разгледаме основните характеристики на тези вещества и как тези елементи влияят на човешкия живот.
Фруктозата, вид захарна молекула, открита в пресните плодове, им придава тяхната сладост. В резултат на това мнозина смятат, че фруктозата е най-полезна, защото... е естествен компонент. Фруктозата също има минимален ефект върху нивата на глюкозата (тъй като има нисък гликемичен индекс).
Самата фруктоза обаче е много сладка, познати на човекаплодовете съдържат относително малки количества. В резултат на това в тялото ни влиза малко количество захар, което се преработва много бързо. Въпреки това, не трябва да въвеждате големи количества фруктоза в тялото, т.к Прекомерната консумация може да доведе до последствия като затлъстяване, цироза (белези на черния дроб), подагра и сърдечни заболявания (повишени нива на пикочна киселина), затлъстяване на черния дроб и, разбира се, преждевременно стареене на кожата, което води до бръчки.
В резултат на изследвания учените стигнаха до извода, че фруктозата, за разлика от глюкозата, натрупва признаци на стареене много по-бързо. Какво можем да кажем за заместителите на фруктозата?
Въз основа на материала, предложен по-рано, можем да заключим, че яденето на разумно количество плодове е полезно за човешкото здраве, тъй като те съдържат минимално количествофруктоза. Но концентрираната фруктоза трябва да се избягва, тъй като може да доведе до истинско заболяване.
Глюкозата - подобно на фруктозата, е една от и е форма на въглехидратите - най-често срещаната форма. направен от нишесте, той бързо повишава нивата на кръвната захар и снабдява тялото ни с енергия за доста дълъг период от време.
Постоянното ядене на силно преработени храни или прости нишестета, като бял ориз или бяло брашно, ще доведе до значително повишаване на нивата на кръвната Ви захар. И резултатът от това ще бъдат определени проблеми, като намаляване на защитните сили на организма, което води до лошо заздравяване на рани, бъбречна недостатъчност, увреждане на нервите, повишени нива на липиди в кръвта, риск на нервни заболявания (периферен отдел), затлъстяване, както и появата на инфаркт и (или) инсулт.

Изкуствени подсладители - вреда или полза
Много хора, които се страхуват да консумират глюкоза или фруктоза, се обръщат към изкуствени подсладители като аспарт или сукрапоза. Те обаче имат и своите недостатъци. Тъй като тези вещества са създадени от човека химични невротоксични вещества, заместителите могат да причинят главоболие и също така представляват висок риск от рак. Следователно тази опция, както и предишните, не е 100%.
всичко Светътзасяга човешкия организъм и никой от нас не може да се предпази от всички болести. Въпреки това, въз основа на известни знания, можем да контролираме процесите на възникване на определени заболявания. Същото важи и за употребата на захароза: не трябва да я пренебрегвате, както трябва да я използвате постоянно. Трябва да намерите „златна“ среда и да се придържате към най-добрите опции. Опции, които ще накарат тялото ви да се почувства страхотно и много ви благодаря! Затова изберете какъв тип захар да използвате и грейте с енергия през целия ден.
Захароза – органично съединение, който е дизахарид. Молекулата му се състои от остатъци d-глюкоза и d-фруктоза. Какво е хидролиза на захароза и какви вещества се образуват по време на тази реакция?
Обща характеристика на захарозата
Захарозата е вещество, принадлежащо към класа на въглехидратите. Счита се за дизахарид, тъй като се състои от два монозахарида: фруктоза и глюкоза.Естествено се намира в много плодове, зеленчуци и горски плодове. Той е особено изобилен в захарното цвекло и захарната тръстика. от външен видпредставлява безцветни кристали, които при разтопяване се превръщат в карамел. Точката на топене е 186 градуса. Захарозата е силно разтворима във вода и етанол, но слабо разтворима в метанол и напълно неразтворима в диетилов етер.

Ориз. 1. Захароза - безцветни кристали.
Химическата формула на захарозата е следната: C 12 H 22 O 11.

Ориз. 2. Структурна формулазахароза.
Химичните характеристики на захарозата са, че тя не проявява редуциращи свойства и не проявява свойствата на алдехиди и кетони.
Захарозата има няколко имена. Това вещество често се нарича цвекло или тръстикова захар.
Хидролиза на захароза
Хидролизата е химическа реакция, при която водата реагира с вещество. Реакционното уравнение за хидролиза на захароза е както следва:
C 6 H 12 O 11 + H 2 O=C 6 H 12 O 6 + C 6 H 12 O 6
– в резултат на тази химична реакция се образуват фруктоза и глюкоза.

Ориз. 3. Формули с фруктоза и глюкоза.
Ако разтвор на захароза се доведе до кипене с малко количество сярна или солна киселина и се добави основа за неутрализиране на киселината и след това получената течност се нагрее отново, получената реакция произвежда молекули, които редуцират медния хидроксид до меден оксид .
Скоростта на реакцията на хидролиза на захароза зависи единствено от концентрацията на захароза в разтвора.
Захарозата е важен елемент, който осигурява на човешкото тяло енергия. Освен това стимулира мозъчната функция и предпазва вътрешните органи от въздействието на токсични вещества. Липсата на вещество може да има много пагубен ефект върху функционирането на тялото и да причини апатия, раздразнителност, загуба на сила и депресия. Излишъкът обаче също може да повлияе негативно на човешкото тяло. Това може да бъде причинено от затлъстяване, кариес и висок риск от развитие на диабет.
Какво научихме?
Захарозата се намира в повечето растения и много храни. Основният продукт, който е източник на захароза, е обикновената захар. По време на хидролиза (реакция химическо веществос вода) захарозата произвежда фруктоза и глюкоза.
По време на обработката хранителни продуктизахарите могат да претърпят киселинна и ензимна хидролиза.
Киселинна хидролиза.Хидролизата на дизахаридите възниква при приготвянето на сладки ястия (желе, компоти, ябълки за печене), както и при приготвянето на сладкарски крем. Хидролизата на захарозата протича в подкиселена водна среда. Захарозата свързва водна молекула и се разгражда на равни количества глюкоза и фруктоза:
C12 H22 O11 C6 H12 O6 + C6 H12 O6
хидролиза глюкоза фруктоза
Процесът се нарича инверсия, а еквимолекулната смес от монозахариди се нарича инвертна захар. Инвертната захар има специфични свойства:
1. Подобрява сладостта на продуктите в захарни разтвори с ниска концентрация.
2. Предпазва концентрираните захарозни разтвори от кристализация (захаризиране). За това е отговорна фруктозата, която е на първо място сред захарите по сладост и е много хигроскопична.
Инверсионната способност на киселините не е еднаква. Най-големият е за оксаловата киселина, най-малкият за оцета. Междинната позиция е заета от лимон и ябълка (10-15 пъти по-малко от оксаловата). Трябва да се отбележи, че оксаловата киселина е отрова и не се използва в кулинарната практика. Но ние говорим за него, защото се съдържа в клетъчния сок на зеленчуците и плодовете
заедно с лимонена и ябълчена киселина.
Скоростта на реакцията на хидролиза на захарозата е пропорционална на концентрацията на водородни йони в средата, а степента на инверсия на захарозата зависи от вида на киселината, нейната концентрация и продължителността на излагане на топлина. На практика това е важно при организиране на технологичен процес. Например, готвене на компот от летни сортове ябълки. Препоръчително е първо да сварите сиропа с добавяне на лимонена киселина и след това да поставите подготвените ябълки в него, да заври и да се охлади.
Ензимна хидролизазахарозата и малтозата се появяват по време на ферментацията на тестото с мая и в началото на печенето на продукти от него, производството на бира, квас, вино и др. Mapltose се образува от действието на амилолитични ензими върху нишестето. Захарозата и малтозата, присъстващи в тестото, се хидролизират от ензимите на дрождите, за да образуват инвертиран саар. Глюкозата и фруктозата, натрупани в процеса от ензимния комплекс на дрождите, се подлагат на дълбоко разцепване с образуването на етанол и въглероден диоксид. Млечнокисела ферментация може да протича и с участието на млечнокисели бактерии. pH на тестото се измества към киселинната страна.
Захарозата в хранителните продукти при производството на ястия и продукти се нагрява по време на готвене до t 0 C = 102 0 C, а по време на пържене до 135 0 C и по-висока. В присъствието на киселини, под въздействието на топлина, захарите се разлагат и техните инверсия , т.е. разделяне на глюкоза и фруктоза.
Смес от глюкоза и фруктоза се нарича инвертна захар. Има по-сладък вкус, променя специфичното въртене на разтвора от дясно на ляво и предпазва разтворите от захаросване.
Това явление се наблюдава при топлинна обработка на плодове и плодове в присъствието на захар (готвене на компоти, конфитюри, консерви), готвене на крем, печене на ябълки, приготвяне на плодови и ягодоплодни напитки и др.
Фруктозата в инвертната захар не само увеличава нейната сладост, но и я прави най-хигроскопичната захар.
Повишената хигроскопичност на инвертната захар и поглъщането на вода от околната среда ограничава използването й (фруктоза) в сладкарската промишленост. А за продукти като мармалад, някои видове marshmallows, използването на фруктоза и инвертна захар, напротив, е желателно, тъй като тези сладкарски продукти не трябва да изсъхват бързо.
Обръщането на захарозата се ускорява в присъствието на киселини. Плодовете и плодовете съдържат главно лимонена и ябълчена киселина и в много по-малка степен киселини като винена, оксалова, янтарна и салицилова.
Лимонената киселина се намира главно в цитрусови плодове и плодове, както в свободно състояние, така и под формата на соли, а ябълчената киселина се намира в семената и семената на плодовете. Активната киселинност (pH) на плодовете и плодовете е от 2,6 до 6.
Степента на инверсия на захарозата зависи от времето и температурата на термичната й обработка, както и от вида и концентрацията на киселината, съдържаща се в продуктите. С повишаване на температурата и увеличаване на продължителността на термичната обработка степента на хидролиза се увеличава. В системи с по-малка концентрация на захар при същите условия хидролизата протича по-добре, отколкото в по-концентрираните.
Тъй като водородният йон действа като катализатор за процеса на хидролиза, важно е да се знае неговият източник. Минералните киселини, особено солната киселина, имат най-добри способности за инверсия. Оксаловата киселина има най-голяма инверсионна способност сред органичните киселини.
10 пъти по-малък - лимон,
15 пъти – ябълка,
17 пъти – млечни,
35 пъти – кехлибар,
45 пъти – оцет.
Количеството инвертирана захароза в продукта зависи от продължителността на термичната обработка. Така че, ако обелени и нарязани ябълки се варят в захарен сироп (18%), количеството инвертирана захароза варира от 14 - 19% от общото количество. Ако се добави лимонена киселина при готвене на ябълки, конфитюри и компоти, степента на инверсия на захарозата се увеличава до 50%.
Готвенето на моркови и цвекло (с високо съдържание на захар) обаче не е придружено от инверсия на съдържащите се в тях захари, тъй като активната киселинност на тези зеленчуци е много ниска (pH 6,3 - 6,7), а ябълчената киселина, която съдържат, има малък способност за инверсия.
Дълбоко разграждане на захарите се наблюдава при редица кулинарни процеси.
По време на подготовката и начална фазатесто с мая за печене - ферментация.
По време на процеса на нагряване на захар или захарен сироп - карамелизиране.
При термична обработка на хранителни продукти, съдържащи редуциращи захари и свободни аминокиселини - образуване на меланоидин.
|
Ферментация |
При производството на тесто с мая основна роля играе процесът на ферментация, при който монозахаридите (глюкоза и фруктоза), съдържащи се в брашното и образувани в тестото в резултат на хидролизата на захароза и малтоза, претърпяват дълбоко разграждане.
Сред многобройните процеси, протичащи по време на ферментацията на тестото, основна роля играе алкохолната ферментация, в резултат на която хексозите се разлагат на въглероден двуокиси етилов алкохол.
C6H12O62CO2 + 2C2H5OH
Крайните продукти са въглероден диоксид и етилов алкохол химична реакция, всяка от които възниква под въздействието на специален ензим.
По време на алкохолната ферментация се образуват странични продукти в малки количества: янтарна киселина, фузелни масла (смес от амилов, изоамилов, бутилов алкохол и др.), Оцетен алдехид, глицерин и др. Глюкозата и фруктозата са най-лесно ферментиращи, галактозата реагира по-лесно бавно. Пентозите не се ферментират от дрожди.
Дизахаридите и малтозата се ферментират само след предварителна хидролиза до съставните им монозахариди.
Дълбокото разграждане на хексозите се случва и в процеса на млечнокисела ферментация, придружаваща алкохолната ферментация:
C 6 H 12 O 6 2CH 3 CHONCOOH (млечна киселина)
Млечнокисела ферментация се причинява от хомо- и хетероферментативни млечнокисели бактерии, влизащи в тестото с брашно.
Хомоферментативните бактерии се образуват от хексози в млечна киселина, а хетеробактериите допълнително образуват оцетна киселина, етилов алкохол и други продукти. Такива процеси се случват и при приготвянето на ферментирали млечни продукти (поради лактоза), квас и ферментация на зеленчуци и плодове.
|
Неензематично покафеняване на захарни вещества |
Сред основните промени в захарите, настъпващи под въздействието на високи температури, са промените във външния вид, цвета, вкуса, мириса и физикохимичните показатели. Общата характеристика на тези промени е промяната в цвета, поради което се наричат още неензимно покафеняване (или неензимно покафеняване).
Продуктите от неензимно покафеняване се разделят на продукти, които се образуват поради преобладаването на процеса на карамелизиране, и продукти, които се образуват в процеса на образуване на меланоиди.
Загряване на захарта до високи температуриги кара да претърпят дълбоки промени с появата на нови продукти с тъмен цвят, процес, наречен карамелизиране.Процесите, протичащи в този случай, все още не са достатъчно проучени, протичащите процеси зависят както от състава на захарите, така и от условията на неговото нагряване.
Киселините католически ускоряват този процес. При нагряване на захарозата до температура 160-185 0 С се образуват монозахаридите глюкоза и фруктоза. Фруктозата е най-чувствителна към последващо нагряване, нейната скорост на промяна е 7 пъти по-голяма от глюкозата. Следователно, при по-нататъшно нагряване, водата се отделя от фруктоза и се образува фруктозан, след което водата се отделя от глюкоза и се образува глюкозен анхидрид, глюкозан:
C 12 H 22 O 11 C 6 H 12 O 6 + C 6 H 12 O 6
захароза глюкоза фруктоза
фруктоза фруктозан
C 6 H 12 O 6 C 6 H 10 O 5 (анхидрид)
глюкоза глюкозан
При по-нататъшно повишаване на температурата и двата анхидрида се комбинират, за да образуват изозахарозан (реверсия)
C 6 H 10 O 5 + C 6 H 10 O 5 = C 12 H 20 O 10