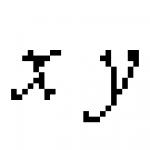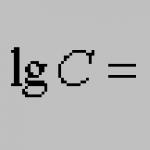ХИМИЧНА КИНЕТИКА И ХИМИЧНО РАВНОВЕСИЕ
Скоростта на всяка химическа реакция зависи от условията, при които протича: от концентрацията на реагентите (или тяхното налягане, ако са газове), температурата, наличието на катализатор или радиация и др. Някои реакции протичат почти мигновено (например неутрализация на киселина с основа), докато други протичат толкова бавно при нормални условия, че забележими промени в концентрациите на реагентите се наблюдават едва след няколко години (например взаимодействието на водород с кислород за образуване на вода в отсъствието на катализатор). Освен това има много реакции, които протичат с доста измерими скорости при обикновени условия. Химическата кинетика се занимава с определянето на скоростите на химичните реакции и изучаването на техния механизъм. Това е сравнително млада наука и има много нерешени проблеми. Всички кинетични изследвания включват време и междинни продукти (вещества, образувани по време на междинните етапи на реакцията). В това те се различават от изследванията на системи в условия на химично равновесие, когато се разглеждат само началните и крайните състояния на реагентите.
Вижте също ХИМИЧНА ТЕРМОДИНАМИКА.
ХИМИЧНА КИНЕТИКА
Един единствен кинетичен експеримент често включва две или повече реакции едновременно и техните скорости може да зависят от наличието на замърсители и следи от катализатори. В резултат на това получените данни са слабо възпроизводими, което затруднява тълкуването им. Ако от термодинамична гледна точка е възможно образуването на различни продукти от едни и същи изходни материали, е необходимо да се избере концентрацията на реагентите, температурата и специфичния катализатор, за да се гарантира, че протича точно реакцията, която интересува изследователя. Скоростта на реакцията обикновено се определя при постоянна температура, за предпочитане при две или повече стойности, като се използват един или повече термостати с висока точност.
Измерване на скоростта на реакцията.Степента на реакция се измерва по различни начини. Можете да вземете проби от реактор с контролирана температура на строго определени интервали или да забавите или напълно да спрете реакцията (чрез бързо охлаждане на реактора или по друг начин) и да анализирате пробите чрез титруване или други аналитични методи. Понякога се стартират няколко идентични реакции едновременно, след което се спират последователно чрез бързо охлаждане и продуктите се анализират. Ако един от реагентите или реакционните продукти има оптична активност, тогава неговата концентрация се наблюдава с помощта на поляриметър. По същия начин, ако промяна в концентрацията на реагент или реакционен продукт, или и двете, е придружена от промяна в електрическата проводимост, за кинетични измервания се използват електрически методи. Понякога концентрацията на един от реагентите се определя чрез измерване на оптичната плътност на разтвор при определена дължина на вълната и използване на закона на Ламберт-Беер.
Вижте също АНАЛИТИЧНА ХИМИЯ. Скоростта на реакцията може да се изчисли въз основа на промените в налягането или обема в газофазова система или обема газ, освободен по време на реакцията. В случай на газофазови реакции, протичащи в поток, понякога в реактора се въвежда катализатор или температурата се повишава, за да се ускори процесът. Входните и изходните тръби в такива системи са направени достатъчно малки, така че газовете да влизат и излизат от реактора възможно най-бързо и да остават в зоната с неконтролиран температурен градиент за кратко време. Времето на престой на газовете в реактора (времето за реакция) се определя въз основа на обема на газовете, преминаващи през реактора за 1 s, разделен на обема на реактора. Ако общият брой на молекулите се промени по време на реакцията, тогава става доста трудно да се прецени времето. Проточните системи използват големи количества реагенти и произвеждат големи количества продукти, което улеснява симулирането на свързаните химически процеси в индустриален мащаб. Скоростта на реакцията може да се определи чрез намаляване на концентрацията на изходните вещества или увеличаване на концентрацията на продуктите. Скоростта на намаляване на концентрацията на изходното вещество е равна на -dC/dt, а скоростта на нарастване на концентрацията на продукта е равна на dC/dt, където C е концентрацията, t е времето. Концентрацията обикновено се измерва в единици моларност (mol/l), времето - в секунди.
Ред на реакция.Реакционният ред е емпирична величина, равна на сумата от показателите, с които концентрациите на реагентите влизат в израза за скоростта на реакцията. По този начин, за реакцията aA + bB -> mM + nN, скоростта на намаляване на концентрацията C на реагент A може да бъде представена като
Където CA и CB са концентрациите съответно на изходните вещества A и B. Редът на реакцията в този случай е a + b. Факторът на пропорционалност k, включен в уравнението, се нарича скоростна константа. Тя е равна на скоростта на реакцията при единица концентрация на реагентите.
Реакции от първи ред.Ако скоростта на реакцията зависи от концентрацията само на един реагент на първа степен, тогава изразът за скоростта приема формата
Такава реакция се нарича реакция от първи ред. За да намерите зависимостта на концентрацията от времето, трябва да интегрирате уравнение (1). Разделяйки променливите и интегрирайки, получаваме -ln C = kt + const
където ln е натурален логаритъм. Или преминаване към десетични логаритми:

Графиката на log C спрямо t е права с наклон от -s, равен на -k/2,303. Следователно k = 2,303*s
Познавайки k и концентрацията C при даден t, може да се намери константата на интегриране (const) и да се изчисли концентрацията за всеки момент от времето. Константата на интегриране може да се определи и от координатите на пресечната точка на правата линия с оста log C при t = 0 (фиг. 1).

Уравнение (1) може да бъде интегрирано в диапазона от C1 до C2, равен на концентрациите на реагента в моменти t1 и t2:
Оттук

Размерността k е равна на размерността t -1. Ако в началния момент от време (t1 = 0) C1 = C0, тогава концентрацията C във всеки момент от време t в съответствие с уравнение (2) ще бъде равна на

Уравнение (1) може да бъде написано в друга форма, като се приеме, че a е първоначалното количество на реагента, x е неговото количество, реагирало през време t. Тогава (a - x) е равно на количеството реагент, оставащ след време t, и уравнението на реакцията приема формата

Разделяйки променливите и интегрирайки, получаваме -ln(a - x) = kt + const
следователно за t = 0, x = 0 и const = -ln a

Често представлява интерес характерната стойност t1/2 - времето за полупреобразуване на реакцията, т.е. време, през което концентрацията на изходното вещество намалява наполовина. За x = (1/2)a и t = t1/2 от уравнение (3) получаваме

Тази зависимост илюстрира важна характеристика на реакциите от първи ред: времето, през което количеството на дадено вещество се намалява наполовина, не зависи от неговото количество в момента на започване на реакцията и във всеки даден момент от реакцията. Ако константата на скоростта k е известна, можете да изчислите количеството вещество, което е реагирало в даден момент, или да определите колко време ще отнеме дадено количество вещество, за да реагира. Много химични реакции следват уравнение от първи ред. Например азотният пентаоксид, разтворен в тетрахлорид на въглерода, се разлага при температура 45 ° C в строго съответствие с уравнението на реакцията от първи ред:

Реакции от втори ред.Когато скоростта на реакцията е пропорционална на квадрата на концентрацията на отделния реагент или на концентрациите на всеки от двата реагента на първа степен, имаме работа с реакция от втори ред. В диференциална форма изразите за скоростта на такава реакция имат формата
И
Нека a е началната моларна концентрация на реагент А, x е броят на неговите молове в 1 литър, които са реагирали за време t; тогава скоростта на реакцията ще бъде равна на dx/dt = k(a - x)2
или dx/(a - x)2 = kdt
Интегрирайки, получаваме 1/(a - x) = kt + C
Тъй като x = 0 при t = 0, константата C = 1/a. Оттук
И

Ако a и b са съответно началните моларни концентрации на реагенти A и B и ако x mol от тези реагенти реагират в 1 литър по време на t, тогава чрез интегриране на съответното уравнение за скоростта на реакцията можем да намерим израза за скоростна константа:
Размерност k - l/(mol*s). Числената стойност на k може да се намери чрез заместване на концентрациите и времето в уравнение (4) или чрез начертаване на зависимостта
Или
От време. Умножаването на наклона на така получената линия по 2,303/(a - b) дава k.
Реакции от трети ред.Скоростта на реакция от трети ред може да зависи от концентрацията на един реагент на трета степен, или концентрацията на един реагент на втора степен и втори реагент на първа степен, или концентрацията на всеки от трите реагента на първата власт. Така,
Или dx/dt = k(a - x)3
Разделянето на променливи и интегрирането дава

или

Тук измерението k е l2/(mol2*s). Реакции от нулев ред. Скоростта на реакциите от нулев порядък не зависи от концентрациите на реагентите и се определя от други ограничаващи фактори, например повърхностната площ на катализатора (при хетерогенни реакции на катализа) или абсорбция на светлина (при фотохимични реакции). Уравнението за скоростта на такава реакция в диференциална форма е -dC/dt = k
или, изразено като концентрация на продукта x, dx/dt = k
Интегрирайки, получаваме x = kt + C
Стойността x = 0 съответства на t = 0, следователно константата C = 0 и x = kt
Стойността на k може да включва различни константи, например интензитет на светлината, концентрация на наситен разтвор или пара. Размерност k - mol/(lHs).
реакции от n-ти ред.Като цяло, за реакция от порядък n с n > 1, връзката между концентрацията и времето за крайно време на наблюдение се описва от уравнението

където C е концентрацията на реагента в момент t, C0 е първоначалната концентрация. Графиката на 1/(Cn - 1) спрямо t е права линия с наклон (n-1) k. Размерност k - (mol/l)1 - n/c. Реакциите не винаги имат целочислен ред. Показателите за концентрациите в израза за скоростта често са дробни. В този случай обаче редът на реакцията е равен на сумата от експонентите. Например за реакция, чиято скорост е

ред n = 0,7 + 1,8 = 2,5. Често редът на реакцията, определен експериментално, не съответства на реда, който следва от стехиометричното уравнение. Повечето химични реакции включват две или повече стъпки, протичащи едновременно, което води до по-сложни изрази за скоростта.
Определяне на реда на реакцията.Заместване във формули. Ако k остава постоянно, когато стойностите на концентрацията и времето се заместват в уравнението за скоростта на реакцията, тогава редът на реакцията, даден от уравнението, е правилен. Ако изчисленията не съвпадат с експерименталните данни, тогава реакцията е по-сложна от очакваното и вероятно протича на два или повече етапа.
Графичен метод.За да определите реда на реакцията, можете да прибягвате до графично представяне на функции, които описват зависимостта на концентрацията от времето. Ако при начертаване на зависимостта на C от t се получи права линия, това означава, че реакцията е от нулев порядък. Ако зависимостта на log C от t е линейна, възниква реакция от първи ред. При условие, че началната концентрация на всички реагенти е една и съща, реакцията е от втори ред, ако графиката на зависимостта на 1 / C от t е линейна, и трети - ако зависимостта на 1 / C 2 от t е линейна .
Определяне на времето за полупреобразуване.За реакция от първи ред времето, необходимо на определена част от реагента да реагира (например половината) не зависи от първоначалната концентрация (виж по-горе),

За реакция от втори ред, когато началните концентрации на двата реагента са равни, a = b, времето, през което половината от веществото реагира, е обратно пропорционално на първоначалната концентрация. От горния израз за константата на скоростта на реакция от втори ред получаваме
Или
t1/2 = 1/ка
Промяна на съотношението между реагентите. Ако изразът за скорост се представи като
![]()
където CA, CB, CC... са концентрациите на веществата A, B и C... участващи в реакцията, а a, b, c... са съответните показатели в уравнението за скоростта, тогава реакцията ред n може да се определи чрез увеличаване на удвояването на стойността на SA без промяна на SV и SS и експериментално определяне на стойността на Dx/Dt за SA и 2CA. Така че, ако -
![]()
скорост при концентрация 2CA, и
Скорост при концентрация на SA, тогава, като вземем съотношението на тези две количества, получаваме

Да приемем, че наблюдаваното съотношение
Равно на 4; тогава a = 2 и реакцията е реакция от втори ред по отношение на реагент A. Ако това съотношение е 2, тогава a = 1 и протича реакция от първи ред по отношение на същия реагент. b, c и т.н. се определят по същия начин.
Добавяне на излишни реактиви.Чрез добавяне на всички реагенти с изключение на един към реакционната смес в голям излишък, можете да определите реда на реакцията въз основа на този реагент, т.е. показател на степента, в която концентрацията на даден реагент влиза в скоростното уравнение. Реакционният ред за всеки реагент се определя по същия начин. Показателят за концентрацията на реагент А, която не е в излишък, се установява чрез нанасяне на dCA/dt спрямо ln CA съгласно уравнението

Наклонът на получената права линия е a. Константата kў е произведението на константата на скоростта и концентрациите на реагентите в излишък, взети в подходящи степени. Молекулярността на реакцията се определя от броя на молекулите, участващи в най-бавния, ограничаващ етап. Реакциите могат да бъдат моно-, би-, три- и др. молекулярно. Редът на реакцията и нейната молекулярност не винаги могат да бъдат предвидени от стехиометрията на реакцията; За да направите това, трябва да извършите кинетични измервания. В някои случаи редът и молекулярността на реакцията, определени въз основа на нейната стехиометрия, съвпадат. Мономолекулна реакция е реакция, при която ограничаващият етап е трансформацията на една молекула, например нейното разпадане на компоненти (дисоциация на йодни молекули I2 -> 2I) или трансформация в друга молекула в резултат на вътрешномолекулно пренареждане:

Бимолекулярна реакция е взаимодействието на две молекули (например молекулярен водород с молекулярен йод, H2 + I2 (r) 2HI). Реакция, протичаща едновременно с участието на три молекули, се нарича тримолекулна. Тъй като вероятността три молекули да се сблъскат наведнъж, особено в правилната взаимна ориентация, е много малка, такива реакции се случват рядко.
Механизъм на химичните реакции.Когато се изучава механизмът на всяка химическа реакция, се разглеждат сблъсъкът между отделните реагиращи частици (класическа теория на сблъсъка) и други елементарни събития, включващи тези частици. Отчита се и взаимната пространствена ориентация (стереохимия) на реагиращите молекули. Смята се, че реакцията протича чрез образуване на междинен комплекс и за установяване на неговия механизъм е необходимо познаването на състава и геометрията на този комплекс – междуатомни разстояния и ъгли на свързване. Реакциите, наречени верижни реакции, протичат през последователност от етапи. Продължаването на веригата се инициира от високоенергийни атоми или свободни радикали. Нека разгледаме фотохимичната реакция на образуване на хлороводород. Когато е изложена на светлина, молекулата на хлора се разпада, за да образува атомен хлор. Хлорните атоми реагират с водородна молекула, за да образуват HCl и атомен водород. Последният реагира с хлорна молекула, като отново образува HCl и освобождава хлорен атом:

(точката в горния индекс обозначава несдвоения електрон във валентната обвивка на атомите; това подчертава, че атомите са силно активни свободни радикали). Понякога тази верига от взаимодействия продължава, докато повече от един милион молекули реагират за всеки хлорен атом, образуван по време на фотодисоциацията. Ако двата атома, отговорни за растежа на веригата(ите), реагират един с друг, за да образуват HCl, или ако един от тях загуби енергия поради сблъсък със стените на реактора или с чужди частици, веригата ще бъде прекъсната. Важен параметър, който определя скоростта на реакциите в газовата фаза, е броят на сблъсъци между молекули за единица време, които имат подходяща ориентация и имат достатъчно енергия, за да влязат в реакция. Честотата и енергията на сблъсъците зависят от размера на частиците и средната им скорост. За да илюстрирате как кинетичните данни могат да предоставят информация за механизма на химичните реакции, разгледайте образуването на HI и HBr: H2 + I2 = 2HI и H2 + Br2 = 2HBr
Стехиометричните уравнения за тези реакции са идентични. Въпреки това, кинетичните измервания на скоростта на реакцията показват, че техните механизми са напълно различни. За първата реакция, при която молекулите на водорода и йода се сблъскват, нарастването на концентрацията на HI с течение на времето се определя от уравнението d[]/dt = k[][], където [] и [] са моларните концентрации на водород и йод , k е константата на скоростта на реакцията. В същото време, както показват кинетичните измервания, нарастването на концентрацията на HBr с течение на времето следва уравнението

където [], [] и [] са моларните концентрации на водород, бром и бромоводород, k и k" са константи. Реакцията следва верижен механизъм, подобен на този, според който хлорът и водородът реагират един с друг, за да образуват водород хлорид: Br2 = 2Br, Br + H2 = HBr + H, H + Br2 = HBr + Br и др.
Израз за скоростта на пълна реакция може да се получи, като се използват уравненията за скоростта за всеки от нейните етапи. Температурни коефициенти на скоростта на реакцията. В температурния диапазон, близък до стайната, скоростта на много реакции се удвоява или утроява за всеки 10° повишаване на температурата. S. Arrhenius предложи следното уравнение, описващо зависимостта на константата на скоростта на реакцията от температурата: k = s exp(-DHa/RT)
Предекспоненциалният фактор s се нарича честотен фактор на Арениус и в бимолекулна реакция се определя от честотата на сблъсъци на молекули, които имат подходяща ориентация, за да влязат в химично взаимодействие, DHa е топлината (или енталпията) на активиране , R е универсалната газова константа []. DHa е равна на кинетичната енергия, която трябва да притежават сблъскващи се частици, за да преодолеят взаимното си отблъскване и да образуват продукти. Уравнението на Арениус може да бъде написано в диференциална форма:

Интегрирането при допускането, че DHa не зависи от T дава
Където
Интегрирането при предположението за независимост на DHa от T дава

или
От уравнение (5) следва, че графиката на ln k спрямо 1/T е права линия с наклон -DHa/R, от който DHa може да се определи като -RChs (където s е наклонът на правата линия). Като използвате дадена стойност на DHa и стойността на k при една температура, можете да намерите честотния фактор и след това да изчислите k при всяка друга температура от температурния диапазон, в който стойността на DHa остава постоянна. Членът ln s в уравнението на Арениус може също да се определи графично чрез екстраполиране на графиката на ln k от 1/T до 1/T = 0. В този момент ln k = ln s (фиг. 2).

Експоненциалният член exp(-DHa/RT) в уравнение (6) е равен на частта от молекули с енталпия, т.е. молекули, които имат достатъчно енергия, за да реагират. За бимолекулни реакции честотният фактор на Арениус може да бъде представен като броя на сблъсъците за единица време в единица обем между молекули с желаната ориентация. По този начин k се определя от броя на сблъсъци на химически активни и правилно ориентирани молекули. В рамките на теорията за абсолютните скорости на реакцията (или термодинамичната теория), честотният фактор може да бъде представен като
![]()
където x е коефициентът на предаване, който е частта от молекули, чиято енергия надвишава енергийната бариера по пътя от реагентите до продуктите, k е константата на Болцман, h е константата на Планк, DSa е ентропията на активиране на мол реагент. DSA е мярка за относителния брой степени на свобода на молекулите в активирано и начално състояние (т.е. броя на независимите видове вибрации и ротации). За някои реакции на мономолекулно газофазово разлагане, активираният комплекс е толкова близък по структура до оригиналните реагенти, че промяната в ентропията е много малка, т.е. DSa може да се приеме равен на нула. В тези случаи
![]()
,
и ако x = 1, тогава константата на скоростта на реакцията се дава от

При 27° C (300 K)

(N е числото на Авогадро). От това получаваме приблизително уравнение за мономолекулни реакции:
И едно по-малко точно уравнение за бимолекулни реакции:
Където 10 10 е, с първо приближение, равно на броя на молекулярните сблъсъци при стайна температура, ако концентрациите са изразени в mol/l.
ХИМИЧНО РАВНОВЕСИЕ
Обратимост и баланс.Обратима химическа реакция е реакция, по време на която се извършват трансформации както в права, така и в обратна посока. Първият, който ясно формулира идеята за обратимостта на химичните реакции, е C. Berthollet (1799). Докато участва в египетската експедиция на Бонапарт, той обръща внимание на образуването на натриев карбонат в солените езера и стига до извода, че натриевият карбонат се образува в резултат на взаимодействието между наситен разтвор на натриев хлорид и разтворен калциев карбонат. Този процес е обратен на лабораторната реакция между натриев карбонат и разтворен калциев хлорид за образуване на калциев карбонат. През 1864 г. К. Гулдберг и П. Вааге откриват закона за масовото действие, според който скоростта на химичната реакция е правопропорционална на концентрацията на реагиращите вещества. Равновесното положение може да се определи, като се знаят скоростите на правата и обратната реакция. Уравнението на обратимата реакция има формата

Ако CA, CB, CL и CM са моларните концентрации на вещества A, B, L и M; a, b, l и m са съответните стехиометрични коефициенти, k1 и k2 са скоростните константи на правата и обратната реакция, тогава

В равновесие скоростите на правата и обратната реакция са равни:
![]()
И

където C е равновесната концентрация на съответното вещество, KS е константата на химичното равновесие, изразена като концентрация. Един по-строг подход за извличане на израза за равновесната константа се основава на принципите на термодинамиката. Може да се покаже, че при равновесни условия (при равновесни концентрации на реагентите и продуктите) стандартната промяна в свободната енергия на системата се определя от уравнението

Тъй като DF0 е константа при постоянна температура, тогава KS също е константа, равна на

За реакциите в газовата фаза равновесната константа може да бъде изразена чрез парциалните налягания на реагентите:

Константата на равновесие, представена по този начин, се различава от KS, изразена като моларни концентрации, и DF0 за тези два случая също се различава съответно. Нека обясним каква е промяната в свободната енергия DF0 по време на химическа реакция. При постоянна температура и налягане намаляването на свободната енергия е максималната работа, която може да бъде извършена по време на процеса, и тази работа не е свързана с промяна в обема или налягането в системата. Стандартната промяна на свободната енергия DF0 е равна на разликата в свободните енергии на реагентите и продуктите в стандартните състояния. Това състояние за идеален газ е налягане от 1 atm, а за твърди вещества или течности - тяхната най-стабилна форма при налягане от 1 atm и определена температура. За идеално разтворено вещество стандартното състояние е при концентрация от 1 mol на 1000 g разтворител (молална концентрация). За реакции в газова фаза KC може да се свърже с Kp с помощта на уравнението на състоянието на идеалния газ: C = 1/V = p/RT
където V е обемът, зает от един мол газ, R е газовата константа, T е абсолютната температура,

където Dn = (l + m) - (a + b) разликата между сумата от молове на реакционните продукти и сумата от молове на изходните реагенти; тази разлика се определя от коефициентите на стехиометричното уравнение на реакцията. Трябва да се има предвид, че DF0 е разликата между свободните енергии на реагентите и продуктите в техните стандартни състояния, а именно при концентрация на разтворени вещества от 1 M и налягане на газа от 1 atm, и тази разлика на свободните енергии е изчислено с помощта на данни за равновесна концентрация и налягане.
Равновесие в газофазни системи.Помислете за дисоциацията на N2O4 (диазотен тетроксид) на две молекули азотен диоксид (NO2). Mol. масата на N2O4 е 92; това е кафяв газ с bp. 21,3° C. При нагряване цветът на газа става черен. При температура 140°C настъпва пълна дисоциация на N2O4 в NO2 с mol. маса 46 съгласно уравнението
Нека a е молната част на газа, който е претърпял дисоциация и от всеки мол се получават n мола газообразни продукти; тогава общият брой молове газ ще бъде 1 - a + na = 1 + (n - 1)a
Плътността на дадена маса газ при постоянно налягане е обратно пропорционална на броя молове. Нека означим с d1 плътността на недисоциирания газ, а с d2 плътността на сместа от първоначалния и дисоциирания газ при едно и също налягане. Тогава

И

Замяна на плътността с мол. маса, получаваме

където M1 - mol. маса на недисоцииран газ, M2 - средна мол. маса на сместа от първоначалния и дисоциирания газ. Тъй като за тази реакция n = 2 и общият брой молове газ в сместа е 1 - a + 2a = 1 + a, парциалните налягания на N2O4 и NO2 са съответно равни

И

където P е общото налягане. Сега

Ако фракцията на дисоциирания газ при 75 ° C е 0,741 и общото налягане е 1 atm, тогава

Обърнете внимание, че с увеличаването на общото налягане степента на дисоциация ще намалее в съответствие с уравнение (7) и принципа на Le Chatelier, според който системата се стреми да поддържа състоянието, в което се намира, за разлика от всякакви външни влияния. Нека дадем като пример няколко изследвани газофазови реакции: N2 + 3H2 2NH3 H2 + I2 2HI N2 + O2 2NO CO2 + H2 CO + H2O В последните три случая промяната на налягането в системата няма да повлияе на хода на реакция, тъй като броят на молекулите на изходните съединения и продукти е еднакъв. Но в първия случай, с увеличаване на налягането, ще се наблюдава ускоряване на процеса - образуването на повече продукт.
Равновесие в хомогенна течна система.Един типичен пример за обратима реакция в хомогенна течна система е реакцията между оцетна киселина и етилов алкохол за образуване на етилацетат и вода:
Равновесната константа KС на тази реакция е равна на

Ако a мола киселина и b мола алкохол в смес с l мола етилацетат и m мола вода образуват разтвор с обем v и ако x мола киселина и x мола алкохол дават x мола етилацетат и x мола вода, тогава можем да напишем уравнение (8) в следната форма:

Различните електролити се дисоциират в полярни разтворители в различна степен (вижте ЕЛЕКТРОЛИТИТЕ). За определяне на степента на дисоциация на електролитите най-често се използва доста прост и точен метод, основан на измерване на тяхната електрическа проводимост. Според Арениус степента на дисоциация на електролита е равна на
Където A е еквивалентната електрическа проводимост (т.е. проводимостта, съответстваща на един „мол“ заряд) на електролита, чиято концентрация искат да определят, L0 е еквивалентната електрическа проводимост на електролита при безкрайно разреждане, когато е напълно дисоцииран. Познавайки концентрацията и степента на дисоциация, е възможно да се определи йонизационната константа (за киселини, константата на протолиза) на слаб електролит. Обикновено йонизацията или дисоциацията се потискат чрез добавяне на излишен продукт на дисоциация към средата. Киселината, образувана, когато дадена основа улавя протон, се нарича спрегната киселина на тази основа; съответно основата, образувана, когато дадена киселина отдаде протон, се нарича спрегната основа на тази киселина. Нека си представим протолиза (или йонизация на киселина във вода) като взаимни трансформации на спрегнати киселини и основи: HA + H2O H3O+ + A-където HA и A- са спрегнати киселина и основа, H2O и H3O+ са спрегнати основа и киселина. Равновесната константа на процеса на йонизация е равна на

Концентрацията на водата се променя леко, когато малки количества NA се разтворят в нея и могат да бъдат включени в константата. Тогава константата на протолизата Kb е равна на

По подобен начин могат да се получат изрази за равновесната константа на основната протолиза. Типичен пример е протолизата на слаба основа, амоняк, във вода:

където С е началната концентрация на амоняк, а е степента на протолиза. При 25°C и концентрация на амоняк 0,020 m (mol на 1000 g вода) степента на протолиза на амоняка е 0,030. Оттук

Нека изчислим стойността на Kb въз основа на активността на веществата, участващи в процеса. Активност a е равна на произведението от концентрация C и коефициент на активност g. Коефициентът на активност на йони във вода при 25° C може да се изчисли в рамките на теорията на Дебай-Хюкел, като се използва емпиричното уравнение
![]()
където Zi е валентността на йоните i, m е йонната сила, определена от съотношението

където Ci е концентрацията на йони i. Във воден разтвор на амоняк концентрацията на NH4+ йони е равна на концентрацията на хидроксилни йони, а именно 0,030×0,020 = 0,00060 mol. По този начин,
И
От тук получаваме g = 0,972
Коефициентът на активност за неутрални амонячни молекули в разреден разтвор може да се приеме равен на 1. Така ефективните концентрации на NH4+ и OH- са еднакви и равни на 0,972 * 0,00060 = 0,00058 и получаваме стойността Kb, изчислена чрез активностите :
Тази стойност на Kb(a) е термодинамичната константа за протолизата на амоняк във вода при 25°C и е от по-голямо значение в термодинамичните приложения, отколкото стойността на Kb, получена от стойностите на концентрацията.
Равновесие в хетерогенни системи.Ако една система има две или повече фази, тогава тя се нарича хетерогенна. Така едно или повече реагиращи вещества или продукти могат да бъдат в твърдо или течно състояние, а останалите в газообразно състояние. Концентрациите на течни или твърди вещества в равновесие не се променят, следователно, в сравнение с хомогенна система, изчисленията са опростени. Налягането на парите и разтворимостта на твърди и течни вещества не зависят от тяхното количество, са постоянни стойности при дадена температура и са включени в константата на равновесието. Нека разгледаме реакцията CaCO3 (твърд) -> За него

И

тъй като при постоянна температура и pCaO са постоянни. Като други примери можем да разгледаме дисоциацията на амониевия хидросулфид NH4HS в H2S и NH3 и амониевия карбамат NH2COONH4 в CO2 и 2NH3. Хетерогенните процеси включват разпределението на разтвореното вещество между два несмесващи се разтворителя и разтварянето на твърди вещества в течности (вижте РАЗТВОРИ). Константата на разпределение на разтвореното вещество между два несмесващи се разтворителя е
Където C2 и C1 са концентрациите на разтвореното вещество в двата разтворителя. Ако асоциирането или дисоциацията на разтвореното вещество се случи в една от фазите, тогава този израз се модифицира. За разтваряне на твърди вещества в течности KC = Csat
където Сnas е концентрацията на твърдо вещество в течност в състояние на насищане при постоянна температура. Зависимост на равновесната константа от температурата. Обикновено равновесната константа се променя с температурата. Ако по време на реакция се отделя топлина, тогава с повишаването на температурата реакцията се забавя и K намалява. Напротив, когато топлината се абсорбира по време на реакция, равновесната константа се увеличава с повишаване на температурата. Температурната зависимост на равновесната константа се изразява като

където DH е топлината на химичния процес (т.е. топлината на химическа реакция, топлината на разтваряне и т.н.). Интегрирането от T1 към T2 дава

От тук, знаейки стойността на K при две температури, можем да намерим DN. Или, ако Kp или KS са известни при една температура и DH, е възможно да се определи Kp или KS при друга температура.
Безплатна енергия и баланс.Правени са много опити за определяне на компонентите на свободната енергия (енталпия и ентропия) или самата нея от калориметрични данни, от данни за електродвижеща сила или чрез статистически методи, използващи спектроскопски данни (изчисляване на разпределителни функции). Промяната в свободната енергия по време на химическа реакция е много важна величина, която ни позволява да определим дали дадена реакция може да протече при определени условия. По този начин, ако при постоянно налягане и температура промяната в свободната енергия за дадена химична реакция е голяма по величина (i10 kcal/mol) и отрицателна по знак, тогава реакцията протича спонтанно. Ако промяната в свободната енергия е нула, тогава съществува равновесие, а ако е положителна, тогава реакцията изисква външно захранване с енергия. Познавайки промяната в свободната енергия по време на реакция за условия, при които реагентите и продуктите са в стандартни състояния, е възможно да се изчисли равновесната константа на реакцията и да се получи информация за условията, при които се получава максимален добив.
Определяне на равновесни константи.За определяне на равновесните константи се използват физични и химични методи. По време на измерванията балансът не трябва да се нарушава. Ако е възможно, концентрациите на всички вещества, налични в системата, трябва да се определят чрез едно или две експериментални измервания. Чрез наблюдение на промяната в налягането или обема по време на реакция може да се изчисли съставът на системата в равновесие. За определяне на концентрацията на един или повече компоненти в равновесна смес се използват оптични методи (поглъщане и пречупване на светлина), измерват се плътността и електрическата проводимост. Може да се използва и химичен анализ, ако времето за анализ е достатъчно кратко и равновесието не е нарушено. Равновесната смес се „замразява“ (чрез отстраняване на катализатора, добавяне на излишък от един от реагентите, бързо охлаждане), за да се предотврати промяна на състава й по време на анализа. За да се гарантира, че равновесната константа е определена правилно, равновесието трябва да бъде постигнато от двете страни или концентрациите на реагентите трябва да варират в широк диапазон. В този случай трябва да се получат същите стойности на равновесните константи. Методите за измерване на потока понякога се използват за определяне на равновесни константи. Газообразните реагенти преминават през каталитичен реактор при висока температура и изтичащите газове бързо се анализират. Чрез промяна на масовите скорости (скорости на потока) се определя константата на равновесие за такива условия, когато при по-нататъшно намаляване на скоростта на потока съставът на отработените газове не се променя. По този начин се определя равновесната константа на реакцията N2 + 3H2 2NH3
ЛИТЕРАТУРА
Emmanuel N.M., Knorre D.G. Курс по химична кинетика. М., 1984 Purmal A.P. Химична кинетика. М., 1993 Семиохин И.А., Страхов Б.В. Кинетика на химичните реакции. М., 1995
Енциклопедия на Collier. - Отворено общество. 2000 .
Химична кинетика
Химично равновесие
Химическата кинетика е дял от химията, който изучава скоростта на химичната реакция и факторите, които я влияят.
Фундаменталната осъществимост на процеса се оценява по стойността на промяната в енергията на Гибс на системата. Той обаче не казва нищо за реалната възможност за реакция при дадени условия, нито дава представа за скоростта и механизма на процеса.
Изследването на скоростите на реакциите позволява да се изясни механизмът на сложните химични трансформации. Това създава перспектива за управление на химичния процес и дава възможност за математическо моделиране на процесите.
Реакциите могат да бъдат:
1. хомогенен– възникват в една среда (в газова фаза); преминават изцяло;
2. разнородни– не се срещат в една и съща среда (между вещества в различни фази); преминава през интерфейса.
Под скорост на химичната реакцияразбират броя на елементарните реакционни събития, възникващи за единица време на единица обем (за хомогенни реакции) и на единица повърхностна площ (за хетерогенни реакции).
Тъй като концентрацията на реагентите се променя по време на реакция, скоростта обикновено се определя като промяна в концентрацията на реагентите за единица време и се изразява в . В този случай не е необходимо да се наблюдават промените в концентрацията на всички вещества, включени в реакцията, тъй като стехиометричният коефициент в уравнението на реакцията установява връзката между концентрациите, т.е. при ![]() скоростта на натрупване на амоняк е два пъти по-висока от скоростта на потребление на водород.
скоростта на натрупване на амоняк е два пъти по-висока от скоростта на потребление на водород.

![]()
![]() , защото не може да бъде отрицателен, затова поставят „–“.
, защото не може да бъде отрицателен, затова поставят „–“.
Скорост във времеви интервал ![]() – истинска моментна скорост– 1-ва производна на концентрацията по време.
– истинска моментна скорост– 1-ва производна на концентрацията по време.
Скоростта на химичните реакции зависи:
1. от естеството на реагиращите вещества;
2. върху концентрацията на реагентите;
3. от катализатора;
4. по температура;
5. по степента на смилане на твърдото вещество (хетерогенни реакции);
6. от околната среда (разтвори);
7. върху формата на реактора (верижни реакции);
8. от осветление (фотохимични реакции).
Основният закон на химичната кинетика е закон за масовото действие: скоростта на химичната реакция е пропорционална на произведението на концентрациите на реагентите в реакцията
където е константата на скоростта на химичната реакция
Физическо значение при.
Ако в реакцията участват не 2 частици, а повече, тогава: ~ в степени, равни на стехиометричните коефициенти, т.е.: ![]() , Където
, Където
– показател за реда на реакцията като цяло (реакции от първи, втори, трети... ред).
Броят на частиците, участващи в това реакционно събитие, определя молекулярност на реакцията:
Мономолекулен ()
бимолекулярно ( ![]() )
)
Тримолекулярна.
Няма повече от 3, защото... сблъсък на повече от 3 частици наведнъж е малко вероятен.
Когато реакцията протича на няколко етапа, тогава общата реакция = най-бавният етап (ограничаващ етап).
Зависимостта на скоростта на реакцията от температурата се определя емпирично правилото на Вант Хоф: при повишаване на температурата с , скоростта на химичната реакция се увеличава 2–4 пъти: .
където е температурният коефициент на скоростта на химичната реакция.
Не всеки сблъсък на молекули е придружен от тяхното взаимодействие. Повечето молекули отскачат като еластични топки. И само активните взаимодействат помежду си по време на сблъсък. Активните молекули имат известна излишна енергия в сравнение с неактивните молекули, така че в активните молекули връзките между тях са отслабени.

Енергията за прехвърляне на молекула в активно състояние е енергия на активиране. Колкото по-малък е той, толкова повече частици реагират, толкова по-голяма е скоростта на химическата реакция.
Стойността зависи от естеството на реагиращите вещества. Това е по-малко от дисоциацията - най-малко силната връзка в реагентите.
Промяна по време на реакция:

Освободен (екзотермичен)
С повишаването на температурата броят на активните молекули се увеличава и следователно се увеличава.
Константата на химичната реакция е свързана с
където е предекспоненциалният фактор (свързан с вероятността и броя на сблъсъци).
В зависимост от природата на реагиращите вещества и условията на тяхното взаимодействие в елементарните реакции на реакцията могат да участват атоми, молекули, радикали или йони.
Свободните радикали са изключително реактивни; има много малко активни радикални реакции ().
Образуването на свободни радикали може да възникне при разлагане на вещества при температура, светлина, под въздействието на ядрено лъчение, по време на електрически разряд и силни механични въздействия.
Много реакции възникват чрез верижен механизъм. Особеността на верижните реакции е, че един първичен акт на активиране води до трансформация на огромен брой молекули на изходните вещества.
Например: .
При обикновени температури и дифузно осветление реакцията протича изключително бавно. Когато смес от газове се нагрее или изложи на светлина, богата на ултравиолетови лъчи (пряка слънчева светлина, светлина от огън), сместа експлодира.
Тази реакция протича чрез отделни елементарни процеси. На първо място, поради поглъщането на квант енергия от UV лъчи (или температура), молекулата се разпада на свободни радикали - атоми: ![]() , след това , след това и т.н.
, след това , след това и т.н.
Естествено е възможно свободните радикали да се сблъскат един с друг, което води до скъсване на веригата: ![]() .
.
Освен температурата, светлината има значително влияние върху реактивността на веществата. Влиянието на светлината (видима, UV) върху реакциите се изучава от клона на химията - фотохимията.
Фотохимичните процеси са много разнообразни. При фотохимично действие молекулите на реагиращите вещества, поглъщащи светлинни кванти, се възбуждат, т.е. стават реактивни или се разпадат на йони и свободни радикали. Фотографията се основава на фотохимични процеси – въздействието на светлината върху фоточувствителните материали (фотосинтеза).
Един от най-разпространените методи за ускоряване на химичните реакции в химическата практика е катализа. Катализатори- вещества, които променят химичната реакция поради участие в междинно химично взаимодействие с компонентите на реакцията, но възстановяват своя химичен състав след всеки цикъл на междинно взаимодействие.
Увеличаването на каталитичната реакция е свързано с по-малко нови реакционни пътища. защото в израза за е отрицателен показател, тогава дори малко намаление причинява много голямо увеличение на химичната реакция.
Химична кинетика
Химично равновесие
Химическата кинетика е дял от химията, който изучава скоростта на химичната реакция и факторите, които я влияят.
Фундаменталната осъществимост на процеса се оценява по стойността на промяната в енергията на Гибс на системата. Той обаче не казва нищо за реалната възможност за реакция при дадени условия, нито дава представа за скоростта и механизма на процеса.
Изследването на скоростите на реакциите позволява да се изясни механизмът на сложните химични трансформации. Това създава перспектива за управление на химичния процес и дава възможност за математическо моделиране на процесите.
Реакциите могат да бъдат:
1. хомогенен– възникват в една среда (в газова фаза); преминават изцяло;
2. разнородни– не се срещат в една и съща среда (между вещества в различни фази); преминава през интерфейса.
Под скорост на химичната реакцияразбират броя на елементарните реакционни събития, възникващи за единица време на единица обем (за хомогенни реакции) и на единица повърхностна площ (за хетерогенни реакции).
Тъй като концентрацията на реагентите се променя по време на реакция, скоростта обикновено се определя като промяна в концентрацията на реагентите за единица време и се изразява в . В този случай не е необходимо да се наблюдават промените в концентрацията на всички вещества, включени в реакцията, тъй като стехиометричният коефициент в уравнението на реакцията установява връзката между концентрациите, т.е. при ![]() скоростта на натрупване на амоняк е два пъти по-висока от скоростта на потребление на водород.
скоростта на натрупване на амоняк е два пъти по-висока от скоростта на потребление на водород.

![]()
![]() , защото не може да бъде отрицателен, затова поставят „–“.
, защото не може да бъде отрицателен, затова поставят „–“.
Скорост във времеви интервал ![]() – истинска моментна скорост– 1-ва производна на концентрацията по време.
– истинска моментна скорост– 1-ва производна на концентрацията по време.
Скоростта на химичните реакции зависи :
1. от естеството на реагиращите вещества;
2. върху концентрацията на реагентите;
3. от катализатора;
4. по температура;
5. по степента на смилане на твърдото вещество (хетерогенни реакции);
6. от околната среда (разтвори);
7. върху формата на реактора (верижни реакции);
8. от осветление (фотохимични реакции).
Основният закон на химичната кинетика е закон за масовото действие: скоростта на химичната реакция е пропорционална на произведението на концентрациите на реагентите в реакцията
където е константата на скоростта на химичната реакция
Физическо значение при.
Ако в реакцията участват не 2 частици, а повече, тогава: ~ в степени, равни на стехиометричните коефициенти, т.е.: ![]() , Където
, Където
– показател за реда на реакцията като цяло (реакции от първи, втори, трети... ред).
Броят на частиците, участващи в това реакционно събитие, определя молекулярност на реакцията :
Мономолекулен ()
бимолекулярно ( ![]() )
)
Тримолекулярна.
Няма повече от 3, защото... сблъсък на повече от 3 частици наведнъж е малко вероятен.
Когато реакцията протича на няколко етапа, тогава общата реакция = най-бавният етап (ограничаващ етап).
Зависимостта на скоростта на реакцията от температурата се определя емпирично правилото на Вант Хоф: при повишаване на температурата с , скоростта на химичната реакция се увеличава 2–4 пъти: .
където е температурният коефициент на скоростта на химичната реакция.
Не всеки сблъсък на молекули е придружен от тяхното взаимодействие. Повечето молекули отскачат като еластични топки. И само активните взаимодействат помежду си по време на сблъсък. Активните молекули имат известна излишна енергия в сравнение с неактивните молекули, така че в активните молекули връзките между тях са отслабени.

Енергията за прехвърляне на молекула в активно състояние е енергия на активиране. Колкото по-малък е той, толкова повече частици реагират, толкова по-голяма е скоростта на химическата реакция.
Стойността зависи от естеството на реагиращите вещества. Това е по-малко от дисоциацията - най-малко силната връзка в реагентите.
Промяна по време на реакция:

Освободен (екзотермичен)
С повишаването на температурата броят на активните молекули се увеличава и следователно се увеличава.
Константата на химичната реакция е свързана с
където е предекспоненциалният фактор (свързан с вероятността и броя на сблъсъци).
В зависимост от природата на реагиращите вещества и условията на тяхното взаимодействие в елементарните реакции на реакцията могат да участват атоми, молекули, радикали или йони.
Свободните радикали са изключително реактивни; има много малко активни радикални реакции ().
Образуването на свободни радикали може да възникне при разлагане на вещества при температура, светлина, под въздействието на ядрено лъчение, по време на електрически разряд и силни механични въздействия.
Много реакции възникват чрез верижен механизъм. Особеността на верижните реакции е, че един първичен акт на активиране води до трансформация на огромен брой молекули на изходните вещества.
Например: .
При обикновени температури и дифузно осветление реакцията протича изключително бавно. Когато смес от газове се нагрее или изложи на светлина, богата на ултравиолетови лъчи (пряка слънчева светлина, светлина от огън), сместа експлодира.
Тази реакция протича чрез отделни елементарни процеси. На първо място, поради поглъщането на квант енергия от UV лъчи (или температура), молекулата се разпада на свободни радикали - атоми: ![]() , след това , след това и т.н.
, след това , след това и т.н.
Естествено е възможно свободните радикали да се сблъскат един с друг, което води до скъсване на веригата: ![]() .
.
Освен температурата, светлината има значително влияние върху реактивността на веществата. Влиянието на светлината (видима, UV) върху реакциите се изучава от клона на химията - фотохимията.
Фотохимичните процеси са много разнообразни. При фотохимично действие молекулите на реагиращите вещества, поглъщащи светлинни кванти, се възбуждат, т.е. стават реактивни или се разпадат на йони и свободни радикали. Фотографията се основава на фотохимични процеси – въздействието на светлината върху фоточувствителните материали (фотосинтеза).
Един от най-разпространените методи за ускоряване на химичните реакции в химическата практика е катализа . Катализатори- вещества, които променят химичната реакция поради участие в междинно химично взаимодействие с компонентите на реакцията, но възстановяват своя химичен състав след всеки цикъл на междинно взаимодействие.
Увеличаването на каталитичната реакция е свързано с по-малко нови реакционни пътища. защото в израза за е отрицателен показател, тогава дори малко намаление причинява много голямо увеличение на химичната реакция.
Съществуват 2 вида катализатори :
хомокатализатори;
хетерокатализатори.
Биологични катализатори – ензими .
инхибитори– вещества, които забавят химичните реакции.
Организатори– вещества, които усилват действието на катализаторите.
Реакции, които протичат само в една посока и стигат до край - необратим(образуване на утайка, отделяне на газ). Те са малко.
Повечето реакции - обратими
:  .
.
Според закона за масовото действие: ![]() – химично равновесие
.
– химично равновесие
.
Извиква се състояние на система, при което правата реакция = обратната реакция химично равновесие .
![]()
 .
.
С повишаване на температурата: за ендотермична реакция се увеличава, за екзотермична реакция намалява и остава постоянна.
Определя се влиянието на различни фактори върху положението на химичното равновесие Принципът на Ла Шателие: ако се окаже някакво въздействие върху система, която е в равновесие, тогава процесите в системата, които се стремят да намалят това въздействие, се засилват.
Химична кинетикае дял от химията, който изучава скоростите на химичните реакции. Химичните реакции могат да протичат с различна скорост (от малки части от секундата до десетилетия и по-дълги интервали от време). Когато се разглежда въпросът за скоростта на реакцията, е необходимо да се прави разлика между хомогенни и хетерогенни реакции. Хомогенни системисе състоят от една фаза (например всяка газова смес) и разнородни– от няколко фази (например вода с лед). Фазае част от системата, отделена от другите й части чрез интерфейс, по време на прехода през който настъпва рязка промяна в свойствата.
Хомогенна скорост на реакцияе количеството вещество, което реагира или се образува по време на реакция за единица време в единица обем на системата. Скорост на хетерогенна реакцияе количеството вещество, което реагира или се образува по време на реакция за единица време на единица повърхност на фазата (или маса, обем на твърдата фаза, когато е трудно да се определи размерът на повърхността на твърдото вещество):
v homog =; v хетерог = . Тези. скорост на хомогенна реакцияможе да се определи като промяна в концентрацията на някое от веществата, които реагират или се образуват по време на реакцията, възникваща за единица време.
Повечето химични реакции са обратими, т.е. могат да протичат както в права, така и в обратна посока. Нека разгледаме обратима реакция:
Скорости на права и обратна реакцияса свързани с концентрациите на реагентите чрез следните уравнения:
v x.r., pr =k pr [A] a ×[B] b и v x.r. arr =k arr [C] c ×[D] d
С течение на времето скоростта на предната реакция ще намалее поради потреблението на реагенти АИ INи намаляване на концентрацията им. Напротив, скоростта на обратната реакция, тъй като продуктите се натрупват СЪСИ дще нарастне. Следователно, след определен период от време скоростите на правата и обратната реакция ще станат равни една на друга. Ще се установи състояние на системата, при което няма потоци на материя и енергия, наречено химично равновесие. Всички обратими процеси не протичат напълно, а само до състояние на равновесие, при което, от условието v x.r. pr = v x.r. обр.следва:
| k pr /k arr =[C] c ×[D] d / [A] a ×[B] b =K |
Където К- константа на химичното равновесие, която зависи от температурата и природата на реагентите, но не зависи от концентрацията на последните. Това е математически израз на закона за масовото действие, който позволява да се изчисли съставът на равновесна реакционна смес.
Най-важните фактори, влияещи върху скоростта на реакцията, са:
1. Естеството на реагиращите вещества;
2. Концентрации на реагиращи вещества;
3. Температурен фактор;
4. Наличие на катализатори.
В някои случаи скоростта на хетерогенните реакции зависи и от интензивността на движение на течност или газ в близост до повърхността, върху която протича реакцията.
1) Влиянието на концентрацията на реагентите.Нека представим уравнението на химична реакция в общ вид: aA+bB+…=, тогава v гл.р. =k[A] a [B] b по същество е математическа нотация закон за масовото действие, открит експериментално от К. Гулдберг и П. Вааге през 1864-1867г. Съгласно този закон, при постоянна температура v, ch.r. е пропорционална на произведението от концентрациите на реагиращите вещества, като всяка концентрация се включва в произведението до степен, равна на коефициента, фигуриращ пред формулата на дадено вещество в уравнение на реакцията.Стойността на константата на скоростта на реакцията (k) зависи от природата на реагентите, температурата и наличието на катализатори, но не зависи от концентрацията на веществата.
2) Зависимост v x.r. от температурата и от природата на реагиращите вещества.Активираща енергия E a (в kJ/mol) е излишната енергия, която трябва да имат молекулите, за да може сблъсъкът им да доведе до образуването на ново вещество. E и различните реакции са различни. Този фактор влияе върху природата на реагиращите вещества на v ч.р. . Ако E a<40 кДж/моль (т.е. мала), то скорость такой реакции велика (например, ионные реакции в растворах, протекающие практически мгновенно). Если Е а >120 kJ/mol (т.е. много значителна), тогава скоростта на такава реакция е незначителна (например реакцията на синтез на амоняк N 2 + 3H 2 = 2NH 3 - скоростта на тази реакция при обикновен T поради високи стойности на E a е толкова малък, че може да се забележи, че изтичането е почти невъзможно).
През 1889 г. известният шведски химик Арениус извежда от експериментални данни уравнение, свързващо константата на скоростта с температурата и енергията на активиране. По-късно това уравнение получи теоретична обосновка. Според Арениус константата на скоростта е експоненциално зависима от температурата: k=k max ×exp(-E a /RT), където R е универсалната газова константа, равна на 8,31 J/mol×K; k max е предекспоненциален фактор, означаващ максималната възможна стойност на константата на скоростта при нулева енергия на активиране или безкрайно висока температура, когато всички сблъсъци на молекулите на реагента стават активни. Уравнението на Арениус често се използва в логаритмична форма: lnk=lnk max -E a /RT.
Увеличаване на v х.р. с повишаване на температурата обикновено се характеризира температурен коефициент на скорост на реакцията– стойност, показваща колко пъти се увеличава скоростта на разглежданата реакция при повишаване на температурата на системата с 10 градуса. Температурният коефициент (g) е различен за различните реакции. При обикновени температури неговата стойност за повечето реакции е в диапазона от 2 до 4 (т.е. g hr = 2-4 пъти).
Катализаториса вещества, които не се изразходват в реакцията, но влияят на нейната скорост. Феноменът на промяна на скоростта на реакцията под въздействието на катализатори се нарича катализа, а самите тези реакции са каталитичен. Действието на катализатора се дължи на намаляване на границата на активиране на химичното взаимодействие, т.е. намаляване на енергията на активиране. Под въздействието на катализаторите реакциите могат да се ускорят милиони и повече пъти. Освен това някои реакции изобщо не протичат без катализатори. Катализаторите се използват широко в промишлеността.
Разграничете хомогененИ хетерогенна катализа. При хомогенна катализакатализаторът и реагентите образуват една фаза (газ или разтвор), и когато хетерогенна катализа– катализаторът е в системата като самостоятелна фаза. Пример за хомогенна катализа е разлагането на водороден пероксид във вода и кислород в присъствието на катализатори Cr 2 O 7 2-, WO 4 2- и др. Пример за хетерогенна катализа е окисляването на серен диоксид в триоксид с помощта на контакт метод за производство на сярна киселина от отпадъчни газове от металургично производство: SO 2 +0,5O 2 +H 2 O=(kt)=H 2 SO 4.
Жлава 6
Химична кинетика. Химически баланс.
6.1.химическикинетика.
Химична кинетика- дял от химията, който изучава скоростите и механизмите на химичните процеси, както и тяхната зависимост от различни фактори.
Изследването на кинетиката на химичните реакции позволява както да се определят механизмите на химичните процеси, така и да се контролират химичните процеси при тяхното практическо изпълнение.
Всеки химичен процес е превръщането на реагентите в реакционни продукти:
реагенти→ преходно състояние→ продукти на реакцията.
Реактиви (изходни материали) – вещества, които влизат в процеса на химично взаимодействие.
Реакционни продукти– вещества, образувани в края на процес на химична трансформация. При обратими процеси продуктите от директната реакция са реагенти на обратната реакция.
Необратими реакции– реакции, протичащи при дадени условия в почти една и съща посока (обозначава се със знака →).
Например:
CaCO 3 → CaO + CO 2
Обратими реакции– реакции, протичащи едновременно в две противоположни посоки (посочени със знак).
Преходно състояние (активиран комплекс) е състояние на химична система, което е междинно между изходните вещества (реагенти) и реакционните продукти. В това състояние старите химични връзки се разкъсват и се образуват нови химични връзки. След това активираният комплекс се превръща в реакционни продукти.
Повечето химични реакции са комплекс и се състои от няколко етапа т.нар елементарни реакции .
Елементарна реакция– единичен акт на образуване или разкъсване на химична връзка. Съвкупността от елементарни реакции, които изграждат химичната реакция, определя механизъм на химична реакция.
Уравнението на химическа реакция обикновено показва началното състояние на системата (изходни вещества) и нейното крайно състояние (продукти на реакцията). В същото време действителният механизъм на химическата реакция може да бъде доста сложен и да включва редица елементарни реакции. Сложните химични реакции включват реверсивен, паралелен, последователен И други многоетапни реакции (верижни реакции , съчетани реакции и т.н.).
Ако скоростите на различните етапи на химичната реакция се различават значително, тогава скоростта на сложната реакция като цяло се определя от скоростта на нейния най-бавен етап. Този етап (елементарна реакция) се нарича ограничаващ етап.
В зависимост от фазовото състояние на реагиращите вещества се разграничават два вида химични реакции: хомогененИ разнородни.
Фазае част от система, която се различава по своите физични и химични свойства от другите части на системата и е отделена от тях чрез интерфейс. Наричат се системи, състоящи се от една фаза хомогенни системи, от няколко фази – разнородни. Пример за хомогенна система би бил въздухът, който е смес от вещества (азот, кислород и др.) в една и съща газова фаза. Суспензия от креда (твърдо) във вода (течност) е пример за хетерогенна система, състояща се от две фази.
Съответно се наричат реакции, при които взаимодействащите вещества са в една и съща фаза хомогенни реакции. Взаимодействието на веществата при такива реакции протича в целия обем на реакционното пространство.
Хетерогенните реакции включват реакции, протичащи на границата. Пример за хетерогенна реакция е реакцията на цинк (твърда фаза) с разтвор на солна киселина (течна фаза). В хетерогенна система реакция винаги протича на границата между две фази, тъй като само тук реагентите, разположени в различни фази, могат да се сблъскат един с друг.
Химичните реакции обикновено се отличават със своите молекулярност, тези. от броя на молекулите, участващи във всеки елементарен акт на взаимодействие . На тази основа реакциите се разграничават между мономолекулни, бимолекулни и тримолекулни.
Мономолекулен се наричат реакции, при които елементарният акт е химична трансформация на една молекула , Например:
Бимолекулярни са считани реакции, при които елементарният акт се случва при сблъсък на две молекули, например:
IN тримолекулен При реакциите възниква елементарен акт по време на едновременния сблъсък на три молекули, например:
Сблъсъкът на повече от три молекули едновременно е почти невъзможен, така че на практика не се срещат реакции с по-голяма молекулност.
Скоростите на химичните реакции могат да варират значително. Химическите реакции могат да протичат изключително бавно, през цели геоложки периоди, като изветрянето на скалите, което е трансформацията на алумосиликатите:
K 2 O Al 2 O 3 6SiO 2 + CO 2 + 2H 2 O → K 2 CO 3 + 4SiO 2 + Al 2 O 3 2SiO 2 2H 2 O.
ортоклаз – фелдшпат, калиев кварц. пясък каолинит (глина)
Някои реакции възникват почти мигновено, например експлозията на черен барут, който е смес от въглища, сяра и селитра:
3C + S + 2KNO3 = N2 + 3CO2 + K2S.
Скоростта на химичната реакция служи като количествена мярка за интензивността на нейното протичане.
Общо взето под скоростта на химическа реакция разберете броя на елементарните реакционни актове, случващи се за единица време в единица реакционно пространство.
Тъй като за хомогенни процеси реакционното пространство е обемът на реакционния съд, тогава
за хомогенни реакциис Скоростта на химичната реакция се определя от количеството вещество, реагирало за единица време в единица обем.
Като се има предвид, че количеството вещество, съдържащо се в определен обем, характеризира концентрацията на веществото, тогава
скоростта на реакцията е стойност, показваща промяната в моларната концентрация на едно от веществата за единица време.
Ако при постоянен обем и температура концентрацията на един от реагентите намалява от с 1 към с 2 за периода от T 1 към T 2, тогава, в съответствие с определението, скоростта на реакция за даден период от време (средна скорост на реакция) е равна на:
Типично за хомогенни реакции размерът на скоростта V[mol/l·s].
Тъй като за хетерогенните реакции реакционното пространство е повърхност , върху която протича реакцията, тогава за хетерогенни химични реакции скоростта на реакцията се отнася до единицата повърхност, върху която протича реакцията. Съответно средната скорост на хетерогенна реакция има формата:
Където С– повърхност, върху която протича реакцията.
Измерението на скоростта за хетерогенни реакции е [mol/l·s·m2].
Скоростта на химичната реакция зависи от редица фактори:
естеството на реагиращите вещества;
концентрации на реагенти;
налягане (за газови системи);
температура на системата;
повърхност (за хетерогенни системи);
наличието на катализатор и други фактори в системата.
Тъй като всяко химическо взаимодействие е резултат от сблъсък на частици, увеличаването на концентрацията (броя на частиците в даден обем) води до по-чести сблъсъци и, като следствие, увеличаване на скоростта на реакцията. Зависимостта на скоростта на химичните реакции от моларните концентрации на реагентите се описва от основния закон на химичната кинетика - закон за масовото действие , който е формулиран през 1865 г. от Н. Н. Бекетов и през 1867 г. от К. М. Гулдберг и П. Вааге.
Закон за масовото действиегласи: скоростта на елементарна химична реакция при постоянна температура е право пропорционална на произведението на моларните концентрации на реагентите в степени, равни на техните стехиометрични коефициенти.
Уравнението, изразяващо зависимостта на скоростта на реакцията от концентрацията на всяко вещество, се нарича кинетично уравнение на реакцията .
Трябва да се отбележи, че законът за масовото действие е напълно приложим само за най-простите хомогенни реакции. Ако реакцията протича на няколко етапа, тогава законът е валиден за всеки етап и скоростта на сложен химичен процес се определя от скоростта на най-бавната реакция, която еограничаващ етап целият процес.
Общо взето, ако се получи елементарна реакция едновременно Tмолекули на материята АИ нмолекули на материята IN:
мА + нIN = СЪС,
тогава уравнението за скоростта на реакцията е (кинетично уравнение)има формата:
Където к– коефициент на пропорционалност, който се нарича скоростна константа химическа реакция; [ А А; [б] – моларна концентрация на веществото б; мИ н– стехиометрични коефициенти в уравнението на реакцията.
Да разбера физичен смисъл на константата на скоростта на реакцията , е необходимо да се вземат в уравненията, написани по-горе, концентрациите на реагиращите вещества [ А] = 1 mol/l и [ IN] = 1 mol/l (или приравнете техния продукт към единица), а след това:
От тук става ясно, че константа на скоростта на реакцията k е числено равно на скоростта на реакцията, при която концентрациите на реагентите (или техния продукт в кинетичните уравнения) са равни на единица.
Константа на скоростта на реакцията кзависи от природата на реагентите и температурата, но не зависи от концентрацията на реагентите.
За хетерогенни реакции концентрацията на твърдата фаза не е включена в израза за скоростта на химичната реакция.
Например, в реакцията на синтез на метан:
Ако реакцията настъпи в газовата фаза, нейната скорост се влияе значително от промяната в налягането в системата, тъй като промяната в налягането в газовата фаза води до пропорционална промяна в концентрацията. Така повишаването на налягането води до пропорционално увеличение на концентрацията, а намаляването на налягането съответно намалява концентрацията на газообразния реагент.
Промените в налягането практически нямат ефект върху концентрацията на течни и твърди вещества (кондензирано състояние на материята) и нямат ефект върху скоростта на реакциите, протичащи в течната или твърдата фаза.
Химичните реакции се извършват поради сблъсъка на частици от реагиращи вещества. Въпреки това, не всеки сблъсък на реагентни частици е такъв ефективен , т.е. води до образуване на реакционни продукти. Само частици с повишена енергия - активни частици , са способни да извършват химическа реакция. С повишаване на температурата кинетичната енергия на частиците се увеличава и броят на активните се увеличава, следователно скоростта на химичните процеси се увеличава.
Установява се зависимостта на скоростта на реакцията от температурата правилото на Вант Хоф : за всеки 10 0 C повишаване на температурата, скоростта на химичната реакция се увеличава два до четири пъти.
V 1 – скорост на реакцията при начална температура на системата T 1 , V 2 – скорост на реакцията при крайна температура на системата T 2 ,
γ – температурен коефициент на реакция (коефициент на Вант Хоф), равен на 2÷4.
Познаването на стойността на температурния коефициент γ позволява да се изчисли промяната в скоростта на реакцията с повишаване на температурата от T 1 към T 2. В този случай можете да използвате формулата:
Очевидно, когато температурата се повишава в аритметична прогресия, скоростта на реакцията нараства експоненциално. Колкото по-голяма е стойността на температурния коефициент g на реакцията, толкова по-голям е ефектът на температурата върху скоростта на реакцията.
Трябва да се отбележи, че правилото на Van't Hoff е приблизително и е приложимо само за приблизителна оценка на ефекта от малки промени в температурата върху скоростта на реакцията.
Енергията, необходима за протичане на реакциите, може да бъде осигурена от различни въздействия (топлина, светлина, електрически ток, лазерно лъчение, плазма, радиоактивно лъчение, високо налягане и др.).
Реакциите могат да бъдат разделени на термични, фотохимични, електрохимични, радиационно-химични и т.н. С всички тези влияния делът на активните молекули, които имат енергия, равна или по-голяма минималната енергия, необходима за дадено взаимодействие E min.
При сблъсък на активни молекули се получава т.нар активиран комплекс , в рамките на който се извършва преразпределението на атомите.
Енергията, необходима за увеличаване на средната енергия на молекулите на реагиращите вещества до енергията на активирания комплекс, се нарича енергия на активиране Ea.
Енергията на активиране може да се разглежда като определена допълнителна енергия, която молекулите на реагента трябва да придобият, за да преодолеят определен енергийна бариера . Така E a рав разликата между средната енергия на реагиращите частици д ref и енергия на активирания комплекс дмин. Енергията на активиране се определя от природата на реагентите. Значение E аварира от 0 до 400 kJ. Ако стойността E анадвишава 150 kJ, тогава такива реакции практически не протичат при температури, близки до стандартните.
Промяната в енергията на система по време на реакция може да бъде представена графично с помощта на следната енергийна диаграма (Фигура 6.1).
|
Ориз. 6.1. Енергийна диаграма на екзотермична реакция:
E out е средната енергия на изходните вещества; Еконд – средна енергия на реакционните продукти; E min – енергия на активирания комплекс; E act – енергия на активиране; ΔH р – топлинен ефект на химична реакция
От енергийната диаграма става ясно, че разликата между енергийните стойности на реакционните продукти и енергията на изходните вещества ще представлява топлинния ефект на реакцията.
E прод. – E ref. = ΔН р.
Според уравнение на Арениус,толкова по-висока е стойността на енергията на активиране ддейства, толкова по-голяма е константата на скоростта на химичната реакция кзависи от температурата:
д- енергия на активиране (J/mol),
Р - универсална газова константа,
T– температура в K,
А- константа на Арениус,
д= 2,718 – основата на естествените логаритми.
Катализатори- Това са вещества, които увеличават скоростта на химичната реакция. Те реагират с реагентите, за да образуват химичен междинен продукт и се освобождават в края на реакцията. Ефектът, който катализаторите оказват върху химичните реакции, се наричакатализа.
Например, смес от алуминиев прах и кристален йод при стайна температура не показва забележими признаци на взаимодействие, но капка вода е достатъчна, за да предизвика бурна реакция:
Разграничете хомогенна катализа (катализаторът образува хомогенна система с реагиращите вещества, например газова смес) и разнородни катализа (катализаторът и реагентите са в различни фази и каталитичният процес протича на границата на фазите).
За да се обясни механизмът на хомогенна катализа, най-широко използваната междинна теория (предложено от френския изследовател Сабатие и развито в трудовете на руския учен Н. Д. Зелински). Според тази теория бавен процес, например реакцията:
при наличие на катализатор става бързо, но на два етапа. В първия етап на процеса се образува междинно съединение на един от реагентите с катализатора А...кат.
Първи етап:
A + kat = A.∙. кат.
На втория етап полученото съединение образува активиран комплекс с друг реагент [ А.∙.кат.∙.Б], който се превръща в краен продукт ABс регенерация на катализатора кат.
Втори етап:
A.∙.kat + B = = AB + kat.
Междинното взаимодействие на катализатора с реагентите насочва процеса по нов път, характеризиращ се с по-ниска енергийна бариера. По този начин, Механизмът на действие на катализаторите е свързан с намаляване на енергията на активиране на реакцията поради образуването на междинни съединения.
Пример за това е бавна реакция:
2SO2 + O2 = 2SO3 бавно.
В промишления азотен метод за производство на сярна киселина азотният оксид (II) се използва като катализатор, което значително ускорява реакцията:
Хетерогенната катализа се използва широко в процесите на рафиниране на нефт. Катализаторите включват платина, никел, алуминиев оксид и др. Хидрогенирането на растително масло се извършва на никелов катализатор (никел върху кизелгур) и др.
Пример за хетерогенна катализа е окислението на SO 2 до SO 3 върху V 2 O 5 катализатор при производството на сярна киселина чрез контактен метод.
Наричат се вещества, които повишават активността на катализатора промоутъри (или активатори). В същото време самите промотори може да нямат каталитични свойства.
Каталитични отрови - чужди примеси в реакционната смес, водещи до частична или пълна загуба на активност на катализатора. По този начин, следи от фосфор и арсен причиняват бърза загуба на активност от V 2 O 5 катализатора в реакцията на окисляване на SO 2 до SO 3.
Много важни химически производства, като производството на сярна киселина, амоняк, азотна киселина, синтетичен каучук, редица полимери и др., се извършват в присъствието на катализатори.
Ускоряват се биохимичните реакции в растителните и животинските организми биохимични катализатори – ензими.
Остър Възможно е да се забави протичането на нежелани химични процеси чрез добавяне на специални вещества към реакционната среда - инхибитори. Например, за инхибиране на нежелани процеси на корозионно разрушаване на метали, различни инхибитори на металната корозия .
6.1.1. Въпроси за самоконтрол на теоретичните знания
по темата "Химична кинетика"
1. Какво изучава химичната кинетика?
2. Какво обикновено се разбира под термина "реактиви"?
3. Какво обикновено се разбира под термина „продукти на реакцията“?
4. Как се обозначават обратимите процеси в химичните реакции?
5. Какво обикновено се разбира под термина „активиран комплекс“?
6. Какво е елементарна реакция?
7. Какви реакции се считат за сложни?
8. Кой етап от реакциите се нарича лимитиращ?
9. Дефинирайте понятието „фаза“?
10. Какви системи се считат за хомогенни?
11. Какви системи се считат за разнородни?
12. Дайте примери за хомогенни системи.
13. Дайте примери за разнородни системи.
14. Какво се счита за „молекулярност“ на реакцията?
15. Какво се разбира под термина „скорост на химична реакция“?
16. Дайте примери за бързи и бавни реакции.
17. Какво се разбира под термина „скорост на хомогенна химична реакция“?
18. Какво се разбира под термина „скорост на хетерогенна химична реакция“?
19. От какви фактори зависи скоростта на химичната реакция?
20. Формулирайте основния закон на химичната кинетика.
21. Каква е константата на скоростта на химичните реакции?
22. От какви фактори зависи константата на скоростта на химичните реакции?
23. Концентрациите на кои вещества не са включени в кинетичното уравнение на химичните реакции?
24. Как скоростта на химичната реакция зависи от налягането?
25. Как скоростта на химичната реакция зависи от температурата?
26. Как се формулира „правилото на Ван’т Хоф“?
27. Какво е "температурен коефициент на химическа реакция"?
28. Дефинирайте понятието „енергия на активиране“.
29. Дефинирайте понятието „катализатор за химическа реакция“?
30. Какво е хомогенна катализа?
31. Какво е хетерогенна катализа?
32. Как се обяснява механизмът на действие на катализатора при хомогенна катализа?
33. Дайте примери за каталитични реакции.
34. Какво представляват ензимите?
35. Какво представляват промоутърите?
6.1.2. Примери за решаване на типични задачи
по темата "Химична кинетика"
Пример 1. Скоростта на реакцията зависи от контактната повърхност на реагентите:
1) сярна киселина с разтвор на бариев хлорид,
2) изгаряне на водород в хлор,
3) сярна киселина с разтвор на калиев хидроксид,
4) изгаряне на желязо в кислород.
Скоростта на хетерогенните реакции зависи от контактната повърхност на реагиращите вещества. Сред горните реакции, хетерогенна реакция, т.е. характеризиращ се с наличието на различни фази е реакцията на горене на желязо (твърда фаза) в кислород (газова фаза).
Отговор. 3.
Пример 2.Как ще се промени скоростта на реакцията?
2H 2(g) + O 2(G) = 2H 2 O (g)
когато концентрацията на изходните вещества се удвои?
Нека напишем кинетичното уравнение на реакцията, което установява зависимостта на скоростта на реакцията от концентрацията на реагентите:
V 1 = к [н 2 ] 2 · [O 2 ].
Ако концентрациите на изходните вещества се удвоят, кинетичното уравнение ще приеме формата:
V 2 = к (2 [н 2 ]) 2 2 [O 2 ] = 8 к [н 2 ] 2 · [O 2 ], т.е.
Когато концентрацията на изходните вещества се удвои, скоростта на тази реакция се увеличи 8 пъти.
Отговор. 8.
Пример 3.Как ще се промени скоростта на реакцията, ако общото налягане в системата CH 4 (G) + 2O 2 (G) = CO 2 (G) + 2H 2 O (G) се намали 5 пъти?
В съответствие с кинетичното уравнение на реакцията ще се определи скоростта на тази реакция:
V 1 = к[CH4] · [O2]2.
Когато налягането намалее с фактор пет, концентрацията на всяко газообразно вещество също ще намалее с фактор пет. Кинетичното уравнение на реакцията при тези условия ще бъде както следва:
може да се определи, че скоростта на реакцията е намаляла 125 пъти.
Отговор. 125.
Пример 4.Как ще се промени скоростта на реакция, характеризираща се с температурен коефициент на реакция 3, ако температурата в системата се повиши от 20 на 60°C?
Решение. Според правилото на Вант Хоф
Когато температурата се повиши с 40 0 C, скоростта на тази реакция се увеличи 81 пъти
Отговор. 81.
6.1.3. Въпроси и упражнения за самоподготовка
Скорост на химичните реакции
1. В зависимост от агрегатното състояние на реагиращите вещества химичните реакции се разделят на:
1) екзотермични и ендотермични,
2) обратими и необратими,
3) каталитични и некаталитични,
4) хомогенни и разнородни.
2. Посочете броя или сумата от условните числа, под които са дадени хомогенните реакции:
3. Посочете броя или сумата от условните числа, под които са дадени изрази, които могат да се използват за изчисляване на скоростта на хомогенна реакция:
4. Единицата за измерване на скоростта на хомогенна реакция може да бъде:
1) mol/l s,
3) mol/l·,
4) l/mol·s.
5. Посочете броя или сумата на условните числа, под които са дадени справедливи изрази. По време на хомогенна реакция
А + 2б® 2 ° С + д:
1) концентрация АИ INнамаляват
2) концентрация СЪСнараства по-бързо от концентрацията д,
4) концентрация INнамалява по-бързо от концентрацията А,
8) скоростта на реакцията остава постоянна.
6. Какво число е показано на линията, която правилно отразява промяната във времето в концентрацията на веществото, образувано в реакцията:
|
|
|
|
|
|
|
|
7. Промяна във времето в концентрацията на изходното вещество в реакция, която протича до завършване, точноописва кривата:
|
|
|
|
|
|
9. Посочете броя или сумата от конвенционалните числа, под които са дадени реакциите, чиято скорост не зависиот какво вещество се изчислява?
10. Посочете броя или сумата на условните числа, под които са дадени факторите, влияещи върху скоростта на реакция:
1) естеството на реагиращите вещества,
2) концентрация на реагиращи вещества,
4) температура на реакционната система,
8) наличието на катализатор в реакционната система.
11. Основният закон на химичната кинетика установява зависимостта на скоростта на реакцията от:
1) температури на реагиращите вещества,
2) концентрации на реагиращи вещества,
3) естеството на реагиращите вещества,
4) време за реакция.
12. Посочете броя или сбора на условните числа, под които са дадени верните твърдения. Химична кинетика:
1) раздел на физиката,
2) изучава скоростта на химична реакция,
4) използва закона за масовото действие,
8) изучава зависимостта на скоростта на реакциите от условията на тяхното възникване.
13. Я.Х. Вант Хоф:
1) първият лауреат на Нобелова награда по химия,
2) изследва зависимостта на скоростта на реакцията от температурата,
4) изследва зависимостта на скоростта на реакцията от концентрацията на веществата,
8) формулира закона за масовото действие.
14. При същите условия реакцията протича по-бързо:
1) Ca + H2O®
3) Mg + H2O®
4) Zn + H2O®
15. Скоростта на отделяне на водород е най-висока при реакцията:
1) Zn + HCl (5% разтвор)®
2) Zn + HCl (10% разтвор)®
3) Zn + HCl (15% разтвор)®
4) Zn + HCl (30% разтвор)®
16. Концентрация на реагента не влияевърху скоростта на реакцията, ако това вещество се включи в реакцията в:
1) твърдо състояние,
2) газообразно състояние,
3) разтворено състояние.
17. Изчислете средната скорост на реакцията A + B = C (mol/l×s), ако е известно, че първоначалната концентрация на A е била 0,8 mol/l, а след 10 секунди е станала 0,6 mol/l.
1) 0,2, 2) 0,01, 3) 0,1, 4) 0,02.
18. С колко mol/l са намалели концентрациите на веществата А и В при реакцията? А + 2б® 3 ° С, ако се знае, че през същото време концентрацията СЪСсе увеличава с 4,5 mol/l?
д СЪС A D СЪСб
19. Изчислете средната скорост на реакцията 2CO + O 2 ® 2CO 2 (mol/l×s), ако е известно, че първоначалната концентрация на CO е била 0,60 mol/l, а след 10 секунди е станала 0,15 mol/l . С колко mol/l се е променила концентрацията на CO 2 за този период от време?
3) 0,045; 0,045,
20. Колко градуса трябва да се нагрее системата, така че скоростта на протичащата в нея реакция да се увеличи 2–4 пъти?
1) 150, 2) 10, 3) 200, 4) 50.
21. Скоростта на реакцията при 20°C е 0,2 mol/l×s. Определете скоростта на реакцията при 60°C (mol/l×s), ако температурният коефициент на скоростта на реакцията е 3.
1) 16,2, 2) 32,4, 3) 8,1, 4) 4,05.
22. Емпирична зависимост на скоростта на реакцията от температурата точноотразява уравнението:
23. Скоростта на реакцията при 20°C е 0,08 mol/l×s. Изчислете скоростта на реакцията при 0°C (mol/l×s), ако температурният коефициент на скоростта на реакцията е 2.
1) 0,16, 2) 0,04, 3) 0,02, 4) 0,002.
24. Колко пъти ще се увеличи скоростта на реакцията при повишаване на температурата с 40°C, ако температурният коефициент на скоростта на реакцията е 3?
1) 64, 2) 243, 3) 81, 4) 27.
25. С колко градуса трябва да се повиши температурата, за да се увеличи скоростта на реакцията 64 пъти, ако температурният коефициент на скоростта на реакцията е 4?
1) 60, 2) 81, 3) 27, 4) 30.
26. Изчислете температурния коефициент на скоростта на реакцията, ако е известно, че при повишаване на температурата с 50 o C скоростта на реакцията се увеличава 32 пъти.
1) 3, 2) 2, 3) 4, 4) 2,5.
27. Причината за увеличаване на скоростта на реакцията с повишаване на температурата е увеличаването на:
1) скоростта на движение на молекулите,
2) броя на сблъсъците между молекулите,
3) делът на активните молекули,
4) стабилност на молекулите на реакционните продукти.
28. Посочете броя или сумата от условните числа, под които са дадени реакциите, за които MnO 2 е катализатор:
1) 2KClO 3 ® 2KCl + 3O 2,
2) 2Al + 3I 2 ® 2AlI 3,
4) 2H 2 O 2 ® 2H 2 O + O 2,
8) 2SO 2 + O 2 ® 2SO 3 .
29. Посочете числото или сумата от условните числа, под които са дадени верните отговори. Използвайки каталитични реакции в промишлеността, се получава следното:
1) солна киселина,
2) сярна киселина,
4) амоняк,
8) азотна киселина.
30. Посочете броя или сбора на условните числа, под които са дадени верните отговори. Катализатор:
1) участва в реакцията,
2) използва се само в твърдо състояние,
4) не се изразходва по време на реакцията,
8) задължително съдържа метален атом в състава си.
31. Посочете числото или сумата от условните числа, под които са дадени верните отговори. Следните се използват като катализатори:
32. Веществата, които намаляват активността на катализатора, се наричат:
1) промоутъри,
2) регенератори,
3) инхибитори,
4) каталитични отрови.
33. Каталитичен не ереакция:
1) (C 6 H 10 O 5) н + н H2O® н C6H12O6,
целулоза
2) 2SO 2 + O 2 ® 2SO 3,
3) 3H 2 + N 2 ® 2NH 3 ,
4) NH3 + HCl® NH4Cl.
34. Под кой номер е дадено уравнението на хомогенната катализа:
35. Механизмът на действие на катализатора правилно отразява твърдението. Катализатор:
1) увеличаване на кинетичната енергия на първоначалните частици, увеличава броя на техните сблъсъци,
2) образува междинни съединения с изходни вещества, които лесно се превръщат в крайни вещества,
3) без да взаимодейства с изходните вещества, насочва реакцията по нов път,
4) намаляването на кинетичната енергия на първоначалните частици увеличава броя на техните сблъсъци.
36. Ролята на промотора в каталитична реакция е, че той:
1) намалява активността на катализатора,
2) повишава активността на катализатора,
3) води реакцията в желаната посока,
4) предпазва катализатора от каталитични отрови.
37. Ензими:
1) биологични катализатори,
2) имат протеинова природа,
4) не се различават по спецификата на действие,
8) ускоряват биохимичните процеси в живите организми.
38. Реакцията е хетерогенна:
39. Посочете числото или сумата от условните числа, под които са дадени верните отговори. За да увеличите скоростта на изгаряне на въглища: C + O 2 ® CO 2, трябва:
1) увеличаване на концентрацията на O 2,
2) увеличаване на концентрацията на въглища,
4) смилайте въглищата,
8) увеличаване на концентрацията на въглероден диоксид.
40. Ако реагент А се включи в реакцията: A t + X газ ® в твърдо състояние, тогава скоростта на реакцията се влияе от:
1) концентрация А,
2) повърхностна площ на контакт между A и X,
4) моларна маса А,
8) концентрация на вещество X.
41. Размерът на скоростта на хетерогенна реакция е:
1) mol/l, 2) mol/cm 3 ×s,
3) mol/l×s 4) mol/cm 2 ×s.
42. Посочете броя или сбора на условните числа, под които са дадени верните отговори. Използва се принципът на кипящия слой:
1) за увеличаване на контактната повърхност на реагентите,
2) при изпичане на пирит,
4) по време на каталитичен крекинг на петролни продукти,
8) за регенериране на активността на катализатора.
43. Най-малко
1) Na + H 2 O ® 2) Ca + H 2 O ®
3) K + H2O® 4) Mg + H2O®
44. Графиката показва енергийни диаграми на некаталитичната и каталитичната реакция на разлагане на йодоводород. Промяната в енергията на активиране отразява енергийния сегмент:
1) b, 2) ° С, 3) д, 4) б–° С.
45. Най-великияРеакцията, описана от схемата, има енергия на активиране:
1) AgNO 3 + KCl ® AgCl + KNO 3,
2) BaCl 2 + K 2 SO 4 ® BaSO 4 + 2KCl,
3) 2Na + 2H 2 O ® 2NaOH + 2H 2,
6.2. Химически баланс.
Наред с практически необратими химични реакции:
СaCl 2 + 2AgNO 3 = Ca(NO 3) 2 + 2AgCl↓ и др.
Известни са много процеси, когато химическата трансформация не е завършена, но възниква равновесна смес от всички участници и продукти на реакцията, разположени както от лявата, така и от дясната страна на уравнението на стехиометричната реакция. Така при стандартни условия системата е обратима:
Нека разгледаме характеристиките на възникването на обратими процеси, използвайки примера на система, която като цяло има формата:
При условие, че правата → и обратната ← реакции протичат на един етап, съгласно закона за масовото действие, стойностите на скоростта за правата реакция ( Vдиректно) и обратно ( Vреакциите се описват със следните кинетични уравнения:
Където кправ И к arr - скоростни константи, съответно на права и обратна реакция.
В началния момент от време (виж фиг. 6.2) концентрациите на изходните вещества [A] и [B] и следователно скоростта на директната реакция имат максимална стойност. Концентрациите на реакционните продукти [C] и [D] и скоростта на обратната реакция в началния момент са нула. По време на реакцията концентрациите на изходните вещества намаляват, което води до намаляване на скоростта на предната реакция. Увеличават се концентрациите на реакционните продукти и съответно скоростта на обратната реакция. Накрая идва момент, в който скоростите на правата и обратната реакция стават равни.
Състоянието на системата, в която V прав = V обр. Наречен химично равновесие. Този баланс е динамичен , тъй като в системата протича двупосочна реакция - в пряка ( АИ б– реактиви, ° СИ д– продукти) и обратно ( АИ б– продукти, C и д– реактиви) указания.
V обр.
Време за реакция
Ориз. 6.2. Зависимост на скоростта на правата и обратната реакция
от момента на тяхното възникване.
В обратима система в равновесие се наричат концентрациите на всички участници в процеса равновесни концентрации, тъй като в този случай както правата, така и обратната реакция протичат постоянно и с еднаква скорост.
Количествена характеристика на химичното равновесие може да бъде получена с помощта на подходящия кинетични уравнения :
Тъй като константите на скоростта на реакцията при фиксирана температура са постоянни, съотношението също ще бъде постоянно
Наречен константа на химичното равновесие. Приравнявайки десните части на кинетичните уравнения за правата и обратната реакция, можем да получим:
Където K r– константа на химичното равновесие, изразена чрез равновесни концентрации на участниците в реакцията.
Константата на химичното равновесие е съотношението на произведението на равновесните концентрации на реакционните продукти към произведението на равновесните концентрации на изходните вещества по степени на техните стехиометрични коефициенти.
Например за обратима реакция
Изразът за равновесната константа има формата:
Ако в процеса на химическа трансформация участват две или повече фази, тогава изразът за равновесната константа трябва да отчита само тези от тях, в които настъпват промени в концентрациите на реагентите. Например в израза за равновесната константа за системата
общият брой молове газообразни вещества преди и след реакцията остава постоянен и налягането в системата не се променя. Равновесието в тази система не се измества при промяна на налягането.
Влиянието на температурните промени върху изместването на химичното равновесие.
Във всяка обратима реакция една от посоките съответства на екзотермичен процес, а другата на ендотермичен процес. Така че в реакцията на синтез на амоняк, правата реакция е екзотермична, а обратната реакция е ендотермична.
1) концентрациите на H 2, N 2 и NH 3 не се променят с времето,
3) броят на молекулите на NH3, разпадащи се за единица време, е равен на половината от общия брой на молекулите на H2 и N2, образувани през това време,
4) общият брой на молекулите H 2 и N 2, превърнати в NH 3 за единица време, е равен на броя на молекулите NH 3, образувани през същото време.
49. Посочете броя или сумата от условните числа, под които са дадени верните отговори. Химичното равновесие в системата: 2SO 2 + O 2 2SO 3 ∆Н ˂0 ще бъде нарушено от:
1) намаляване на налягането в системата,
2) отопление,
4) повишаване на концентрацията на кислород.
50. Посочете числото или сумата от условните числа, под които са дадени верните отговори. За да изместите равновесието в системата N 2 + 3H 2 2NH 3 ∆H ˂0 наляво, трябва:
1) въведете H 2 в системата,
2) отстранете NH3 от системата,
4) повишаване на кръвното налягане,
8) повишаване на температурата.
51. За да се измести равновесието на реакцията 2SO 2 + O 2 2SO 3 ∆Н ˂0 надясно, е необходимо:
1) загрейте системата,
2) въведете O 2 в системата,
4) въведете SO 3 в системата,
8) намаляване на налягането в системата.
52. Правилото на Льо Шателие (принцип) не съответстваизявление:
1) повишаването на температурата измества равновесието към ендотермична реакция;
2) намаляването на температурата измества равновесието към екзотермична реакция;
3) повишаването на налягането измества равновесието към реакция, водеща до увеличаване на обема;
N 2 + O 2 ∆H ˂0.2H 2 O (пара), 2NH 3 кат. 3H2 + N2. Б,
2) к 1 H = к 2 2 ,
67. За равновесната константа ( Kp) засяга:
1) налягане,
2) температура,
3) концентрация,
4) катализатор.