Водородът (паус от латински: лат. Hydrogenium - hydro = “вода”, gen = “генериращ”; hydrogenium - “генериращ вода”; означава се със символа H) е първият елемент от периодичната таблица на елементите. Широко разпространен в природата. Катионът (и ядрото) на най-разпространения изотоп на водорода, 1H, е протонът. Свойствата на ядрото 1H позволяват широко използване на ЯМР спектроскопия при анализа на органични вещества.
Три изотопа на водорода имат свои имена: 1 H - протий (H), 2 H - деутерий (D) и 3 H - тритий (радиоактивен) (T).
Простото вещество водород - Н 2 - е лек безцветен газ. Когато се смеси с въздух или кислород, той е запалим и експлозивен. Нетоксичен. Разтворим в етанол и редица метали: желязо, никел, паладий, платина.
История
Отделянето на запалим газ при взаимодействието на киселини и метали се наблюдава през 16-17 век в зората на формирането на химията като наука. Михаил Василиевич Ломоносов също директно посочи неговата изолация, но вече определено знаеше, че това не е флогистон. Английският физик и химик Хенри Кавендиш изследва този газ през 1766 г. и го нарече „горим въздух“. При изгаряне „запалимият въздух“ произвежда вода, но придържането на Кавендиш към теорията за флогистона му попречи да направи правилните заключения. Френският химик Антоан Лавоазие, заедно с инженера J. Meunier, използвайки специални газометри, през 1783 г. извършват синтез на вода и след това нейния анализ, разлагайки водни пари с горещо желязо. По този начин той установи, че "горимият въздух" е част от водата и може да бъде получен от нея.
произход на името
Лавоазие дава на водорода името hydrogène (от старогръцки ὕδωρ - вода и γεννάω - раждам) - „раждащ вода“. Руското наименование "водород" е предложено от химика М. Ф. Соловьов през 1824 г. - по аналогия с "кислород" от М. В. Ломоносов.
Разпространение
Във Вселената
Водородът е най-често срещаният елемент във Вселената. Той представлява около 92% от всички атоми (8% са атоми на хелий, делът на всички останали елементи взети заедно е по-малко от 0,1%). По този начин водородът е основният компонент на звездите и междузвездния газ. При условия на звездни температури (например повърхностната температура на Слънцето е ~ 6000 °C) водородът съществува под формата на плазма; в междузвездното пространство този елемент съществува под формата на отделни молекули, атоми и йони и може да образува молекулярни облаци, които се различават значително по размер, плътност и температура.
Земната кора и живите организми
Масовата част на водорода в земната кора е 1% - той е десетият най-разпространен елемент. Неговата роля в природата обаче се определя не от масата, а от броя на атомите, чийто дял сред другите елементи е 17% (второ място след кислорода, чийто дял на атомите е ~ 52%). Следователно значението на водорода в химичните процеси, протичащи на Земята, е почти толкова голямо, колкото и на кислорода. За разлика от кислорода, който съществува на Земята както в свързано, така и в свободно състояние, почти целият водород на Земята е под формата на съединения; Само много малко количество водород под формата на просто вещество се съдържа в атмосферата (0,00005% от обема).
Водородът е част от почти всички органични вещества и присъства във всички живи клетки. В живите клетки водородът представлява почти 50% от броя на атомите.
Касова бележка
Промишлените методи за производство на прости вещества зависят от формата, в която съответният елемент се намира в природата, тоест каква може да бъде суровината за неговото производство. Така кислородът, който е наличен в свободно състояние, се получава физически – чрез отделяне от течния въздух. Почти целият водород е под формата на съединения, така че за получаването му се използват химични методи. По-специално могат да се използват реакции на разлагане. Един от начините за производство на водород е чрез разлагането на водата чрез електрически ток.
Основният промишлен метод за производство на водород е реакцията на метан, който е част от природния газ, с вода. Извършва се при висока температура:
CH 4 + 2H 2 O = CO 2 + 4H 2 −165 kJ
Един от лабораторните методи за производство на водород, който понякога се използва в промишлеността, е разлагането на водата чрез електрически ток. Обикновено водородът се произвежда в лабораторията чрез взаимодействие на цинк със солна киселина.
ВОДОРОД, H, химичен елемент, пореден номер 1; атомно тегло 1,008 (1,00775). Преди това атомното тегло на водорода се приемаше за единица; в този случай атомното тегло на кислорода трябваше да се счита за равно на 15,879 и атомните тегла на много други елементи бяха изразени като смесени числа, което се оказа неудобно за стехиометрични изчисления; следователно текущото прието число за атомното тегло на кислорода е 16; В тази връзка атомното тегло на водорода се оказа равно на 1,008. Наскоро бяха направени опити да се обясни дробната част от атомното тегло на водорода чрез релативистичен ефект. Независимо от това, последните постижения в областта на теоретичната химия и физика потвърдиха казаното в самото начало на 19 век. Ние предложихме хипотезата, че водородът е най-простият елемент, от който са изградени всички други химични елементи. Наистина, водородните атоми се освобождават заедно с хелиевите атоми по време на радиоактивното и изкуствено разпадане на много химически елементи, с освобождаването в някои случаи на много значителни (сравнително) количества енергия. Тази роля на водорода в образуването на други химични елементи съответства на неговото разпространение във Вселената: спектрите на всички светила, включително слънцето, съдържат линии на водород и много от светилата очевидно се състоят изключително от натрупвания на горещ водороден газ.
Физични свойства . Водородът е газ без цвят, вкус и мирис; това е най-лекото от всички известни до момента вещества: водородът е 1472 пъти по-лек от въздуха и 16 пъти по-лек от кислорода. Един литър водород на географска ширина 45° тежи при нормални условия 0,089871 ± 0,000005 g; точка на кипене -252,7°C; точка на топене -259.1°C; критична температура -239,9°C; критично налягане 12,8 Atm; критична плътност 0,531 g cm -3 ; специфично тегло на водорода при точка на кипене 0,07081 (спрямо въздуха); водороден коефициент на разширение 0,0036613 при 760 mm налягане между 0 и 100 °C; топлопроводимост 0.0322 при -252°C (Eucken), 0.4994 при 100°C, 0.445 при 40°C (Kundt und Warburg); специфичната топлина при 15°C е 14,5 джаула на грам-атом, при температури от 0 до 2500°C е 2,89 (c v); молекулярна топлина 5.82 (при температура 0-2500°C); латентната топлина на изпарение при точката на кипене е 0,450 килоджаула на грам-атом; скоростта на звука във водорода е около 1270 m/sec при 0°C (Dulong). При обикновени температури водородът е перфектен газ. Коефициент на дифузия на водород спрямо кислород = 0,677 cm 3 sec -1 при 0°C и 760 mm; 1 g водород при 0°C и 760 mm заема обем от 11,1176 литра. Теглото на водороден атом (според Спиъринг) във всеки случай не надвишава 2,5 десетмилиардни от g; вискозитетът на водорода при 20°C е 88,7 х 10 -6 поаза; повърхностното напрежение при точката на кипене е 1,91; Индексът на пречупване за линията Hg 5790 Ӑ при точката на кипене е 1,197. Водородът предлага по-малко съпротивление при преминаването на електрическа искра от кислорода, азота във въздуха и въглеродния окис. Водородът е много разтворим във вода: при температура 0-24°C 100 обема вода разтварят 1,93 обема водород. Въгленът кондензира водород върху повърхността си, а 1 cm 3 въглен адсорбира (при 0°C) 1,5 cm 3 водород. Водородът може да проникне през порести тела при обикновени температури; през платина, паладий и желязо - при червена топлина; при температура от около 1300°C, водородът дифундира дори през стените на разтопени кварцови тръби; Водородът дифундира през порестата стена на глинен съд със скорост 4 пъти по-голяма от скоростта на кислорода. Различни метали, намиращи се във водородна атмосфера, абсорбират водород и го освобождават обратно само когато температурата се повиши; при студ това поглъщане е незначително, при червена топлина е много значително; Тази оклузия или разтворимост на водорода в металите обяснява факта, че водородът може да проникне в металите; Водородът прониква най-лесно през паладий; калцинираните паладиеви листа абсорбират 376 обема водород при обикновена температура, 643 при 97°C; Освен това е интересно, че във вакуум металите не връщат водород, а го освобождават само при температура, близка до червената топлина. Абсорбцията на водород от металите също зависи от състоянието на метала: металният прах в повечето случаи абсорбира повече водород от легирания, валцуван или кован метал. Процесът на абсорбция на водород от метали е придружен от отделяне на значително количество топлина. Течният водород е бистра, безцветна течност с ниско повърхностно напрежение. Критичната температура на водорода е 239,9°C, критичното налягане е 12,8 Atm. Течният водород не провежда електричество, неговата топлина на изпаряване близо до точката на кипене е 200 cal; специфична топлина 6,4; атомният обем при точката на кипене е 14,3 cm 3, а плътността е 0,07. Когато газообразният водород е изложен на волтова дъга между волфрамови електроди или когато водородът преминава през зона на електрически разряд, молекулярният водород се дисоциира на атоми на особено активен атомен водород, които се комбинират обратно в молекули Н 2 с освобождаване на значително количество топлина (около 100 000 кал).
Химични свойства . При обикновени температури водородът е слабо активен елемент, свързва се само с флуор (с който реагира дори при температура -210°C) и литий. Когато водородът се нагрява с алкални, алкалоземни (с изключение на магнезий и берилий) метали и с онези редкоземни метали, които са по-основни по природа, се образуват хидриди на тези метали, например: KH, CaH 2, LaH 3. В алкални хидриди (като LiH) водородът функционира като анион, а не като катион. Водородът се свързва с хлора на тъмно при стайна температура изключително бавно, но ако смес от един обем водород с един обем хлор се освети с химически активни лъчи, тогава и двата газа се комбинират експлозивно. Водородът реагира с други халогени и с елементи от кислородната група само при по-високи температури. Смесен с кислород в съотношение 2:1, водородът образува експлозивна смес, която гори при запалване или преминаване на електрическа искра със силна експлозия. При изгаряне на 2,02 g водород с 16 g кислород се отделят 68360 cal. Скоростта на разпространение на експлозия на експлозивен газ е 2500 m/sec. Фино натрошената платина може да запали смеси от водород с кислород или въздух. Водородът се свързва с азот изключително бавно: дори при червена топлина скоростта на реакцията е изключително ниска; но дори и при по-нататъшно повишаване на температурата, условията на равновесие за обратимата реакция на свързване на водород с азот са такива, че в сместа от реагиращи газове не се образува значителна концентрация на NH3. Водородът действа редуциращо върху разтвори на сребърни соли и върху платинов хлорид дори при налягане от една атмосфера; при повишено налягане на водорода други метали също се редуцират от техните соли (например Hg от сол на живачна киселина). При високи температури водородът редуцира много неорганични съединения: оксиди, серни съединения и др. При високи налягания и температури водородът редуцира, както показват В. Н. Ипатиев и неговата школа, редица соли, когато действат във водни разтвори. В присъствието на някои метални катализатори, особено Ni, Co, както и някои метални оксиди, водородът има способността да хидрогенира ненаситени ароматни съединения при нагряване, както и да редуцира други органични съединения (Sabatier и Sanderen, Ipatiev). В присъствието на колоидни Pt и Pd редица подобни процеси протичат и в студа (Paal Skita, Willstatter, Fokin, Zelinsky). Под въздействието на α-лъчи на излъчване или електрически разряд при понижено налягане, водородът преминава с едновременно намаляване на обема си в активен водород. Активният водород може директно да се свързва със сяра и фосфор и да редуцира As 2 O 3 и KMnO 4 .
Производство на водород в технологиите . Най-простите методи за производство на водород са в същото време най-малко рентабилни, когато се прилагат в технологията; поради което се използват само във военновременни условия; Тези методи включват производството на водород чрез действието на киселини върху метали, чрез действието на разяждащи основи върху алуминий, цинк или феросилиций (силикол) и др. Военната технология е разработила редица методи и препарати (хидрогенит, хидролит, алуминиева амалгама , хидрон или сплав на натрий с олово), които са удобни за транспортиране и позволяват лесно и бързо производство на водород в областта на аеронавтиката с помощта на мобилни устройства. Но техническото производство на водород за промишлени цели е в пъти по-голямо от необходимостта от водород за военни нужди и се основава на съвсем други процеси. Значителна част от водорода, произведен от световната индустрия, се изразходва за синтеза на амоняк в Хабер. При този процес обаче първоначалният водород не влиза в производствения процес по метода на BASF в чист вид, а вече е смесен с необходимото количество азот. Смес от генераторен газ, воден газ и водна пара, преминавайки през контактна маса (оксиди на метали от желязната група), влиза в химическо взаимодействие и въглеродният оксид CO, съдържащ се във водата и генераторния газ, реагира с водна пара съгласно уравнение:
Въглеродният диоксид се абсорбира от вода при високо налягане; Сместа се пречиства от останалия СО чрез преминаване през амонячен разтвор на меден оксид. В резултат на това, с правилното съотношение на смесване на воден газ с генераторен газ, който съдържа, в допълнение към другите газове, непроменен азот от въздуха, се получава смес от азот и водород директно в съотношението N 2: 3H 2, необходимо за синтез на амоняк.
В случаите, когато д.б. Ако се получи само водород, без никаква азотна добавка, е необходимо да се използва воден газ, а не генераторен газ, съдържащ азот, за отделяне на водород от водна пара. В този случай взаимодействието между водната пара и редуциращия газ протича съгласно уравнение (I). Този процес е обратим и положението на неговото равновесие зависи до голяма степен от температурата, а скоростта на реакцията зависи и от използването на подходящи катализатори. Когато водната пара взаимодейства с горещ кокс при температура 800°C, основно се образуват водород и въглероден диоксид съгласно уравнението:
междувременно при температури над 1000°C се образува воден газ, т.е. смес от водород с въглероден оксид съгласно уравнение (I). Този метод, разработен от BASF, произвежда над 400 милиона m 3 (35 000 тона) водород годишно. За да се отдели водород от смес от газове, най-добре е първо да се освободи от CO 2 [чрез промиване с вода под високо налягане, абсорбиране на CO 2 с основи или соли на въглероден диоксид, импрегниране на въглища със сулфатни, силикатни и хлоридни соли (An. P. 7718, 7719, 7720, Diefenbach and Moldenhauer)]. Отделянето на водород от CO е много по-трудно. С понижаването на температурата обаче скоростта на реакцията намалява значително; следователно е необходимо да се проведе реакцията съгласно уравнение (I) и да се намерят удобни методи за отделяне на водород от CO от воден газ, образуван при по-висока температура. Тези методи се основават на свързването на CO при високо налягане (над 100 Atm) с амонячен разтвор на меден оксид. В същото време беше открито, че медният хлорид е малко полезен за тази цел поради разрушителния му ефект върху железните части на оборудването; следователно, съгласно G.P. 289694, медният оксид, разтворен в амоняк или амониев карбонат, се използва за абсорбиране на CO. За да се предотврати наблюдаваното отлагане на метална мед върху железните части на оборудването, малки количества кислород или въздух се добавят към водния газ, който окислява металната мед обратно до меден оксид. Предлага се също да се добави по-голямо количество кислород към газовата смес, така че част от Cu 2 O да се окисли до CuO; медният оксид от своя страна окислява CO, като се редуцира отново до Cu 2 O. В допълнение, въглеродният оксид, както е посочено в някои патенти, може. се превръща в натриева мравчена киселина, когато се третира под налягане от 50 Atm с разтвор на много концентриран натриев хидроксид.
Наред с този метод широко се използва методът за разлагане на водна пара при контакт с желязо (по-специално, най-често срещаният е методът на Месершмит, управляван от компанията Карл Франк в Бремен, и по-специално методът BAMAG). През 1918 г. заводите на BAMAG произвеждат до 125 милиона m3 водород годишно. Този метод също така позволява да се получи сравнително чист водород отделно, независимо от азота. Съгласно метода на Франк и Каро (G.P. 174324), предварително изсушен воден газ, съдържащ приблизително 50% H2, 40% CO, 5% CO2, 4,5% N2 и 0,5% O2, се пропуска при висока температура над калциевия карбид ; още след първото преминаване се получава газ, съдържащ от 99 до 99,6% Н2; N 2 се свързва с карбида, за да образува цианамид, а CO, CO 2 и O 2 се комбинират, за да образуват CaO и CaCO 3; В същото време сред продуктите на реакцията се образува и графит. Но идеята на А. Франк, реализирана от обществото Линде, която се състоеше в използването на метода на кондензация с помощта на хладилни машини за отделяне на водород от воден газ, придоби много по-голямо техническо значение. Този метод - Linde-Frank-Caro - е разработен със съдействието на BAMAG (G.P. 254043 и 261735 и Swiss P. 56594). С оглед на факта, че точката на кипене на H 2 е 20,4°K, а точката на кипене на CO е 82°K, и двата газа могат. разделени един от друг чрез фракционирана кондензация. При точката на кипене на течен въздух и атмосферно налягане не може да се използва смес от 50% H 2 и 50% CO. разделени по посочения начин. Но при -197°C, част от CO кондензира в течност; при -205°C, парциалното налягане на парите на течния CO не надвишава 1/7 Atm, а дестилиращият газ съдържа само 14% CO. Чрез по-нататъшно намаляване на температурата или увеличаване на налягането могат да се постигнат още по-благоприятни резултати. И така, при налягане от 50 Atm и температура от -197 ° C, парциалното налягане на CO е 0,5 Atm, а парциалното налягане на H2 е 49,5 Atm, т.е. съдържанието на CO в сместа е 0,5: 50 = 1 % . При -203°C и 50 Atm водородът съдържа само 0,3% CO примеси. Такова значително охлаждане на водния газ е възможно само с използването на течен въздух (или течен азот при понижено налягане; последният е по-рентабилен), тъй като водният газ, поради значителното съдържание на H 2 в него, проявява само много леко охлаждане при понижаване на налягането (незначителен ефект на Джаул - Томсън).
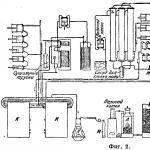
Диаграма на процеса на втечняване на CO е показана на фиг. 1. Воден газ d.b. изчистени от CO2. За да се спести потреблението на NaOH, Бедфорд предложи "промиване" на водния газ с вода под високо налягане, след което той съдържа само 0,3 - 0,5% CO 2.
За да се пречисти газът и да се отстранят тези следи от CO 2, той се обработва под налягане с натриева вар. Влиза сгъстен воден газ Аи се охлажда от противостудени газове; в този случай СО кондензира в течност и се събира b. Клапан Vпонижава налягането на CO парите, след което те излизат Жпрез дпри стайна температура. На свой ред, водородът напуска д. Необходимият за охлаждане течен въздух се намира (схематично) в ч. Водородът, изолиран по описания метод, не съдържа лесно кондензиращи примеси (CO 2, O 2, CH 4 = 0%), но също така съдържа от 2 до 1,7% CO и от 1,0 до 0,8% N 2; Че. съдържанието на чист водород в него е 97,0-97,5%. Такъв водород със специфично тегло 0,094 е доста подходящ за металостроенето, металургията и аеронавтиката. Въглеродният окис, кондензиран по време на този процес, съдържа 80-85% CO и се използва като горим газ за покриване на разходите за гориво в предприятието. Полученият въглероден окис CO е достатъчен за тази цел вече в инсталации с капацитет от 100 m 3 /h водород. При големи инсталации има дори излишък на CO, който може да се използва като гориво за процеса на фракциониране на използването на течен въздух на O 2 и Na. Първият се използва за автогенно заваряване, вторият - за синтез на амоняк. Напоследък се откриха нови перспективи за използването на въглероден окис във връзка с блестящите открития на Вергий и Фр. Фишер, обещавайки да извърши синтетично производство на течни въглеводороди и многобройни продукти на органичния синтез директно от въглища или от първия продукт на изгарянето му, CO. Усъвършенстването на химико-технологичните методи, свързани с тази област, трябва да доведе до безпрецедентна революция в цялата област на приложната химия и в същото време да засегне всички отрасли на световната индустрия.
На фиг. Фигура 2 показва диаграма на цялата инсталация по метода Linde-Frank-Caro. От генератор A газът се подава за почистване към скрубер B и камера за сухо почистване C, след което се събира в газов резервоар G.

Оттук газът, все още съдържащ до 3% CO 2, постъпва в компресори, които след двустепенно компресиране го прехвърлят за „измиване“ на CO 2 във водни кули, от които газът постъпва в охладени съдове К и К, където остатъкът от CO 2 се абсорбира от CO 2, присъстващ в тези NaOH съдове. K и K работят последователно, една седмица наведнъж, така че процесът може да се извършва непрекъснато. В K и K водородът се отделя от CO, кондензиран в течност и излиза под налягане от 50 atm. Компресор L допълнително повишава налягането на водорода, влизащ в стоманените цилиндри M.
Понастоящем най-важният метод за производство на водород в технически мащаб е методът, основан на окисляването на метално желязо при нажежена до червено температура с водна пара за образуване на свободен водород:
Този процес е последван от обратния процес на редукция на железните оксиди, който обикновено се постига чрез действието на водния газ върху тях; след това желязото отново реагира с водна пара и т.н. Този процес е открит за първи път от Лавоазие (1783) и през 1794 г. е използван след разработването му от Preiner и Saint-Clair-Deville във френската армия за пълнене на въздушни топки. За да бъде процесът успешен, желязото, заредено в редукционната пещ, трябва да има специални свойства: трябва да е поресто и да не се рони или стопява. Такова желязо се получава чрез редуциране на определени руди при подходящи условия (железен блясък) или чрез редуциране на железни оксиди, оставащи по време на изпичането на несъдържащи арсен и цинк проби от железни пирити (Internationale Wasserstoff-A.-G., G. P. 220889). Дифенбах и Молденхауер използват калциниран железен шпат за тази цел с голям успех. Наличието на железни оксиди, серни съединения и въглероден оксид в газа, използван за обратна редукция на железни оксиди, има много вреден ефект върху процеса на редукция на водни пари с желязо; в последния случай редуцираното желязо е покрито с покритие от въглища, което предотвратява по-нататъшното образуване на водород. Lane и Zauberman (G.P. 234175) използват желязна руда (на големи парчета) като контактна маса, редуцирана при 800 ° C с газове, които не съдържат въглеводороди и съдържат незначителен % CO в сравнение с тяхното съдържание на H 2 ; те разбраха това. силно поресто гъбено желязо. Internationale Wasserstoff-A.-G. използвана контактна маса, редуцирана от руда при 800°C под действието на технически blaugas; Месершмит предлага зареждане на апарата с маса, която заедно с порестото желязо включва и компактно желязо (GP 258053). За да се избегне запушването на тръби с хлабава контактна маса и да се избегне нейното синтероване и сливане, същият Месершмит предложи да се използва желязо под формата на тесни тръби, които биха били в контакт с редуциращи газове както отвън, така и отвътре. Diefenbach и Moldengauer (GP 270704) смесват Mn, Cr, W, Ti и други метали в контактната маса, които се окисляват от водна пара заедно с желязото, но не се редуцират обратно като последното чрез редуциращи газове. Следователно, те образуват един вид скелет от техните оксиди за поресто желязо, без да се топят и предотвратяват синтероването на контактната маса с желязо. Neger и Noding използват чугунени стълбове като контактна маса, които се възстановяват по-лесно и не променят формата си със седмици при 1000°C (точката на топене на чугуна е около 1200°C), но в този случай горивната камера е д. b. масло, тъй като при изгаряне на генератор и воден газ се достигат температури над 1200°C. Герхарц предлага вдухване на водна пара в разтопени метали, при което водата окислява някои от металите (подобно на процеса на Бесемер и Томас) и водородът се освобождава в газообразно състояние. Редица други патенти: Белу (G.P. 43989), F. Krupna (G.P. 73978 и 67827), Strache (G.P. 77350), G. Schimming (G.P. 95071), Ю. Пинча (G.P. 283160), Elworthy и Williamson (G.P. 164350) ), Caro (G.P. 249269), съдържат определени подобрения, гл. обр. в смисъл на по-икономично изразходване на енергията, както и по-успешен подбор и обработка на контактната маса или най-рационална последователност на отделните етапи на процеса. В това отношение за най-успешен метод трябва да се счита методът, патентован от BAMAG (G.P. 294039), който се състои в това, че след първоначалното окисляване на контактната маса не следва веднага обратният процес на нейната редукция с генераторния газ първият процес, но за известно време между двата процеса въздухът се продухва през контактната маса, причинявайки пълно окисление на последната, за разлика от частичното окисляване на контактната маса, когато е изложена на водна пара. В този случай се отделя толкова значително количество топлина, че е повече от достатъчно за поддържане на целия процес. Редица патенти, подадени от Messerschmitt (G.P. 263391 и други), много успешно решават въпроса за регулиране на нагряването на контактната желязна маса. Водородът се произвежда в шахтова пещ. Първоначалното нагряване на генератора до температура 700-900°C се извършва с помощта на воден газ и продължава 7-8 часа, но след това, при повторение, тази фаза на процеса не изисква повече от 17-19 минути. След като се възстанови цялата контактна маса, последните следи от воден газ и въздух се отстраняват чрез продухване за 5-10 секунди. воден газ и превключете процеса в обратна посока съгласно уравнението:
Тази фаза продължава около 8 минути, след това за 3-5 минути. издухайте въздух, за да изгорите отложените въглища (и понякога сяра); това генерира значително количество топлина; след това отново следва фазата на възстановяване и т.н. Методът BAMAG (GP 267944 и 300711) е много подобен на метода на Messerschmitt, описан по-горе. Фазата на образуване на водород тук продължава около 5 минути. Промяната на окислителната и редукционната фаза се извършва автоматично. Този метод дава възможност да се получи продукт, съдържащ 98,5% водород.
На фиг. 3 показва схематична диаграма на апарата на Григс, подобен по вид на апарата на К. Франк-Месершмит. В този апарат процесът протича в следния ред. 1) Редукционна фаза: преминава смес от въздух и редуциращ газ Аи се нагрява в камерата b, след което загрява шамотните решетки, които образуват централната част на апарата; след това се пропуска излишък от редуциращ газ, който редуцира железните оксиди, съдържащи се в V. 2) Фаза на образуване на водород: навлизане на пари Ж, преминават през частта от апарата, съдържаща шамотни решетки, след което влизат V, след което излизат през д. 3) Фаза на предаване на пара: през нея влиза водна пара д, проверете V, слиза се по централната част и се излиза през Ж. 4) Фаза на аериране: навлиза въздух А.

Когато се произвежда водород чрез действието на желязото върху водната пара, човек трябва да се грижи най-много за подобряване на топлинното използване, защото ако не се погрижи за възстановяването, тогава 90% от топлината на водния газ се губи. Пещите са изработени от специални сплави, които могат да издържат добре на температурни промени. Потокът и изходът на газовете в пещта се регулират автоматично (например патент на Dempston: американски P. 104115/16, патент на Bath, белгийски P. 137674/19 и др.). Апарат от типа на Месершмит (с една пещ) очевидно има предимство пред апарат с няколко пещи (тип Лейн). Редуциращите промишлени газове все повече се използват като заместител на водния газ, например газове от пещи (апарат на Григс - английски P. 142882/20), газове от коксови пещи, които съдържат до 50% H 2, който обикновено остава без никаква употреба, газ за осветление. Последното обстоятелство прави възможно лесното адаптиране на коксови пещи или газови инсталации за производство на водород (Soc. Oxyhydrique Frangaise, F.P. 563600). Методът на завода Electron в Griesheim се следва от Ch. обр. целта за елиминиране на въглеродния окис, доколкото е възможно, чрез преминаване на смес от газове през катализатори и през вар и чрез разделяне на двата основни реакционни газа един от друг (Greenwood, английски P. 137340/18). Методът на Diefenbach и Moldenhauer прави възможно в същия процес да се получи воден газ, да се окисли с водна пара и да се абсорбира CO 2 (Catalysateurs Griesheim, Prius; английски P. 128273/17 Neville et Taylor). Методът на Graer (белгийски P. -561409/22) включва разпръскване на вар и следователно водният газ преминава през водния вар в отсъствието на водна пара.
Други методи за физическо разделяне. Claude (F.P. 130092, 130358/18) предложи да се възползва от значително по-ниската разтворимост на водорода в органични разтворители (например етер) в сравнение с други газове от коксови пещи, за да се отдели водородът от други газове. Кривите на фиг. 4 изразява отношението на разтворимост на въглероден окис и водород в етер. Методът на втечняване обаче очевидно запазва своето предимство. Клод кондензира газовете от коксовата пещ и отделя водорода от тях. В същото време също така е възможно да се изолират тези въглеводороди, съдържащи се в коксовите газове, които имат промишлени приложения.

Напоследък методите, базирани на разделянето на въглеводороди и други органични съединения при високи температури или под действието на катализатори с освобождаване на свободен водород, стават все по-важни. Друг вид метод за производство на водород е взаимодействието при високи температури на въглеводороди, смесени с водна пара, което произвежда чист водород и въглероден оксид или въглероден диоксид. BASF постига тази цел, като прекарва сместа през много къс слой контактна маса, например през мрежи от никелова тел. Разлагането на въглеводородите се постига при температура на нагряване до червено още по-бързо и по-пълно, когато се използва никелов оксид или метален никел като катализатор, фино натрошен и приложен в това състояние към огнеупорни материали. Според Rinker и Wolter (G.P. 174253, 210435) водородът може да се получи и от петролен газ. Парите от масло или въглищен катран се въвеждат в генератор, пълен с горещ кокс (или остатъци от масло или каменовъглен катран се впръскват в него отгоре). Парите преминават през слоеве кокс, където се разделят и при достатъчно висока температура образуват краен газ, съдържащ до 96% водород. С оглед на факта, че температурата на генератора, поради ендотермичността на реакцията на разлагане на нефтения газ, е значително намалена, е необходимо от време на време да се спре добавянето на нефтен газ и да се увеличи температурата на генератора с нагрети газове . Методът на Rinker-Wolter първоначално означаваше само производството на осветителен газ с малко въглеродно съдържание от петрол или от неговите остатъци. BAMAG обаче е подобрила този метод толкова много, че е възможно да се получи продукт със специфично тегло 0,087-0,090 и съдържание на водород до 98% (останалото е азот).
В случаите, когато използването на водород не позволява наличието на токсични примеси в него, които "тровят" катализатора, участващ в производствения процес, за който се използва водород (също и при производството на водород за крушки с нажежаема жичка), най-удобно е да използвам електролитен водород(особено ако наличието на водноелектрически ресурси и възможността за едновременно използване на кислород, получен като страничен продукт, намаляват цената на електролитния водород). В такива случаи е възможно да се използва електролитен водород за предпочитане пред водород, произведен по други методи, при които е необходимо водородът да се пречисти от неизбежни токсични примеси. Електролитният водород, разбира се, е напълно чист. За електролиза се използва вода, към която е добавено известно количество киселина, каустик алкали и въглеродни алкали. Електродите са направени от желязо (за реакции с алкални разтвори) или олово (за киселинни разтвори). За да се избегне смесването на H 2 с O 2, електродите са разделени един от друг с диафрагма, изработена от порест (азбестов плат) непроводим материал. Въз основа на този принцип в Chalet-Meudon (метод Repart) е проектирана водородна инсталация за военни авиационни цели. За електролиза се използва напрежение от 2,25-2,5 V при температура на електролита 50-70 ° C. Устройствата, изградени на този принцип, произвеждат водород с чистота 99,8%. Друг принцип на проектиране на устройства за електролиза включва наличието на преграда между електродите, изработена от електропроводим материал.
Инсталацията на О. Шмит (G.P. 111131) придоби особено значение за електролитното производство на водород. Този електролизатор се състои от система от електроди, свързани заедно като филтърна преса. Структурата на целия апарат е ясна от фиг. 5а - схематичен страничен изглед на апарата, 5b - хоризонтален разрез, 5c - разрез през една рамка (изглед отпред) и 5d - разрез през газовия сепаратор; ee - двойни електроди, d - диафрагми; всяка електродна плоча отгоре и отдолу има два отвора o, o и o", o".


През тези дупки преминават два канала: долният подава вода към електродните пространства, горният служи за отстраняване на получените газове. Допълнително подобрение на тази инсталация се състои в пълното изолиране на чиниите от техните държачи чрез въвеждане на къси слоеве от порцелан, стъкло и други изолационни материали между чиниите и държачите. Заводът Oerlikon произвежда (G.P. 275515) електролизатори за 20, 40, 75 и 125 A, устройства за напрежение 65, 110 и 220 V. Електролитът е 10% разтвор на поташ. За производството на 1 m 3 водород при 40°C са необходими 6 kW. Поради затворения характер на целия апарат, газовете могат получени под налягане. Разновидности на същата електролизерна система са устройствата на Aiken, Leroy и Moritz, както и електролизаторът на Френското анонимно общество (Societe Anonyme Oxyhydrique). Устройствата на системата Levin (G.P. 288776) се отличават с особено удобен дизайн, разликата от описаните по-горе е възможността за регулиране на хидростатичното и газовото налягане на всяка клетка поотделно поради факта, че в долната част на газовите колектори има канали с дупки, огънати настрани, с помощта на които газовете от индивидуалните газови колектори влизат в общия колектор. Чрез промяна на височината на нивото на изхода е възможно да се регулира налягането на газа и нивата на течността на всяка клетка поотделно. Устройствата Levine се произвеждат в Ню Йорк в International Oxygen C°.
Значителни количества водород се образуват като страничен продукт при производството на бутилов алкохол по метода на ферментация под въздействието на чисти култури от Clostridium acetobutilicum. Фабриките на Commercial Solvents Corporation в САЩ произвеждат около 69 000 m3 водород на ден като страничен продукт, използвайки този метод, заедно с един и половина пъти количеството CO2. Такъв значителен добив на водород прави възможно използването му на място за производството на синтетичен амоняк.
По време на война са използвани методи за производство на водород (независимо от изчислението на цената на водорода), които осигуряват възможност за бързо производство на водород с помощта на лесно подвижни инсталации. Тези методи включват: силиконов метод (Jaubert или Lelorge - действието на алкали върху феросилиций), хидрогенитният метод (действието на NaOH върху силиций), хидролитичният метод (действието на водата върху CaH 2), методът на действие на киселина върху цинк или желязо, действието на алуминия върху разтвор на сода каустик, методът на Morino-Beaupre (ефектът на алуминиевата амалгама върху содата каустик), методът на хидрон (ефектът на сплав от натрий и олово върху вода), Метод на Ринкер-Волтер, адаптиран към теренната обстановка и др.
Приложения на водорода . Преди войната 1914-18г. потреблението и производството на водород беше сравнително много ограничено. Водородът се използва за аеронавтиката, за (много слабо развито по това време) производство на синтетичен амоняк, за автогенно заваряване на метали, където водородът постепенно се заменя с ацетилен. Само войната, като постави огромна нужда от водород, значително допринесе за подобряването на методите за неговото производство и развитието на водородната индустрия. Синтетичният амоняк беше необходим в огромни количества както за целите на торовете, поради трудностите при транспортирането на чилийската селитра, така и като изходен продукт за окисляването му по метода на Оствалд в азотна киселина, необходима за производството на експлозиви. Нуждата от водород за аеронавтиката по време на войната също достига значителни размери. След края на войната производството на синтетичен амоняк за целите на торовете не само не намалява, но и се увеличава значително (само заводите на BASF консумират 2 милиона m 3 водород на ден за производството на синтетичен амоняк). По същия начин консумацията на водород за хидрогениране на мазнини се е увеличила значително, което прави възможно получаването на твърди мазнини, подходящи за храна, както и за производство на сапун, от растителни мазнини с ниска стойност и неядливо рибено масло. Производството на хидрогенирани мазнини е много добре развито във Франция (Марсилия), САЩ и Япония. През 1922 г. Япония е произвеждала 62 тона хидрогенирани мазнини на ден. Преди войната в Русия работят няколко фабрики за хидрогениране на мазнини (Волжско акционерно дружество "Салолин" в Санкт Петербург и Н. Новгород). В СССР производството на хидрогенирани мазнини се предлага например в завода за саламас в Ростов на Дон, в Москва в бившия Невски стеаринов завод и на други места. Този тип индустрия се развива много бързо, консумирайки все по-големи количества водород. Водородът се използва широко в технологиите и в изследователските лаборатории за хидрогениране на други ненаситени органични съединения (с изключение на мазнини), като ароматни въглеводороди (например при производството на декалин, тетралин от нафталин, за хидрогениране на ацетилен и въглеводороди, получени чрез суха дестилация на каменни и кафяви въглища и за хидрогениране на петролни остатъци, обработени в присъствието на катализатори с добавяне на водород в хидрогенирани продукти). В допълнение, водородът се използва в редица химически индустрии, например при производството на амини от нитро съединения, алкохоли от алдехиди (например винен алкохол от ацеталдехид), при производството на метан от въглероден оксид, за производството на мравчена киселина чрез действието на водород върху въглероден диоксид или бикарбонати под въздействието на тъмни електрически разряди. Редица фармацевтични лекарства се получават от действието на водород върху алкалоиди, лецитин и други органични съединения. През последните години нуждата от водород беше посрещната от нова индустрия, която е предназначена да играе важна роля в химическата индустрия. Тази област на използване на водорода е свързана с откриването на така наречените методи от Бергиус и Фишер. втечняване на въглища, т.е. методи за добавяне на водород към въглища при високо налягане и с участието на катализатори с образуването на течни запалими въглеводороди, както и методи за добавяне на водород при високо налягане към ненаситени органични съединения. Трябва да се отбележи и работата на швейцарския проф. Fiertz, който разработва метод за добавяне на водород към целулозата. Следователно не е изненадващо, че методите за производство на водород напоследък са интензивно разработени във всички страни и че броят на патентите, свързани с тези методи, нараства с невероятна скорост във всички страни.
За производството на водород вижте.
Той има свое специфично място в периодичната таблица, което отразява свойствата, които проявява и говори за неговата електронна структура. Но сред всички тях има един специален атом, който заема две клетки едновременно. Разположен е в две напълно противоположни по свойства групи елементи. Това е водород. Такива характеристики го правят уникален.
Водородът е не само елемент, но и просто вещество, както и неразделна част от много сложни съединения, биогенен и органогенен елемент. Затова нека разгледаме неговите характеристики и свойства по-подробно.
Водородът като химичен елемент
Водородът е елемент от първа група на главната подгрупа, както и седма група на главната подгрупа в първия малък период. Този период се състои само от два атома: хелий и елементът, който разглеждаме. Нека опишем основните характеристики на позицията на водорода в периодичната таблица.
- Атомният номер на водорода е 1, броят на електроните е същият и съответно броят на протоните е същият. Атомна маса - 1.00795. Има три изотопа на този елемент с масови числа 1, 2, 3. Свойствата на всеки от тях обаче са много различни, тъй като увеличаването на масата дори с един за водорода веднага се удвоява.
- Фактът, че съдържа само един електрон на външната си повърхност, му позволява успешно да проявява както окислителни, така и редуциращи свойства. Освен това, след като отдаде електрон, той остава със свободна орбитала, която участва в образуването на химични връзки по донорно-акцепторния механизъм.
- Водородът е силен редуциращ агент. Следователно основното му място се счита за първа група от основната подгрупа, където той оглавява най-активните метали - алкалните.
- Въпреки това, когато взаимодейства със силни редуциращи агенти, като метали, той може да бъде и окислител, приемайки електрон. Тези съединения се наричат хидриди. По този признак той оглавява подгрупата на халогените, с които е сходен.
- Поради много малката си атомна маса, водородът се счита за най-лекия елемент. Освен това плътността му също е много ниска, така че е и еталон за лекота.
По този начин е очевидно, че водородният атом е напълно уникален елемент, за разлика от всички други елементи. Следователно свойствата му също са специални, а образуваните прости и сложни вещества са много важни. Нека ги разгледаме по-нататък.

Просто вещество
Ако говорим за този елемент като молекула, тогава трябва да кажем, че той е двуатомен. Тоест водородът (просто вещество) е газ. Нейната емпирична формула ще бъде написана като H2, а нейната графична формула ще бъде написана чрез една сигма връзка H-H. Механизмът на образуване на връзка между атомите е ковалентен неполярен.
- Парен реформинг на метан.
- Газификация на въглища - процесът включва нагряване на въглища до 1000 0 C, което води до образуването на водород и високовъглеродни въглища.
- Електролиза. Този метод може да се използва само за водни разтвори на различни соли, тъй като стопилките не водят до изпускане на вода в катода.
Лабораторни методи за получаване на водород:
- Хидролиза на метални хидриди.
- Ефектът на разредените киселини върху активните метали и средната активност.
- Взаимодействие на алкални и алкалоземни метали с вода.
За да съберете произведения водород, трябва да държите епруветката с главата надолу. В края на краищата този газ не може да се събира по същия начин, както например въглеродният диоксид. Това е водород, той е много по-лек от въздуха. Изпарява се бързо и в големи количества експлодира при смесване с въздух. Следователно епруветката трябва да се обърне. След като се напълни, трябва да се затвори с гумена запушалка.
За да проверите чистотата на събрания водород, трябва да поднесете запалена кибритена клечка към врата. Ако пляскането е глухо и тихо, това означава, че газът е чист, с минимални въздушни примеси. Ако е силен и свирещ, значи е мръсен, с голям дял чужди компоненти.

Области на използване
При изгаряне на водород се отделя толкова голямо количество енергия (топлина), че този газ се счита за най-рентабилното гориво. Освен това е екологично чист. Към днешна дата обаче приложението му в тази област е ограничено. Това се дължи на зле обмислени и нерешени проблеми за синтезиране на чист водород, който би бил подходящ за използване като гориво в реактори, двигатели и преносими устройства, както и котли за битово отопление.
В крайна сметка методите за производство на този газ са доста скъпи, така че първо е необходимо да се разработи специален метод за синтез. Такава, която ще ви позволи да получите продукта в големи количества и на минимална цена.
Има няколко основни области, в които се използва газът, който разглеждаме.
- Химически синтези. Хидрогенирането се използва за производството на сапуни, маргарини и пластмаси. С участието на водород се синтезират метанол и амоняк, както и други съединения.
- В хранително-вкусовата промишленост - като добавка E949.
- Авиационна индустрия (ракетна наука, самолетостроене).
- Електроенергетика.
- Метеорология.
- Екологично гориво.
Очевидно водородът е толкова важен, колкото и изобилен в природата. Различните съединения, които образува, играят още по-голяма роля.

Водородни съединения
Това са сложни вещества, съдържащи водородни атоми. Има няколко основни вида такива вещества.
- Халогеноводороди. Общата формула е HHal. От особено значение сред тях е хлороводородът. Това е газ, който се разтваря във вода, за да образува разтвор на солна киселина. Тази киселина се използва широко в почти всички химически синтези. Освен това, както органични, така и неорганични. Хлороводородът е съединение с емпирична формула HCL и е едно от най-големите произвеждани у нас годишно. Водородните халиди също включват йодид, флуороводород и бромоводород. Всички те образуват съответните киселини.
- Летливи Почти всички от тях са доста отровни газове. Например сероводород, метан, силан, фосфин и други. В същото време те са много запалими.
- Хидридите са съединения с метали. Те принадлежат към класа на солите.
- Хидроксиди: основи, киселини и амфотерни съединения. Те задължително съдържат водородни атоми, един или повече. Пример: NaOH, K 2, H 2 SO 4 и др.
- Водороден хидроксид. Това съединение е по-известно като вода. Друго име е водороден оксид. Емпиричната формула изглежда така - H 2 O.
- Водороден прекис. Това е силен окислител, чиято формула е H 2 O 2.
- Многобройни органични съединения: въглеводороди, протеини, мазнини, липиди, витамини, хормони, етерични масла и др.
Очевидно е, че разнообразието от съединения на разглеждания елемент е много голямо. Това още веднъж потвърждава нейното високо значение както за природата и хората, така и за всички живи същества.
- това е най-добрият разтворител
Както бе споменато по-горе, общото име за това вещество е вода. Състои се от два водородни атома и един кислород, свързани с ковалентни полярни връзки. Водната молекула е дипол, това обяснява много от свойствата, които проявява. По-специално, той е универсален разтворител.
Именно във водната среда протичат почти всички химични процеси. Вътрешните реакции на пластичния и енергийния метаболизъм в живите организми също се извършват с помощта на водороден оксид.
Водата с право се смята за най-важното вещество на планетата. Известно е, че нито един жив организъм не може да живее без него. На Земята може да съществува в три агрегатни състояния:
- течност;
- газ (пара);
- твърд (лед).
В зависимост от изотопа на водорода, включен в молекулата, се разграничават три вида вода.
- Светлина или протиум. Изотоп с масово число 1. Формула - H 2 O. Това е обичайната форма, която използват всички организми.
- Деутерий или тежък, формулата му е D 2 O. Съдържа изотопа 2 H.
- Супер тежък или тритий. Формулата изглежда като T 3 O, изотоп - 3 H.
Запасите от прясна протиева вода на планетата са много важни. В много страни вече има недостиг от него. Разработват се методи за обработка на солена вода за производство на питейна вода.

Водородният прекис е универсално средство
Това съединение, както беше споменато по-горе, е отличен окислител. Но със силни представители той може да се държи и като реставратор. В допълнение, той има подчертан бактерициден ефект.
Друго име за това съединение е пероксид. Именно в тази форма се използва в медицината. 3% разтвор на кристален хидрат на въпросното съединение е медицинско лекарство, което се използва за лечение на малки рани с цел дезинфекция. Доказано е обаче, че това увеличава времето за заздравяване на раната.
Водородният прекис се използва и в ракетното гориво, в промишлеността за дезинфекция и избелване и като пенообразувател за производството на подходящи материали (пяна, например). Освен това пероксидът помага за почистване на аквариуми, избелване на косата и избелване на зъбите. Въпреки това, той причинява увреждане на тъканите, така че не се препоръчва от специалисти за тези цели.
Разпространение в природата. V. е широко разпространен в природата, съдържанието му в земната кора (литосфера и хидросфера) е 1% от масата и 16% от броя на атомите. V. е част от най-често срещаното вещество на Земята - вода (11,19% от теглото на V.), в състава на съединения, които съставляват въглища, нефт, природни газове, глини, както и животински и растителни организми (т.е. в състава протеини, нуклеинови киселини, мазнини, въглехидрати и др.). В свободно състояние V. е изключително рядък, намира се в малки количества във вулканични и други природни газове. В атмосферата присъстват малки количества свободен водород (0,0001% от броя на атомите). В околоземното пространство радиацията образува вътрешния („протонен“) радиационен пояс на Земята под формата на поток от протони. В пространството В. е най-често срещаният елемент. Под формата на плазма тя съставлява около половината от масата на Слънцето и повечето звезди, по-голямата част от газовете на междузвездната среда и газовите мъглявини. В. присъства в атмосферата на редица планети и в комети под формата на свободен H2, метан CH4, амоняк NH3, вода H2O, радикали като CH, NH, OH, SiH, PH и др. Под формата на поток от протони енергията е част от корпускулярното излъчване на Слънцето и космическите лъчи.
Изотопи, атом и молекула. Обикновеният витриол се състои от смес от два стабилни изотопа: лек витриол или протий (1H) и тежък витриол или деутерий (2H или D). В природните съединения има средно 6800 1H атома на 1 2H атом. Изкуствено е получен радиоактивен изотоп - свръхтежък V., или тритий (3H, или T), с меко β-лъчение и период на полуразпад T1/2 = 12,262 години. В природата тритий се образува, например, от атмосферния азот под въздействието на неутроните на космическите лъчи; в атмосферата е пренебрежимо малък (4-10-15% от общия брой V атоми). Получава се изключително нестабилен изотоп 4H. Масовите числа на изотопите 1H, 2H, 3H и 4H, съответно 1,2, 3 и 4, показват, че ядрото на атома на протия съдържа само 1 протон, на деутерия - 1 протон и 1 неутрон, на трития - 1 протон и 2 неутрони, 4H - 1 протон и 3 неутрона. Голямата разлика в масите на изотопите на V. определя по-забележима разлика в техните физични и химични свойства, отколкото в случая на изотопите на други елементи.
Атомът V. има най-простата структура сред атомите на всички други елементи: състои се от ядро и един електрон. Енергията на свързване на електрон с ядро (йонизационен потенциал) е 13,595 eV. Неутрален атом може също да добави втори електрон, образувайки отрицателен йон Н-; в този случай енергията на свързване на втория електрон с неутрален атом (електронен афинитет) е 0,78 eV. Квантовата механика дава възможност да се изчислят всички възможни енергийни нива на атом и следователно да се даде пълна интерпретация на неговия атомен спектър. Атомът V се използва като модел на атом в квантово-механичните изчисления на енергийните нива на други, по-сложни атоми. Молекула B. H2 се състои от два атома, свързани с ковалентна химична връзка. Енергията на дисоциация (т.е. разпадане на атоми) е 4,776 eV (1 eV = 1,60210-10-19 J). Междуатомното разстояние при равновесното положение на ядрата е 0,7414-Å. При високи температури молекулярният водород се разпада на атоми (степента на дисоциация при 2000°C е 0,0013, при 5000°C 0,95). Атомният V. също се образува в различни химични реакции (например чрез действието на Zn върху солна киселина). Съществуването на водород в атомно състояние обаче продължава само кратко време; атомите се рекомбинират в молекули H2.
Физични и химични свойства. V. е най-лекото от всички известни вещества (14,4 пъти по-леко от въздуха), плътност 0,0899 g/l при 0°C и 1 atm. Хелият кипи (втечнява се) и се топи (втвърдява) съответно при -252,6°C и -259,1°C (само хелият има по-ниски точки на топене и кипене). Критичната температура на водата е много ниска (-240 ° C), така че нейното втечняване е изпълнено с големи трудности; критично налягане 12,8 kgf/cm2 (12,8 atm), критична плътност 0,0312 g/cm3. От всички газове V. има най-голяма топлопроводимост, равна на 0,174 W / (m-K) при 0 ° C и 1 atm, т.е. 4,16-0-4 cal / (s-cm - ° C). Специфичният топлинен капацитет на V. при 0°C и 1 atm Ср 14.208-103 J/(kg-K), т.е. 3.394 cal/(g-°C). V. е слабо разтворим във вода (0,0182 ml/g при 20°C и 1 atm), но добре разтворим в много метали (Ni, Pt, Pd и др.), особено в паладий (850 обема на 1 обем Pd) . Разтворимостта на В. в метали е свързана със способността му да дифундира през тях; дифузията през въглеродна сплав (например стомана) понякога е придружена от разрушаване на сплавта поради взаимодействието на въглерод с въглерод (така наречената декарбонизация). Течността V. е много лека (плътност при -253 ° C 0,0708 g / cm3) и течна (вискозитет при -253 ° C 13,8 spuaz).
В повечето съединения V. проявява валентност (по-точно степен на окисление) +1, като натрий и други алкални метали; обикновено се счита за аналог на тези метали, водещ 1 грам. Системата на Менделеев. В металните хидриди обаче В йонът е отрицателно зареден (степен на окисление -1), т.е. Na+H- хидридът е структуриран подобно на Na+Cl- хлорида. Това и някои други факти (сходството на физичните свойства на V. и халогените, способността на халогените да заместват V. в органични съединения) дават основание да класифицират V. също в VII група на периодичната таблица (за повече подробности, виж Периодичната таблица на елементите). При нормални условия молекулярната В. е сравнително малко активна, директно се свързва само с най-активните неметали (с флуор и на светлина с хлор). Въпреки това, когато се нагрява, той реагира с много елементи. Атомната V. има повишена химическа активност в сравнение с молекулярната. С кислород V. образува вода: H2 + 1/2O2 = H2O с отделяне на 285,937-103 J/mol, т.е. 68,3174 kcal/mol топлина (при 25 ° C и 1 atm). При нормални температури реакцията протича изключително бавно, над 550°C експлодира. Границите на експлозивност на смес водород-кислород са (по обем) от 4 до 94% Н2, а на смес водород-въздух - от 4 до 74% Н2 (смес от 2 обема Н2 и 1 обем О2 се нарича детониращ газ). V. се използва за редуциране на много метали, тъй като премахва кислорода от техните оксиди:
CuO + H2 = Cu + H2O,
Fe3O4 + 4H2 = 3Fe + 4H2O и др.
С халогени V. образува водородни халиди, например:
H2 + Cl2 = 2HCl.
В същото време V. експлодира с флуор (дори на тъмно и при -252 ° C), реагира с хлор и бром само при осветяване или нагряване и с йод само при нагряване. V. реагира с азота с образуване на амоняк: 3H2 + N2 = 2NH3 само на катализатор и при повишени температури и налягания. При нагряване V. реагира енергично със сяра: H2 + S = H2S (сероводород), много по-трудно със селен и телур. V. може да реагира с чист въглерод без катализатор само при високи температури: 2H2 + C (аморфен) = CH4 (метан). V. реагира директно с някои метали (алкални, алкалоземни и др.), Образувайки хидриди: H2 + 2Li = 2LiH. От голямо практическо значение са реакциите на въглероден диоксид с въглероден оксид, при които се образуват различни органични съединения в зависимост от температурата, налягането и катализатора, например HCHO, CH3OH и др. (виж Въглероден оксид). Ненаситените въглеводороди реагират с водород, стават наситени, например: CnH2n + H2 = CnH2n+2 (виж Хидрогениране).
Целта на днешната публикация е да предостави на неподготвения читател изчерпателна информация за какво е водород, какви са неговите физични и химични свойства, обхват на приложение, значение и методи на производство.
Водородът присъства в по-голямата част от органичната материя и клетките, в които той представлява почти две трети от атомите.
Снимка 1. Водородът се счита за един от най-често срещаните елементи в природата
В периодичната таблица на елементите на Менделеев водородът заема почетното първо място с атомно тегло, равно на единица.
Името "водород" (на латински - Водород) произлиза от две старогръцки думи: ὕδωρ - „” и γεννάω – „раждам” (буквално „раждам”) и е предложена за първи път през 1824 г. от руския химик Михаил Соловьов.
Водородът е един от водообразуващите елементи (заедно с кислорода) (химичната формула на водата е H 2 O).
Според физичните си свойства водородът се характеризира като безцветен газ (по-лек от въздуха). Когато се смеси с кислород или въздух, той е изключително запалим.
Той може да се разтвори в някои метали (титан, желязо, платина, паладий, никел) и в етанол, но е много слабо разтворим в сребро.
Молекулата на водорода се състои от два атома и се обозначава като Н2. Водородът има няколко изотопа: протий (H), деутерий (D) и тритий (T).
История на откриването на водорода
Още през първата половина на 16 век, докато провежда алхимични експерименти, смесвайки метали с киселини, Парацелз забелязва непознат дотогава запалим газ, който не успява да отдели от въздуха.
Почти век и половина по-късно - в края на 17 век - френският учен Лемери успява да отдели водорода (все още без да знае, че е водород) от въздуха и да докаже неговата запалимост.

Снимка 2. Хенри Кавендиш - откривател на водорода
Химически експерименти в средата на 18 век позволиха на Михаил Ломоносов да идентифицира процеса на отделяне на определен газ в резултат на определени химични реакции, който обаче не е флогистон.
Английски химик направи истински пробив в изследването на запалимия газ. Хенри Кавендиш, на когото се приписва откриването на водорода (1766).
Кавендиш нарече този газ „запалим въздух“. Той също така извърши реакцията на изгаряне на това вещество, което доведе до вода.
През 1783 г. френски химици, ръководени от Антоан Лавоазие, извършват синтеза на вода и впоследствие разлагането на водата с отделяне на „горим въздух“.
Тези изследвания окончателно доказват наличието на водород във водата. Лавоазие е този, който предлага да наречем новия газ водород (1801).
Полезни свойства на водорода
Водородът е четиринадесет и половина пъти по-лек от въздуха.
Освен това се отличава с най-висока топлопроводимост сред другите газове (повече от седем пъти топлопроводимостта на въздуха).
В миналото балоните и дирижаблите са били пълни с водород. След поредица от бедствия в средата на 30-те години на миналия век, завършили с експлозии на дирижабли, дизайнерите трябваше да търсят заместител на водорода.
Сега такива самолети използват хелий, който е много по-скъп от водорода, но не е толкова експлозивен.

Снимка 3. Водородът се използва за производство на ракетно гориво
В много страни се провеждат изследвания за създаване на ефективни двигатели, базирани на водород, за автомобили и камиони.
Автомобилите, задвижвани с водородно гориво, са много по-екологични от своите бензинови и дизелови събратя.
При нормални условия (стайна температура и естествено налягане) водородът не е склонен да реагира.
Когато смес от водород и кислород се нагрее до 600 °C, започва реакция, която завършва с образуването на водни молекули.
Същата реакция може да бъде провокирана с помощта на електрическа искра.
Реакциите, включващи водород, завършват само когато компонентите, участващи в реакцията, са напълно изразходвани.
Температурата на горене на водород достига 2500-2800 °C.
Водородът се използва за пречистване на различни видове гориво на базата на нефт и нефтопродукти.
В живата природа няма какво да замени водорода, тъй като той присъства във всяка органична материя (включително масло) и във всички протеинови съединения.
Без участието на водород това би било невъзможно.
Агрегатни състояния на водорода
Водородът може да съществува в три основни състояния на агрегиране:
- газообразен;
- течност;
- твърд
Нормалното състояние на водорода е газ. При понижаване на температурата до -252,8 °C водородът се превръща в течност и след температурен праг от -262 °C водородът става твърд.

Снимка 4. От няколко десетилетия вместо евтин водород за пълнене на балони се използва скъп хелий.
Учените предполагат, че водородът може да бъде в допълнително (четвърто) агрегатно състояние - метално.
За да направите това, просто трябва да създадете налягане от два и половина милиона атмосфери.
Засега, уви, това е само научна хипотеза, тъй като все още никой не е успял да получи „метален водород“.
Поради температурата си, течният водород може да причини силно измръзване, когато влезе в контакт с човешката кожа.
Водород в периодичната таблица
Разпределението на химичните елементи в периодичната таблица се основава на тяхното атомно тегло, изчислено спрямо атомното тегло на водорода.

Снимка 5. В периодичната таблица на водорода е присвоена клетка с пореден номер 1
В продължение на много години никой не може нито да отхвърли, нито да потвърди този подход.
С появата в началото на 20 век и по-специално с появата на известните постулати на Нилс Бор, обясняващи структурата на атома от гледна точка на квантовата механика, стана възможно да се докаже валидността на хипотезата на Менделеев.
Обратното също е вярно: именно съответствието на постулатите на Нилс Бор с периодичния закон, лежащ в основата на периодичната таблица, стана най-убедителният аргумент в полза на признаването на тяхната истинност.
Участие на водорода в термоядрена реакция
Водородните изотопи деутерий и тритий са източници на невероятно мощна енергия, освободена по време на термоядрена реакция.

Снимка 6. Термоядрен взрив без водород би бил невъзможен
Тази реакция е възможна при температури не по-ниски от 1060 °C и протича много бързо - в рамките на няколко секунди.
На Слънцето термоядрените реакции протичат бавно.
Задачата на учените е да разберат защо това се случва, за да използват получените знания за създаване на нови - практически неизчерпаеми - източници на енергия.
Какво е водород (видео):
>