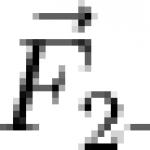Въведение -3-
1. Сграда -4-
2. Номенклатура и изомерия -6-
3. Физични свойстваи да си сред природата -7-
4. Химични свойства -8-
5. Получаване -9-
6. Приложение -10-
6.1 Приложение на естери на неорганични киселини -10-
6.2 Използване на естери на органични киселини -12-
Заключение -14-
Използвани източници на информация -15-
Приложение -16-
Въведение
Сред функционалните производни на киселините специално място заемат естерите - производни на киселини, в които киселинният водород е заменен с алкилови (или най-общо въглеводородни) радикали.
Естерисе делят в зависимост от това на каква киселина са производни (неорганична или карбоксилна).
Сред естерите специално място заемат естествените естери - мазнини и масла, които се образуват от триатомен алкохол глицерол и висши мастни киселини, съдържащи четно числовъглеродни атоми. Мазнините са част от растителни и животински организми и служат като един от източниците на енергия на живите организми, която се освобождава при окисляването на мазнините.
Целта на моята работа е да представя този клас в детайли. органични съединениякато естери и задълбочен поглед върху техните приложения отделни представителитози клас.
1. Структура
Обща формула на естерите карбоксилни киселини:
където R и R" са въглеводородни радикали (в естери мравчена киселина R - водороден атом).
Обща формула на мазнините:

където R", R", R"" са въглеродни радикали.
Мазнините са "прости" или "смесени". Простите мазнини съдържат остатъци от същите киселини (т.е. R’ = R" = R""), докато смесените мазнини съдържат различни.
Най-често срещаните мастни киселини в мазнините са:
Алканови киселини
1. Маслена киселина CH 3 - (CH 2) 2 - COOH
3. Палмитинова киселина CH 3 - (CH 2) 14 - COOH
4. Стеаринова киселина CH 3 - (CH 2) 16 - COOH
Алкенови киселини
5. Олеинова киселина C 17 H 33 COOH
CH3-(CH2)7-CH === CH-(CH2)7-COOH
Алкадиенови киселини
6. Линолова киселина C 17 H 31 COOH
CH3-(CH2)4-CH = CH-CH2-CH = CH-COOH
Алкатриенова киселина
7. Линоленова киселина C 17 H 29 COOH
CH 3 CH 2 CH = CHCH 2 CH == CHCH 2 CH = CH(CH 2) 4 COOH
2. Номенклатура и изомерия
Имената на естерите произлизат от името на въглеводородния радикал и името на киселината, в която се използва наставката вместо края -ova - при , Например:
Естерите се характеризират с следните видовеизомерия:
1. Изомерията на въглеродната верига започва при киселинния остатък с бутанова киселина, при алкохолния остатък с пропилов алкохол, например етил изобутират, пропил ацетат и изопропил ацетат са изомери.
2. Изомерия на позицията на естерната група -CO-O-. Този тип изомерия започва с естери, чиито молекули съдържат най-малко 4 въглеродни атома, като етил ацетат и метил пропионат.
3. Междукласова изомерия, например, пропановата киселина е изомерна на метилацетат.
За естери, съдържащи ненаситена киселина или ненаситен алкохол, са възможни още два вида изомерия: изомерия на позицията на кратната връзка и цис-, транс-изомерия.
3. Физични свойства и срещане в природата
Естерите на нисшите карбоксилни киселини и алкохолите са летливи, неразтворими във вода течности. Много от тях имат приятна миризма. Например бутилбутиратът мирише на ананас, изоамилацетатът мирише на круша и т.н.
Естерите на висшите мастни киселини и алкохолите са восъчни вещества, без мирис и неразтворими във вода.
Приятният аромат на цветя, плодове и горски плодове до голяма степен се дължи на наличието на определени естери в тях.
Мазнините са широко разпространени в природата. Наред с въглеводородите и протеините, те са част от всички растителни и животински организми и съставляват една от основните части на нашата храна.
Според агрегатното си състояние при стайна температура мазнините се делят на течни и твърди. Твърдите мазнини, като правило, се образуват от наситени киселини, докато течните мазнини (често наричани масла) се образуват от ненаситени киселини. Мазнините са разтворими в органични разтворители и неразтворими във вода.
4. Химични свойства
1. Реакция на хидролиза или осапунване. Тъй като реакцията на естерификация е обратима, следователно в присъствието на киселини протича реакцията на обратна хидролиза:
Реакцията на хидролиза също се катализира от основи; в този случай хидролизата е необратима, тъй като получената киселина и основа образуват сол:
2. Реакция на присъединяване. Естерите, съдържащи ненаситена киселина или алкохол, са способни на присъединителни реакции.
3. Реакция на възстановяване. Редукцията на естери с водород води до образуването на два алкохола:
4. Реакция на образуване на амиди. Под въздействието на амоняка естерите се превръщат в киселинни амиди и алкохоли:
5. Разписка
1. Реакция на естерификация:
Алкохолите реагират с минерални и органични киселини, образувайки естери. Реакцията е обратима ( обратен процес– хидролиза на естери).

Реактивността на едновалентните алкохоли при тези реакции намалява от първична към третична.
2. Взаимодействие на киселинни анхидриди с алкохоли:

3. Взаимодействие на киселинни халогениди с алкохоли:

6. Приложение
6.1 Използване на естери на неорганични киселини
Естери на борна киселина - триалкилборати- лесно се получава чрез нагряване на алкохол и борна киселина с добавяне на концентрирана сярна киселина. Борнометилов етер (триметил борат) кипи при 65 ° C, борен етилов етер (триетил борат) кипи при 119 ° C. Естерите на борната киселина лесно се хидролизират от вода.
Реакцията с борна киселина служи за установяване на конфигурацията на поливалентните алкохоли и многократно е използвана при изследване на захарите.
Ортосилициеви естери- течности. Метиловият етер кипи при 122° C, етиловият етер при 156° C. Хидролизата с вода протича лесно дори на студено, но протича постепенно и при липса на вода води до образуването на високомолекулни анхидридни форми, в които са свързани силициеви атоми един към друг чрез кислород (силоксанови групи):
Тези вещества с високо молекулно тегло (полиалкоксисилоксани) се използват като свързващи вещества, които могат да издържат на доста високи температури, по-специално за покриване на повърхността на формите за прецизно леене на метал.Диалкилдихлоросиланите реагират подобно на SiCl 4, например ((CH 3) 2 SiCl 2, образувайки диалкокси производни:
Тяхната хидролиза с липса на вода дава така наречените полиалкилсилоксани:
Те имат различни (но много значителни) молекулни тегла и са вискозни течности, използвани като топлоустойчиви лубриканти, и с дори по-дълги силоксанови скелети, топлоустойчиви електрически изолационни смоли и каучуци.
Естери на ортотитановата киселина. Тяхнатасе получават подобно на ортосилициевите етери чрез реакцията:
Това са течности, които лесно се хидролизират до метилов алкохол и TiO 2 и се използват за импрегниране на тъкани, за да ги направят водоустойчиви.
Естери на азотната киселина.Те се получават чрез третиране на алкохоли със смес от азотна и концентрирана сярна киселина. Метил нитрат CH 3 ONO 2 (т.к. 60° C) и етилов нитрат C 2 H 5 ONO 2 (т.к. 87° C) могат да се дестилират внимателно, но при нагряване над точката на кипене или при детонация те са много силни.

Като експлозиви се използват етилен гликол и глицерин нитрати, неправилно наричани нитрогликол и нитроглицерин. Самият нитроглицерин (тежка течност) е неудобен и опасен за работа.
Пентрит - пентаеритритол тетранитрат C(CH 2 ONO 2) 4, получен чрез третиране на пентаеритритол със смес от азотна и сярна киселина, също е силен взривен експлозив.
Глицерол нитрат и пентаеритритол нитрат имат съдоразширяващ ефект и се използват като симптоматични средства при ангина пекторис.
Номенклатура
Имената на естерите произлизат от името, въглеводородния радикал а и името на киселината, в която вместо окончанието „-оева киселина“ се използва наставката „ат“ (както в имената на неорганични соли: натриев карбонат, хром нитрат), например:

(Фрагменти от молекули и съответните фрагменти от имена са маркирани в същия цвят.)
Естерите обикновено се разглеждат като продукти на реакцията между киселина и алкохол; например, бутил пропионат може да се разглежда като резултат от реакцията между пропионова киселина и бутанол.
Ако се използва тривиалното наименование на изходната киселина, тогава думата „естер“ е включена в името на съединението, например C 3 H 7 COOC 5 H 11 - амилов естер на маслена киселина.
Хомоложни серии

Изомерия
Естерите се характеризират с три вида изомерия:
1. Изомерията на въглеродната верига, започва в киселинния остатък с бутанова киселина, в алкохолния остатък - с пропилов алкохол, например:
2. Изомерия на позицията на естерната група -CO-O-. Този тип изомерия започва с естери, чиито молекули съдържат най-малко 4 въглеродни атома, например:
3. Междукласова изомерия, естери (алкил алканоати) са изомерни на наситени монокарбоксилни киселини; Например:
За естери, съдържащи ненаситена киселина или ненаситен алкохол, са възможни още два вида изомерия: изомерия на позицията на кратната връзка; цис-транс изомерия.
Физични свойства
Естерите на нисшите хомолози на киселини и алкохоли са безцветни, нискокипящи течности с приятна миризма; използвани като ароматни добавки за хранителни продукти и в парфюмерията. Естерите не се разтварят добре във вода.
Методи за получаване
1. Извлечен от естествени продукти
2. Взаимодействие на киселини с алкохоли (реакции на естерификация); Например:

Химични свойства
1. Най-типичните реакции за естерите са киселинна или алкална хидролиза (осапуняване). Това са реакции, които са обратни на реакциите на естерификация. Например:

2. Редукция (хидрогениране) на сложни етери, в резултат на което се образуват алкохоли (един или два); Например:

Когато карбоксилните киселини реагират с алкохоли (реакция на естерификация), те се образуват естери:
R 1 -COOH (киселина) + R 2 -OH (алкохол) ↔ R 1 -COOR 2 (естер) + H 2 O
Тази реакция е обратима. Продуктите на реакцията могат да взаимодействат помежду си, за да образуват изходните материали - алкохол и киселина. По този начин реакцията на естери с вода - естерна хидролиза - е обратната на реакцията на естерификация. Химично равновесие, което се установява, когато скоростите на директните (естерификация) и обратните (хидролиза) реакции са равни, може да се измести към образуването на естер чрез наличието на вещества, премахващи водата.
Естери в природата и технологията
Естерите са широко разпространени в природата и се използват в технологиите и различни индустрии. Те са добри разтворители на органични вещества, плътността им е по-малка от плътността на водата и практически не се разтварят в нея. По този начин, естери с относително малък молекулно теглоТе са запалими течности с ниски точки на кипене и имат миризми на различни плодове. Използват се като разтворители за лакове и бои, овкусители за продукти в хранително-вкусовата промишленост. Например метиловият естер на маслената киселина има миризмата на ябълки, етиловият алкохол на тази киселина има миризмата на ананаси, а изобутиловият естер на оцетната киселина има миризмата на банани:
C3H7-COO-CH3 (метилов естер на маслена киселина);
C3H7-COO-C2H5 (етилбутират);
CH 3 -COO-CH 2 -CH 2 (изобутилацетат)
Нар. естери на висши карбоксилни киселини и висши едноосновни алкохоли восъци. По този начин пчелният восък се състои главно от естер на палмитинова киселина на мирицилов алкохол C 15 H 31 COOC 31 H 63; восък от кашалот – спермацет – естер на същата палмитинова киселина и цетилов алкохол C 15 H 31 COOC 16 H 33
Най-важните представители на естерите са мазнините.
Мазнини, масла
мазнини- това са естери на глицерол и висши едноатомни . Общото наименование на такива съединения е триглицериди или триацилглицероли, където ацилът е остатък на карбоксилна киселина -C(O)R. Съставът на естествените триглицериди включва остатъци от наситени киселини (палмитинова C 15 H 31 COOH, стеаринова C 17 H 35 COOH) и ненаситени (олеинова C 17 H 33 COOH, линолова C 17 H 31 COOH). Висшите карбоксилни киселини, които са част от мазнините, винаги имат четен брой въглеродни атоми (C 8 - C 18) и неразклонен въглеводороден остатък. Естествените мазнини и масла са смеси от глицериди на висши карбоксилни киселини.
Съставът и структурата на мазнините могат да бъдат отразени от общата формула:

Естерификация- реакция на образуване на естери.

Съставът на мазнините може да включва остатъци както от наситени, така и от ненаситени карбоксилни киселини в различни комбинации.
При нормални условия мазнините, съдържащи остатъци от ненаситени киселини, най-често са течни. Те се наричат масла. Основно това са мазнини от растителен произход - ленено, конопено, слънчогледово и други масла (с изключение на палмово и кокосово масло - твърди при нормални условия). По-рядко се срещат течни мазнини от животински произход, например рибено масло. Повечето естествени мазнини от животински произход при нормални условия са твърди (ниско топими) вещества и съдържат главно остатъци от наситени карбоксилни киселини, например агнешка мазнина.
Съставът на мазнините определя техните физически и химични свойства.
Физични свойства на мазнините
Мазнините са неразтворими във вода, нямат ясна точка на топене и значително увеличават обема си при разтопяване.
Агрегатното състояние на мазнините е твърдо, това се дължи на факта, че мазнините съдържат остатъци от наситени киселини и мастните молекули са способни на плътно опаковане. Съставът на маслата включва остатъци от ненаситени киселини в цис конфигурация, поради което плътното опаковане на молекулите е невъзможно и физическо състояние– течност.
Химични свойства на мазнините
Мазнините (маслата) са естери и се характеризират с естерни реакции.
Ясно е, че за мазнини, съдържащи остатъци от ненаситени карбоксилни киселини, всички реакции на ненаситени съединения са характерни. Те обезцветяват бромната вода и влизат в други присъединителни реакции. Най-важната реакция в практическо отношение е хидрогенирането на мазнините. Твърдите естери се получават чрез хидрогениране на течни мазнини. Именно тази реакция е в основата на производството на маргарин - твърда мазнина от растителни масла. Обикновено този процес може да се опише с уравнението на реакцията:

Всички мазнини, подобно на други естери, се подлагат на хидролиза:

Хидролизата на естерите е обратима реакция. За да се осигури образуването на продукти от хидролиза, тя се извършва в алкална среда (в присъствието на основи или Na 2 CO 3). При тези условия хидролизата на мазнините протича обратимо и води до образуването на соли на карбоксилните киселини, които се наричат. мазнините в алкална среда се наричат осапуняване на мазнини.
При осапуняване на мазнини се образуват глицерин и сапуни - натриеви и калиеви соли на висши карбоксилни киселини:
Сапонификация– алкална хидролиза на мазнини, производство на сапун.

сапун– смеси от натриеви (калиеви) соли на висши наситени карбоксилни киселини (натриев сапун – твърд, калиев сапун – течен).
Сапуните са ПАВ (съкратено ПАВ, детергенти). Детергентният ефект на сапуна се дължи на факта, че сапунът емулгира мазнините. Сапуните образуват мицели със замърсители (относително това са мазнини с различни включвания).
Липофилната част на молекулата на сапуна се разтваря в замърсителя, а хидрофилната част се озовава на повърхността на мицела. Мицелите се зареждат по същия начин, поради което се отблъскват, а замърсителят и водата се превръщат в емулсия (на практика това е мръсна вода).

Сапунът също се среща във вода, което създава алкална среда.
Сапуните не трябва да се използват в груби или морска вода, тъй като получените калциеви (магнезиеви) стеарати са неразтворими във вода.

10.5. Естери. мазнини
Естери– функционални производни на карбоксилни киселини,
в молекули, в които хидроксилната група (-OH) е заменена с алкохолен остатък (-ИЛИ)
Естери на карбоксилни киселини – съединения с обща формула.
R-COOR", където R и R" са въглеводородни радикали.
Естери на наситени едноосновни карбоксилни киселини имат обща формула:

Физични свойства:
· Летливи, безцветни течности
· Слабо разтворим във вода
· Най-често с приятна миризма
По-лек от вода
Естерите се намират в цветя, плодове и горски плодове. Те определят специфичната им миризма.
са неразделна част етерични масла(известни са около 3000 е.м. - портокал, лавандула, роза и др.)
Естерите на нисшите карбоксилни киселини и нисшите едновалентни алкохоли имат приятна миризма на цветя, горски плодове и плодове. Естери на висши едноосновни киселини и висши моновалентни алкохоли са в основата на естествените восъци. Например, пчелният восък съдържа естер на палмитинова киселина и мирицилов алкохол (мирицилов палмитат):
CH 3 (CH 2) 14 –CO–O– (CH 2) 29 CH 3
Аромат. Структурна формула. |
Естерно име |
Ябълка
|
Етилов етер 2-метилбутанова киселина |
Череша
|
Амилов естер на мравчена киселина |
Круша
|
Изоамилов естер на оцетна киселина |
Ананас |
Етилов естер на маслена киселина (етил бутират) |
банан |
Изобутилов естер на оцетна киселина (изоамил ацетатът също има миризма на банан) |
Жасмин
|
Бензилов етер ацетат (бензилов ацетат) |
Кратките имена на естерите се основават на името на радикала (R") в алкохолния остатък и името на RCOO групата в киселинния остатък. Например, етил оцетна киселина CH 3 COO C 2 H 5наречен етилацетат.

Приложение
· Като ароматизатори и подобрители на мириса в хранително-вкусовата и парфюмерийната (производство на сапуни, парфюми, кремове) промишлености;
· При производството на пластмаси и каучук като пластификатори.

Пластификатори – вещества, които се въвеждат в състава на полимерни материали за придаване (или увеличаване) на еластичност и (или) пластичност по време на обработка и работа.
Приложение в медицината
IN края на XIX- началото на ХХ век, когато органичен синтезнаправи първите си стъпки, много естери бяха синтезирани и тествани от фармаколози. Те станаха основата на такива лекарства като салол, валидол и др. Метилсалицилатът се използва широко като локално дразнещо и аналгетично средство, което сега е практически заменено от по-ефективни лекарства.
Получаване на естери
Естерите могат да бъдат получени чрез взаимодействие на карбоксилни киселини с алкохоли ( реакция на естерификация). Катализаторите са минерални киселини.
Реакцията на естерификация при киселинна катализа е обратима. Обратният процес - разцепване на естер под действието на вода до карбоксилна киселина и алкохол - се нарича естерна хидролиза.
RCOOR " + H2O ( з +) ↔ RCOOH + R "OH
Хидролизата в присъствието на алкали е необратима (тъй като полученият отрицателно зареден карбоксилатен анион RCOO не реагира с нуклеофилния реагент - алкохол).
Тази реакция се нарича осапуняване на естери(по аналогия с алкалната хидролиза на естерните връзки в мазнините при производството на сапун).
Мазнини, тяхната структура, свойства и приложение
„Химията е навсякъде, химията е във всичко:
Във всичко, което дишаме
Във всичко, което пием
Във всичко, което ядем."
Във всичко, което носим



Хората отдавна са се научили да извличат мазнини от природни обекти и да ги използват в ежедневието. Мазнини, изгаряни в примитивни лампи, осветяващи пещерите първобитни хорагрес се е използвала за смазване на плъзгачите, по които са спускани корабите. Мазнините са основният източник на нашето хранене. Но неправилното хранене и заседналият начин на живот водят до наднормено тегло. Пустинните животни съхраняват мазнини като източник на енергия и вода. Дебелият мастен слой на тюлените и китовете им помага да плуват в студените води на Северния ледовит океан.
Мазнините са широко разпространени в природата. Наред с въглехидратите и белтъчините, те са част от всички животински и растителни организми и съставляват една от основните части на нашата храна. Източници на мазнини са живите организми. Животните включват крави, прасета, овце, пилета, тюлени, китове, гъски, риби (акули, треска, херинга). Рибеното масло, лекарствен продукт, се получава от черния дроб на треска и акула, а мазнините, използвани за храна на селскостопански животни, се получават от херинга. Растителните мазнини са най-често течни и се наричат масла. Използват се мазнини от растения като памук, лен, соя, фъстъци, сусам, рапица, слънчоглед, горчица, царевица, мак, коноп, кокос, морски зърнастец, шипки, маслодайна палма и много други.

Мазнините изпълняват различни функции: строителни, енергийни (1 g мазнини осигуряват 9 kcal енергия), защитни, складови. Мазнините осигуряват 50% от енергията, необходима на човек, така че човек трябва да консумира 70-80 грама мазнини на ден. Мазнините съставляват 10-20% от телесното тегло на здравия човек. Мазнините са основен източник на мастни киселини. Някои мазнини съдържат витамини A, D, E, K и хормони.
Много животни и хора използват мазнината като топлоизолираща обвивка; например при някои морски животни дебелината на мастния слой достига метър. В допълнение, мазнините са разтворители за ароматизатори и багрила в тялото. Много витамини, като витамин А, са само мастноразтворими.
Някои животни (обикновено водолюбиви птици) използват мазнини за смазване на собствените си мускулни влакна.
Мазнините повишават ефекта на засищане на храните, тъй като се усвояват много бавно и забавят появата на глад. .
История на откриването на мазнините
Още през 17 век. Немски учен, един от първите аналитични химици Ото Тачени(1652–1699) пръв предполага, че мазнините съдържат „скрита киселина“.
През 1741 г. френски химик Клод Жозеф Жофроа(1685–1752) открива, че когато сапунът (който е приготвен чрез кипене на мазнина с основа) се разлага с киселина, се образува маса, която е мазна на пипане.
Фактът, че мазнините и маслата съдържат глицерин, е открит за първи път през 1779 г. от известния шведски химик Карл Вилхелм Шееле.
Химичният състав на мазнините е определен за първи път от френски химик в началото на миналия век. Мишел Юджийн Шеврол, основоположник на химията на мазнините, автор на множество изследвания върху тяхната природа, обобщени в шесттомната монография „Химически изследвания на телата от животински произход“.
1813 E. Chevreul установи структурата на мазнините, благодарение на реакцията на хидролиза на мазнините в алкална среда. Той показа, че мазнините се състоят от глицерол и мастни киселини и това не е просто смес от тях, а съединение, което чрез добавяне на вода се разгражда. в глицерол и киселини.
Синтез на мазнини

През 1854 г. френският химик Марселин Бертло (1827–1907) извършва реакция на естерификация, тоест образуването на естер между глицерол и мастни киселини, и по този начин синтезира мазнини за първи път.

Обща формула на мазнини (триглицериди)

мазнини
– естери на глицерол и висши карбоксилни киселини.
Общото име за тези съединения е триглицериди.
Класификация на мазнините



Животинските мазнини съдържат главно глицериди на наситени киселини и са твърди вещества. Растителните мазнини, често наричани масла, съдържат глицериди на ненаситени карбоксилни киселини. Това са например течните слънчогледово, конопено и ленено масло.

Естествените мазнини съдържат следните мастни киселини
наситени: стеаринова (C 17 H 35 COOH) палмитинова (C 15 H 31 COOH) Маслен (C 3 H 7 COOH) |
СЪДЪРЖАЩИ ЖИВОТНИ МАЗНИНИ |
Ненаситени : олеинова (C 17 H 33 COOH, 1 двойна връзка) линолова (C 17 H 31 COOH, 2 двойни връзки) линолен (C 17 H 29 COOH, 3 двойни връзки) арахидон (C 19 H 31 COOH, 4 двойни връзки, по-рядко) |
СЪДЪРЖАЩИ РАСТЕНИЕ МАЗНИНИ |
Мазнините се намират във всички растения и животни. Те са смеси от пълни глицеринови естери и нямат ясно определена точка на топене.
· Животински мазнини(агнешко, свинско, говеждо и др.), като правило, са твърди вещества с ниска точка на топене (изключение е рибеното масло). В твърдите мазнини преобладават остатъците наситенкиселини
· Растителни мазнини - масла (слънчогледово, соево, памучно и др.) – течности (изключение – кокосово масло, масло от какаови зърна). Маслата съдържат предимно остатъци ненаситени (ненаситени)киселини
Химични свойства на мазнините
1. хидролиза,или осапуняване , мазнини възниква под въздействието на вода, с участието на ензими или киселинни катализатори (обратимо), в този случай се образува алкохол - глицерин и смес от карбоксилни киселини:

или основи (необратими). Алкалната хидролиза произвежда соли на висши мастни киселини, наречени сапуни. Сапуните се получават чрез хидролиза на мазнини в присъствието на основи:

Сапуните са калиеви и натриеви соли на висши карбоксилни киселини.
2. Хидрогениране на мазнини – превръщане на течните растителни масла в твърди мазнини – има голяма стойностза хранителни цели. Продуктът от хидрогенирането на маслото е твърда мазнина (изкуствена сланина, саломас). Маргарин– хранителна мазнина, състои се от смес от хидрогенирани масла (слънчогледово, царевично, памучно семе и др.), животински мазнини, мляко и ароматични добавки (сол, захар, витамини и др.).
Ето как маргаринът се произвежда в промишлеността:

При условията на процеса на хидрогениране на маслото ( висока температура, метален катализатор) се получава изомеризация на част от киселинните остатъци, съдържащи цис-С=С връзки в по-стабилни транс-изомери. Повишено съдържаниев маргарина (особено в евтините сортове) остатъците от транс-ненаситени киселини повишават риска от атеросклероза, сърдечно-съдови и други заболявания.

Реакция на производство на мазнини (естерификация)

Прилагане на мазнини


Мазнините са хранителен продукт. Биологична ролямазнини
Животинските мазнини и растителните масла, заедно с протеините и въглехидратите, са един от основните компоненти на нормалното хранене на човека. Те са основният източник на енергия: 1 g мазнина, когато е напълно окислена (проявява се в клетките с участието на кислород), осигурява 9,5 kcal (около 40 kJ) енергия, което е почти два пъти повече, отколкото може да се получи от протеини или въглехидрати. В допълнение, запасите от мазнини в тялото практически не съдържат вода, докато протеиновите и въглехидратните молекули винаги са заобиколени от водни молекули. В резултат на това един грам мазнини осигурява почти 6 пъти повече енергия от един грам животинско нишесте – гликоген. Следователно мазнините с право трябва да се считат за висококалорично „гориво“. Използва се основно за поддържаненормална температура
човешкото тяло, както и работата на различни мускули, така че дори когато човек не прави нищо (например спи), той се нуждае от около 350 kJ енергия всеки час, за да покрие разходите за енергия, приблизително същата мощност като 100- ватова крушка. За осигуряване на тялото с енергия при неблагоприятни условия в него се създават мастни запаси, които се отлагат в подкожната тъкан, в мастната гънка на перитонеума - т. нар. оментум. Подкожната мазнина предпазва тялото от хипотермия (тази функция на мазнините е особено важна за морските животни). В продължение на хиляди години хората са се справяли трудно, което изискваше голямо количество енергия и съответно повишено хранене. За покриване на минималните дневни енергийни нужди на човек са достатъчни само 50 g мазнини. Въпреки това, при умерена физическа активност, възрастен трябва да получава малко повече мазнини от храната, но тяхното количество не трябва да надвишава 100 g (това осигурява една трета от съдържанието на калории за диета от около 3000 kcal). Трябва да се отбележи, че половината от тези 100 г се съдържат в храната под формата на така наречените скрити мазнини. Мазнините се намират в почти всичко хранителни продукти: дори се намират в малки количества в картофите (0,4% там), в хляба (1-2%), в овесените ядки (6%). Млякото обикновено съдържа 2-3% мазнини (но има и специални разновидности на обезмасленото мляко). В постното месо има доста скрити мазнини - от 2 до 33%. Скритите мазнини присъстват в продукта под формата на отделни малки частици. Почти чисти мазнини са свинската мас и растителното масло; Маслото съдържа около 80% мазнини, а гхи – 98%. Разбира се, всички дадени препоръки за консумация на мазнини са средни, зависят от пола и възрастта, физическата активност и климатичните условия. При прекомерна консумация на мазнини човек бързо напълнява, но не трябва да забравяме, че мазнините в тялото могат да се синтезират и от други храни. „Отработването“ на излишни калории чрез физическа активност не е толкова лесно. Например, след 7 км джогинг, човек изразходва приблизително толкова енергия, колкото получава, като изяде само един стограмов шоколад (35% мазнини, 55% въглехидрати). по-висока от обичайната, лицето, получаващо диетата с мазнини, е било напълно изтощено след 1,5 часа. При въглехидратна диета човек издържа на същото натоварване 4 часа. Този на пръв поглед парадоксален резултат се обяснява с особеностите на биохимичните процеси. Въпреки високата „енергийна интензивност“ на мазнините, получаването на енергия от тях в тялото е бавен процес. Това се дължи на ниската реактивност на мазнините, особено на техните въглеводородни вериги. Въглехидратите, въпреки че осигуряват по-малко енергия от мазнините, я "освобождават" много по-бързо. Ето защо, преди физическа активност, за предпочитане е да ядете сладкиши, а не мазни храни, особено животински, увеличава риска от развитие на заболявания като атеросклероза, сърдечна недостатъчност и др. Животинските мазнини съдържат много холестерол ( но не трябва да забравяме, че две трети от холестерола се синтезира в организма от храни с ниско съдържание на мазнини - въглехидрати и протеини).
Известно е, че значителна част от консумираните мазнини трябва да бъдат растителни масла, които съдържат много важни за организма съединения - полиненаситени мастни киселини с няколко двойни връзки. Тези киселини се наричат "есенциални". Подобно на витамините, те трябва да постъпват в тялото в готов вид. От тях най-голяма активност има арахидоновата киселина (синтезира се в организма от линолова киселина), а най-малка е линоленовата киселина (10 пъти по-ниска от линоловата). Според различни оценки дневната нужда на човек от линолова киселина варира от 4 до 10 g. Най-голямо количество линолова киселина (до 84%) има в шафрановото масло, изцедено от семената на шафран, едногодишно растение с ярко оранжеви цветове. . В слънчогледовото и ядковото масло също има много от тази киселина.
Според диетолозите балансираната диета трябва да съдържа 10% полиненаситени киселини, 60% мононенаситени киселини (предимно олеинова киселина) и 30% наситени киселини. Това е съотношението, което се осигурява, ако човек получава една трета от мазнините под формата на течни растителни масла - в размер на 30-35 g на ден. Тези масла се включват и в маргарина, който съдържа от 15 до 22% наситени мастни киселини, от 27 до 49% ненаситени и от 30 до 54% полиненаситени. За сравнение: маслото съдържа 45-50% наситени мастни киселини, 22-27% ненаситени и по-малко от 1% полиненаситени. В това отношение висококачественият маргарин е по-здравословен от маслото.
Трябва да се помни!!!
Наситените мастни киселини влияят негативно върху метаболизма на мазнините, чернодробната функция и допринасят за развитието на атеросклероза. Ненаситените киселини (особено линоловата и арахидоновата) регулират метаболизма на мазнините и участват в отстраняването на холестерола от тялото. Колкото по-високо е съдържанието на ненаситени мастни киселини, толкова по-ниска е точката на топене на мазнините. Калоричното съдържание на твърдите животински и течните растителни мазнини е приблизително еднакво, но физиологичната стойност на растителните мазнини е много по-висока. Млечната мазнина има по-ценни качества. Съдържа една трета ненаситени мастни киселини и консервиран под формата на емулсия се усвоява лесно от организма. Въпреки тези положителни качества, не трябва да консумирате само млечни мазнини, тъй като нито една мазнина не съдържа идеалния състав на мастни киселини. Най-добре е да се консумират мазнини както от животински, така и от растителен произход. Съотношението им трябва да бъде 1:2,3 (70% животински и 30% растителен) за млади хора и хора на средна възраст. В диетата на възрастните хора трябва да преобладават растителните мазнини.
Мазнините не само участват в метаболитните процеси, но и се съхраняват в резерв (главно в коремната стена и около бъбреците). Резервите от мазнини осигуряват метаболитни процеси, запазвайки протеините за цял живот. Тази мазнина осигурява енергия при физическа активност, ако се набавя малко мазнина от храната, както и при тежки заболявания, когато поради намален апетит тя не се набавя достатъчно от храната.
Прекомерната консумация на мазнини в храната е вредна за здравето: тя се съхранява в големи количества в резерв, което увеличава телесното тегло, което понякога води до обезобразяване на фигурата. Повишава се концентрацията му в кръвта, което като рисков фактор допринася за развитието на атеросклероза, исхемична болест на сърцето, хипертония и др.
УПРАЖНЕНИЯ
1. Има 148 g смес от две органични съединения с еднакъв състав: C 3 H 6 O 2. Определете структурата на тези соеви зърна диений и техните масови дялове в сместа, ако е известно, че един откогато взаимодействат с излишния натриев бикарбонат, те освобождават 22,4 l (n.s.) въглероден оксид ( IV), а другият не реагира с натриев карбонат и амонячен разтвор на сребърен оксид, но при нагряване с воден разтворнатриевият хидроксид образува алкохол и кисела сол.
Решение:
Известно е, че въглеродният окис ( IV ) се освобождава, когато натриевият карбонат реагира с киселина. Може да има само една киселина от състава C 3 H 6 O 2 - пропионова, CH 3 CH 2 COOH.
C 2 H 5 COOH + N aHCO 3 → C 2 H 5 COONa + CO 2 + H 2 O.
Съгласно условието се отделят 22,4 литра CO 2, което е 1 mol, което означава, че в сместа има и 1 mol киселина. Моларната маса на изходните органични съединения е:М (C3H6O2) = 74 g/mol, следователно 148 g е 2 mol.
Второто съединение при хидролиза образува алкохол и киселинна сол, което означава, че е естер:
RCOOR' + NaOH → RCOONa + R‘OH.
Съставът C3H6O2 съответства на два естера: етилформиат HCOOC2H5 и метилацетат CH3COOCH3. Естерите на мравчената киселина реагират с амонячен разтвор на сребърен оксид, така че първият естер не отговаря на условията на проблема. Следователно второто вещество в сместа е метилацетат.
Тъй като сместа съдържа един мол съединения с еднаква моларна маса, техните масови дялове са равни и възлизат на 50%.
отговор. 50% CH 3 CH 2 COOH, 50% CH 3 COOCH 3.
2. Относителната плътност на естерните пари по отношение на водорода е 44. При хидролизата на този естер се образуват две съединения, при изгаряне на равни количества от които се образуват равни обеми въглероден диоксид(при същите условия) Дайте структурната формула на този етер.
Решение:
Общата формула на естерите, образувани от наситени алкохоли и киселини, е С n N 2 n О 2. Стойността на n може да се определи от плътността на водорода:
M (CnH2nO2) = 14 n + 32 = 44. 2 = 88 g/mol,
откъдето n = 4, тоест етерът съдържа 4 въглеродни атома. Тъй като при изгарянето на алкохол и киселина, образувани по време на хидролизата на етер, се освобождават равни обеми въглероден диоксид, киселината и алкохолът съдържат еднакъв брой въглеродни атоми, по два. Така желаният естер се образува от оцетна киселина и етанол и се нарича етилацетат:
CH 3 - |
O-S 2 N 5 |
отговор. Етилацетат, CH3SOOC2H5.
________________________________________________________________
3. По време на естерна хидролиза, моларна масакоето е 130 g/mol, се образуват киселина A и алкохол B. Определете структурата на естера, ако е известно, че сребърната сол на киселината съдържа 59,66% сребро по маса. Алкохол B не се окислява от натриев дихромат и лесно реагира със солна киселина, за да образува алкил хлорид.
Решение:
Естерът има общата формула RCOOR ‘. Известно е, че сребърната сол на киселината, RCOOAg , съдържа 59,66% сребро, следователно моларната маса на солта е: M (RCOOAg) = M (A g )/0,5966 = 181 g/mol, откъдето M(R ) = 181-(12+2. 16+108) = 29 g/mol. Този радикал е етил, C 2 H 5, и естерът е образуван от пропионова киселина: C 2 H 5 COOR '.
Моларната маса на втория радикал е: M (R') = M (C 2 H 5 COOR ') - M(C2H5COO) = 130-73 = 57 g/mol. Този радикал има молекулна формула C4H9. Според условието алкохолът C 4 H 9 OH не се окислява Na 2 C r 2 O 7 и лесно реагира сНС1 следователно този алкохол е третичен, (CH 3) 3 SON.
По този начин желаният естер се образува от пропионова киселина и терт-бутанол и се нарича терт-бутилпропионат:
CH 3 |
||
C 2 H 5 - |
C—O— |
C - CH 3 |
CH 3 |
отговор . Терт-бутил пропионат.
________________________________________________________________
4. Напишете две възможни формули за мазнина, която има 57 въглеродни атома в молекулата си и реагира с йод в съотношение 1:2. Мазнината съдържа киселинни остатъци с четен брой въглеродни атоми.
Решение:
Обща формула на мазнините:
където R, R', R " - въглеводородни радикали, съдържащи нечетен брой въглеродни атоми (друг атом от киселинния остатък е част от -CO- групата). Три въглеводородни радикала отговарят на 57-6 = 51 въглеродни атома. Може да се приеме, че всеки от радикалите съдържа 17 въглеродни атома.
Тъй като една мастна молекула може да прикрепи две йодни молекули, има две двойни връзки или една тройна връзка на три радикала. Ако две двойни връзки са в един радикал, тогава мазнината съдържа остатък от линолова киселина (Р = C 17 H 31) и два остатъка от стеаринова киселина ( R' = R " = C 17 H 35). Ако две двойни връзки са в различни радикали, тогава мазнината съдържа два остатъка от олеинова киселина ( R = R ' = C 17 H 33 ) и остатък от стеаринова киселина (Р " = C 17 H 35). Възможни мастни формули:
|
|
________________________________________________________________


5.

ЗАДАЧИ ЗА САМОСТОЯТЕЛНО РЕШАВАНЕ
1. Какво е реакция на естерификация?
2. Каква е разликата в структурата на твърдите и течните мазнини?
3. Какви са химичните свойства на мазнините.
4. Дайте уравнението на реакцията за получаване на метилформиат.
5. Пишете структурни формулидва естера и киселина със състав C3H6O2. Наименувайте тези вещества според международната номенклатура.
6. Напишете уравненията за реакциите на естерификация между: а) оцетна киселина и 3-метилбутанол-1; б) маслена киселина и пропанол-1. Назовете етерите.
7. Колко грама мазнини са взети, ако са необходими 13,44 литра водород (N.S.) за хидрогениране на киселината, образувана в резултат на нейната хидролиза?
8. Изчислете масовата част на добива на естера, образуван при нагряване на 32 g оцетна киселина и 50 g 2-пропанол в присъствието на концентрирана сярна киселина, ако се образуват 24 g естер.
9. За да се хидролизира мастна проба с тегло 221 g, 150 g разтвор на натриев хидроксид с масова частоснова 0,2. Предложете структурната формула на оригиналната мазнина.
10. Изчислете обема на разтвор на калиев хидроксид с алкална масова част 0,25 и плътност 1,23 g/cm 3, който трябва да се изразходва за извършване на хидролизата на 15 g смес, състояща се от етилов естер на етанова киселина, пропил на метанова киселина естер и метилов естер на пропановата киселина.
ВИДЕО ИЗЖИВЯВАНЕ
1. Каква реакция е в основата на производството на естери: |
|
а) неутрализиране |
б) полимеризация |
в) естерификация |
г) хидрогениране |
2. Колко изомерни естери отговарят на формулата C 4 H 8 O 2: |
|
а) 2 |
|