хлор- елемент от 3-ти период и VII А-група на периодичната таблица, пореден номер 17. Електронна формулаатом [10Ne]3s 2 Зр 5, характерните степени на окисление са 0, -1, + 1, +5 и +7. Най-стабилното състояние е Cl -1. Скала на степента на окисление на хлора:
7 – Cl 2 O 7 , ClO 4 – , HClO 4 , KClO 4
5 - ClO 3 -, HClO 3 , KClO 3
1 – Cl 2 O, ClO -, HClO, NaClO, Ca(ClO) 2
- 1 - Cl -, HCl, KCl, PCl 5
Хлорът има висока електроотрицателност (2,83), експонати неметални свойства. Влиза в състава на много вещества - оксиди, киселини, соли, бинарни съединения.
В природата - дванадесетиелемент по химично изобилие (пети сред неметалите). Намира се само в химически свързана форма. Третият най-разпространен елемент в естествените води (след O и H), има особено много хлор в морска вода(до 2% от теглото). Жизнен елемент за всички организми.
Хлор C1 2. Просто вещество. Жълто-зелен газ с остър задушлив мирис. Молекулата Cl 2 е неполярна и съдържа C1-C1 σ връзка. Термично стабилен, незапалим на въздух; смес с водород експлодира на светлина (водородът гори в хлор):
Cl 2 +H 2 ⇌HCl
Той е силно разтворим във вода, претърпява 50% дисмутация в нея и напълно в алкален разтвор:
Cl 2 0 +H 2 O ⇌HCl I O+HCl -I
Cl 2 +2NaOH (студен) = NaClO+NaCl+H 2 O
3Cl2 +6NaOH (час) =NaClO3 +5NaCl+H2O
Разтвор на хлор във вода се нарича хлорна вода, на светлина киселината HClO се разлага на HCl и атомен кислород O 0, така че „хлорната вода“ трябва да се съхранява в тъмна бутилка. Наличието на киселина HClO в „хлорна вода“ и образуването на атомарен кислород обясняват нейните силни окислителни свойства: например много багрила се обезцветяват във влажен хлор.
Хлорът е много силен окислител към метали и неметали:
Сl 2 + 2Nа = 2NаСl 2
ЗСl 2 + 2Fe→2FeСl 3 (200 °C)
Сl 2 +Se=SeCl 4
Cl 2 + Pb → PbCl 2 (300°СЪС)
5Cl 2 +2P→2PCl 5 (90 °C)
2Cl 2 +Si→SiCl 4 (340 °C)
Реакции със съединения на други халогени:
а) Cl 2 + 2KVg (P) = 2KCl + Br 2 (кипи)
б) Cl 2 (седмица) + 2КI (р) = 2Кl + I 2 ↓
3Cl (пр.) + 3H 2 O+ KI = 6HCl + KIO 3 (80 °C)
Качествена реакция- взаимодействие на дефицит на CL 2 с KI (виж по-горе) и откриване на йод чрез син цвят след добавяне на разтвор на нишесте.
Касова бележкахлор в индустрия:
2NаСl (топи се) → 2Nа + Сl 2 (електролиза)
2NaCl+ 2H 2 O→H 2+ Cl 2+ 2NaOH (електролиза)
и в лаборатории:
4HCl (конц.) + MnO 2 = Cl 2 + MnCl 2 + 2H 2 O
(подобно с участието на други окислители; за повече подробности вижте реакциите за HCl и NaCl).
Хлорът е продукт на основно химическо производство и се използва за производство на бром и йод, хлориди и кислородсъдържащи производни, за избелване на хартия и като дезинфектант за питейна вода. Отровни.
Хлороводород NS л . Аноксична киселина. Безцветен газ с остра миризма, по-тежък от въздуха. Молекулата съдържа ковалентна σ връзка H - Cl. Термично стабилен. Силно разтворим във вода; се наричат разредени разтвори солна киселина, и концентриран разтвор за пушене (35-38%) - солна киселина(името е дадено от алхимиците). Силна киселина в разтвор, неутрализирана от основи и амонячен хидрат. Силен редуциращ агент в концентриран разтвор (поради Cl - I), слаб окислител в разреден разтвор (поради H I). Неразделна част от "царската водка".
Качествената реакция към Cl йона е образуването на бели утайки AgCl и Hg 2 Cl 2, които не се прехвърлят в разтвор чрез действието на разредена азотна киселина.
Хлороводородът служи като суровина при производството на хлориди, хлорорганични продукти и се използва (под формата на разтвор) при ецване на метали и разлагане на минерали и руди. Уравнения на най-важните реакции:
HCl (разредена) + NaOH (разредена) = NaCl + H2O
HCl (разреден) + NH3H2O = NH4Cl + H2O
4HCl (конц., хоризонтално) + MO 2 = MCl 2 + Cl 2 + 2H 2 O (M = Mn, Pb)
16HCl (конц., хоризонтален) + 2KMnO 4 (s) = 2MnCl 2 + 5Cl 2 + 8H 2 O + 2KCl
14HCl (конц.) + K 2 Cr 2 O 7 (t) = 2СrСl 3 + 3Сl 2 + 7Н 2 O + 2КCl
6HCl (конц.) + KClO 3(T) = KCl + 3Cl 2 + 3H 2 O (50-80 °C)
4HCl (конц.) + Ca(ClO) 2(t) = CaCl 2 + 2Cl 2 + 2H 2 O
2HCl (разреден) + M = MCl2 + H2 (M = Re, 2p)
2HCl (разреден) + MSO 3 = MCl 2 + CO 2 + H 2 O (M = Sa, Va)
HCl (разреден) + AgNO 3 = HNO 3 + AgCl↓
Производството на HCl в промишлеността е изгарянето на H 2 в Cl 2 (виж), в лабораторията - изместване от хлориди със сярна киселина:
NaCl (t) + H2SO4 (конц.) = NaHSO4+ НСл(50 °C)
2NaCl (t) + H 2 SO 4 (конц.) = Na 2 SO 4 + 2HCl(120 °C)
Хлориди
Натриев хлорид Na кл . Безкислородна сол. Често срещано име сол. Бял, леко хигроскопичен. Топи се и кипи без разлагане. Умерено разтворим във вода, разтворимостта зависи слабо от температурата, разтворът има характерен солен вкус. Не се подлага на хидролиза. Слаб редуциращ агент. Влиза в йонообменни реакции. Подлежи на електролиза в стопилка и разтвор.
Използва се за производство на водород, натрий и хлор, сода, сода каустик и хлороводород, като компонент на охлаждащи смеси, хранителен продукт и консервант.
В природата по-голямата част от находищата на каменна сол или халит, И силвинит(заедно с KCl), саламура на солени езера, минерални примеси на морска вода (съдържание на NaCl = 2,7%). В промишлеността се получава чрез изпаряване на естествени саламура.
Уравнения на най-важните реакции:
2NaCl (s) + 2H 2 SO 4 (конц.) + MnO 2 (s) = Cl 2 + MnSO 4 + 2H 2 O + Na 2 SO 4 (100 °C)
10NаСl (t) + 8Н 2 SO 4 (конц.) + 2КМnO 4 (t) = 5Сl 2 + 2МnSO 4 + 8Н 2 О + 5Nа 2 SO 4 + К 2 SO 4 (100°C)
6NaCl (T) + 7H 2 SO 4 (конц.) + K 2 Cr 2 O 7 (t) = 3Cl 2 + Cr 2 (SO 4) 3 + 7H 2 O+ ZNa 2 SO 4 + K 2 SO 4 (100 °C)
2NaCl (s) + 4H 2 SO 4 (конц.) + PbO 2 (s) = Cl 2 + Pb(HSO 4) 2 + 2H 2 O + 2NaHSO 4 (50 °C)
NaСl (разреден) + AgNO 3 = NaNO 3 + AgСl↓
NaCl (l) → 2Na+Cl 2 (850°С, електролиза)
2NaCl + 2H 2 O→H 2 + Cl 2 + 2NaOH (електролиза)
2NаСl (р,20%) → Сl 2 + 2 нa(Nж) "амалгама"(електролиза, наHg-катод)
Калиев хлорид KCl . Безкислородна сол. Бял, нехигроскопичен. Топи се и кипи без разлагане. Умерено разтворим във вода, разтворът има горчив вкус, няма хидролиза. Влиза в йонообменни реакции. Използва се като калиев тор за производство на K, KOH и Cl 2. В природата основното компонент(заедно с NaCl) отлагания силвинит.
Уравненията за най-важните реакции са същите като тези за NaCl.
Калциев хлорид CaCl2 . Безкислородна сол. Бяло, топи се без разлагане. Разтваря се във въздуха поради интензивно абсорбиране на влага. Образува кристален хидрат CaCl 2 6H 2 O с температура на дехидратация 260 °C. Силно разтворим във вода, без хидролиза. Влиза в йонообменни реакции. Използва се за изсушаване на газове и течности и приготвяне на охлаждащи смеси. Компонент на природните води, неразделна част от тяхната “постоянна” твърдост.
Уравнения на най-важните реакции:
CaCl 2(T) + 2H 2 SO 4 (конц.) = Ca(HSO 4) 2 + 2HCl (50 °C)
CaCl 2(T) + H 2 SO 4 (конц.) = CaSO 4 ↓+ 2HCl (100 °C)
CaCl 2 + 2NaOH (конц.) = Ca(OH) 2 ↓+ 2NaCl
ZCaCl 2 + 2Na 3 PO 4 = Ca 3 (PO 4) 2 ↓ + 6NaCl
CaCl 2 + K 2 CO 3 = CaCO 3 ↓ + 2КCl
CaCl 2 + 2NaF = CaF 2 ↓+ 2NaCl
CaCl 2(l) → Ca + Cl 2 (електролиза, 800°C)
Касова бележка:
CaCO3 + 2HCl = CaCl2 + CO3 + H2O
Алуминиев хлорид AlCl3 . Безкислородна сол. Бял, топим, силно летлив. Двойката се състои от ковалентни мономери AlCl 3 (триъгълна структура, sp 2 хибридизация, преобладават при 440-800 ° C) и димери Al 2 Cl 6 (по-точно Cl 2 AlCl 2 AlCl 2, структура - два тетраедра с общ ръб, sp 3 -хибридизация, преобладават при 183-440 °C). Той е хигроскопичен и „пуши” във въздуха. Образува кристален хидрат, който се разлага при нагряване. Той е силно разтворим във вода (със силен екзо-ефект), напълно се дисоциира на йони и създава силно кисела среда в разтвора поради хидролиза. Реагира с основи, амонячен хидрат. Възстановява се чрез електролиза на стопилката. Влиза в йонообменни реакции.
Качествена реакциявърху йона Al 3+ - образуването на утайка AlPO 4, която се прехвърля в разтвор с концентрирана сярна киселина.
Използва се като суровина при производството на алуминий, катализатор в органичния синтез и крекинг на нефт, носител на хлор в органични реакции. Уравнения на най-важните реакции:
AlCl 3. 6H 2 O → AlCl(OH) 2 (100-200°С, —НС1, з 2 О) →Al 2 O 3 (250-450°С,-HCl, H2O)
AlCl 3(t) + 2H 2 O (влага) = AlCl(OH) 2(t) + 2HCl (бял дим")
AlCl 3 + 3NaON (разреден) = Al(OH) 3 (аморфен) ↓ + 3NaCl
AlCl3 + 4NaOH (конц.) = Na[Al(OH)4] + 3NaCl
AlCl3 + 3(NH3. H2O) (конц.) = Al(OH)3 (аморфен) + 3NH4Cl
AlCl 3 + 3(NH 3 H 2 O) (конц.) = Al (OH) ↓ + ZNH 4 Cl + H 2 O (100°C)
2Al 3+ + 3H 2 O + 3SO 2- 3 = 2Al(OH) 3 ↓ + 3CO 2 (80°C)
2Al 3+ =6H 2 O+ 3S 2- = 2Al(OH) 3 ↓+ 3H 2 S
Al 3+ + 2HPO 4 2- — AlPO 4 ↓ + H 2 PO 4 —
2АlСl 3 →2Аl + 3Сl 2 (електролиза, 800 °C ,в стопилкатанаСл)
Касова бележка AlCl в индустрияи - хлориране на каолин, двуалуминиев оксид или боксит в присъствието на кокс:
Al 2 O 3 + 3C (кокс) + 3Cl 2 = 2AlCl 3 + 3CO (900 °C)
железен хлорид ( II ) Е ЕС l 2 . Безкислородна сол. Бял (хидрат синкаво-зелен), хигроскопичен. Топи се и кипи без разлагане. При силно нагряване той е летлив в поток от HCl. Fe-Cl връзките са предимно ковалентни, двойката се състои от FeCl 2 мономери (линейна структура, sp-хибридизация) и Fe 2 Cl 4 димери. Чувствителен към кислорода във въздуха (потъмнява). Той е силно разтворим във вода (със силен екзо-ефект), напълно се дисоциира на йони и слабо хидролизира при катиона. Когато разтворът се вари, той се разлага. Реагира с киселини, основи, амонячен хидрат. Типичен редуктор. Влиза в йонообменни и комплексообразуващи реакции.
Използва се за синтез на FeCl и Fe 2 O 3, като катализатор в органичния синтез, компонент на лекарства срещу анемия.
Уравнения на най-важните реакции:
FeCl 2 4H 2 O = FeCl 2 + 4H 2 O (220 °C, атм.н 2 )
FeCl2 (конц.) + H2O=FeCl (OH)↓ + HCl (кипи)
FeCl 2 (t) + H 2 SO 4 (конц.) = FeSO 4 + 2HCl (кипи)
FeCl 2(t) + 4HNO 3 (конц.) = Fe(NO 3) 3 + NO 2 + 2HCl + H 2 O
FeCl 2 + 2NaOH (разреден) = Fe(OH) 2 ↓+ 2NaCl (в атм.н 2 )
FeCl 2 + 2(NH 3 . H 2 O) (конц.) = Fe(OH) 2 ↓ + 2NH 4 Cl (80 °C)
FeCl2 + H2 = 2HCl + Fe (изключително чист, над 500 °C)
4FeCl 2 + O 2 (въздух) → 2Fe(Cl)O + 2FeCl 3 (T)
2FeCl 2(p) + Cl 2 (пр.) = 2FeCl 3(p)
5Fe 2+ + 8H + + MnO - 4 = 5Fe 3+ + Mn 2+ + 4H 2 O
6Fe 2+ + 14Н + + Сr 2 O 7 2- = 6Fe 3+ + 2Сr 3+ +7Н 2 O
Fe 2+ + S 2- (разделен) = FeS↓
2Fe 2+ + H 2 O + 2CO 3 2- (разреден) = Fe 2 CO 3 (OH) 2 ↓+ CO 2
FeСl 2 →Fe↓ + Сl 2 (90°C, разреден с HCl, електролиза)
Получете e: взаимодействие на Fe със солна киселина:
Fe + 2HCl = FeCl 2+ H 2
(В индустрияИзползва се хлороводород и процесът се провежда при 500 °C).
железен хлорид ( III ) Е ЕС л 3 . Безкислородна сол. Черно-кафяв (тъмночервен при преминаваща светлина, зелен при отразена светлина), хидратът е тъмно жълт. При разтопяване се превръща в червена течност. Много летлив, разлага се при силно нагряване. Fe-Cl връзките са предимно ковалентни. Парата се състои от FeCl3 мономери (триъгълна структура, sp 2 -хибридизация, преобладават над 750 °C) и Fe 2 Cl 6 димери (по-точно Cl 2 FeCl 2 FeCl 2, структура - два тетраедъра с общ ръб, sp 3 -хибридизация, преобладават при 316-750 °C). FeCl кристален хидрат. 6H 2 O има структурата Cl 2H 2 O. Той е силно разтворим във вода, разтворът е жълт; силно хидролизиран при катиона. Разлага се в гореща вода, реагира с алкали. Слаб окислител и редуциращ агент.
Използва се като хлорен агент, катализатор в органичния синтез, оцветител за боядисване на тъкани, коагулант за пречистване на питейна вода, ецващ препарат за медни плочи при галванопластика и компонент на хемостатични лекарства.
Уравнения на най-важните реакции:
FeCl3 6H 2 O=Cl + 2H 2 O (37 °C)
2(FeCl 8 6H 2 O) = Fe 2 O 3 + 6HCl + 9H 2 O (над 250 °C)
FeCl3 (10%) + 4H 2 O = Cl - + + (жълто)
2FeCl3 (конц.) + 4H 2 O = + (жълто) + - (bc.)
FeCl 3 (разреден, конц.) + 2H 2 O → FeCl (OH) 2 ↓ + 2HCl (100 °C)
FeCl 3 + 3NaOH (разреден) = FeO(OH)↓ + H 2 O + 3NaCl (50 °C)
FeCl 3 + 3(NH 3 H 2 O) (конц., хоризонтално) =FeO(OH)↓+H 2 O+3NH 4 Cl
4FeCl 3 + 3O 2 (въздух) = 2Fe 2 O 3 + 3Cl 2 (350-500 °C)
2FeCl 3(p) + Cu→ 2FeCl 2 + CuCl 2
Амониев хлорид н H 4 Cl . Безкислородна сол, техническото наименование е амоняк. Бял, летлив, термично нестабилен. Той е силно разтворим във вода (със забележим ендо-ефект, Q = -16 kJ), хидролизира при катиона. Той се разлага с алкали, когато разтворът се вари, прехвърляйки магнезий и магнезиев хидроксид в разтвор. Комутира с нитрати.
Качествена реакцияза йона NH 4 + - освобождаването на NH 3 при варене с алкали или при нагряване с гасена вар.
Използва се в неорганичния синтез, по-специално за създаване на слабо кисела среда, като компонент на азотни торове, сухи галванични клетки, при запояване на медни и калайдисани стоманени продукти.
Уравнения на най-важните реакции:
NH 4 Cl (t) ⇌ NH 3 (g) + HCl (g) (над 337,8 °C)
NH 4 Cl + NaOH (наситен) = NaCl + NH 3 + H 2 O (100 °C)
2NH 4 Cl (T) + Ca(OH) 2 (t) = 2NH 3 + CaCl 2 + 2H 2 O (200°C)
2NH 4 Cl (конц.) + Mg = H 2 + MgCl 2 + 2NH 3 (80°C)
2NH 4 Cl (конц., хоризонтално) + Mg(OH) 2 = MgCl 2 + 2NH 3 + 2H 2 O
NH + (наситен) + NO - 2 (наситен) = N 2 + 2H 2 O (100°C)
NH4Cl + KNO3 = N2O + 2H2O + KCl (230-300 °C)
Касова бележка: взаимодействие на NH3 с HCl в газова фаза или NH3H2O с HCl в разтвор.
Калциев хипохлорит Ca(C л О) 2 . Сол на хипохлорната киселина HClO. Бял, разлага се при нагряване, без да се топи. Той е силно разтворим в студена вода (образува се безцветен разтвор), хидролизира при аниона. Реактивен, напълно се разлага топла вода, киселини. Силен окислител. При престояване разтворът попива въглероден двуокисот въздуха. Е активният компонент хлор (белина) вар -смеси с неясен състав с CaCl2 и Ca(OH)2. Уравнения на най-важните реакции:
Ca(ClO) 2 = CaCl 2 + O 2 (180 °C)
Ca(ClO) 2(t) + 4HCl (конц.) = CaCl + 2Cl 2 + 2H 2 O (80 °C)
Ca(ClO) 2 + H 2 O + CO 2 = CaCO 3 ↓ + 2HClO (на студено)
Ca(ClO) 2 + 2H 2 O 2 (разреден) = CaCl 2 + 2H 2 O + 2O 2
Касова бележка:
2Ca(OH) 2 (суспензия) + 2Cl 2 (g) = Ca(ClO) 2 + CaCl 2 + 2H 2 O
Калиев хлорат KS 10 3 . Солта на хлорната киселина HClO 3, най-известната сол на съдържащите кислород хлорни киселини. Техническо наименование - Бертолетова сол(на името на своя откривател C.-L. Berthollet, 1786). Бяло, топи се без разлагане, разлага се при допълнително нагряване. Той е силно разтворим във вода (образува се безцветен разтвор), няма хидролиза. Разлага се концентрирани киселини. Силен окислител по време на топене.
Използва се като компонент на експлозивни и пиротехнически смеси, кибритени глави и в лабораторията като солиден източник на кислород.
Уравнения на най-важните реакции:
4KlO 3 = ZKlO 4 + KCl (400 °C)
2KlO 3 = 2Kl + 3O 2 (150-300 °C, кат. MPО 2 )
KClO 3(T) + 6HCl (конц.) = KCl + 3Cl 2 + ZN 2 O (50-80 °C)
3КlO 3(T) + 2Н 2 SO 4 (конц., хоризонтално) = 2СlO 2 + КСlO 4 + Н 2 O + 2КНSO 4
(хлорният диоксид експлодира на светлина: 2C102(G)= Cl 2 + 2О 2 )
2KlO 3 + E 2 (разх.) = 2KEO 3 + Cl 2 (в раздел NНЕ 3 , E = Br, аз)
KClO 3 +H 2 O→H 2 +KClO 4 (Електролиза)
Касова бележка KClO 3 в промишлеността - електролиза на горещ разтвор на KCl (продуктът KClO 3 се освобождава на анода):
KCl + 3H 2 O → H 2 + KClO 3 (40-60 °C, електролиза)
Калиев бромид KV r . Безкислородна сол. Бял, нехигроскопичен, топи се без разлагане. Силно разтворим във вода, без хидролиза. Редуциращ агент (по-слаб от
Качествена реакцияза Br йон - изместване на бром от разтвора на KBr с хлор и екстракция на бром в органичен разтворител, например CCl 4 (в резултат на това водният слой се обезцветява, органичният слой става кафяв).
Използва се като компонент на ецващите вещества за гравиране на метали, компонент на фотографски емулсии и лекарство.
Уравнения на най-важните реакции:
2KBr (t) + 2H 2 SO 4 (CONC., hor.) + MnO 2 (t) = Br 2 + MnSO 4 + 2H 2 O + K 2 SO 4
5Вr - + 6Н + + ВrО 3 - = 3Вr 2 + 3Н 2 O
Вr — + Аg + =АgВr↓
2КВr (р) + Сl 2(Г) = 2КСl + Вг 2(р)
KBr + 3H 2 O→3H 2 + KVrO 3 (60-80 °C, електролиза)
Касова бележка:
K 2 CO 3 + 2НВr = 2KVr+ CO 2 + H 2 O
Калиев йодид К аз . Безкислородна сол. Бял, нехигроскопичен. При съхранение на светло пожълтява. Силно разтворим във вода, без хидролиза. Типичен редуктор. Воден разтвор на KI разтваря добре I2 поради комплексообразуване.
Високо качествореакция към йон I - изместване на йод от разтвора на KI поради липса на хлор и екстракция на йод в органичен разтворител, например CCl 4 (в резултат на това водният слой се обезцветява, органичният слой става лилав).
Уравнения на най-важните реакции:
10I — + 16Н + + 2МnO 4 — = 5I 2 ↓ + 2Мn 2+ + 8Н 2 O
6I - + 14Н + + Сr 2 O 7 2- =3I 2 ↓ + 2Сr 3+ + 7Н 2 O
2I - + 2H + + H 2 O 2 (3%) = I 2 ↓+ 2H 2 O
2I - + 4H + + 2NO 2 - = I 2 ↓ + 2NO + 2H 2 O
5I - + 6H + + IO 3 - = 3I 2 + 3H 2 O
I - + Ag + = AgI (жълто.) ↓
2KI (r) + Cl 2(r) (седмица) = 2Кl + I 2 ↓
KI + 3H 2 O + 3Cl 2(p) (пр.) = KIO 3 + 6HCl (80°C)
KI (P) + I 2(t) = K) (P) (кор.) ("йодна вода")
KI + 3H 2 O → 3H 2 + KIO 3 (електролиза, 50-60 °C)
Касова бележка:
K 2 CO 3 + 2HI = 2 Каз+ CO 2 + H 2 O
ФИЗИКОХИМИЧНИ ХАРАКТЕРИСТИКИ
Хлорът образува редица кислородни киселини - хипохлорна HCIO, хлорна HCIO2, хипохлорна HCIO3 и перхлорна HCв уравнението за зависимостта на концентрацията на хлорния диоксид в разтвора с(В мол/л)от неговото парциално налягане P (in mmHg чл.) с =KRсъответно при 0, 5, 10, 25 и 35° са: 70.6, 56.3, 46.2, 30.2 и 21.5. С повишаване на температурата разтворимостта на хлорния диоксид във вода рязко намалява. Разтворимостта на CSO в други разтворители (CC14, H2SO4 и CH3COOH) също се подчинява на закона на Хенри34. В студени водни разтвори хлорният диоксид се разлага изключително бавно, в гореща вода се разлага с образуването на HCIO3, CI2 и O2. Установено е съществуването на кристален хидрат C102 6H2035.
Предполага се, че хлорният диоксид е анхидрид36, който образува с вода съответните киселини H2CIO3 и H2CI2O5, които са много нестабилни и могат да бъдат редуцирани от метали до HCl2.При липса на редуциращи агенти скоростта на разлагане на тези киселини е по-висока от скоростта на образуването им. Хлорният диоксид реагира с водороден пероксид, за да образува хлорна киселина37: 2СУ2 + Н202 = 2НС102 + 02
Хлорният диоксид дразни дихателните пътища и причинява главоболие дори при разреждане 45:1000.
Хлорната киселина 38-40 също се изолира в свободна форма, но обикновено се получава във водни разтвори. Константата му на дисоциация е 1,07-10-2 при 18°. Образуването на хлорна киселина се случва в значителни количества само в силно кисела среда (рН<3). При этом в растворе наряду с хлористой кислотой находится и двуокись хлора 4I.
Хлоритите - соли на хлорната киселина в твърдо състояние при обикновени условия са доста стабилни съединения. Киселинните водни разтвори се разлагат толкова по-бързо, колкото по-висока е температурата и колкото по-ниска е стойността на pH. Алкалните разтвори са доста стабилни42. Някои хлорити могат да бъдат получени чрез действието на свободна хлорна киселина върху неразтворими карбонати43. Натриевият хлорит кристализира от алкален разтвор под формата на безводна сол NaC102 и трихидрат NaC102-3H20, който се превръща в безводна сол при 37,4°44. При нагряване до 175 ° се разлага с отделяне на кислород. Реакцията протича с висока скорост, докато експлодира. В леко алкални разтвори, съдържащи не повече от 1 g-mol/l NaC102, натриевият хлорит не се разлага при варене. В по-концентрирани разтвори се разлага съгласно реакции 45,46:
3 NaCl02 = 2 NaClC>3 + NaClNaC102 - NaCl+ 02
Скоростните константи на тези реакции са равни47 съответно при 103°: 0,65-10-6 и 1,2-10-7; при 83°: 1,6-10-7 и 0,2-10-8.
Хипохлорната киселина може да съществува само в свободна форма в разтвор. Това е силна киселина и силен окислител. Неговите соли - хлорати - са предимно силно разтворими във вода; в разтвори те не са окислители.
Калиевият хлорат или калиево-хлоратната сол KSUz кристализира в безводна форма под формата на прозрачен безцветни кристалимоноклинна система с плътност 2,32 g/cm3.Разтворимост на KS103 във вода: при 0° - 3,21%, при 104° (точка на кипене) - 37,6%. При нагряване до 368,4 ° KSUS се топи и след това започва да се разлага според реакциите:
2КСЮз = 2КС1 +302 +23,6 към изпражненията 4KS103 = ZKSYu4 + KS1 + 70,9 ккал
Получените продукти (KS1 и KS104) ускоряват48 отделянето на кислород. При 610° полученият калиев перхлорат се топи и разлага:
KSYu4 = KS1 + 202 - 7,9ккал
В присъствието на катализатори (MnO2 и други), калиевият хлорат се разлага при повече от ниски температурис интензивно отделяне на кислород. Калиевият хлорат в кисела среда е силен окислител. Смесите му с въглища, сяра и други вещества експлодират при удар. Калиевият хлорат (и други хлорати) е отровен (летална доза - 2-3g KSO3).
Натриевият хлорат NaC103 кристализира в безводна форма, силно е хигроскопичен и дифундира във въздуха. Наситен воден разтвор съдържа 41,9% при -15° и 74,1% NaC103 при 122°. Точката на топене на натриевия хлорат е в диапазона 248-264 °. Има случаи на експлозии на натриев хлорат в складове по време на съхранение, както и възпаление на сухи части от растения, които са били изложени на натриев хлорат. В присъствието на хигроскопични вещества (CaCl2, MgCl2 и др.) 4E, както и полиборати или натриеви метаборати, експлозивната и запалима опасност от натриев хлорат се намалява. В системата NaC103-NaC102-H20 50 безводният NaC103 и NaCl02, както и NaC102-3H20 кристализират в температурния диапазон 15-45°.
Калциевият хлорат Ca(Cl3)2 кристализира от воден разтвор под формата на дихидрат51, топящ се при 130°. Наситен воден разтвор кипи при 182°. Безводният калциев хлорат се разлага при нагряване до 334°.
Магнезиевият хлорат хексахидрат Mg(C103)2 6H20 е орторомбични кристали - дълги игли или листа. При 35° се стопява частично и се превръща в тетрахидрат. Разтворимостта му във вода е 53% при 0°, 56,5% при 18°, 60,23% при 29° и 63,65% при 35°. Той е силно хигроскопичен, не експлодира и е пожаробезопасен49.
Перхлорната киселина52 образува два кристални хидрата - HC104 4H20 и HCIO4 3H20 53 и е силен електролит 54. Коефициентът на активност на перхлорната киселина при 25° се променя от 0,911 до 0,804, когато концентрацията на HCIO4 се променя от 0,01 до 0,1 Мв 1 килограмаразтвор®5.
Калиевият перхлорат KSIu4 образува орторомбични кристали с плътност 2,52 g/cm3.От 0 до 100 млвода се разтваря 0,75 G, и при 100° - 21,8 g KSO4. Чистият калиев перхлорат се разлага при 537-600° на KC1 и 02. KC103 се образува като междинен продукт, който при стопяване ускорява разлагането56. Реакцията се ускорява в присъствието на KCl, KBr, KI57, Cu, Fe, Co, MgO и др.58.
Магнезиевият перхлорат образува кристални хидрати с 2, 4 и 6 водни молекули. Равновесното налягане на парите при 23° над Mg(C104)2 6H20 е 20,9 mmHg Изкуство.,над Mg(C104)2 4H20- 8.15 mmHg Изкуство.,и над Mg(C104)2-2H20 около Yu-4-Sh-5 мм rt. чл.5Д.При нагряване над 400° Mg(C104)2 се разлага60.
Амониевият перхлорат се характеризира с най-високото тегловно съдържание на кислород сред всички перхлорати. 10.7 се разтваря в 100 g при 0° G,при 85° - 42,5 Ж NH4CI04. Във взаимна водна система от перхлорати и хлориди. най-малко амоний и магнезий разтворима солпри 25° е NH4CIO461.
Кислородни съединения на хлора по-високи степениокисляване - опасност от пожар и експлозия, особено при наличие на лесно окисляеми примеси, например органична материя, от които те трябва да бъдат защитени от замърсяване. Експлозията на твърди сухи хлорати и перхлорати може да бъде причинена от удар или силен удар, което трябва да се вземе предвид при сушенето, смилането и транспортирането им в< ществ. Эти операции должны осуществляться в аппаратах, в которых исключена возможность ударов металлических частей.
ПРИЛОЖЕНИЕ
Солите на по-ниските кислородни киселини на хлора са добри избелващи агенти поради тяхната висока окислителна активност. Основното избелващо и окисляващо хлорно съединение е белина62. Понастоящем за тези цели широко се използват и хипохлорити, хлорити и хлорен диоксид.
Най-големите количества белина се използват в текстилната и хартиената промишленост за избелване на тъкани и целулоза (белината често се нарича избелваща вар). Варовият хлорид се използва като окислител в някои химическо производство(при получаване на хлороформ, хлорпикрин и други продукти), за дезинфекция на питейни и Отпадъчни води, за дезинфекция на зеленчукови складове63 и като добър дегазатор. Използва се и за пречистване на ацетилен и някои петролни продукти.
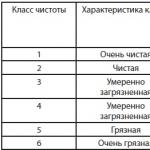
Варовият хлорид се произвежда в три степени (Таблица 112).
Загубите на активен хлор в белина клас А трябва да бъдат не повече от 4% в продължение на 3 години на съхранение от датата на изпращане от завода.
Варовият хлорид клас В и С се опакова в дървени бъчви с вместимост от 50 до 275 л,в шперплатови щамповани варели или шперплатови варели с капацитет 50 и 100 л,а също и (за краткотрайно съхранение) в сухи, напълнени дървени бъчви с вместимост от 50 до 250 л.Варовият хлорид клас А, както и клас Б (за дългосрочно съхранение) се опакова в стоманени варели с капацитет 100 л.Бъчвите или варелите с белина се затварят херметически и се съхраняват в сухо и хладно помещение, защитено от пряка слънчева светлина. Вместо дървени бъчви и варели се използват и найлонови торби.
Въпреки тези предпазни мерки, белината постепенно губи активен хлор по време на съхранение. Ако контейнерът не е плътно затворен, някои проби от продукти почти напълно губят активен хлор в рамките на една година, а понякога и много по-рано. При 40-45° обикновената белина напълно губи своята активност в рамките на 2 месеца.
Варовият хлорид все повече се заменя с други по-удобни избелващи и окисляващи вещества62 - хипохлорити, хлорен диоксид и др.
Натриевият хипохлорит под формата на воден разтвор се използва широко поради лесното му производство на мястото на консумация. Той е междинен продукт 64 при производството на хидразин, пластмаси, синтетични влакна и др. Предложен е метод с хипохлорит 65 за обработка на прахообразни отпадъци от заточващи карбидни инструменти, базиран на окисляването на волфрамов карбид в алкални разтвори на NaCIO и прехода на волфрам в разтвор.
Съгласно GOST 11086-64 натриевият хипохлорит трябва да бъде прозрачна зеленикаво-жълта течност без утайка или суспендирани частици, съдържаща най-малко 185 g/lактивен хлор и не повече от 0,07 g/lжлеза; Съдържанието на NaOH трябва да бъде в рамките на 10-20 g/l.Разтворът на натриев хипохлорит се съхранява и транспортира в затворени гумирани или защитени с винил цистерни и контейнери при температура не по-висока от 25 °.
Техническият калциев хипохлорит, съдържащ повече от 50% активен хлор, е по-транспортируем от белината. По-малко от 100% баласт (примеси и контейнери) се транспортира с калциев хипохлорит, докато 250-300% се транспортира с белина. Важно предимство на калциевия хипохлорит в сравнение с белина е липсата на значителна утайка при разтварянето му във вода66 (при разтваряне на белина се образува утайка от основни соли, в която понякога се губи до 50% активен хлор). Предложено е67 да се използва смес от 2 тегл. части Ca(OS1)2 и 0,8 тегл. включително Na2S04 под формата на таблетки за пречистване на вода.
Калциевият хипохлорит се произвежда под формата на двуосновна сол 3Ca(CiO)2 2Ca (OH)2 2H20, обозначена като DTSGK, и по-рядко под формата на двуосновен калциев хипохлорит Ca (C10)2 2Ca(OH)2, обозначена като DSGK - GOST 13392-67 предвижда освобождаването на DTSGK
и 2 клас. Те трябва да съдържат съответно: активен хлор не по-малко от 55 и 50% и влага не повече от 1 и 1,5%; общото съдържание на хлор не трябва да надвишава половината от съдържанието на активен хлор (%) плюс 6% за 1-ви клас или плюс 7% за
ДТСГК се опакова в поцинковани варели. Продуктът трябва да се съхранява в сухо неотопляемо помещение.
По своите окислителни свойства хлорният диоксид заема междинна позиция между хлоратите и хипохлоритите. Основното му предимство като избелващ реагент е, че няма почти никакъв разрушителен ефект върху влакната на влакната. Поради това се използва широко какНай-добрият избелващ агент за дървесна (хартиена) маса и целулоза, както и за стерилизация и дезодориране на вода68 и хранителни продукти. Поради трудностите при съхранение и транспортиране COG обикновено се получава на мястото на консумация и се използва като 10% смес с въздух69.
Натриевият хлорит се използва широко в текстилната промишленост за избелване на тъкани, прежди и влакна. Това постига високо качествоизбелване без намаляване на здравината на влакната. Използва се и като изходен материал за производството на малки количества хлорен диоксид.
Калиевият хлорат се използва главно в производството на кибрит, в пиротехниката, в малки количества във фармацевтичната индустрия, а също и в експлозивите.
Състав на технически бертолетова солтрябва да съответства на данните в таблицата. 113.
ТАБЛИЦА 113
Състав на техническа бертолетасол(ОтГОСТ 2713-70)
Калиев хлорат (по отношение на сухо вещество), неНе.....
Влага, не повече.................................................. ..... ................................
Не е разтворим Vвещества във вода, не Повече ▼................................
Хлориди (по отношение на CaC12), не повече.................................
Сулфати (по отношение на CaS04), не повече...................................
Бромати (по отношение на KVg03), не повече...................................
Алкални (по отношение на CaO), не повече.....................................
Органични вещества, не повече............................................. ...... ....
Тежки метали (по отношение на Pb), не повече. . . . Желязо (Fe), не сол
Натриевият хлорат се използва като хербицид и дефолиант (в ограничени количества поради неговата хигроскопичност). Използва се главно като междинен продукт за производството на други хлорати, калиев перхлорат, перхлорна киселина, хлорен диоксид и натриев хлорит. Някои (малки) количества натриев хлорат се използват за избелване на целулоза. Описано е използването на NaC103 за производството на свещи, които са източник на кислород на атомни подводници70.
Съставът на техническия натриев хлорат, кристален и разтвор (или пулп), съгласно GOST 12257-66, трябва да отговаря на изискванията, посочени в табл. 114.
ТАБЛИЦА U4
Състав на технически натриев хлорат (ГОСТ 12257-66)
|
0,7* 0,3* 0,2* |
* По отношение на 100% продукт.
Бертолетовата сол и натриевият хлорат се опаковат в торби от полиетиленово или поливинилхлоридно фолио, затворени варели от галванизирана стомана или покрити с перхлоровинилов лак, или в торби от хлорна тъкан (също с филмова обвивка).
Калциевият хлорат е хербицид общо действиеи се използва широко за унищожаване на плевели.
Магнезиевият хлорат също така служи като хербицид и освен това е дефолиант, използван за отстраняване на памукови листа преди прибиране на реколтата 71>72, а в големи дози може да служи като десикант за изсушаване преди прибиране на реколтата на памук и други растения.
Магнезиевият хлорат (дефолиант), съгласно GOST 10483-66, трябва да съдържа 60 ± 2% Mg(C103)2 · 6H20 и не повече от 0,6% неразтворим във вода остатък; температурата, при която започва да се топи, не трябва да бъде по-ниска от 44 °. Транспортира се в запечатани варели от черна покривна стомана или в петслойни хартиени битумни торби с подложка от полиетиленово или поливинилхлоридно фолио.
Перхлоратите се използват в производството на експлозиви и пиротехнически материали 52 – 73. Предложени са смеси, съдържащи ~60% KS104, които образуват хигроскопичен дим за регулиране на атмосферните валежи 74.
Сред перхлоратите амониевият перхлорат е от особено значение, използван за производството на бездимни експлозиви75"76. Перхлорати тежки металии перхлорна киселина се използват като електролити при галванопластика, циментиране и др. В присъствието на HC104 се получават плътни, блестящи паладиеви отлагания върху електролитно полирана мед77. Те показват78 възможността за повторно извличане на рений с перхлорна киселина от органични разтворители.
Халогените образуват редица съединения с кислорода. Всички тези съединения обаче са нестабилни, не могат да бъдат получени чрез директно взаимодействие на халогени с кислород и могат да бъдат получени само индиректно. Такива характеристики на кислородните съединения на халогените са в съответствие с факта, че почти всички от тях са характеризирани положителни стойностистандартна енергия на образуване на Гибс (вижте например Таблица 7 на страница 194 за стойности за ).
От кислородсъдържащите халогенни съединения най-стабилни са солите на кислородните киселини, най-малко стабилни са оксидите и киселините. Във всички кислородсъдържащи съединения халогените, с изключение на флуора, проявяват положителна степен на окисление, достигаща седем.
Кислородният флуорид може да се получи чрез преминаване на флуор в охладен разтвор. Реакцията протича по уравнението:
Освен това винаги се образуват кислород, озон и водороден прекис. При нормални условия това е безцветен газ с остра миризма на озон. Кислородният флуорид е много токсичен, проявява силни окислителни свойства и може да служи като един от ефективните окислители на ракетните горива.
Най-многобройни и практически важни са кислородните съединения на хлора, които ще разгледаме малко по-подробно.
Както вече беше посочено, кислородните съединения на хлора могат да бъдат получени само чрез индиректни методи. Нека започнем разглеждането на начините на тяхното образуване с процеса на хидролиза на хлор, т.е. с обратима реакция между хлор и вода
в резултат на което се образуват солна киселина и хипохлориста киселина.
Хидролизата на хлор е реакция на самоокисление-саморедукция, при която един от хлорните атоми, получавайки електрон от друг атом, се редуцира, а другият хлорен атом се окислява.
Получената хидролиза на хлор може да взаимодейства помежду си, като отново образува хлор и вода, така че реакцията не завършва; равновесието се установява, когато приблизително разтвореният хлор реагира. По този начин хлорната вода винаги съдържа, заедно с молекулите, значително количество солна и хипохлориста киселина.
Хипохлорната киселина е много слаба киселина (), по-слаба от въглеродната киселина; неговите соли се наричат хипохлорити. Тъй като е много нестабилно съединение, хипохлорната киселина постепенно се разпада дори в разреден разтвор (вижте по-долу).
Хипохлорната киселина е много силен окислител; Образуването му при взаимодействието на хлора с водата обяснява избелващите свойства на хлора. Напълно сухият хлор не избелва, но при наличие на влага оцветителят бързо се разрушава от хипохлорната киселина, образувана при хидролизата на хлора.
Ако алкалите се добавят към хлорната вода, тогава поради неутрализирането на хипохлорната и солната киселина, равновесието в системата
се движи надясно; реакцията почти завършва и се получава разтвор, съдържащ соли на хипохлорна и солна киселина:
Същият резултат ще се получи, ако хлорът се прекара директно в студен алкален разтвор
или в йонно-молекулярна форма:
Полученият по този начин разтвор на соли на хипохлорна и солна киселина се използва за избелване; неговите избелващи свойства се дължат на факта, че калиевият хипохлорит лесно се разлага вече под въздействието на въглероден диоксид във въздуха и се образува хипохлорна киселина:
Последният обезцветява боите, като ги окислява.
Подобен разтвор, съдържащ натриев хипохлорит, се получава чрез преминаване на хлор в разтвор на натриев хидроксид. И двата разтвора могат да бъдат получени чрез електролиза на разтвори на калиеви или натриеви хлориди, ако освободеният хлор се остави да реагира с алкалите, образувани по време на електролизата (виж, страница 549).
Когато хлорът действа върху суха гасена вар, се получава така наречената избелваща или избелваща вар. Основният му компонент е солта, която се образува по уравнението:
Тази сол е отговорна структурна формула, според което трябва да се разглежда като смесена сол на солна и хипохлорна киселина.
Белината е бял прах с остра миризма и има силни окислителни свойства. Във влажен въздух, под въздействието на въглероден диоксид, той постепенно се разлага, отделяйки хипохлорна киселина:
При излагане на белина на солна киселинаотделя се хлор:
Варовият хлорид се използва за избелване на растителни влакна (тъкани, хартия) и за дезинфекция.
В разтвор хипохлорната киселина претърпява три различни типа трансформации, които протичат независимо една от друга:

Чрез промяна на условията е възможно да се гарантира, че реакцията протича почти изцяло в една посока.
Когато е изложена на пряка слънчева светлина и в присъствието на определени катализатори или редуциращи агенти, разлагането на хипохлорната киселина протича съгласно уравнение (1).
Реакция (2) протича например в присъствието на средства за отстраняване на водата. Реакцията води до оксид (хипохлорен анхидрид), който е изключително нестабилен жълто-кафяв газ с миризма, подобна на тази на хлор.
Разлагането по реакция (3) става особено лесно при нагряване. Следователно, ако прехвърлите хлор в горещ разтвор на калиев хидроксид, вместо това веднага получавате:
Продуктите на реакцията са калиев хлорид и калиев хлорит, сол на перхлорната киселина. Тъй като калиевият хлорат (или бертолетовата сол) е слабо разтворим в студена вода, той се утаява, когато разтворът се охлади.
Хипохлорната киселина, съответстваща на хлоратите, е известна само под формата на воден разтвор с концентрация не по-висока от . Проявява свойствата на силна киселина (приблизително равна по сила на и) и силен окислител. И така, концентрираните разтвори от него запалват дърво.
За разлика от свободните хлорати, окислителните свойства в разтвора са слабо изразени. Повечето от тях са силно разтворими във вода; всички те са отровни. Най-широко използваният от хлоратите е хлоратът, който лесно се разлага при нагряване. В присъствие (като катализатор) разлагането обикновено протича съгласно уравнението:
С различни запалими вещества (сяра, въглища, фосфор) образува смеси, които експлодират при удар. Това е основата за използването му в артилерията за изработка на фитили. Калиевият хлорат се използва в пиротехниката за приготвяне на бенгалски огън и други силно запалими смеси. Основният потребител на калиев хлорат е производството на кибрит. Главата на обикновен мач съдържа около .
Хлорният анхидрид е неизвестен. Когато действа концентрирана сярна киселина, вместо това се отделя жълто-кафяв газ с характерна миризма - хлорен диоксид (или диоксид). Това е много нестабилно съединение, което при нагряване, удар или контакт с други вещества лесно се разлага експлозивно на хлор и кислород.
Хлорният диоксид се използва за избелване или стерилизиране на различни материали (хартиена маса, брашно и др.).
При взаимодействие с алкален разтвор реакцията протича бавно
с образуването на соли на две киселини - перхлорна и хлорна.
Хлорната киселина не е много стабилна. По сила и окислителна активност той заема междинна позиция между и. Хлоритните соли се използват при избелване на тъкани.
Когато калиевият хлорат се нагрява внимателно без катализатор, неговото разлагане протича по същество съгласно следната схема:
Полученият калиев перхлорат е много слабо разтворим във вода и следователно може лесно да бъде изолиран.
Действието на концентрираната сярна киселина може да произведе свободна перхлорна киселина, която е безцветна течност, която дими във въздуха.
Безводният е нестабилен и понякога експлодира по време на съхранение, но неговите водни разтвори са доста стабилни. Окислителните свойства са по-слабо изразени от тези на, а киселинните са по-силни. Перхлорната киселина е най-силната от всички известни киселини.
Солите, с няколко изключения, които включват и, са силно разтворими и не проявяват окислителни свойства в разтвор.
Ако загреете перхлорна киселина, като премахнете водата от нея, се образува оксид или перхлорен анхидрид,
Оксидът е мазна течност, която кипи с разлагане при. Експлодира при удар или при излагане на екстремна топлина.
Промяната в свойствата на серията хлорни кислородни киселини може да се изрази чрез следната схема:

С увеличаване на степента на окисляване на хлора стабилността на неговите кислородни киселини се увеличава и тяхната окислителна способност намалява. Най-силният окислител е хипохлорната киселина, най-малко силният е перхлорната киселина.
Напротив, силата на кислородните киселини на хлора се увеличава с увеличаване на неговата степен на окисление. От всички хлорни хидроксиди най-слабата киселина е хипохлорната киселина, най-силната е перхлорната киселина. Този модел е увеличение киселинни свойствахидроксид, съответно отслабване на неговите основни свойства) с увеличаване на степента на окисление на елемента е характерно не само за хлора, но и за други елементи. При първо приближение този модел може да се обясни, като се разглеждат всички химични връзки в хидроксидните молекули като чисто йонни.
На фиг. 108 схематично показва част от молекула хидроксид, съставена от зареден йон, кислороден йон и водороден йон (протон). Дисоциацията на тази част от молекулата на йони може да се случи или с разцепване на връзката (което води до разцепване) или с разцепване на връзката (което води до разцепване на йони); в първия случай хидроксидът ще прояви свойствата на основа, във втория - свойствата на киселина.
Всеки от възможните начини за дисоциация на хидроксид ще се извърши толкова по-лесно, колкото по-слаба е връзката между съответните йони. С увеличаване на степента на окисление на даден елемент, зарядът на йона ще се увеличи, което ще увеличи привличането му към йона и по този начин ще усложни дисоциацията на хидроксида като основа.

Ориз. 108. Йонна схема на фрагмент от хидроксидна молекула
В същото време взаимното отблъскване на еднакво заредените йони и ще се увеличи, което ще улесни дисоциацията от киселинен тип. По този начин, с увеличаване на степента на окисление на даден елемент, киселинните свойства се увеличават и основните свойства на хидроксида, образуван от този елемент, отслабват.
Увеличаването на радиуса на йона, докато зарядът му остава непроменен, ще доведе до увеличаване на разстоянията между центъра на този йон и центровете на йоните и . В резултат на това взаимното електростатично привличане на йоните ще стане по-слабо, което ще улесни дисоциацията според основния тип; в същото време взаимното отблъскване на йоните и ще намалее, така че дисоциацията от киселинен тип ще стане по-трудна. Следователно, с увеличаване на радиуса на йона на даден елемент (като зарядът му остава непроменен), основните свойства се подобряват и киселинните свойства на хидроксида, образуван от този елемент, се отслабват. Пример за проявлението на този модел е промяната в константите на киселинна дисоциация в серията.
 Всички хлорни оксиди имат остра миризма, термично и фотохимично са нестабилни и са склонни към експлозивно разлагане. +1 Cl 2 O T. Pl o. C T. kip °C -120,6 +3 +4 +4 +5 +6 +7 Cl 2 O 3 Cl. O 2 Cl 2 O 4 Cl 2 O 5 Cl 2 O 6 Cl 2 O 7 не се получава чрез HCl. O 2 -117 9.7 2.0 -59 не се получава 44.5 -93.4 203 HCl. О 3 3 87 НС1. O 4 хлорен хлорид разтворен хлор силен много силен хипохлорити хлорати Na. кл. O 2 KCl. O 3 перхлорати слаб средно силен хлор KCl. О 4
Всички хлорни оксиди имат остра миризма, термично и фотохимично са нестабилни и са склонни към експлозивно разлагане. +1 Cl 2 O T. Pl o. C T. kip °C -120,6 +3 +4 +4 +5 +6 +7 Cl 2 O 3 Cl. O 2 Cl 2 O 4 Cl 2 O 5 Cl 2 O 6 Cl 2 O 7 не се получава чрез HCl. O 2 -117 9.7 2.0 -59 не се получава 44.5 -93.4 203 HCl. О 3 3 87 НС1. O 4 хлорен хлорид разтворен хлор силен много силен хипохлорити хлорати Na. кл. O 2 KCl. O 3 перхлорати слаб средно силен хлор KCl. О 4
 § Всички съединения с хлор в положителни степени са много силни окислители. § Най-силно окислителни свойства има хипохлорната киселина, въпреки че тя е слаба и нестабилна. § Свободните кислородсъдържащи хлорни киселини са нестабилни и, с изключение на перхлорната киселина, съществуват само в разтвор. Всички те са силни окислители. § Силата на киселините и техните окислителни свойства са различни понятия. § В серията HCl. O - HCl. O 2 - HCl. O 3 - HCl. O 4 стабилността и силата на киселините се увеличават, а реактивността намалява.
§ Всички съединения с хлор в положителни степени са много силни окислители. § Най-силно окислителни свойства има хипохлорната киселина, въпреки че тя е слаба и нестабилна. § Свободните кислородсъдържащи хлорни киселини са нестабилни и, с изключение на перхлорната киселина, съществуват само в разтвор. Всички те са силни окислители. § Силата на киселините и техните окислителни свойства са различни понятия. § В серията HCl. O - HCl. O 2 - HCl. O 3 - HCl. O 4 стабилността и силата на киселините се увеличават, а реактивността намалява.
 Съотношение на халогени към вода ü 2 F 20 + 2 H 2 O− 2 → 4 HF + O 2 взаимодействие, F 2 - окислител, ü Cl 20 + H 2 O ↔ HCl+1 O + HCl− 1 взаимодействие, Cl 20 - окислител, редуциращ агент; реакция - диспропорциониране, ü Br 20 + H 2 O ↔ HBr +1 O + HBr - 1 е силно разтворим, практически не възниква взаимодействие; Br 20 – окислител, редуктор; реакция – диспропорциониране, ü I 2 + H 2 O ≠ слабо разтворим, практически не се получава взаимодействие; ü При 2 + H 2 O ≠ слабо разтворим, практически не възниква взаимодействие
Съотношение на халогени към вода ü 2 F 20 + 2 H 2 O− 2 → 4 HF + O 2 взаимодействие, F 2 - окислител, ü Cl 20 + H 2 O ↔ HCl+1 O + HCl− 1 взаимодействие, Cl 20 - окислител, редуциращ агент; реакция - диспропорциониране, ü Br 20 + H 2 O ↔ HBr +1 O + HBr - 1 е силно разтворим, практически не възниква взаимодействие; Br 20 – окислител, редуктор; реакция – диспропорциониране, ü I 2 + H 2 O ≠ слабо разтворим, практически не се получава взаимодействие; ü При 2 + H 2 O ≠ слабо разтворим, практически не възниква взаимодействие
 Хлорни оксиди Параметър за сравнение Хлорен оксид (I) хлор (IV) Агрегатно състояние при n. u. , цвят Кафяво-жълт газ; при t°
Хлорни оксиди Параметър за сравнение Хлорен оксид (I) хлор (IV) Агрегатно състояние при n. u. , цвят Кафяво-жълт газ; при t°
 Параметър за сравнение Хлорен оксид (I) Хлорен оксид (IV) Хлорен оксид (VII) Термична стабилност Термично нестабилен, разлага се на светлина Термично много нестабилен Бавно се разлага при стайна температура Най-стабилният хлорен оксид, разлага се при нагряване до 120 ° C Токсичност Токсичен, засяга пътищата на дихателните пътища Токсичен Силно отровен Токсично отношениекъм вода Разтворим добре, взаимодейства с вода
Параметър за сравнение Хлорен оксид (I) Хлорен оксид (IV) Хлорен оксид (VII) Термична стабилност Термично нестабилен, разлага се на светлина Термично много нестабилен Бавно се разлага при стайна температура Най-стабилният хлорен оксид, разлага се при нагряване до 120 ° C Токсичност Токсичен, засяга пътищата на дихателните пътища Токсичен Силно отровен Токсично отношениекъм вода Разтворим добре, взаимодейства с вода
 Методи за получаване на хлорни оксиди Хлорен оксид Име на метода, UHR Хлорен оксид (I) Взаимодействие на живачен оксид (II) с хлор при 0°C: Hg. O(твърд) + 2 Cl 2(газ) → Hg. Cl 2 + Cl 2 O Хлорен оксид (IV) 1) Взаимодействие на калиев хлорат с оксалова киселина: KCl. O 3 + H 2 C 2 O 4 → K 2 CO 3 + 2 Cl. O 2 + CO 2 + H 2 O (лабораторен метод); 2) Преминаване на серен диоксид SO 2 в подкислен разтвор на натриев хлорат: 2 Na. кл. O 3 + SO 2 + H 2 SO 4 = 2 Na. HSO 4 + 2 Cl. O 2 (промишлен метод) Хлорен (VI) оксид Окисляване на хлорен (IV) оксид с озон: 2 Cl. O 2 + 2 O 3 = 2 O 2 + Cl 2 O 6 Хлорен оксид (VII) Реакция на перхлорна киселина с фосфорен анхидрид - фосфорен оксид (V): 8 HCl. O 4 + P 4 O 10 → 4 Cl 2 O 7 + 2 H 4 P 2 O 7
Методи за получаване на хлорни оксиди Хлорен оксид Име на метода, UHR Хлорен оксид (I) Взаимодействие на живачен оксид (II) с хлор при 0°C: Hg. O(твърд) + 2 Cl 2(газ) → Hg. Cl 2 + Cl 2 O Хлорен оксид (IV) 1) Взаимодействие на калиев хлорат с оксалова киселина: KCl. O 3 + H 2 C 2 O 4 → K 2 CO 3 + 2 Cl. O 2 + CO 2 + H 2 O (лабораторен метод); 2) Преминаване на серен диоксид SO 2 в подкислен разтвор на натриев хлорат: 2 Na. кл. O 3 + SO 2 + H 2 SO 4 = 2 Na. HSO 4 + 2 Cl. O 2 (промишлен метод) Хлорен (VI) оксид Окисляване на хлорен (IV) оксид с озон: 2 Cl. O 2 + 2 O 3 = 2 O 2 + Cl 2 O 6 Хлорен оксид (VII) Реакция на перхлорна киселина с фосфорен анхидрид - фосфорен оксид (V): 8 HCl. O 4 + P 4 O 10 → 4 Cl 2 O 7 + 2 H 4 P 2 O 7
 Химични свойства на хлорните оксиди Cl 2 O – хлорен оксид (I) Cl 2+1 O + H 2 O = 2 HCl+1 O не е ORP, Cl 2+1 O + 2 KOH = 2 KCl+1 O + H 2 O не OVR, Cl. O 2 – хлорен оксид (IV) 2 Cl+4 O 2 + H 2 O = HCl+3 O 2 + HCl+5 O 3 ORR, Cl+4 – както редуциращ агент, така и окислител 2 Cl+4 O 2 + 2 KOH = KCl+3 O 2 + KCl+5 O 3 + H 2 O ORR, Cl+4 – както редуциращ агент, така и окислител Cl 2 O 6 – хлорен оксид (VI) Cl 2+6 O 6 + H 2 O = HCl+ 5 O 3 + HCl+7 O 4 ORR, Cl+6 – както редуциращ агент, така и окислител Cl 2+6 O 6 + 2 KOH = KCl+5 O 3 + KCl+7 O 4 + H 2 O ORR, Cl+6 – както редуциращ агент, така и окислител Cl 2 O 7 – хлорен оксид (VII) Cl 2+7 O 7 + H 2 O = 2 HCl+7 O 4 не е ORR, а Cl 2+7 O 7 + 2 KOH = 2 KCl+ 7 O 4 + H 2 O не ORR,
Химични свойства на хлорните оксиди Cl 2 O – хлорен оксид (I) Cl 2+1 O + H 2 O = 2 HCl+1 O не е ORP, Cl 2+1 O + 2 KOH = 2 KCl+1 O + H 2 O не OVR, Cl. O 2 – хлорен оксид (IV) 2 Cl+4 O 2 + H 2 O = HCl+3 O 2 + HCl+5 O 3 ORR, Cl+4 – както редуциращ агент, така и окислител 2 Cl+4 O 2 + 2 KOH = KCl+3 O 2 + KCl+5 O 3 + H 2 O ORR, Cl+4 – както редуциращ агент, така и окислител Cl 2 O 6 – хлорен оксид (VI) Cl 2+6 O 6 + H 2 O = HCl+ 5 O 3 + HCl+7 O 4 ORR, Cl+6 – както редуциращ агент, така и окислител Cl 2+6 O 6 + 2 KOH = KCl+5 O 3 + KCl+7 O 4 + H 2 O ORR, Cl+6 – както редуциращ агент, така и окислител Cl 2 O 7 – хлорен оксид (VII) Cl 2+7 O 7 + H 2 O = 2 HCl+7 O 4 не е ORR, а Cl 2+7 O 7 + 2 KOH = 2 KCl+ 7 O 4 + H 2 O не ORR,
 Кислородсъдържащи хлорни киселини Физични свойства, методи на получаване Химични свойства - връзка с нагряване, алкални разтвори и основни оксиди
Кислородсъдържащи хлорни киселини Физични свойства, методи на получаване Химични свойства - връзка с нагряване, алкални разтвори и основни оксиди
 Кислородсъдържащи киселини на хлор Формула на киселина Степен на окисление на Cl в киселина HCl+1 O HCl+3 O 2 HCl+5 O 3 HCl+7 O 4 +1 +3 +5 +7 Увеличава Термична стабилност Увеличава Киселинна сила Увеличава Много слаба киселина Частично слаба киселина дисоциира във вода Форма на съществуване Киселина със средна сила, по-близо до силна Една от най-силните киселини дисоциира почти необратимо съществува само в разтвор, изолиран в свободна форма
Кислородсъдържащи киселини на хлор Формула на киселина Степен на окисление на Cl в киселина HCl+1 O HCl+3 O 2 HCl+5 O 3 HCl+7 O 4 +1 +3 +5 +7 Увеличава Термична стабилност Увеличава Киселинна сила Увеличава Много слаба киселина Частично слаба киселина дисоциира във вода Форма на съществуване Киселина със средна сила, по-близо до силна Една от най-силните киселини дисоциира почти необратимо съществува само в разтвор, изолиран в свободна форма
 Хипохлорната киселина се получава чрез разтваряне на хлорен оксид (I) във вода (1): (1) Cl 2 O + H 2 O → 2 HCl. O Хипохлорна киселина – хлорна вода, разтвор на хлор във вода. Получава се в хлоратор чрез преминаване на хлор във вода до насищане (1 обем вода разтваря около 2,2 обема газообразен хлор при 20°C) (2): (2) Cl 2 + H 2 O ⇌ HCl. Образува се O + HCl HCl. O се разлага на светлина на O 2 и HCl. Хлорната вода е силен окислител и се използва за дезинфекция на вода и избелване на тъкани.
Хипохлорната киселина се получава чрез разтваряне на хлорен оксид (I) във вода (1): (1) Cl 2 O + H 2 O → 2 HCl. O Хипохлорна киселина – хлорна вода, разтвор на хлор във вода. Получава се в хлоратор чрез преминаване на хлор във вода до насищане (1 обем вода разтваря около 2,2 обема газообразен хлор при 20°C) (2): (2) Cl 2 + H 2 O ⇌ HCl. Образува се O + HCl HCl. O се разлага на светлина на O 2 и HCl. Хлорната вода е силен окислител и се използва за дезинфекция на вода и избелване на тъкани.
 Хлориста киселина Киселинният разтвор се получава от нейните соли - хлорити Ba(Cl. O 2)2 + H 2 SO 4 → 2 HCl. O 2 + Ba. SO 4↓ И също според реакцията: 2 Cl. O 2 + H 2 O → HCl. О2 + НС1. O 3 Хлорната киселина е киселина със средна сила, по-близо до слаба.Хлоритите се използват за избелване.
Хлориста киселина Киселинният разтвор се получава от нейните соли - хлорити Ba(Cl. O 2)2 + H 2 SO 4 → 2 HCl. O 2 + Ba. SO 4↓ И също според реакцията: 2 Cl. O 2 + H 2 O → HCl. О2 + НС1. O 3 Хлорната киселина е киселина със средна сила, по-близо до слаба.Хлоритите се използват за избелване.
 Хипохлорната киселина във водни разтвори при концентрации под 30% е доста стабилна на студено; в по-концентрирани разтвори се разлага: В 8 HCl. О3 = 4 НС1. O 4 + 3 O 2 + 2 Cl 2 + 2 H 2 O. Хипохлорната киселина е силен окислител; окислителният капацитет се увеличава с увеличаване на концентрацията и температурата, например филтърната хартия се запалва в 40% киселина. Перхлорна киселина в лабораторни условиясе получават при взаимодействие на бариев хлорат с разредена сярна киселина: Ba(Cl. O 3)2 + H 2 SO 4 = Ba. SO 4↓+ 2 HCl. О 3.
Хипохлорната киселина във водни разтвори при концентрации под 30% е доста стабилна на студено; в по-концентрирани разтвори се разлага: В 8 HCl. О3 = 4 НС1. O 4 + 3 O 2 + 2 Cl 2 + 2 H 2 O. Хипохлорната киселина е силен окислител; окислителният капацитет се увеличава с увеличаване на концентрацията и температурата, например филтърната хартия се запалва в 40% киселина. Перхлорна киселина в лабораторни условиясе получават при взаимодействие на бариев хлорат с разредена сярна киселина: Ba(Cl. O 3)2 + H 2 SO 4 = Ba. SO 4↓+ 2 HCl. О 3.
 Перхлорна киселина Безводната перхлорна киселина се получава чрез взаимодействие на натриеви или калиеви перхлорати с концентрирана сярна киселина или водни разтвори на перхлорна киселина с олеум, както и чрез взаимодействие на хлорен оксид (VII) с вода: KCl. O 4 + H 2 SO 4 → KHSO 4 + HCl. O 4 Cl 2 O 7 + H 2 O → 2 HCl. О 4
Перхлорна киселина Безводната перхлорна киселина се получава чрез взаимодействие на натриеви или калиеви перхлорати с концентрирана сярна киселина или водни разтвори на перхлорна киселина с олеум, както и чрез взаимодействие на хлорен оксид (VII) с вода: KCl. O 4 + H 2 SO 4 → KHSO 4 + HCl. O 4 Cl 2 O 7 + H 2 O → 2 HCl. О 4
 Термична стабилност на киселините - връзка с нагряване Перхлорна киселина (HCl. O 4) Ø Може да се изолира в свободна форма; Ø При умерено нагряване с фосфорен анхидрид § 2 HCl се разлага. O 4 + P 2 O 5 = Cl 2 O 7 + 2 HPO 3 Хипохлорна киселина (HCl. O 3) Ø При леко нагряване § 8 HCl се разлага. О3 = 4 НС1. O 4 + 3 O 2 + 2 Cl 2 + 2 H 2 O Хлориста киселина (HCl. O 2) Ø Много нестабилна, разлага се при стайна температура на светлина § 4 HCl. O 2 = HCl + HCl. O 3 + 2 Cl. O 2 + H 2 O Хипохлорна киселина (HCl. O) Ø 2 HCl. O = 2 HCl + O 2 (под въздействието на светлина)
Термична стабилност на киселините - връзка с нагряване Перхлорна киселина (HCl. O 4) Ø Може да се изолира в свободна форма; Ø При умерено нагряване с фосфорен анхидрид § 2 HCl се разлага. O 4 + P 2 O 5 = Cl 2 O 7 + 2 HPO 3 Хипохлорна киселина (HCl. O 3) Ø При леко нагряване § 8 HCl се разлага. О3 = 4 НС1. O 4 + 3 O 2 + 2 Cl 2 + 2 H 2 O Хлориста киселина (HCl. O 2) Ø Много нестабилна, разлага се при стайна температура на светлина § 4 HCl. O 2 = HCl + HCl. O 3 + 2 Cl. O 2 + H 2 O Хипохлорна киселина (HCl. O) Ø 2 HCl. O = 2 HCl + O 2 (под въздействието на светлина)
 Връзка с алкални разтвори Когато кислородсъдържащи хлорни киселини взаимодействат с алкални разтвори, обменна реакция произвежда сол на тази киселина и вода. Възниква реакция на неутрализация. НС1. O2+Na. OH = Na. кл. О2 + Н2О; НС1. O 3 + KOH = KCl. 03 + Н20; Връзка с основните оксиди Когато кислородсъдържащи хлорни киселини взаимодействат с основни оксиди, обменна реакция произвежда сол на тази киселина и вода. 2 НС1. O + Na 2 O = 2 Na. кл. О + Н2О; 2 НС1. O 4 + Cu. O = Cu(Cl. O 4) 2 + H 2 O
Връзка с алкални разтвори Когато кислородсъдържащи хлорни киселини взаимодействат с алкални разтвори, обменна реакция произвежда сол на тази киселина и вода. Възниква реакция на неутрализация. НС1. O2+Na. OH = Na. кл. О2 + Н2О; НС1. O 3 + KOH = KCl. 03 + Н20; Връзка с основните оксиди Когато кислородсъдържащи хлорни киселини взаимодействат с основни оксиди, обменна реакция произвежда сол на тази киселина и вода. 2 НС1. O + Na 2 O = 2 Na. кл. О + Н2О; 2 НС1. O 4 + Cu. O = Cu(Cl. O 4) 2 + H 2 O
Учител по химия
Продължение. Вижте в бр.22/2005г.; 1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16, 18, 22/2006 г.;
3, 4, 7, 10, 11, 21/2007;
2, 7, 11, 18, 19, 21/2008;
1, 3/2009
УРОК 29
10 клас(първа година на обучение)
Халогени и техните най-важни съединения
1. Позиция в таблицата на Д. И. Менделеев, структура на атома.
2. Произход на имената.
3. Физични свойства.
4. Химични свойства (на примера на хлор).
5. Да бъдеш сред природата.
6. Основни методи за производство (на примера на хлор).
7. Хлороводород и хлориди.
8. Кислородсъдържащи хлорни киселини и техните соли.
Халогените ("сол-халогени") са разположени в подгрупа VIIa периодичната таблица. Те включват флуор, хлор, бром, йод и астат. Всички халогени са Р-елементи, имат конфигурацията на външното енергийно ниво ns 2 стр 5. Тъй като на външното ниво на халогенните атоми има 1 несдвоен Р-електрон, характерната валентност е I. В допълнение към флуора, броят на несдвоените електрони в атомите на всички халогени във възбудено състояние може да се увеличи, така че са възможни валенции III, V и VII.

Cl: 1 с 2 2с 2 2стр 6 3с 2 3стр 5 3д 0 (валентност I),
Cl*: 1 с 2 2с 2 2стр 6 3с 2 3стр 4 3д 1 (валентност III),
Cl**: 1 с 2 2с 2 2стр 6 3с 2 3стр 3 3д 2 (валентност V),
Cl***: 1 с 2 2с 2 2стр 6 3с 1 3стр 3 3д 3 (валентност VII).
Халогените са типични неметали и проявяват окислителни свойства. Степента на окисление на халогените в съединения с метали и водород е –1; във всички кислородсъдържащи съединения халогените (с изключение на флуора) проявяват степени на окисление +1, +3, +5, +7, например:
Надолу по подгрупата, агрегатното състояние на халогените се променя, разтворимостта във вода намалява, радиусът на атома се увеличава, електроотрицателността, неметалните свойства и окислителната способност намаляват (флуорът е най-силният окислител). За халогенни съединения: от Cl – до I – редукционната способност на халогенните йони се увеличава. В серията от безкислородни и кислородсъдържащи киселини киселинните свойства се увеличават:

Името флуор идва от гръцката дума - разрушителен, тъй като флуороводородна киселина, от която се опитаха да получат флуор, корозира стъклото. Хлорът получава името си от гръцката дума жълто-зелен, цвета на избледнялите листа. Бромът е кръстен на миризмата на течен бром от гръцката дума - гаден. Името йод произлиза от гръцката дума - виолетово - за цвета на йодните пари. Радиоактивният астат е кръстен на гръцката дума - нестабилен.
Според физичните свойства флуорът е трудно втечняващ се газ със светлозелен цвят, хлорът е лесно втечняващ се газ с жълто-зелен цвят, бромът е тежка течност с червено-кафяв цвят, йодът е твърд кристално веществотъмно лилав цвят с метален блясък, лесно сублимиран. Всички халогени, с изключение на йода, имат силна задушлива миризма и са токсични.
Химични свойства
Всички халогени проявяват висока химическа активност, която намалява при преминаване от флуор към йод. Нека да разгледаме химичните свойства на халогените, използвайки хлор като пример:
![]()
(F 2 - с експлозия; Br 2, I 2 - на светлина и при повишена температура.)
Метали (+):
2Na + Cl 2 = 2NaCl;
2Fe + 3Cl 2 2FeCl 3 .
Неметали (+/–):*

Реакцията N 2 + Cl 2 не протича.
Основни оксиди (–).
Киселинни оксиди (–).
Основи (+/–):

Киселини (+/–):
2HBr + Cl 2 = 2HCl + Br 2,
HCl + Br 2 реакция не възниква.
Соли (+/–):
2KBr + Cl 2 = 2KCl + Br 2,
KCl + Br 2 реакция не се случва.
В природата халогените не се срещат в свободна форма поради тяхната висока химична активност. Сред най-често срещаните хлорни съединения са каменна или готварска сол (NaCl), силвинит (KCl NaCl), карналит (KCl MgCl 2). В морската вода се съдържат големи количества хлориди. Хлорът е част от хлорофила. Естественият хлор се състои от два изотопа 35 Cl и 37 Cl. Подчертаваме, че в случая на хлор броят на неутроните в атома може да се изчисли само за всеки изотоп поотделно:
35 Cl, стр = 17, д = 17, н = 35 – 17 = 18;
37 Cl, стр = 17,д = 17, н = 37 – 17 = 20.
Промишлено хлорът се получава чрез електролиза на воден разтвор или стопилка на хлорид:

Лабораторни методи за получаване (ефектът на концентрирана солна киселина върху различни окислители):
MnO 2 + 4HCl (конц.) = MnCl 2 + Cl 2 + 2H 2 O,
2KMnO 4 + 16HCl (конц.) = 2MnCl 2 + 5Cl 2 + 2KCl + 8H 2 O,
KClO 3 + 6HCl (конц.) = KCl + 3Cl 2 + 3H 2 O,
K 2 Cr 2 O 7 + 14HCl (конц.) = 2CrCl 3 + 3Cl 2 + 2KCl + 7H 2 O,
Ca(ClO) 2 + 4HCl (конц.) = CaCl 2 + 2Cl 2 + 2H 2 O.
C h o l o r d i d es
Хлороводород(HCl) е безцветен газ с остра миризма, по-тежък от въздуха, силно разтворим във вода (450 обема хлороводород се разтварят в 1 обем вода). Молекулата се образува като ковалентна полярна връзка. Воден разтвор на хлороводород се нарича солна киселина. Концентрираната солна киселина "пуши" във въздуха, максималната концентрация на хлороводород в разтвора е 35-36%. Това е силна киселина, която проявява всички характерни свойства на киселините:
HCl H + + Cl – ,
2HCl + Zn = ZnCl 2 + H 2,
HCl + Cu реакция не възниква,
2HCl + CaO = CaCl 2 + H 2 O,
HCl + NaOH = NaCl + H2O,
2HCl + Na 2 CO 3 = 2NaCl + H 2 O + CO 2.
Качествена реакция на солна киселина и нейните соли (хлориди) е реакцията с разтвор на сребърен нитрат:
Ag + + Cl – -> AgCl,
AgNO 3 + NaCl -> AgCl + NaNO 3.
Хлороводородът може да се получи:
Директен синтез от водород и хлор (синтетичен метод):
![]()
Действието на концентрирана сярна киселина върху твърди хлориди - сулфатният метод (HF може да се получи по подобен начин, но HBr и HI не могат да бъдат получени):
NaCl (твърд) + H 2 SO 4 (конц.) = HCl + NaHSO 4.
С повишаване степента на окисление на хлора силата на киселините рязко нараства. По този начин хипохлорната киселина е много слаба (по-слаба от въглеродната киселина), а перхлорната киселина е най-силната от всички известни киселини.
Акцентни соли
| Киселинни оксиди | Cl2O | Cl2O3 | Cl2O5 | Cl2O7 |
| Киселини | HClO хипохлорист | HClO2 Хлорид |
HClO 3 Хлорен | HClO 4 Хлорен |
| Графични формули киселини |
H–O–Cl | H–O–Cl=O | ||
| Имена и примери за соли | Натриев хипохлорит NaClO |
Натриев хлорит NaClO2 |
Натриев хлорат NaClO3 |
Натриев перхлорат NaClO4 |
Хипохлорна киселина(HClO) – слаб, много нестабилен.

Солите на тази киселина (хипохлорити) са много силни окислители. Най-широко използвана е смесена сол на солна и хипохлорна киселина - калциев хлорид-хипохлорит (белина):

Хлорна киселина(HClO 3) - съществува само в разредени разтвори. Самата киселина и нейните соли (хлорати) са силни окислители. Най-известната сол на тази киселина е калиевият хлорат (солта на Бертоле).
5KClO 3 + 6P = 3P 2 O 5 + 5KCl,
KClO 3 + 3MnO 2 + 6KOH = KCl + 3K 2 MnO 4 + 3H 2 O,
4KClO 3 + 3K 2 S = 4KCl + 3K 2 SO 4.
Много соли на кислородсъдържащи хлорни киселини са термично нестабилни, например:
2KClO 3 2KCl + 3O 2,
4KClO 3 3KClO 4 + KCl (без катализатор),
3KClO KClO 3 + 2KCl,
KClO 4 KCl + 2O 2.
Тест по темата „Халогени и техните най-важни съединения“
1. Газът има плътност 3,485 g/l при налягане 1,2 atm и температура 25 °C. Определете формулата на газа.
а) флуор; б) хлор;
в) бромоводород;
г) хлороводород.
2. Феноменът на преминаване на вещество от твърдо в газообразно състояние, заобикаляйки течното състояние, се нарича:
а) кондензация; б) сублимация;
в) сублимация; г) дестилация.
3. Естественият хлор е смес от изотопи с масови числа 35 и 37. Изчислете изотопния състав на хлора, като вземете неговия относителен атомна масаза 35.5.
а) 75% и 25%;
б) 24,4% и 75,8%;
в) 50% и 50%;
г) няма достатъчно данни за решаване на проблема.
4. Хлорът може да се получи чрез електролиза:
а) стопен калиев хлорид;
б) разтвор на калиев хлорид;
в) разтопен меден хлорид;
г) разтвор на меден хлорид.
5. Разтвор на флуороводород във вода се нарича:
а) Javel вода;
б) флуороводородна киселина;
в) избелваща вар;
г) флуороводородна киселина.
6. Хлорният (V) оксид е анхидридът на следната киселина:
а) хипохлорист; б) хлорен;
в) хлорид; г) хлор.
7. При калциниране на бертолетовата сол в присъствието на манганов диоксид като катализатор се образуват:
а) калиев хлорид и кислород;
б) калиев перхлорат и калиев хлорид;
в) калиев перхлорат и озон;
г) калиев хипохлорит и хлор.
8. К подкислен разтвор, съдържащ 0,543 g някаква сол, която включва литий, хлор и кислород, се добавя разтвор на натриев йодид до спиране на отделянето на йод. Масата на отделения йод е 4,57 г. Име на оригиналната сол:
а) литиев хипохлорит; б) литиев хлорит;
в) литиев хлорат; г) литиев перхлорат.
9. В халогенни молекули химическа връзка:
а) ковалентен полярен;
б) ковалентен неполярен;
в) йонни;
г) донор-акцептор.
10. хлор, за разлика от флуора, при определени условия може да реагира с:
вода; б) водород;
в) мед; г) натриев хидроксид.
Ключ към теста
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| b | b, c | А | a B C D | b, d | b | А | V | b | Ж |
Задачи и упражнения върху халогени и техните съединения
Верига от трансформации
1. Калиев хлорид -> хлор -> хлороводород -> калциев хлорид -> хлороводород -> хлор -> калиев хлорат.
2. Хлор -> бертолетова сол -> калиев хлорид -> солна киселина + манганов диоксид + вода -> хлор -> меден (II) хлорид -> хлор.
3. Калиев хлорид -> хлор -> калиев хлорат -> калиев хлорид -> калий.
4. Калиев хлорид -> хлор -> хлороводород -> хлор -> калиев хипохлорит.
5. Натриев хлорид -> хлороводород -> хлор -> бертолетова сол -> калиев хлорид -> калиев хидроксид -> калиев хипохлорит.
6. Калиев хлорат -> A -> B-> C -> A -> калиев нитрат (веществата A, B, C съдържат хлор, първите три трансформации са редокс реакции).
7. Калциев оксид -> калциев хидроксид -> избелваща вар -> калциев хлорид -> калций.
8. Натриев бромид -> натриев хлорид -> хлор -> белина -> калциев карбонат -> калциев бикарбонат -> въглероден диоксид.
9. Натриев йодид -> йод -> калиев йодид -> сребърен йодид.
10. Калиев хипохлорит -> калиев хлорат -> калиев перхлорат -> калиев хлорид.
| Ниво А |
1. Съд с 200 g хлорирана вода се държи на пряка слънчева светлина и се събира отделеният газ, чийто обем при нормални условия е възлиза на 0,18л. Определете състава на хлорната вода ( масова частхлор).
Отговор. 0,57 %.
2. Газът, получен чрез калциниране на 9,8 g бертолетова сол, се смесва с газа, получен на анода в резултат на пълна електролиза на стопилката от 22,2 g калциев хлорид. Получената газова смес се пропуска през 400 g 2% горещ разтвор на натриев хидроксид. Определете състава на получения разтвор.
Отговор. 2,38% NaCl; 0,84% NaClO 3 .
3. Изчислете масата на солта и обема на газа (бр.), образувани при разлагането на 17 g сол, която оцветява пламъка на горелката в жълто и съдържа 27,06% метал, 16,47% азот и 56,47% кислород. Каква маса бертолитова сол ще е необходима за производството на същото количество газ?
Отговор. 13.8 g NaNO2; 2,24 l O 2; 8,13 g KClO3.
4. Какъв обем хлор (бр.) може да се получи от 1 m 3 разтвор (плътност 1,23 g/cm 3), съдържащ 20,7% натриев хлорид и 4,3% магнезиев хлорид?
Отговор. 61,2 м3.
5. Газът, отделен на анода по време на електролизата на 200 g 20% разтвор на натриев хлорид, се пропуска през 400 g 30% разтвор на калиев бромид. Към получения разтвор се добавя излишък от разтвор на сребърен нитрат. Определете количествения състав на утайката.
Отговор. 59,4 g AgBr; 98,154 g AgCl.
| Ниво Б |
1. 1,3 литра хлор бяха прекарани през епруветка, съдържаща прахообразна смес от натриев хлорид и йодид с тегло 3 g при температура 42 °C и налягане 101,3 kPa. Веществото, получено в епруветката, се калцинира при 300 °C, оставяйки 2 g от веществото. Определете масовите дялове на солите в първоначалната смес.
Отговор. 45,3% NaCl; 54,6% NaI.
2. Смес от магнезиев йодид и цинков йодид се третира с излишък от бромна вода и полученият разтвор се изпарява. Масата на сухия остатък се оказа 1,445 пъти по-малка от масата на първоначалната смес. Колко пъти масата на утайката, получена след третиране на същата смес с излишък от натриев карбонат, ще бъде по-малка от масата на първоначалната смес?
Отговор. 2,74 пъти.
3. За окисляване на 2,17 g сулфит на алкалоземен метал се добавя хлорна вода, съдържаща 1,42 g хлор. Към получената смес се добавя излишък от калиев бромид и се освобождават 1,6 g бром. Определете състава на утайката, съдържаща се в сместа, и изчислете нейната маса.
(BaSO 4) = (BaSO 3) = 0,01 mol,
m(BaSO 4) = (BaSO 4) М(BaSO 4) = 0,01 233 = 2,33 g.
Отговор. 2,33 g BaSO4.
4. През 800 g 10% воден разтвор на натриев хлорид беше прокаран ток. След приключване на процеса на електролиза на солта, целият газ, освободен от анода, се абсорбира от горещия разтвор, получен в резултат на електролизата. Определете състава на разтвора, получен след абсорбцията на газ.
Отговор. В разтвор от 8,35% NaCl и
3,03% NaCl03.
5. Плътността на смес от хлор и водород при налягане 0,2 atm и температура 27 °C е 0,0894 g/l. Хлороводородът, получен чрез експлозия на 100 l (n.s.) от такава смес, се разтваря в 500 g 10% солна киселина. Намерете масовата част на хлороводорода в получения разтвор.
Отговор. 17 %.
ЧЕСТНИ ЗАДАЧИ
1. Наименувайте вещества A, B и C, ако е известно, че претърпяват реакции, описани в схемите по-долу; напишете пълните уравнения на реакцията за тези схеми:
A + H 2 -> B,
A + H 2 O B + C,
A + H 2 O + SO 2 -> B + ...,
C -> B + … .
Отговор. Вещества: A – Cl 2,
B – HCl; C – HClO.
2. Газ А, под въздействието на концентрирана сярна киселина, се превръща в просто вещество В, което реагира с хидросулфидна киселина, за да образува просто вещество C и разтвор на изходното вещество A. Идентифицирайте веществата и напишете уравненията на реакцията.
Отговор.Вещества: А – HBr; B – Br 2 ; C–S.
3. Когато хлорът преминава през разтвор на силна киселина А, се освобождава просто вещество В и разтворът става тъмен на цвят. При по-нататъшно преминаване на хлор вещество B се превръща в киселина C и разтворът се обезцветява. Наименувайте веществата A, B и C, напишете уравненията на реакцията.
Отговор.Вещества: A – HI; B – I 2, C – HIO 3.
4. Дайте примери за реакции, по време на които протича пълна редукция на свободния бром: а) в кисел воден разтвор; б) в алкален воден разтвор; в) в газова фаза.
Отговор. Реакционни уравнения:

5. Какви вещества са реагирали и при какви условия, ако в резултат са се образували следните вещества (всички продукти са посочени без коефициенти): а) бариев хлорид и калиев хидроксид; б) калциев бромид и бромоводород; в) калиев хлорид и фосфорен пентоксид. Пишете пълни уравненияреакции.
Отговор. Реакционни уравнения:
а) Ba(ClO) 2 + 2KH = BaCl 2 + 2KOH;
b) CaH2 + 2Br2 = CaBr2 + 2HBr;
в) 5KClO 3 + 6P 5KCl + 3P 2 O 5.
6. За дегазиране са необходими 254 g белина. Лабораторията съдържа: калций, манганов диоксид, натрий, цинк, натриев хлорид, сярна киселина, вода, фосфор, сяра, бариев сулфат. Какви реактиви и в какво количество ще са необходими? Напишете пълни уравнения на реакцията.
Отговор. 142 g Са; 830.7 g NaCl; 308.85 g MnO2;
1391,6 g H2SO4.
Реакционни уравнения:
Ca + 2H 2 O = Ca(OH) 2 + H 2,
NaCl (твърд) + H 2 SO 4 (конц.) = HCl + NaHSO 4,
MnO 2 + 4HCl = Cl 2 + MnCl 2 + 2H 2 O,
2Cl 2 + 2Ca(OH) 2 Ca(ClO) 2 + CaCl 2 + 2H 2 O.
7. Прясно приготвената хлорна вода се добавя на капки към воден разтвор на калиев йодид. Обяснете защо първоначално появилият се цвят на разтвора след това изчезва. Подкрепете отговора си с уравнения на реакцията.
Отговор.Реакционни уравнения:
2KI + Cl 2 = 2KCl + I 2,
I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl.
* Знакът +/– означава, че тази реакция не протича с всички реагенти или при определени условия.
Следва продължение