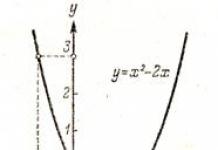
ОБЯСНИТЕЛНА ЗАПИСКА
Състояние на документа
Примерната програма по химия се основава на федералния компонент държавен стандартосновен общо образование.
Приблизителната програма уточнява съдържанието на стандарта, дава приблизително разпределение на учебните часове между разделите на курса и препоръчителната последователност на изучаване на теми и раздели, като се вземат предвид междудисциплинарните и вътрешнопредметните връзки и логика учебен процес, възрастови характеристики на учениците. Приблизителната програма определя списък от демонстрации, лабораторни експерименти, практически занятияи изчислителни проблеми.
Примерната програма изпълнява две основни функции:
Информационно-методическата функция позволява на всички участници учебен процесдобийте представа за целите, съдържанието, цялостна стратегияобучение, образование и развитие на учениците чрез това академичен предмет.
Функцията на организационното планиране включва идентифициране на етапи на обучение, структуриране учебен материал, определяне на неговите количествени и качествени характеристики на всеки етап, включително за съдържанието на междинното атестиране на учениците.
Приблизителната програма е насока за съставяне на оригинални учебни програми и учебници. Примерната програма определя инвариантната (задължителната) част от курса по химия в началното училище, извън която остава възможността за авторски избор на вариативен компонент от учебното съдържание. В същото време авторите на учебни програми и учебници по химия могат да предложат свой собствен подход по отношение на структурирането и определянето на последователността на изучаване на учебния материал, както и начини за формиране на система от знания, умения и методи на дейност, развитие и социализация. на учениците. По този начин примерната програма допринася за запазването на единно образователно пространство и предоставя широки възможности за прилагане на различни подходи за изграждане на курс по химия в началното училище.
Структура на документа
Примерната програма включва три раздела: обяснителна бележка; основно съдържание с приблизително (в модалността „не по-малко от“) разпределение на учебните часове по раздели на курса и възможна последователност на изучаване на теми и раздели; изисквания за нивото на подготовка на завършилите основно училище по химия. Примерната програма съдържа минимално, но функционално пълно съдържание.
основни характеристикиакадемичен предмет
Основните проблеми на химията са изучаването на състава и структурата на веществата, зависимостта на техните свойства от структурата, дизайна на вещества с дадени свойства, изучаването на законите на химичните превръщания и начините за тяхното контролиране, за да се получи вещества, материали и енергия. Следователно, колкото и авторските програми и учебници да се различават по дълбочината на интерпретация на изучаваните въпроси, тяхното образователно съдържание трябва да се основава на съдържанието примерна програма, който е структуриран в шест блока: Методи за познаване на веществата и химични явления. Експериментални основи на химията; вещество; Химическа реакция; Елементарни основи на неорганичната химия; Първоначални представи за органичните вещества; Химия и живот. Съдържанието на тези образователни блокове в авторските програми може да бъде структурирано по теми и детайли, като се вземат предвид концепциите на автора, но трябва да е насочено към постигане на целите химическо образование.
цели
Изучаването на химия в основното училище е насочено към постигане на следните цели:
- · развитие съществени знания за основните понятия и закони на химията, химичната символика;
- · владеене на умениянаблюдават химични явления, провеждат химичен експеримент, правят изчисления въз основа на химични формули на вещества и уравнения на химични реакции;
- · развитиепознавателни интереси и интелектуални способности в процеса на провеждане на химичен експеримент, самостоятелно придобиване на знания в съответствие с възникващите жизнени потребности;
- · възпитаниеотношение към химията като един от основните компоненти на естествознанието и елемент на общочовешката култура;
- · прилагане на придобитите знания и уменияза безопасна употреба на вещества и материали в бита, селското стопанство и производството, решаване на практически проблеми в Ежедневието, предотвратяване на явления, вредни за човешкото здраве и околната среда.
Място на учебния предмет в основния учебен план
За задължителното изучаване на учебния предмет "Химия" на етапа на основно общо образование, федералната основна учебна програма за образователни институции Руска федерацияотделя 140 часа. Включително 70 часа в VIII и IX клас на база 2 учебни часа седмично.
Примерната програма е разработена за 140 учебни часа. Осигурява резерв от свободно учебно време в размер на 14 академични часа (или 10%) за прилагане на оригинални подходи, използване на различни форми на организиране на учебния процес, внедряване съвременни методиучебни и педагогически технологии.
Общообразователни способности, умения и методи на дейност
Примерната програма предвижда развитието на общообразователни умения и способности на учениците, универсални методи на дейност и ключови компетенции. В тази насока приоритетите за учебния предмет „Химия” на ниво основно общо образование са: използването на различни методи (наблюдения, измервания, опити, опити) за разбиране на околния свят; провеждане на практически и лабораторни работи, прости експерименти и описание на резултатите от тях; използване на различни източници на информация за решаване на когнитивни проблеми; спазване на норми и правила за поведение в химически лаборатории, в околната среда, както и правила здрав образживот.
Резултати от обучението
Резултатите от курса „Химия“ са дадени в раздела „Изисквания за нивото на обучение на завършилите“, което напълно отговаря на стандарта. Изискванията са насочени към прилагане на дейностен, практически ориентиран и личностно ориентиран подход; овладяване от учениците на интелектуални и практически дейности; овладяване на знания и умения, които се търсят в ежедневието, позволяват на човек да се ориентира в света около себе си и които са важни за опазването заобикаляща средаи вашето собствено здраве.
Разделът „Можете да“ включва изисквания, базирани на повече сложни типоведейности, включително творчески: обясняват, характеризират, дефинират, съставят, разпознават емпирично, изчисли.
Заглавието „Използване на придобитите знания и умения в практическата дейност и ежедневието“ представя изисквания, които надхвърлят образователния процес и са насочени към решаване на различни житейски проблеми.
ОСНОВНО СЪДЪРЖАНИЕ (140 часа)
МЕТОДИ ЗА ПОЗНАВАНЕ НА ВЕЩЕСТВАТА И ХИМИЧНИТЕ ЯВЛЕНИЯ.
ЕКСПЕРИМЕНТАЛНИ ОСНОВИ НА ХИМИЯТА (8 часа).
Химията като част от природните науки. Химията е наука за веществата, тяхната структура, свойства и превръщания.
Наблюдение, описание, измерване, експеримент, моделиране. Концепцията за химичен анализ и синтез.
Правила за работа в училищна лаборатория. Лабораторна стъклария и оборудване. Правила за безопасност.
Разделяне на смеси. Пречистване на вещества. Филтриране.
Претегляне. Приготвяне на разтвори. Получаване на солни кристали. Провеждане на химични реакции в разтвори.
Отоплителни уреди. Провеждане на химични реакции при нагряване.
Методи за анализ на вещества. Качествени реакции на газообразни вещества и йони в разтвор. Определяне на характера на средата. Индикатори.
Касова бележка газообразни вещества.
Демонстрации
Образци на прости и сложни вещества.
Изгаряне на магнезий.
Разтваряне на вещества в различни разтворители.
Лабораторни опити
Запознаване с проби от прости и сложни вещества.
Разделяне на смеси.
Химични явления (калциниране на медна тел; взаимодействие на креда с киселина).
Практически уроци
Запознаване с лабораторно оборудване. правила безопасна работа V химическа лаборатория.
Почистване на замърсена трапезна сол.
Приготвяне на разтвор с даден масова частто разтворено вещество.
ВЕЩЕСТВО (25 часа).
Атоми и молекули. Химичен елемент. Езикът на химията. Знаци на химични елементи, химични формули. Закон за постоянството на състава.
Относителни атомни и молекулни маси. Атомна единица за маса. Количество вещество, мол. Моларна маса. Моларен обем.
Чисти веществаи смеси от вещества. Природни смеси: въздух, природен газ, нефт, природни води.
Качествен и количествен състав на веществото. Прости вещества(метали и неметали). Сложни вещества (органични и неорганични). Основни класове неорганични вещества.
Периодичен закон и периодична система на химичните елементи D.I. Менделеев. Групи и периоди на периодичната система.
Структурата на атома. Ядро (протони, неутрони) и електрони. Изотопи. Структурата на електронните обвивки на атомите на първите 20 елемента от периодичната таблица D.I. Менделеев.
Структурата на молекулите. Химическа връзка. Видове химични връзки: ковалентни (полярни и неполярни), йонни, метални. Концепцията за валентност и степен на окисление. Съставяне на формули на съединения по валентност (или степен на окисление).
Вещества в твърдо, течно и газообразно състояние. Кристални и аморфни вещества. Видове кристални решетки (атомни, молекулни, йонни и метални).
Демонстрации
Химични съединения количество вещество в 1 мол.
Модел на моларния обем на газовете.
Колекции от нефт, въглища и техните продукти.
Запознаване с проби от оксиди, киселини, основи и соли.
Модели на кристални решетки на ковалентни и йонни съединения.
Сублимация на йод.
Сравнение физични и химични свойствасъединения с ковалентни и йонни връзки.
Образци на типични метали и неметали.
Проблеми с изчисленията
Изчисляване на относителната молекулна маса на вещество по формулата.
Изчисляване на масовата част на елемент в химическо съединение.
Установяване на най-простата формула на вещество въз основа на масовите фракции на елементите.
ХИМИЧНА РЕАКЦИЯ (15 часа).
Химическа реакция. Уравнение и диаграма на химична реакция. Условия и признаци на химичните реакции. Запазване на масата на веществата по време на химични реакции.
Класификация на химичните реакции по различни критерии: брой и състав на изходните и получените вещества; промени в степента на окисление на химичните елементи; поглъщане или освобождаване на енергия Концепцията за скоростта на химичните реакции. Катализатори.
Електролити и неелектролити. Електролитна дисоциация на киселини, основи и соли във водни разтвори. йони. Катиони и аниони. Йонообменни реакции.
Редокс реакции. Окислител и редуциращ агент.
Демонстрации
Реакции, илюстриращи основните характеристики на характерните реакции
Неутрализиране на алкали с киселина в присъствието на индикатор.
Лабораторни опити
Взаимодействие на магнезиев оксид с киселини.
Взаимодействие на въглероден диоксид с варовита вода.
Получаване на утайки от неразтворими хидроксиди и изследване на техните свойства.
Практически уроци
Извършвайте експерименти, демонстриращи генетични връзки между основните класове неорганични съединения.
Проблеми с изчисленията
Изчисления по химични уравнениямаса, обем или количество на един от реакционните продукти по маса на изходното вещество и веществото, съдържащо определен процент примеси.
ЕЛЕМЕНТАРНИ ОСНОВИ НА НЕОРГАНИЧНАТА ХИМИЯ (62 часа).
Водород, физически и Химични свойства, получаване и приложение.
Кислород, физични и химични свойства, получаване и приложение.
Водата и нейните свойства. Разтворимост на веществата във вода. Кръговратът на водата в природата.
Халогени. Хлороводород. Солна киселина и нейните соли.
Сяра, физични и химични свойства, срещане в природата. Серен (VI) оксид. Сярна киселина и нейните соли. Окислителни свойства на концентрираната сярна киселина. Сярна и сярноводородна киселини и техните соли.
Амоняк. Амониеви соли. Азот, физични и химични свойства, получаване и приложение. Цикъл на азота. Азотни оксиди (II и IV). Азотна киселина и нейните соли. Окислителни свойства на азотната киселина.
Фосфор. Фосфорен (V) оксид. Ортофосфорна киселина и нейните соли.
Въглерод, алотропни модификации, физични и химични свойства на въглерода. Въглероден окис – свойства и физиологични ефекти върху организма. Въглероден диоксид, въглена киселина и нейните соли. Въглероден цикъл.
Силиций. Силициев(IV) оксид. Силициева киселина и силикати. Стъклена чаша.
Позиция на металите в периодичната таблица на химичните елементи D.I. Менделеев. Концепцията за металургията. Методи за получаване на метали. Сплави (стомана, чугун, дуралуминий, бронз). Общи химични свойства на металите: реакции с неметали, киселини, соли. Диапазон от метални напрежения.
Алкални и алкалоземни метали и техните съединения.
Алуминий. Амфотерност на оксид и хидроксид.
Желязо. Оксиди, хидроксиди и соли на желязото (II и III).
Демонстрации
Взаимодействие на натрий и калций с вода.
Проби от неметали.
Алотропия на сярата.
Получаване на хлороводород и разтварянето му във вода.
Разпознаване на хлорни съединения.
Кристални решетки на диамант и графит.
Производство на амоняк.
Лабораторни опити
Запознаване с образци на метали и сплави (работа с колекции).
Разтваряне на желязо и цинк в солна киселина.
Изместване на един метал от друг от солев разтвор.
Запознаване с образци на природни съединения на неметали (хлориди, сулфиди, сулфати, нитрати, карбонати, силикати).
Запознаване с метални проби, железни руди, алуминиеви съединения.
Разпознаване на хлоридни, сулфатни, карбонатни аниони и катиони на амоний, натрий, калий, калций, барий.
Практически уроци
Получаване, събиране и разпознаване на газове (кислород, водород, въглероден диоксид).
Решаване на експериментални задачи по химия по темата „Получаване на метални съединения и изучаване на техните свойства“.
Решаване на експериментални задачи
Отдел по образованието на Болшесосновски общински район
Общинско бюджетно учебно заведение
„Болшесновская средна общообразователно училище»
„ДОГОВОРЕНО“ „ОДОБРЕНО“
Протокол от заседанието, решение на учителския съвет, протокол No1 от 28.08.2015г.
методологическа асоциация Директор на MBOU "Болшесновская гимназия"
учители _________________ ____________________ O.A. Лискова
РАБОТЕЩА ПРОГРАМА
от химия
Ниво на обучение (клас): основно общо образование: 8 класа
Брой часове 68 (2 часа седмично)
Учител Дегтерева Алена Григориевна
Програмата е разработена на базата напрограми за основно общо образование по химия (основно ниво) и оригиналната програма на O.S. Габриелян, А.В. Купцова програма за основно общо образование по химия. 8-9 клас. M: Bustard, 2012.
с. Голяма Соснова
2015 г
Работна програмапо химия
8 клас (2 часа седмично, 68 часа годишно)
1. Обяснителна бележка
Работната програма по химия се основава на федералния компонент на държавата образователен стандартосновно общо образование при начално ниво, базиран на приблизителна учебна програма по химия за 8-9 клас образователни институцииОПЕРАЦИОННА СИСТЕМА. Gaborielyan (O.S. Gabrielyan Курсова програма по химия за 8-11 клас на образователни институции) M. Bustard, 2009.
Работната програма е предназначена за изучаване на химия в 8. клас на училище по учебника на О.С. Габриелян „Химия. 8 клас“. Bustard, 2012. Учебникът отговаря на федералния компонент на държавния образователен стандарт за основно общо образование по химия и изпълнява авторската програма на O.S. Габриелян. Включен във федералния списък на учебниците, препоръчани от Министерството на образованието и науката на Руската федерация за използване в образователния процес в образователните институции, за 2015/2016 г. академична година. Учебникът е сертифициран като „Препоръчан от Министерството на образованието и науката на Руската федерация“.
В съответствие с федералната основна учебна програма за основно общо образование и в съответствие с учебната програма на Болшесновската гимназия, програмата е предназначена за преподаване на курс по химия в 8 клас за 2 часа седмично (68 часа годишно).
Количество тестовеслед година – 5
Брой практически работи за година – 7
2. Цели на курса
Изучаването на химия в основното училище е насочено към постигане на следните цели:
развитие съществени знанияза основните понятия и закони на химията, химичната символика;
владеене на умениянаблюдават химични явления, провеждат химичен експеримент, правят изчисления въз основа на химични формули на вещества и уравнения на химични реакции;
развитиепознавателни интереси и интелектуални способности в процеса на провеждане на химичен експеримент, самостоятелно придобиване на знания в съответствие с възникващите жизнени потребности;
възпитаниеотношение към химията като един от основните компоненти на естествознанието и елемент на общочовешката култура;
прилагане на придобитите знания и уменияза безопасна употреба на вещества и материали в ежедневието, селското стопанство и производството, решаване на практически проблеми в ежедневието, предотвратяване на явления, вредни за човешкото здраве и околната среда.
3. Структура на курса
ГЛАВА
Брой часове
Въведение.
Атоми на химични елементи.
Прости вещества.
Съединения на химични елементи.
Промени, настъпващи във веществата.
ОБЩА СУМА
68
В резултат на изучаването на химия ученикът трябва
знам/разбирам
химическа символика : признаци на химични елементи, формули химически веществаи уравнения на химичните реакции;
най-важните химически понятия : химичен елемент, атом, молекула, относителни атомни и молекулни маси, йон, химична връзка, вещество, класификация на веществата, мол, моларна маса, моларен обем, химична реакция, класификация на реакциите, електролитни и неелектролитни, електролитна дисоциация, окислител и редуциращ агент, окисление и редукция;
основни закони на химията : запазване на масата на веществата, постоянство на състава, периодичен закон;
да бъде в състояние да
обадете се: химични елементи, съединения на изучаваните класове;
обясни: физически смисълатомен (порядков) номер химичен елемент, номера на групи и период, към който принадлежи елементът периодичната таблица DI. Менделеев; модели на промени в свойствата на елементите в малки периоди и основни подгрупи; същността на йонообменните реакции;
характеризират: химични елементи (от водород до калций) въз основа на позицията им в периодичната таблица D.I. Менделеев и структурните особености на техните атоми; връзка между състава, структурата и свойствата на веществата; химични свойства на основните класове неорганични вещества;
дефинирам: състав на веществата според техните формули, принадлежност на веществата към определен клас съединения, видове химични реакции, валентност и степен на окисление на елемент в съединенията, вид на химичната връзка в съединенията, възможност за йонообменни реакции;
грим : формули неорганични съединенияизучавани класове; диаграми на структурата на атомите на първите 20 елемента от периодичната таблица D.I. Менделеев; уравнения на химичните реакции;
адрес с химическа стъклария и лабораторно оборудване;
разпознават емпирично: разтвори на киселини и основи, хлоридни, сулфатни, карбонатни йони;
изчисли: масова част на химичен елемент според формулата на съединението; масова част на веществото в разтвор; количество вещество, обем или маса по количество вещество, обем или маса на реагентите или реакционните продукти;
използват придобитите знания и умения в практическата дейност и ежедневиетоЗа:
безопасно боравене с вещества и материали;
екологично съзнателно поведение в околната среда;
оценка на въздействието на химическото замърсяване на околната среда върху човешкия организъм;
критична оценка на информацията за веществата, използвани в ежедневието;
приготвяне на разтвори с определена концентрация.
4. Тематично планиране.
Добре " Неорганична химия» 8 клас (основно ниво)
№ П / П
ПРЕДМЕТ
Основни понятия
Знания, умения, планирани резултати
Средства за възпитание
Форми на организация на учебния процес
ВЪВЕДЕНИЕ (6 часа)
Химия -
наука за
вещества, техните свойства и превръщания
Химия, вещество, свойства на веществата.
Зная: дефиниране на понятия – химия, вещество, свойства на веществата.
Умейте да:характеризират физични свойствавещества
Учебник, тетрадка.
Стъклени изделия и
алуминий Молекулярни модели
Урок за усвояване на нови знания
въведете-
ция.
§ 1, пр.
3, 6, 10
Трансформации на веществата.
Ролята на химията
в живота
човек
Химическо явление, физични явления, химична реакция
Зная: концепция за химична реакция
Умейте да: разграничават химичните реакции от физичните явления
Меден проводник, спиртна лампа, креда, солна киселина, епруветка
Комбиниран урок
§2,
пр. 12.
§3
Периодична таблица на химичните елементи. Знаци на химически елементи
Структура на P.S.: период, серия, група, подгрупа, признаци на химични елементи
Зная: знаците на първите 20 химични елемента
Умейте да: определяне на позицията на химически елемент в P.S., именувайте химичните елементи
Таблица "Периодичната таблица на химичните елементи на Менделеев"
Комбиниран урок
§4,
пр. 5
Химични формули. Относителна атомна и молекулна маса
Химическа формула, закон за постоянство на състава на веществото, качествен и количествен състав, Ar, Mr. Атомна единица за маса.
Зная : определяне на химичната формула на веществото, формулиране на закона за постоянство на състава, pпрегръдка и запишете химичните формули на веществата.
Бъдете в състояние да : определят състава на веществата с помощта на химична формула; принадлежащи към простите и сложни вещества
PSHE
Комбиниран урок
§5,
пр. 1, 2, 8
Масова част на елемента в съединението
Изчислете молекулното тегло и масовата част на елемент в химично съединение
Умейте да: изчисляване на масовата част на химичен елемент в съединение
Учебник, тетрадка, ПВО
Комбиниран урок
§5,
пр. 6, 7. Практическа работа 1-2,
стр.174-181
Практичен
работа номер 1.
Запознанство
с лаборатория
оборудване. Правила за безопасна работа в химическата лаборатория .
Практическа работа 1
Правила за безопасна работа в химическа лаборатория.
Статив,
спиртна лампа,
епруветка,
химически
стъкло, количество
бах, вода,
градуиран цилиндър, фар
недъг
чаша, свещ, кибрит
Практически урок
Страница 174
АТОМИ НА ХИМИЧНИТЕ ЕЛЕМЕНТИ (10 часа)
Основни сведения за структурата на атомите.
Структурата на атома. Ядро (протони, неутрони), електрони.
Умейте да: обяснете физическото значение на серийния номер на химикала. елемент
Учебник, тетрадка, ПВО
Урок за усвояване на нови знания
§6,
пр. 3, 5
Изотопите като разновидности на химически атоми
елемент
Изотопи
Зная: определение на понятието – химичен елемент
Учебник, тетрадка, ПВО
Комбиниран урок
§7,
пр. 3
Електрони. Структурата на електронните обвивки на атомите на химичните елементи
Структура на електронни обвивки на атоми от 20 PS елемента
Умейте да: обяснява физическия смисъл на номера на групата, периода, чертае диаграми на първите 20 елемента на системата
Учебник, тетрадка, ПВО
Комбиниран урок
§8,
пр. 12
Периодичната таблица на химичните елементи и атомната структура
Периодичен закон и периодична система на химичните елементи. Групи и периоди на периодичната система
Зная : формулиране на периодичния закон. Умейте да: обясняват моделите на промени в свойствата на елементите в рамките на малки периоди и основни подгрупи, характеризират химикала. елементи въз основа на тяхното положение в PS и структурните характеристики на техните атоми.
Учебник, тетрадка, ПВО
Комбиниран урок
§ 8, 9,
пр. 3-5
Йонна връзка
Структурата на молекулите. Химическа връзка. Йонна връзка
Зная: дефиниране на понятия – химична връзка, йон, йонна връзка. Да може да: определя вида на химичната връзка (йонна) в съединение
Учебник, тетрадка, ПВО
Комбиниран урок
§9,
пр. 2
Ковалентна неполярна химична връзка
Ковалентна неполярна връзка
Умейте да: определи вида на химичната връзка (ковалентна неполярна) в съединение.
Учебник, тетрадка, ПВО
Комбиниран урок
§ 10,
пр. 1-5
Ковалентна полярна химична връзка
Ковалентна полярна връзка.
Умейте да: определят вида на химичната връзка (полярна ковалентна) в съединение
Учебник, тетрадка, ПВО
Комбиниран урок
§ единадесет,
пр. 1-4
Метална химична връзка
Понятие за метална връзка
Зная : дефиниция на метална връзка, обяснява свойствата на металите въз основа на вида на химичната връзка, намира прилики и разлики с ковалентни и йонни връзки.
Учебник, тетрадка, ПВО
Комбиниран урок
§ 12, пр. 13
Обобщаване и систематизиране на знанията по темата „Атоми на химични елементи“
Учебник, тетрадка, ПВО
Тест №1.
Атоми на химични елементи
Бележник, PSHE
Урок за проверка и оценка на документи за образование
ПРОСТИ ВЕЩЕСТВА (7 часа)
Простите вещества са металите.
Прости вещества метали
Зная: общи физични свойства на металите.
Умейте да: характеризират връзката между състава, структурата и свойствата на металите.
Учебник, тетрадка
Урок за усвояване на нови знания
§13
Простите вещества са неметали. Алотропия.
Елементи, неметали, алотропия
Бъдете в състояние да : характеризира физичните свойства на неметалите. Разберете връзката между състава, структурата и свойствата на неметалите.
Учебник, тетрадка
Комбиниран урок
§14
Количество вещество. Моларна маса
Количество вещество, мол, моларна маса.
Зная: определение на понятието "мол", "моларна маса"
Умейте да: изчисляване на моларната маса от формулата на съединение, масата на веществото и броя на частиците от количеството на веществото.
Учебник, тетрадка, ПВО
Комбиниран урок
§15
Моларен обем на газовете. Закон на Авогадро.
Моларен обем
Зная: определяне на моларния обем на газовете.
Учебник, тетрадка
Комбиниран урок
§16
Решаване на изчислителни задачи.
Умейте да: изчисляване на обема на газовете по количеството вещество или броя на газовите молекули.
Учебник, тетрадка, ПВО
Комбиниран урок
§16
Обобщаване на знанията по темата „Прости вещества“
Учебник, тетрадка, ПВО
Урок за обобщаване и систематизиране на знанията
Тест No2.
Прости вещества
Бележник, PSHE
Урок за проверка и оценка на документи за образование
СЪЕДИНЕНИЯ НА ХИМИЧНИТЕ ЕЛЕМЕНТИ (14 часа)
Степен на окисление. Бинарни съединения
Концепцията за валентност и S.O. Съставяне на формули на съединения съгласно S.O.
Умейте да: определяне на валентността и степента на окисление в бинарни съединения, съставяне на формули на съединения според степента на окисление, назоваване на бинарни съединения
Учебник, тетрадка, ПВО
Урок за усвояване на нови знания
§17
Оксиди. Летливи водородни съединения
Основни класове съединения - оксиди, LAN
Умейте да: определят дали дадено вещество принадлежи към класа на оксидите, назовават ги, съставят формули на оксиди
Учебник, тетрадка
Комбиниран урок
§18
Основания
Основни класове съединения - основи
Умейте да: определят дали дадено вещество принадлежи към класа на основите, назовават ги, съставят формули на бази
Знайте: качествена реакция при разпознаване на алкали.
Комбиниран урок
§19
Киселини
Основни класове съединения - киселини
Умейте да: определят дали дадено вещество принадлежи към класа на киселините, назовават ги, правят киселинни формули Зная: формули и имена на киселини, качествена реакция за разпознаване на киселини
Учебник, тетрадка, таблица за разтворимост
Комбиниран урок
§20
28 29
5,6
соли
Основни класове съединения - соли
Умейте да: определят дали дадено вещество принадлежи към класа на соли, назовават ги, съставят формули на соли
Учебник, тетрадка, таблица за разтворимост
Комбиниран урок
§21
Основни класове неорганични вещества
Основни класове съединения
Умейте да: определят дали дадено вещество принадлежи към съответния клас съединения, назовават и съставят формули на веществата.
Учебник, тетрадка, таблица за разтворимост
Урок за обобщаване и систематизиране на знанията
§18-21
Кристални решетки
Кристални и аморфни вещества. Видове кристални решетки
Бъдете в състояние да : характеризира и обяснява свойствата на веществата въз основа на вида и вида на химичната връзка кристална решетка
Учебник, тетрадка
Комбиниран урок
§22
Чисти вещества и смеси
Чисти вещества и смеси
Зная: методи за разделяне на смеси, природни смеси: въздух, природен газ, нефт, природни води.
Учебник, тетрадка
Комбиниран урок
§23
Масова и обемна част на компонентите на сместа (разтвора).
Масова (обемна) част от веществото
Умейте да:
Учебник, тетрадка
Комбиниран урок
§24
Решаване на изчислителни задачи
Умейте да: изчисляват масовата част на веществото в разтвор и обемната част на компонентите на сместа
Учебник, тетрадка
Урок за консолидиране на ZUN
Практичен
работа № 2
Приготвяне на захарен разтвор с определена масова част на захарта в разтвора.
Умейте да: приготвяне на разтвори с дадена концентрация
Учебник, тетрадка
Практически урок
стр.185
Обобщаване на знанията по темата „Съединения на химичните елементи“
Учебник, тетрадка ПШЕ
Урок за обобщаване и систематизиране на знанията
Тест No3Съединения на химични елементи
Бележник, PSHE
Урок за проверка и оценка на документи за образование
ПРОМЕНИ В ВЕЩЕСТВАТА (11 часа)
Методи за разделяне на смеси. Пречистване на вещество. Филтриране.
Зная: Методи за разделяне на смеси
Учебник, тетрадка
Урок за усвояване на нови знания
§25
Химична реакция
Химическа реакция. Условия и признаци на химичните реакции.
Зная: определение на понятието „химична реакция“, признаци на химични реакции, видове реакции чрез абсорбция или освобождаване на енергия.
Учебник, тетрадка
Урок за усвояване на нови знания
§26
Химични уравнения
Уравнение и диаграма на химична реакция. Запазване на масата на веществото по време на химична реакция
Зная: определение за "химическа реакция"
Умейте да: съставят уравнения на химичните реакции въз основа на закона за запазване на масата на веществата
Учебник, тетрадка
Комбиниран урок
§27
Практическа работа №3Признаци на химични реакции
Умейте да: идентифицирайте признаци на химични реакции
Учебник, тетрадка
Практически урок
Изчисления с помощта на химични уравнения
Изчисляване с използване на химични уравнения на масата, обема или количеството на един от реакционните продукти въз основа на масата на изходното вещество
Бъдете в състояние да : изчислете с помощта на химични уравнения масата, обема или количеството на един от реакционните продукти въз основа на масата на изходното вещество
Учебник, тетрадка ПШЕ
Комбиниран урок
§28
Реакции на разлагане. Реакции на съединения.
Реакции на разлагане, реакции на съединения
Умейте да: разграничават реакциите на разлагане и реакциите на съединения от други видове реакции, съставят уравнения за реакции от този тип
Учебник, тетрадка
Комбиниран урок
§29, 30
Реакции на заместване.
Реакции на заместване
Умейте да: разграничете реакциите на заместване от други видове реакции, съставете уравнения за реакции от този тип
Зная: условия на потока и да могат да съставят реакционни уравнения за взаимодействие на метали с разтвори на киселини и соли, като използват серията активност на метали.
Учебник, тетрадка
Комбиниран урок
§31
Обменни реакции.
Обменни реакции
Умейте да: разграничете обменните реакции от други видове реакции, съставете уравнения за реакции от този тип, определете възможността обменните реакции да протичат до завършване.
Учебник, тетрадка
Комбиниран урок
§32
Видове химични реакции, като се използват свойствата на водата като пример
Умейте да: съставете уравнения за реакциите на разлагане, комбиниране, заместване и обмен (хидролиза), като използвате примера за взаимодействие на вода с различни вещества
Зная: видове химични реакции, използвайки примера на свойствата на водата, концепцията за „хидроксиди“
Учебник, тетрадка
§33
47
10
Обобщаване на знанията по темата „Класове неорганични вещества. Видове химични реакции
Учебник, тетрадка
Урок за обобщаване и систематизиране на знанията
48
11
Тест No4Промени, настъпващи във веществата
Бележник, PSHE
Урок за проверка и оценка на документи за образование
РАЗТВАРЯНЕ. РЕШЕНИЯ. СВОЙСТВА НА ЕЛЕКТРОЛИТНИТЕ РАЗТВОРИ (20 часа)
49
1
Разтваряне. Разтворимост на веществата във вода.
Разтвори, процес на разтваряне. Разтворимост на веществата във вода. Силно разтворими, слабо разтворими и слабо разтворими вещества.
Зная: определение на понятието „разтвори“, условия за разтваряне на вещества във вода.
Умейте да: използвайте таблицата за разтворимост.
Учебник, тетрадка
Урок за усвояване на нови знания
§34
50
2
Електролитна дисоциация
Електролити, неелектролити. Електролитна дисоциация. Силни и слаби електролити.
Зная: дефиниране на понятията „електролит“, „неелектролит“, „електролитна дисоциация“, „силен електролит“, „слаб електролит“, разбиране на същността на процеса на ЕД.
Учебник, тетрадка
Комбиниран урок
§35
51
3
Основни положения на TED
Йони, катиони, аниони
Зная: основни разпоредби на TED
Учебник, тетрадка
Комбиниран урок
§36
52
4
Йонни уравненияреакции
Йонообменни реакции
Умейте да: съставят уравнения за йонообменни реакции и разбират същността им. Определете възможността за възникване на йонообменни реакции.
Учебник, тетрадка, таблица за разтворимост
Комбиниран урок
§37
53 54
5-6
Киселини в светлината на TED, тяхната класификация и свойства.
Класификация на киселините и техните химични свойства в светлината на TED.
Зная: класификация и химични свойства на киселините
Умейте да: съставят реакционни уравнения в молекулярна и йонна форма, които характеризират свойствата на киселините
Учебник, тетрадка, таблица за разтворимост
Комбиниран урок
§38
55
7
Основи в светлината на TED, тяхната класификация и свойства.
Класификация на основите и техните химични свойства в светлината на TED.
Зная: класификация и химични свойства на основите
Умейте да: съставят реакционни уравнения в молекулярна и йонна форма, характеризиращи свойствата на основите
Учебник, тетрадка, таблица за разтворимост
Комбиниран урок
§39
56
8
Оксиди в светлината на TED, техните свойства
Класификация на оксидите и техните химични свойства в светлината на TED.
Зная: класификация и химични свойства на оксидите
Умейте да: съставят реакционни уравнения в молекулярна и йонна форма, които характеризират свойствата на оксидите
Учебник, тетрадка, таблица за разтворимост
Комбиниран урок
§40
57
9
Соли в светлината на TED, техните свойства.
Класификация на солите и техните химични свойства в светлината на TED.
Зная: класификация и химични свойства на солите
Умейте да: съставят реакционни уравнения в молекулярна и йонна форма, които характеризират свойствата на солите
Учебник, тетрадка, таблица за разтворимост
Комбиниран урок
§41
58 59
10,11
Генетични връзки между основните класове неорганични съединения.
Химични свойства на основните класове неорганични съединения. Генетични връзки между основните класове неорганични съединения.
Умейте да: съставя уравнения на химични реакции, характеризиращи химичните свойства и генетичните връзки на основните класове неорганични съединения в молекулна и йонна форма
Учебник, тетрадка, таблица за разтворимост. PSHE
Комбиниран урок
§42
60
12
Тест No5Разтваряне. Решения. Свойства на електролитни разтвори.
Тетрадка, таблица за разтворимост. PSHE
Урок за проверка и оценка на документи за образование
61
13
Практическа работа №4.
Практически урок
62
14
Практическа работа № 5.
Практически урок
63
15
Практическа работа №6.
Практически урок
64
16
Практическа работа №7.
Практически урок
65
17
Класификация на химичните реакции. Редокс реакции
Редокс реакции. Окислител, редуциращ агент. Окисляване, редукция.
Зная: дефиниране на понятията „окислител“, „редуциращ агент“, „окисление“. "възстановяване"
Умейте да: идентифицират окислители и редуциращи агенти, разграничават ORR от други видове химични реакции, класифицират реакциите в различни типове.
Учебник, тетрадка, ПВО
Комбиниран урок
§43
66
18
Упражнение по съставяне на оксидация- редукционни реакции
Умейте да: идентифицирайте окислители и редуциращи агенти, разграничете ORR от други видове химични реакции, класифицирайте реакциите в различни типове, подредете коефициенти в ORR с помощта на метода на електронния баланс
Комбиниран урок
§43
67
19
Свойства на веществата от изследваните класове вещества в светлината на ORR.
Умейте да: разгледайте химичните свойства на основните класове неорганични съединения от гледна точка на преподаването на ORR.
Учебник, тетрадка, ПВО
Комбиниран урок
68
20
Обобщаване на знанията по ОВР.
Учебник, тетрадка, ПВО
Урок за обобщаване и систематизиране на знанията
5 Раздаване на учебен материал
1 четвърт
9 седмици
2-ра четвърт
7 седмици
3-та четвърт
10 седмици
4-та четвърт
8 седмици
година
34 седмици
Брой часове
18
14
20
16
68
Глава
1. Въведение
2. Атоми на химичните елементи
3. Прости вещества
4. Съединения на химични елементи
5. Промени, настъпващи с веществата
6. Решения. Разтваряне. Свойства на електролитни разтвори
7. Обобщаване и систематизиране на знанията
7
Тестови работи
"Атоми на химични елементи"
"Прости вещества"
"Съединения на химични елементи"
„Промени,
срещащи се с вещества"
"Разтваряне. Решения. Свойства на електролитни разтвори"
5
Въведение в лабораторното оборудване
nim. Правила за безопасна работа в химическа лаборатория
-
Приготвяне на захарен разтвор с определена масова част на захарта в разтвора
Признаци на химични реакции
Йонни реакции
Условия за завършване на химични реакции между електролитни разтвори
Свойства на киселини, основи и соли
Решаване на експериментални задачи.
7
6. Критерии за оценяване на знанията на студентите
Резултат за вербален отговор
Оценка „5“: отговорът е пълен и верен въз основа на изучаваните теории, материалът е представен в определена логическа последователност, книжовен език, отговорът е независим.
Оценка „4“: отговорът е пълен и верен въз основа на изучаваните теории, материалът е представен в определена логическа последователност, като са допуснати две или три незначителни грешки, коригирани по искане на учителя.
Оценка „3“: отговорът е пълен, но е допусната съществена грешка или отговорът е непълен или несвързан.
Оценка „2“: при отговор се разкрива неразбирането на основното съдържание на учебния материал от ученика или са направени значителни грешки, които ученикът не може да коригира с водещите въпроси на учителя.
Маркировка "1": няма отговор
Оценка на тестове
Оценка “5”: отговорът е пълен и правилен, възможна е малка грешка.
Оценка „4”: отговорът е непълен или са допуснати не повече от две несъществени грешки.
Оценка „3“: работата е завършена поне наполовина, допусната е една съществена грешка и са допуснати две или три незначителни грешки.
Оценка „2“: работата е по-малко от половината завършена или съдържа няколко съществени грешки.
Оценка „1”: работата не е завършена
Оценка на уменията за решаване на проблеми
Оценка „5“: няма грешки в логическите разсъждения и решение, проблемът е решен по рационален начин.
Оценка „4”: няма съществени грешки в логическото разсъждение и решение, но проблемът не е решен по рационален начин или са допуснати не повече от две незначителни грешки.
Оценка „3“: няма съществени грешки в логическите разсъждения, но има съществена грешка в математическите изчисления.
Оценка „2“: има значителни грешки в логическите разсъждения и решения.
Оценка „1”: няма отговор на задачата.
Оценка на експерименталните умения
Оценка „5“: работата е завършена напълно и правилно, направени са правилни наблюдения и изводи, експериментът е проведен по план, като се вземат предвид туберкулозата, демонстрирани са организационни и трудови умения.
Оценка „4“: работата е завършена правилно, направени са правилните заключения и наблюдения, но експериментът не е завършен напълно или са допуснати незначителни грешки при работа с вещества.
Марка „3“: работата е завършена правилно, експериментът е завършен поне наполовина, но е допусната значителна грешка по време на експеримента, в обяснението, в дизайна на работата, в съответствие с правилата за безопасност.
Марка „2“: две или повече съществени грешки са допуснати по време на експеримента, в обяснението, в дизайна на работата, при спазване на правилата за безопасност при работа с вещества.
Оценка "1": студентът няма експериментални умения, работата не е завършена.
7. Материално-техническа база:
Оборудване:лаптоп, проектор, екран, магнитна дъска, абсорбатор.
CD "Обща и неорганична химия". Учебен сборник.
CD “Голяма енциклопедия на Кирил и Методий” - М.: Образование, 2001 г.
CD "Неорганична химия 8-9 клас". Учебен сборник.
CD "Учител". Учебен сборник.
Нагледни помагала:
Периодична таблица на химичните елементи D.I. Менделеев
Електрохимични серииметални напрежения
Таблица за разтворимост на соли, киселини, основи.
Индикаторна таблица
8. Информационен – методическа подкрепа
Основна литература:
Габриелян О.С. Курсова програма по химия за 8-11 клас в общообразователните институции. – М.: Дропла, 2009.
Химия. 8. клас: учебник. за общо образование институции / О.С. Габриелян. М: „Дропла”, 2012. – 270, с. : аз ще.
Наръчник за учителя. Химия. 8 клас / О.С. Габриелян, Н.П. Воскобойникова, А.В. Яшукова. – М.: Дропла, 2008.
Химия. 8 клас: тестове и тестова работакъм учебника О.С. Габриелян „Химия. 8 клас” / О.С. Габриелян, П.Н. Березкин, А.А. Ушакова и др.– 8 изд., стереотип. – М.: Дропла, 2010. – 158, с.
Химия. 8 клас: работна книгакъм учебника О.С. Габриелян „Химия. 8 клас” / О.С. Габриелян, А.В. Яшукова. – 6-то изд., стереотип. – М.: Дропла, 2010. – 176 с. : аз ще.
Допълнителна литература:
Ние учим химия в 8. клас: дидактическо ръководство към учебника на О.С. Габриелян „Химия. 8 клас” за ученици и учители – 5 изд., преговор и доп. – Москва: “БЛИК и К”, 2004. – 224 с.
- цифрова библиотека.
Дидактически карти-задачи по химия: 8. клас: към учебника О.С. Габриелян Химия. 8 клас” / Н.С. Павлова. – М.: Издателство „Експертиза”, 2004. – 159, с. (Поредица „Учебно-методически комплект”).
Хомченко И.Г. Решаване на задачи по химия. – М.: Издателска къща „Новая волна” ООД, 2005. – 256 с.
Глинка Н.Л. обща химия. Издателство "Химия", 1979г www . edios . ru – Ейдос – център дистанционно обучение
16. www . км . ru / образование - учебни материали и речници на сайта „Кирил и Методий”
Приблизителна програма за средно (пълно) общо образование по химия (основно ниво)
ОБЯСНИТЕЛНА ЗАПИСКА
Състояние на документа
Приблизителната програма по химия е съставена въз основа на федералния компонент на Държавния стандарт за средно (пълно) общо образование.
Приблизителната програма уточнява съдържанието на предметните теми на образователния стандарт, дава приблизително разпределение на учебните часове между разделите на курса и препоръчителната последователност на изучаване на теми и раздели на учебния предмет, като се вземат предвид междупредметните и вътрешнопредметните връзки, логиката на учебния процес и възрастовите характеристики на учениците. Приблизителната програма определя списък от демонстрации, лабораторни опити, практически упражнения и изчислителни задачи.
Примерната програма изпълнява две основни функции.
Информационна и методическа функция позволява на всички участници в образователния процес да придобият представа за целите, съдържанието, общата стратегия за обучение, възпитание и развитие на учениците чрез средствата на даден учебен предмет.
Функция на организационното планиране предвижда идентифициране на етапи на обучение, структуриране на учебния материал, определяне на неговите количествени и качествени характеристики на всеки етап, включително за съдържанието на междинното сертифициране на учениците.
Приблизителната програма е насока за съставяне на оригинални учебни програми и учебници. Примерна програма дефинира инвариантната (задължителна) част от курса по химия в гимназияна основно ниво, отвъд което остава възможността за избор на автора на вариативен компонент от съдържанието на образованието. Съставителите на учебни програми и учебници по химия могат да предложат свой собствен подход по отношение на структурирането и определянето на последователността на изучаване на учебния материал, както и начини за формиране на система от знания, умения и методи на дейност, развитие и социализация на учениците. По този начин примерната програма допринася за запазването на единно образователно пространство и предоставя широки възможности за прилагане на различни подходи за изграждане на курса по химия в гимназията в основно ниво.
Структура на документа
Примерната програма включва три раздела: обяснителна записка; основно съдържание с приблизително (в модалността „не по-малко от“) разпределение на учебните часове) по раздели на курса и възможна последователност на изучаване на теми и раздели; изисквания за нивото на подготовка на завършилите средно (пълно) образование по химия на основно ниво. Примерната програма съдържа минимално, но функционално пълно съдържание.
Обща характеристика на предмета
Основните проблеми на химията са изучаването на състава и структурата на веществата, зависимостта на техните свойства от структурата, дизайна на вещества с дадени свойства, изучаването на законите на химичните превръщания и начините за тяхното контролиране, за да се получи вещества, материали и енергия. Следователно, колкото и авторските програми и учебници да се различават по дълбочината на интерпретация на изучаваните въпроси, тяхното съдържание трябва да се основава на съдържанието на примерната програма, която е структурирана в пет блока: 1. Методи на познанието по химия. 2. Теоретична основахимия. 3. Неорганична химия. 4. Органична химия. 5. Химия и живот. Съдържанието на тези образователни блокове в авторските програми може да бъде структурирано по теми и детайлизирано, като се вземат предвид концепциите на автора, но трябва да е насочено към постигане на целите на химическото образование в гимназията.
цели
Изучаването на химия в гимназията на основно ниво е насочено към постигане на следните цели:
Овладяване на знания относно химическия компонент естествено- научна картинасвета, най-важните химични концепции, закони и теории;
владеене на умения прилагат придобитите знания за обяснение на различни химични явления и свойства на веществата, оценяват ролята на химията в развитието на съвременните технологии и производството на нови материали;
развитие познавателни интереси и интелектуални способности в процеса на самостоятелно придобиване на химически знания с използване на различни източници на информация, включително компютърни;
възпитание вярата в положителната роля на химията в живота модерно общество, необходимостта от химически грамотно отношение към вашето здраве и околната среда;
прилагане на придобитите знания и умения за безопасна употреба на вещества и материали в ежедневието, селското стопанство и производството, за решаване на практически проблеми в ежедневието и предотвратяване на явления, вредни за човешкото здраве и околната среда.
Място на учебния предмет в основния учебен план
Федералната основна учебна програма за образователните институции на Руската федерация разпределя 70 часа за задължително изучаване на учебния предмет „Химия“ на етапа на средно (пълно) общо образование на основно ниво.
Примерната програма е разработена за 70 учебни часа. Осигурява резерв от свободно учебно време - 7 академични часа (10%) за прилагане на оригинални подходи, използване на различни форми на организация на учебния процес, въвеждане на съвременни методи на обучение и педагогически технологии.
Общообразователни способности, умения и методи на дейност
Примерната програма предвижда развитие на общообразователни умения и способности у учениците, универсални методи на дейност и ключови компетентности. В тази насока приоритетите за учебния предмет „Химия” в гимназията на базово ниво са: способността за самостоятелно и мотивирано организиране на познавателна дейност(от поставяне на цели до получаване и оценка на резултатите); използване на елементи от причинно-следствения и структурно-функционалния анализ; определение съществени характеристикиобектът, който се изучава; способността да обосновава подробно преценки, да дава определения и да предоставя доказателства; оценяване и коригиране на поведението в околната среда, изпълнение на екологичните изисквания в практически дейности и в ежедневието; използването на мултимедийни ресурси и компютърни технологии за обработка, предаване, систематизиране на информация, създаване на бази данни, представяне на резултатите от познавателни и практически дейности.
Резултати от обучението
Резултатите от курса „Химия“ са дадени в раздела „Изисквания за нивото на обучение на завършилите“, което напълно отговаря на стандарта. Изискванията са насочени към прилагане на дейностен, практически ориентиран и личностно ориентиран подход; овладяване на интелектуални и практически дейности от учениците; овладяване на знания и умения, които са необходими в ежедневието, позволяващи да се ориентирате в света около себе си и които са важни за опазване на околната среда и собственото здраве.
Категорията „може“ включва изисквания, базирани на по-сложни видове дейности, включително творчески: обясняват, изучават, разпознават и описват, идентифицират, сравняват, дефинират, анализират и оценяват, извършват независимо търсене на необходимата информация и др.
Заглавието „използване на придобитите знания и умения в практическата дейност и ежедневието“ представя изисквания, които надхвърлят образователния процес и са насочени към решаване на различни житейски проблеми.
ГЛАВНО СЪДЪРЖАНИЕ(70 часа, резерв 7 часа)
1. Методи на познанието по химия (2 часа)
Научни методи за познание на веществата и химичните явления. Ролята на експеримента и теорията в химията. Симулация на химични процеси.
Демонстрации
Анализ и синтез на химични вещества.
2. Теоретични основи на химията (18 часа)
Съвременни представи за структурата на атома
атом Изотопи. Атомни орбитали.Електронна класификация на елементите (с -, p-елементи.). Характеристики на структурата на електронните обвивки на атомите на преходните елементи. Периодичен закон и периодична система на химичните елементи D.I. Менделеев, тяхното идейно и научно значение.
Химическа връзка
Ковалентна връзка, нейните разновидности и механизми на образуване. Степен на окисление и валентност на химичните елементи.
Йонна връзка. Катиони и аниони. Метална връзка. Водородната връзка, нейната роля в образуването на биополимерни структури.Единната природа на химичните връзки.
вещество
Качествен и количествен състав на веществото. Вещества с молекулярна и немолекулна структура. Кристални решетки.
Причини за разнообразието на веществата: изомерия, хомология, алотропия.
Чисти вещества и смеси. Методи за разделяне на смеси и тяхното използване. Явления, възникващи по време на разтварянето на вещества - разрушаване на кристалната решетка, дифузия,дисоциация, хидратация.
Верни решения. Начини за изразяване на концентрацията на разтворите: масова част на разтвореното вещество. Дисоциация на електролити във водни разтвори. Силни и слаби електролити.
Понятие за колоиди и тяхното значение (золове, гелове).
Химична реакция
Класификация на химичните реакции в неорганичната и органичната химия по различни критерии. Характеристики на реакциите в органичната химия.
Йонообменни реакции във водни разтвори. Хидролиза на неорганични и органични съединения. Среда на водния разтвор: кисела, неутрална, алкална. pH стойност(рН) на разтвора.
Топлинен ефект на химическа реакция.
Редокс реакции. Електролиза на разтвори и стопилки.Практическа употребаелектролиза.
Скоростта на реакцията, нейната зависимост от различни фактори. Катализатори и катализа. Идеята за ензимите като биологични катализатори от протеинова природа.
Обратимост на реакциите. Химично равновесие и методи за неговото изместване.
Демонстрации
Модели на йонни, атомни, молекулни и метални кристални решетки
Модели на молекули на изомери и хомолози.
Получаване на алотропни модификации на сяра и фосфор.
Разтваряне на оцветени вещества във вода (меден сулфат ( II ), калиев перманганат, железен (III) хлорид).
Зависимост на скоростта на реакцията от концентрацията и температурата.
Разлагане на водороден пероксид в присъствието на катализатор (манганов оксид ( IV ) и ензим (каталаза)).
Мостри от хранителни, козметични, биологични и медицински золи и гелове.
Ефект на Тиндал.
Лабораторни опити
Определяне на естеството на средата на разтвора с помощта на универсален индикатор.
Провеждане на йонообменни реакции за характеризиране на свойствата на електролитите.
3. Неорганична химия (13 часа)
Класификация на неорганичните съединения. Химични свойства на основните класове неорганични съединения.
Метали. Електрохимични напреженови серии от метали. Общи методи за получаване на метали. Концепцията за корозия на метала. Методи за защита от корозия.
Неметали. Редокс свойства на типичните неметали (например водород, кислород, халогени и сяра). Обща характеристика на подгрупата на халогените (от флуор до йод). Благородни газове.
Демонстрации
Проби от метали и неметали.
Сублимация на йод.
Приготвяне на йодна спиртна тинктура.
Взаимно изместване на халогени от разтвори на техните соли.
Образци на метали и техните съединения.
Изгаряне на сяра, фосфор, желязо, магнезий в кислород.
Взаимодействие на алкални и алкалоземни метали с вода.
Взаимодействие на мед с кислород и сяра.
Експерименти върху металната корозия и защита срещу нея.
Лабораторни опити
Взаимодействие на цинк и желязо с разтвори на киселини и основи.
Запознаване с метални проби и техните руди (работа с колекции).
Запознаване с образци на неметали и техните естествени съединения (работа с колекции).
Разпознаване на хлориди и сулфати.
Практически уроци
Получаване, събиране и разпознаване на газове.
Решаване на експериментални задачи по темата „Метали и неметали“.
Идентификация на неорганични съединения.
4. Органична химия (25 часа)
Класификация и номенклатура на органичните съединения. Химични свойства на основните класове органични съединения.
Теория на структурата на органичните съединения. Въглероден скелет. Радикали. Функционални групи. Хомоложни редове, хомолози. Структурна изомерия.
Въглеводороди: алкани, алкени и диени, алкини, арени. Естествени изворивъглеводороди: нефт и природен газ.
Кислородсъдържащи съединения: едновалентни и многовалентни алкохоли, фенол, алдехиди, едноосновни карбоксилни киселини, естери, мазнини, въглехидрати.
Полимери: пластмаси, каучук, влакна.
Демонстрации
Примери за въглеводороди в различни агрегатни състояния (смес от пропан-бутан в запалка, бензин, парафин, асфалт).
Производство на етилен и ацетилен.
Качествени реакции на множество връзки.
Лабораторни опити
Запознаване с образци на пластмаси, влакна и каучук (работа с колекции).
Запознаване с проби от природни въглеводороди и продукти от тяхната преработка (работа с колекции).
Запознаване с мостри на хранителни, козметични, биологични и медицински золи и гелове.
Изработване на модели на молекули на органични съединения.
Откриване на ненаситени съединения в течни петролни продукти и растителни масла.
Качествени реакции към алдехиди, многовалентни алкохоли, нишесте и протеини.
Практически уроци
Идентификация на органични съединения.
Разпознаване на пластмаси и влакна.
5. Химия и живот (5 часа)
Химия и здраве. Лекарства, ензими, витамини, хормони, минерална вода. Проблеми, свързани с употребата на лекарства.
Химията в ежедневието. Перилни и почистващи препарати. Правила за безопасна работа с битова химия. Битова химическа грамотност.
Промишлено производство на химикали по примера на производството на сярна киселина.
Химическото замърсяване на околната среда и последствията от него.
Демонстрации
Образци на лекарства и витамини.
Мостри на хигиенни и козметични продукти.
Лабораторни опити
Представяне на мостри на лекарства от домашна аптечка.
Представяне на мостри на перилни и почистващи препарати. Проучете инструкциите за употреба.
ИЗИСКВАНИЯ КЪМ НИВОТО НА ПОДГОТОВКА НА ЗАВЪРШИЛИТЕ СРЕДНО ОБРАЗОВАНИЕ
В резултат на изучаването на химия на основно ниво ученикът трябва:
знам (разбирам)
най-важните химични понятия:
вещество, химичен елемент, атом, молекула, относителни атомни и молекулни маси, йон, алотропия, изотопи, химична връзка, електроотрицателност, валентност, степен на окисление, мол, моларна маса, моларен обем, вещества с молекулна и немолекулна структура, разтвори, електролит и неелектролит, електролитна дисоциация, окислител и редуциращ агент, окисление и редукция, топлинен ефект на реакцията, скорост на химичната реакция, катализа, химично равновесие, въглероден скелет, функционална група, изомерия, хомология;
основни закони на химията: запазване на масата на веществата, постоянство на състава, периодичен закон;
основни теории на химията: химично свързване, електролитна дисоциация, структура на органични съединения;
най-важните вещества и материали: основни метали и сплави; сярна, солна, азотна и оцетна киселина; алкали, амоняк, минерални торове, метан, етилен, ацетилен, бензен, етанол, мазнини, сапуни, глюкоза, захароза, нишесте, целулоза, протеини, изкуствени и синтетични влакна, каучук, пластмаси;
да бъде в състояние да
обадете се изследвани вещества по „тривиална” или международна номенклатура;
дефинирам: валентност и степен на окисление на химичните елементи, вид на химичната връзка в съединенията, заряд на йони, природа на средата във водни разтвори на неорганични съединения, окислител и редуктор, принадлежност на веществата към различни класове органични съединения;
характеризират: елементи на малки периоди според позицията им в периодичната система D.I. Менделеев; общи химични свойства на металите, неметалите, основните класове неорганични и органични съединения; структура и химични свойства на изучаваните органични съединения;
обясни: зависимост на свойствата на веществата от техния състав и структура; естеството на химичната връзка (йонна, ковалентна, метална), зависимостта на скоростта на химичната реакция и положението на химичното равновесие от различни фактори;
извършете химичен експеримент за разпознаване на най-важните неорганични и органични вещества;
поведение, ръководене самостоятелно търсене на химическа информация с помощта на различни източници (научно-популярни публикации, компютърни бази данни, интернет ресурси); използват компютърни технологии за обработка и предаване на химическа информация и представянето й в различни форми;
използват придобитите знания и умения в практически дейности и ежедневието, за да:
Обяснения на химични явления,
срещащи се в природата, бита и на работното място;
Определяне на възможността за протичане на химични трансформации в различни условияи оценка на последствията от тях;
Екологично компетентно поведение в околната среда;
Оценка на въздействието на химическото замърсяване на околната среда върху човешкия организъм и други живи организми;
Безопасно боравене със запалими и токсични вещества и лабораторно оборудване;
Приготвяне на разтвори с определена концентрация в бита и на работното място;
Критично оценяване на надеждността на химическата информация, идваща от различни източници.
ПРИМЕРНА ПРОГРАМА
СРЕДНО (ПЪЛНО) ОБЩО ОБРАЗОВАНИЕ
ПО ХИМИЯ( ОСНОВНО НИВО НА)
ОБЯСНИТЕЛНА ЗАПИСКА
Състояние на документа
Приблизителната програма уточнява съдържанието на предметните теми на образователния стандарт, дава приблизително разпределение на учебните часове между разделите на курса и препоръчителната последователност на изучаване на теми и раздели на учебния предмет, като се вземат предвид междупредметните и вътрешнопредметните връзки, логиката на учебния процес и възрастовите характеристики на учениците. Приблизителната програма определя списък от демонстрации, лабораторни опити, практически упражнения и изчислителни задачи.
Информационно-методически
Организационно планиране
Приблизителната програма е насока за съставяне на оригинални учебни програми и учебници. Примерната програма определя инвариантната (задължителната) част от курса по химия в гимназията на основно ниво, след което остава възможността за авторски избор на вариативен компонент от учебното съдържание. Съставителите на учебни програми и учебници по химия могат да предложат свой собствен подход по отношение на структурирането и определянето на последователността на изучаване на учебния материал, както и начини за формиране на система от знания, умения и методи на дейност, развитие и социализация на учениците. По този начин примерната програма допринася за запазването на единно образователно пространство и предоставя широки възможности за прилагане на различни подходи за изграждане на курса по химия в гимназията в основно ниво.
Структура на документа
Примерната програма включва три раздела: обяснителна записка; основно съдържание с приблизително (в модалността „не по-малко от“) разпределение на учебните часове по раздели на курса и възможна последователност на изучаване на теми и раздели; изисквания за нивото на подготовка на завършилите средно (пълно) образование по химия на основно ниво. Примерната програма съдържа минимално, но функционално пълно съдържание.
Основните проблеми на химията са изучаването на състава и структурата на веществата, зависимостта на техните свойства от структурата, дизайна на вещества с дадени свойства, изучаването на законите на химичните превръщания и начините за тяхното контролиране, за да се получи вещества, материали и енергия. Следователно, колкото и авторските програми и учебници да се различават по дълбочината на интерпретация на изучаваните въпроси, тяхното учебно съдържание трябва да се основава на съдържанието на примерната програма, която е структурирана в пет блока: Методи на познанието по химия; Теоретични основи на химията; Неорганична химия; Органична химия; Химия и живот. Съдържанието на тези образователни блокове в авторските програми може да бъде структурирано по теми и детайлизирано, като се вземат предвид концепциите на автора, но трябва да е насочено към постигане на целите на химическото образование в гимназията.
цели
Изучаването на химия в гимназията на основно ниво е насочено към постигане на следните цели:
· овладяване на знания за химичната съставна част на природонаучната картина на света, най-важните химични понятия, закони и теории;
· овладяване на умения за прилагане на придобитите знания за обяснение на различни химични явления и свойства на веществата, оценяване на ролята на химията в развитието на съвременните технологии и производството на нови материали;
· развитие на познавателни интереси и интелектуални способности в процеса на самостоятелно придобиване на химически знания с помощта на различни източници на информация, включително компютърни;
· внушаване на увереност в положителната роля на химията в живота на съвременното общество, необходимостта от химически грамотно отношение към здравето и околната среда;
· прилагане на придобитите знания и умения за безопасна употреба на вещества и материали в бита, селското стопанство и производството, решаване на практически проблеми в бита, предотвратяване на явления, вредни за човешкото здраве и околната среда.
Федералната основна учебна програма за образователните институции на Руската федерация разпределя 70 часа за задължително изучаване на учебния предмет „Химия“ на етапа на средно (пълно) общо образование на основно ниво.
Примерната програма е разработена за 70 учебни часа. В същото време се предвижда резерв от свободно учебно време в размер на (7) учебни часа (или 10%) за прилагане на оригинални подходи, използване на различни форми на организация на учебния процес, въвеждане на съвременни методи на обучение и педагогически технологии.
Примерната програма предвижда развитие на общообразователни умения и способности у учениците, универсални методи на дейност и ключови компетентности. В тази насока приоритетите за учебния предмет „Химия” в гимназията на основно ниво са: умението за самостоятелно и мотивирано организиране на познавателната дейност (от поставяне на цел до получаване и оценка на резултата); използване на елементи от причинно-следствения и структурно-функционалния анализ; определяне на съществените характеристики на обекта, който се изучава; способността да обосновава подробно преценки, да дава определения и да предоставя доказателства; оценяване и коригиране на поведението в околната среда, изпълнение на екологичните изисквания в практически дейности и в ежедневието; използването на мултимедийни ресурси и компютърни технологии за обработка, предаване, систематизиране на информация, създаване на бази данни, представяне на резултатите от познавателни и практически дейности.
Резултати от обучението
ОСНОВНО СЪДЪРЖАНИЕ (70 часа)
МЕТОДИ НА ПОЗНАНИЕТО ПО ХИМИЯ (2 часа)
Научни методи за познание на веществата и химичните явления. Ролята на експеримента и теорията в химията. Симулация на химични процеси.
Демонстрации
ТЕОРЕТИЧНИ ОСНОВИ НА ХИМИЯТА (18 часа)
Съвременни представиза структурата на атома.
атом Изотопи. Атомни орбитали. Електронна класификация на елементите ( с-, стр- елементи). Характеристики на структурата на електронните обвивки на атомите на преходните елементи. Периодичният закон и периодичната система на химичните елементи от D.I. Менделеев, тяхното идеологическо и научно значение.
Химическа връзка
Ковалентна връзка, нейните разновидности и механизми на образуване. Степен на окисление и валентност на химичните елементи. Йонна връзка. Катиони и аниони. Метална връзка. Водородната връзка, нейната роля в образуването на биополимерни структури.
вещество
Качествен и количествен състав на веществото. Вещества с молекулярна и немолекулна структура. Кристални решетки.
Причини за разнообразието на веществата: изомерия, хомология, алотропия.
Чисти вещества и смеси. Методи за разделяне на смеси и тяхното използване. Явления, възникващи по време на разтварянето на вещества - разрушаване на кристалната решетка, дифузия, дисоциация, хидратация.
Верни решения. Начини за изразяване на концентрацията на разтворите: масова част на разтвореното вещество. Дисоциация на електролити във водни разтвори. Силни и слаби електролити.
Понятие за колоиди и тяхното значение (золове, гелове).
Химична реакция
Класификация на химичните реакции в неорганичната и органичната химия по различни критерии. Характеристики на реакциите в органичната химия.
Йонообменни реакции във водни разтвори. Хидролиза на неорганични и органични съединения. Среда на водния разтвор: кисела, неутрална, алкална. Водородно число (рН) на разтвора.
Топлинен ефект на химическа реакция.
Редокс реакции. Електролиза на разтвори и стопилки.Практическо приложение на електролизата.
Скоростта на реакцията, нейната зависимост от различни фактори. Катализатори и катализа. Идея за ензимите като биологични катализатори от протеинова природа.
Обратимост на реакциите. Химично равновесие и методи за неговото изместване.
Демонстрации
Разтваряне на оцветени вещества във вода (меден сулфат ( II ), калиев перманганат, железен хлорид ( III)).
Разлагане на водороден пероксид в присъствието на катализатор (манганов оксид ( IV ) и ензим (каталаза).
Ефект на Тиндал.
Лабораторни опити
НЕОРГАНИЧНА ХИМИЯ (13 часа).
Класификация на неорганичните съединения. Химични свойства на основните класове неорганични съединения.
Метали. Електрохимични напреженови серии от метали. Общи методи за получаване на метали. Концепцията за корозия на метала. Методи за защита от корозия.
Неметали. Редокс свойства на типичните неметали (например водород, кислород, халогени и сяра). Обща характеристика на подгрупата на халогените (от флуор до йод). Благородни газове.
Демонстрации
Проби от метали и неметали.
Сублимация на йод.
Приготвяне на йодна спиртна тинктура.
Взаимно изместване на халогени от разтвори на техните соли.
Образци на метали и техните съединения.
Изгаряне на сяра, фосфор, желязо, магнезий в кислород.
Взаимодействие на алкални и алкалоземни метали с вода.
Взаимодействие на мед с кислород и сяра.
Експерименти върху металната корозия и защита срещу нея.
Лабораторни опити
Взаимодействие на цинк и желязо с разтвори на киселини и основи.
Запознаване с метални проби и техните руди (работа с колекции).
Запознаване с образци на неметали и техните естествени съединения (работа с колекции).
Разпознаване на хлориди и сулфати.
Практически уроци
Получаване, събиране и разпознаване на газове.
Решаване на експериментални задачи по темата „Метали и неметали“.
ОРГАНИЧНА ХИМИЯ (25 часа)
Класификация и номенклатура на органичните съединения. Химични свойства на основните класове органични съединения.
Теория на структурата на органичните съединения. Въглероден скелет. Радикали. Функционални групи. Хомоложни редове, хомолози. Структурна изомерия.
Въглеводороди: алкани, алкени и диени, алкини, арени. Природни източници на въглеводороди: нефт и природен газ.
Кислородсъдържащи съединения: едновалентни и многовалентни алкохоли, фенол, алдехиди, едноосновни карбоксилни киселини, естери, мазнини, въглехидрати.
Азотсъдържащи съединения: амини, аминокиселини, протеини.
Полимери: пластмаси, каучук, влакна.
Демонстрации
Примери за въглеводороди в различни агрегатни състояния (смес от пропан-бутан в запалка, бензин, парафин, асфалт).
Производство на етилен и ацетилен.
Качествени реакции на множество връзки.
Лабораторни опити
Запознаване с образци на пластмаси, влакна и каучук (работа с колекции).
Запознаване с проби от природни въглеводороди и продукти от тяхната преработка (работа с колекции).
Запознаване с мостри на хранителни, козметични, биологични и медицински золи и гелове.
Изработване на модели на молекули на органични съединения.
Откриване на ненаситени съединения в течни петролни продукти и растителни масла.
Качествени реакции към алдехиди, многовалентни алкохоли, нишесте и протеини.
Практически уроци
Идентификация на органични съединения.
Разпознаване на пластмаси и влакна.
ХИМИЯ И ЖИВОТ (5 часа)
Химия и здраве. Лекарства, ензими, витамини, хормони, минерални води. Проблеми, свързани с употребата на лекарства.
Химията в ежедневието. Перилни и почистващи препарати. Правила за безопасна работа с битова химия. Битова химическа грамотност.
Промишлено производство на химикали по примера на производството на сярна киселина.
Демонстрации
Образци на лекарства и витамини.
Мостри на хигиенни и козметични продукти.
Лабораторни опити
Представяне на мостри на лекарства от домашна аптечка.
Представяне на мостри на перилни и почистващи препарати. Проучване на инструкциите за техния състав и употреба
РЕЗЕРВ СВОБОДНО ВРЕМЕ7 часа.
В резултат на изучаването на химия на основно ниво ученикът трябва
знам/разбирам
· най-важните химични понятия: вещество, химичен елемент, атом, молекула, относителни атомни и молекулни маси, йон, алотропия, изотопи, химическа връзка, електроотрицателност, валентност, степен на окисление, мол, моларна маса, моларен обем, вещества с молекулярна и немолекулна структура, разтвори , електролит и неелектролит, електролитна дисоциация, окислител и редуциращ агент, окисление и редукция, топлинен ефект на реакцията, скорост на химичната реакция, катализа, химично равновесие, въглероден скелет, функционална група, изомерия, хомология;
· основни закони на химията: запазване на масата на веществата, постоянство на състава, периодичен закон;
· основни теории на химията: химично свързване, електролитна дисоциация, структура на органичните съединения;
· основни вещества и материали: основни метали и сплави; сярна, солна, азотна и оцетна киселина; алкали, амоняк, минерални торове, метан, етилен, ацетилен, бензен, етанол, мазнини, сапуни, глюкоза, захароза, нишесте, фибри, протеини, изкуствени и синтетични влакна, каучук, пластмаси;
да бъде в състояние да
· обадете сеизучавани вещества съгласно "тривиалната" или международната номенклатура;
· определи: валентност и степен на окисление на химичните елементи, вид на химичната връзка в съединенията, заряд на йони, природа на средата във водни разтвори на неорганични съединения, окислител и редуктор, принадлежност на веществата към различни класове органични съединения;
· характеризират : елементи от малки периоди според позицията им в периодичната система на Д. И. Менделеев; общи химични свойства на металите, неметалите, основните класове неорганични и органични съединения; структура и химични свойства на изучаваните органични съединения;
· обясни: зависимост на свойствата на веществата от техния състав и структура; естеството на химичната връзка (йонна, ковалентна, метална), зависимостта на скоростта на химичната реакция и положението на химичното равновесие от различни фактори;
· за разпознаване на най-важните неорганични и органични вещества;
· поведение, ръководенесамостоятелно търсене на химическа информация с помощта на различни източници (научно-популярни публикации, компютърни бази данни, интернет ресурси); използват компютърни технологии за обработка и предаване на химическа информация и представянето й в различни форми;
· безопасно боравене със запалими и токсични вещества и лабораторно оборудване;
· приготвяне на разтвори с определена концентрация в бита и на работното място;
· критична оценка на надеждността на химическата информация, идваща от различни източници.
ПРИМЕРНА ПРОГРАМА
СРЕДНО (ПЪЛНО) ОБЩО ОБРАЗОВАНИЕ
ПО ХИМИЯ( НИВО НА ПРОФИЛ)
ОБЯСНИТЕЛНА ЗАПИСКА
Състояние на документа
Приблизителната програма по химия е съставена въз основа на федералния компонент на държавния стандарт за средно (пълно) общо образование.
Приблизителната програма уточнява съдържанието на предметните теми на образователния стандарт, дава приблизително разпределение на учебните часове по основните раздели на курса и препоръчителната последователност на изучаване на теми и раздели на учебния предмет, като се вземат предвид междупредметните и вътрешнопредметните връзки , логиката на учебния процес и възрастовите особености на учениците. Приблизителната програма определя списък от демонстрации, лабораторни опити, практически упражнения и изчислителни задачи.
Примерната програма изпълнява две основни функции:
Информационно-методически функцията позволява на всички участници в образователния процес да получат представа за целите, съдържанието, общата стратегия за преподаване, възпитание и развитие на учениците, използвайки средствата на даден учебен предмет.
Организационно планиране функцията включва подчертаване на етапите на обучение, структуриране на учебния материал, определяне на неговите количествени и качествени характеристики на всеки етап, включително за съдържанието на междинното сертифициране на учениците.
Примерната програма е насока за съставяне на оригинални учебни програми и учебници и определя инвариантната (задължителната) част от курса по химия в гимназията на ниво профил, извън която остава възможността за авторски избор на вариативен компонент на учебно съдържание. Съставителите на учебни програми и учебници по химия могат да предложат свой собствен подход по отношение на структурирането и определянето на последователността на изучаване на учебния материал, както и начини за формиране на система от знания, умения и методи на дейност, развитие и социализация на учениците. По този начин примерната програма допринася за запазването на единно образователно пространство и предоставя широки възможности за прилагане на различни подходи за изграждане на курс по химия в гимназията на ниво профил.
Структура на документа
Примерната програма включва три раздела: обяснителна записка; основно съдържание с приблизително (в модалността „не по-малко от“) разпределение на учебните часове по раздели на курса и възможна последователност на изучаване на теми и раздели; изисквания за нивото на обучение на завършилите средно (пълно) образование по химия на ниво профил. Примерната програма съдържа минимално, но функционално пълно съдържание.
Обща характеристика на предмета
Основните проблеми на химията са изучаването на състава и структурата на веществата, зависимостта на техните свойства от структурата, дизайна на вещества с дадени свойства, изучаването на законите на химичните превръщания и начините за тяхното контролиране, за да се получи вещества, материали и енергия. Следователно, колкото и авторските програми и учебници да се различават по дълбочината на интерпретация на изучаваните въпроси, тяхното учебно съдържание трябва да се основава на съдържанието на примерната програма, която е структурирана в пет блока: Методи научно познание; Основи на теоретичната химия; Неорганична химия; Органична химия; Химия и живот. Съдържанието на тези образователни блокове в авторските програми може да бъде структурирано по теми и детайлизирано, като се вземат предвид концепциите на автора, но трябва да е насочено към постигане на целите на химическото образование в гимназията.
цели
Изучаването на химия в гимназията на профилирано ниво е насочено към постигане на следните цели:
· овладяване на системата от знанияза основните закони, теории, факти от химията, необходими за разбиране на научната картина на света;
· владеене на умения:характеризира вещества, материали и химични реакции; извършват лабораторни опити; извършват изчисления според химични формулии уравнения; търсене на химическа информация и оценка на нейната надеждност; навигация и вземане на решения в проблемни ситуации;
· развитие познавателни интереси, интелектуални и креативноств процеса на изучаване на химическата наука и нейния принос към технически прогресцивилизация; сложни и противоречиви начини за развитие на идеи, теории и концепции на съвременната химия;
· подхранване на увереностфактът, че химията е мощен инструмент за въздействие върху околната среда, и чувство за отговорност за използването на придобитите знания и умения;
· прилагане на придобитите знания и уменияза: безопасна работа с вещества в лаборатория, у дома и на работното място; решаване на практически проблеми от ежедневието; предотвратяване на явления, вредни за човешкото здраве и околната среда; извършване изследователска работа; съзнателен избор на професия, свързана с химията.
Място на учебния предмет в основния учебен план
Федералната основна учебна програма за образователните институции на Руската федерация разпределя часове за задължително изучаване на учебния предмет „Химия“ на етапа на средно (пълно) общо образование на ниво профил.
Примерната програма е разработена за 210 учебни часа. В същото време се осигурява резерв от свободно учебно време в размер на (21) учебни часа (или 10%) за прилагане на оригинални подходи, използване на различни форми на организация на учебния процес, въвеждане на модерно обучение. методи и педагогически технологии.
Общообразователни способности, умения и методи на дейност
Примерната програма предвижда развитие на общообразователни умения и способности у учениците, универсални методи на дейност и ключови компетентности. В тази насока приоритетите за учебния предмет „Химия” в гимназията на ниво профил са: умението за самостоятелно и мотивирано организиране на познавателната дейност (от поставяне на цел до получаване и оценка на резултата); използване на елементи от причинно-следствения и структурно-функционалния анализ; изследване на прости реални връзки и зависимости; определяне на съществените характеристики на обекта, който се изучава; самостоятелен избор на критерии за съпоставяне, сравнение, оценка и класификация на обекти; търсене на необходимата информация по дадена тема в източници от различен тип; способността да обосновава подробно преценки, да дава определения и да предоставя доказателства; обяснение на изучаваните разпоредби с помощта на самостоятелно подбрани конкретни примери; оценка и коригиране на поведението в околната среда, прилагане на екологичните изисквания в практически дейности и в ежедневието; използването на мултимедийни ресурси и компютърни технологии за обработка, предаване, систематизиране на информация, създаване на бази данни, представяне на резултатите от познавателни и практически дейности.
Резултати от обучението
Резултатите от курса „Химия“ са дадени в раздела „Изисквания за нивото на обучение на завършилите“, което напълно отговаря на стандарта. Изискванията са насочени към прилагане на дейностен, практически ориентиран и личностно ориентиран подход; овладяване на интелектуални и практически дейности от учениците; овладяване на знания и умения, които са необходими в ежедневието, позволяващи да се ориентирате в света около себе си и които са важни за опазване на околната среда и собственото здраве.
Разделът „Можете“ включва изисквания, базирани на по-сложни видове дейности, включително творчески: обяснявайте, изучавайте, разпознавайте и описвайте, идентифицирайте, сравнявайте, дефинирайте, анализирайте и оценявайте, извършвайте независимо търсене на необходимата информация и др.
Заглавието „Използване на придобитите знания и умения в практическата дейност и ежедневието“ представя изисквания, които надхвърлят образователния процес и са насочени към решаване на различни житейски проблеми.
ОСНОВНО СЪДЪРЖАНИЕ (210 часа)
МЕТОДИ НА НАУЧНОТО ПОЗНАНИЕ (4 часа)
Научни методи за изследване на химичните вещества и превръщания. Ролята на химичния експеримент в познаването на природата. Симулация на химични явления. Връзката между химия, физика, математика и биология. Природонаучна картина на света.
Демонстрации
Анализ и синтез на химични вещества.
ОСНОВИ НА ТЕОРЕТИЧНАТА ХИМИЯ (50 часа)
атом Модели на атомната структура. Ядро и нуклони. Нуклиди и изотопи. Електрон. Електронен дуализъм. Квантови числа. Атомна орбитала. Разпределение на електроните между орбиталите в съответствие с принципа на Паули и правилото на Хунд. Електронна конфигурация на атом. Валентни електрони. Основни и възбудени състояния на атомите.
Електронна класификация на химичните елементи (s-, p-, d-елементи). Електронни конфигурацииатоми на преходни елементи.
Съвременна формулировка на периодичния закон и сегашно състояниепериодична система на химичните елементи от Д. И. Менделеев. Периодични свойстваелементи (атомни радиуси, йонизационна енергия) и вещества, образувани от тях.
Молекули и химично свързване. Ковалентна връзка, нейните разновидности и механизми на образуване. Характеристики на ковалентните връзки. Сложни връзки. Електроотрицателност. Степен на окисление и валентност. Хибридизация атомни орбитали. Пространствена структура на молекулите. Полярност на молекулите. Йонна връзка. Метална връзка. Водородна връзка. Междумолекулни взаимодействия.Единната природа на химичните връзки.
Вещества с молекулярна и немолекулна структура. Съвременни представи за строежа на твърди, течни и газообразни вещества. Кристални и аморфни вещества. Видове кристални решетки (атомни, молекулни, йонни, метални). Зависимост на свойствата на веществата от вида на кристалните решетки.
Причини за разнообразието на веществата: изомерия, хомология, алотропия, изотопия .
Класификация и номенклатура на неорганични и органични вещества.
Чисти вещества и смеси. Дисперсни системи. Колоидни системи.Верни решения. Разтварянето като физико-химичен процес. Топлинни явлениякогато се разтвори. Начини за изразяване на концентрацията на разтвори: масова част от разтвореното вещество, моларна и молалконцентрация.
Химични реакции, тяхната класификация в неорганичната и органичната химия.
Модели на химични реакции. Топлинни ефекти на реакциите. Термохимични уравнения. Концепцията за енталпия и ентропия. Енергия на Гибс.Законът на Хес и последствията от него.
Скоростта на реакцията, нейната зависимост от различни фактори. Закон за масовото действие. Елементарни и сложни реакции. Механизъм на реакцията.Активираща енергия. Катализатори и катализа (хомогенна, хетерогенна, ензимна).
Обратимост на реакциите. Химически баланс. Константа на равновесие. Изместване на равновесието под влияние на различни фактори. Принцип на Льо Шателие.
Електролитна дисоциация. Силни и слаби електролити. Константа на дисоциация. Йонообменни реакции. Продукт на разтворимост. Киселинно-базови взаимодействия в разтвори. Амфотерни. Йонно произведение на вода. Водородно число (рН) на разтвора.
Хидролиза на органични и неорганични съединения. Значението на хидролизата в биологичните метаболитни процеси. Приложение на хидролизата в промишлеността (осапунване на мазнини, производство на хидролитичен алкохол).
Редокс реакции. Електронни и електронно-йоннибаланс. Посока на редокс реакциите. Диапазон от стандартни електродни потенциали. Корозия на метали и нейните видове (химическа и електрохимична). Методи за защита от корозия.
Химически източници на ток. Галванични и горивни клетки, батерии. Електролиза на разтвори и стопилки. Електролитно производство на алкални, алкалоземни метали и алуминий. Практическо приложение на електролизата.
Демонстрации
Модели на йонни, атомни, молекулни и метални кристални решетки.
Модели на молекули на изомери и хомолози.
Получаване на алотропни модификации на сяра и фосфор.
Разтваряне на оцветени вещества във вода (меден (II) сулфат, калиев перманганат, железен (III) хлорид).
Зависимост на скоростта на реакцията от концентрацията и температурата.
Разлагане на водороден пероксид в присъствието на катализатор (манганов (IV) оксид) и ензим (каталаза).
Мостри от хранителни, козметични, биологични и медицински золи и гелове.
Ефект на Тиндал.
Лабораторни опити
Определяне на естеството на средата на разтвора с помощта на универсален индикатор.
Провеждане на йонообменни реакции за характеризиране на свойствата на електролитите.
Практически уроци
Приготвяне на разтвор с дадена моларна концентрация.
Идентификация на неорганични съединения.
НЕОРГАНИЧНА ХИМИЯ (55 часа)
Характерни химични свойства на металите, неметалите и основните класове неорганични съединения.
Водород. Положението на водорода в периодичната система. Изотопи на водорода. Съединения на водорода с метали и неметали. вода. Твърдост на водата и начини за премахването й. Тежка вода.
Халогени. Обща характеристика на халогенната подгрупа. Характеристики на химията на флуора. Халогеноводороди. Получаване на халогеноводороди. Концепцията на верижни реакции. Халогеноводородните киселини и техните соли са халогениди. Качествена реакция към халогенни йони. Кислородсъдържащи хлорни съединения.
Приложение на халогените и техните най-важни съединения.
Кислородът, неговите физични и химични свойства, получаване и използване, срещане в природата. Алотропия. Озон, неговите свойства, получаване и използване. Оксиди и пероксиди. Водороден пероксид, неговите окислителни свойства и приложение.
Сяра Алотропия на сярата. Физични и химични свойства на сярата, нейното производство и употреба, срещане в природата. Сероводород, неговите физични и химични свойства, получаване и използване, срещане в природата. Сулфиди. Серен (IV) оксид, неговите физични и химични свойства, получаване и приложение. Серен оксид (VI), неговите физични и химични свойства, получаване и приложение. Сярна киселина и сулфити. Сярна киселина, свойства на разредена и концентрирана сярна киселина. Сярна киселина като окислител. сулфати. Качествени реакции на сулфидни, сулфитни и сулфатни йони.
Азот, неговите физични и химични свойства, получаване и използване, срещане в природата. Нитриди. Амоняк, неговите физични и химични свойства, производство и употреба. Амонячна вода. Образуване на амониев йон. Амониеви соли, техните свойства, получаване и употреба. Качествена реакция на амониев йон. Азотен оксид (II), неговите физични и химични свойства, получаване и приложение. Азотен оксид (IV), неговите физични и химични свойства, получаване и приложение. Азотен оксид (III) и азотна киселина, азотен оксид (V) и азотна киселина. Свойства на азотната киселина, нейното получаване и употреба. Нитрати, техните физични и химични свойства, приложение.
Фосфор. Алотропия на фосфора. Свойства, получаване и използване на бял и червен фосфор. Фосфин. Фосфорни оксиди (III и V). Фосфорни киселини. Ортофосфати.
въглерод. Алотропия на въглерод (диамант, графит, карбин, фулерен). Активен въглен. Адсорбция. Свойства, производство и използване на въглищата. Калций, алуминий и жлеза. Въглероден двуокис и въглероден диоксид, техните физични и химични свойства, получаване и приложение.Въглеродна киселина и нейните соли (карбонати и бикарбонати). Качествена реакция на карбонатен йон.
Силиций, алотропия, физични и химични свойства на силиция, получаване и използване, срещане в природата. Силани. Силициев(IV) оксид. Силициеви киселини, силикати. Силикатна индустрия.
Благородни газове. Връзки благородни газове. Приложение.
Алкални метали. Обща характеристика на подгрупата. Физични и химични свойства на лития, натрия и калия. Тяхното производство и използване, присъствието им в природата. Оксиди и пероксиди на натрий и калий. Каустични алкали, техните свойства, получаване и употреба. Соли на алкални метали. Разпознаване на натриеви и калиеви катиони.
Алкалоземни метали. Обща характеристика на подгрупата. Физични и химични свойства на магнезий и калций, тяхното получаване и използване, срещане в природата. Калциеви и магнезиеви соли, тяхното значение в природата и живота на човека.
Алуминият, неговите физични и химични свойства, получаване и използване, срещане в природата. Алумосиликати. Амфотерност на алуминиевия оксид и хидроксид. Алуминиеви соли.
Преходни елементи (сребро, мед, цинк, хром, живак, манган, желязо), структурни особености на атомите, физични и химични свойства, получаване и приложение. Оксиди и хидроксиди на тези метали, зависимостта на техните свойства от степента на окисление на елемента. Най-важните соли на преходните елементи. Окислителните свойства на хромовите и мангановите соли в най-висока степенокисление. Сложни връзки на преходни елементи.
Общи методи за получаване на метали. Концепцията за металургията. Сплави (черни и цветни). Производство на желязо и стомана.
Демонстрации
Взаимодействие на метали с неметали и вода.
Експерименти по корозия и защита на металите от корозия.
Взаимодействие на калциев оксид с вода.
Елиминирайте твърдостта на водата.
Качествена реакция към калциеви и бариеви йони.
Доказателство за механичната якост на филма от алуминиев оксид.
Съотношение на алуминий към концентрирана азотна киселина.
Образци от метали, техните оксиди и някои соли.
Получаване и свойства на хромов (III) хидроксид.
Окислителни свойства на дихроматите.
Изгаряне на желязо в кислород и хлор.
Експерименти за определяне на връзката на желязото с концентрираните киселини.
Получаване на железни (II) и (III) хидроксиди, техните свойства.
Синтез на хлороводород и разтварянето му във вода.
Взаимно изместване на халогени от техните съединения.
Получаване на алотропни модификации на кислород и сяра.
Взаимодействие на сярата с водород и кислород.
Ефектът на концентрираната сярна киселина върху металите (цинк, мед) и органичните вещества (целулоза, захароза).
Разтваряне на амоняк във вода.
Получаване на азотна киселина от нитрати и запознаване с нейните свойства: взаимодействие с мед.
Термично разлагане на амониеви соли.
Получаване на въглероден оксид (IV), взаимодействието му с вода и твърд натриев хидроксид.
Получаване на силициева киселина.
Запознаване с образци на стъклени и керамични материали.
Лабораторни опити
Запознаване с образци на метали и сплави.
Превръщане на калциев карбонат в бикарбонат и бикарбонат в карбонат.
Получаване на алуминиев хидроксид и изследване на неговите свойства.
Хидролиза на алуминиеви соли.
Окисляване на хромова (III) сол с водороден пероксид.
Окислителни свойства на калиев перманганат и калиев дихромат в различни среди.
Взаимодействие на железни хидроксиди с киселини.
Взаимодействие на желязна (II) сол с калиев перманганат.
Качествени реакции към железни (II) и (III) соли.
Запознаване с образци от чугун и стомана.
Решаване на експериментални задачи за разпознаване на метални съединения.
Изследване на свойствата на солната киселина.
Въведение в сярата и нейните природни съединения.
Разпознаване на хлоридни, сулфатни и карбонатни йони в разтвор.
Взаимодействие на амониеви соли с алкали.
Запознаване с различни видове торове. Качествени реакции към амониеви соли и нитрати.
Решаване на експериментални задачи за разпознаване на вещества.
Запознаване с различни видове горива.
Запознаване със свойствата на карбонатите и бикарбонатите.
Практически уроци
Получаване и събиране на газове (кислород, амоняк, въглероден окис (IV) и др.), Експерименти с тях.
Определяне на карбонатно съдържание във варовик.
Премахване на временната твърдост на водата.
Изследване на редукционните свойства на металите.
Експерименти, характеризиращи свойствата на метални съединения.
Експериментални задачи за получаване и разпознаване на вещества.
Експериментално установяване на връзки между класове неорганични съединения.
Проблеми с изчисленията
Изчисляване на масовата част на химичен елемент в съединение.
Установяване на най-простата формула на вещество въз основа на масовите фракции на химичните елементи.
Изчисляване на обемни съотношения на газове при химични реакции.
Изчисляване на масата на веществата или обема на газовете от известно количество вещество на едно от реагиращите или получените вещества.
Изчисляване топлинен ефектвъз основа на данни за количеството на едно от участващите в реакцията вещества и отделената (погълната) топлина.
Изчисления с помощта на уравнения, когато едно от веществата се приема под формата на разтвор с определена концентрация.
Изчисления с помощта на уравнения, когато едно или повече вещества са взети в излишък.
Изчисляване на масата или обема на продукт от реакцията от известната маса или обем на изходно вещество, съдържащо примеси.
Определяне на добива на реакционния продукт от теоретично възможното.
Изчисляване на реакционната енталпия.
Изчисляване на промените на ентропията в химичен процес.
Изчисляване на промяната в енергията на Гибс на реакцията.
Изчисляване на масата или обема на разтворено вещество и разтворител за приготвяне на определена маса или обем на разтвор с дадена концентрация (маса, молар, молал).
ОРГАНИЧНА ХИМИЯ (70 часа)
Основни принципи на теорията за структурата на органичните съединения. Химическа структура като ред на свързване и взаимно влияние на атомите в молекулите. Свойството на въглеродните атоми да образуват прави, разклонени и затворени вериги, обикновени и множествени облигации. Хомология, изомерия, функционални групи в органичните съединения.Зависимост на свойствата на веществата от химичния строеж. Класификация на органичните съединения. Основни насоки на развитие на теорията за химичната структура.
Образуване на единични, двойни и тройни въглерод-въглеродни връзки в светлината на идеите за хибридизация на електронни облаци. Йонно и свободнорадикално разцепване на ковалентни връзки.
Наситени въглеводороди (алкани), обща формуласъстав, хомоложна разлика, химическа структура. Ковалентни връзки в молекулите sp 3-хибридизация. Зигзагообразна структура на въглеродната верига, възможност за въртене на връзките около въглерод-въглеродни връзки. Изомерия на въглеродния скелет. Систематична номенклатура. Химични свойства: изгаряне, халогениране, термично разлагане, дехидрогениране, окисление, изомеризация. Механизмът на реакцията на заместване. Синтез на въглеводороди (реакция на Вюрц). Практическо значениенаситени въглеводороди и техните халоген-заместени. Получаване на водород и ненаситени въглеводороди от наситени въглеводороди. Определяне на молекулната формула на газообразен въглеводород по неговата плътност и масова част от елементи или по продукти от горенето.
Ненаситени въглеводороди от етиленовата серия (алкени). sp 2 и sp-хибридизация електронни облаци от въглеродни атоми, ?- и ?-връзки. Изомерия на въглеродния скелет и позицията на двойната връзка. Номенклатура на етиленовите въглеводороди. Геометрична изомерия. Химични свойства: присъединяване на водород, халогени, халогеноводороди, вода, окисление, полимеризация. Механизъм на присъединителна реакция. Правилото на Марковников. Получаване на въглеводороди чрез реакция на дехидрогениране. Приложение на етиленовите въглеводороди в органичния синтез. Концепцията за диенови въглеводороди. Каучукът като естествен полимер, неговата структура, свойства, вулканизация. Ацетиленът е представител на алкините - въглеводороди с тройна връзка в молекулата. Характеристики на химичните свойства на ацетилена. Получаване на ацетилен, използване в органичния синтез.
Ароматни въглеводороди. Електронна структура на молекулата. Химични свойства на бензена: реакции на заместване (бромиране, нитриране), присъединяване (водород, хлор). Бензенови хомолози, изомерия в редица хомолози. Взаимно влияние на атомите в молекулата на толуола. Получаване и използване на бензен и неговите хомолози. Концепцията за пестицидите и тяхното използване в селското стопанство при спазване на изискванията за опазване на околната среда.
Сравнение на структурата и свойствата на наситени, ненаситени и ароматни въглеводороди. Взаимна връзка на хомоложните редове.
Природни източници на въглеводороди и тяхната преработка. Природни и съпътстващи нефтени газове, техният състав и употреба в национална икономика. Масло, неговия състав и свойства. Продукти от фракционна дестилация на масло. Крекинг и ароматизиране на петролни продукти. Опазване на околната среда при рафиниране на нефт и транспортиране на нефтопродукти. Октаново число на бензина. Начини за намаляване на токсичността на отработените газове от превозни средства. Коксуване на въглища, продукти от коксуване. Проблемът с получаването на течно гориво от въглища.
Алкохоли и феноли. Атомност на алкохолите. Електронна структура на функционалната група, полярност на връзката O – H. Хомоложна серия на наситени едновалентни алкохоли. Изомерия на въглеродния скелет и положение на функционалната група Първични, вторични, третични алкохоли Номенклатура на алкохолите. Водородната връзка между молекулите, нейното влияние върху физичните свойства на алкохолите. Химични свойства: изгаряне, окисление до алдехиди, взаимодействие с алкални метали, халогеноводороди, карбоксилни киселини. Изместване на плътността на електронната връзка в хидроксилната група под влияние на заместителите във въглеводородния радикал Приложение на алкохолите. Токсичността на алкохолите има пагубен ефект върху човешкото тяло. Получаване на алкохоли от наситени (чрез халогенопроизводни) и ненаситени въглеводороди. Промишлен синтез на метанол.
Етиленгликолът и глицеринът като представители на многовалентните алкохоли. Характеристики на техните химични свойства, практическа употреба.
Феноли. Структурата на фенолите, разликата в структурата от ароматните алкохоли. Физични свойства на фенолите. Химични свойства: взаимодействие с натрий, алкали, бром. Взаимно влияние на атомите в една молекула. Методи за защита на околната среда от промишлени отпадъци, съдържащи фенол.
Алдехиди. Структура на алдехиди, функционална група, нейната електронна структура, характеристики на двойната връзка. Хомоложна серия от алдехиди. Номенклатура. Химични свойства: окисление, присъединяване на водород. Получаване на алдехиди чрез окисление на алкохоли. Получаване на ацеталдехид чрез хидратиране на ацетилен и каталитично окисление на етилен Приложение на мравчен и ацеталдехид.
Структурата на кетоните. Номенклатура. Характеристики на окислителната реакция. Получаване на кетони чрез окисление на вторични алкохоли. Ацетонът е най-важният представител на кетоните, неговата практическа употреба.
Структура карбоксилни киселини. Електронна структура на карбоксилната група, обяснение на подвижността на водородния атом. Основност на киселините. Хомоложна серия от наситени едноосновни киселини. Номенклатура. Химични свойства: взаимодействие с някои метали, основи, алкохоли. Промяна в силата на киселините под влияние на заместителите във въглеводородния радикал. Особености мравчена киселина. Най-важните представители на карбоксилните киселини. Получаване на киселини чрез окисляване на алдехиди, алкохоли и наситени въглеводороди. Използването на киселини в националната икономика. Сапуните като соли на висшите карбоксилни киселини, тяхното почистващо действие.
Акриловата и олеиновата киселини като представители на ненаситените карбоксилни киселини. Концепцията за киселини с различна основност.
Генетична връзка на въглеводороди, алкохоли, алдехиди и кетони, карбоксилни киселини.
Структура на естерите. Обратимост на реакцията на естерификация. Хидролиза на естери. Практическа употреба.
Мазнини като естери на глицерин и карбоксилни киселини. Мазнините в природата, техните свойства. Трансформации на мазни храни в организма. Хидролиза и хидрогениране на мазнини в технологиите, продукти за преработка на мазнини. Понятие за синтетични детергенти (СДП) - техният състав, структура и свойства. Опазване на природата от SMS замърсяване.
Класификация на въглехидратите.
Глюкозата като най-важен представител на монозахаридите. Физични свойства и срещане в природата. Структурата на глюкозата. Химични свойства: взаимодействие с метални хидроксиди, реакции на окисление, редукция, ферментация. Използване на глюкозата Фруктозата като изомер на глюкозата.
Кратка информация за структурата и свойствата на рибозата и дезоксирибозата.
захароза. Физични свойства и срещане в природата. Химични свойства: образуване на захари, хидролиза. Химични процеси за получаване на захароза от естествени източници.
нишесте. Структурата на макромолекулите от глюкозни единици. Химични свойства: реакция с йод, хидролиза. Преобразуване на хранително нишесте в тялото. Гликоген.
Целулоза. Структурата на макромолекулите от глюкозни единици. Химични свойства: хидролиза, образуване на естери Приложение на целулозата и нейните производни. Концепцията за изкуствени влакна на примера на ацетатни влакна.
Структура на амините. Аминогрупа, нейната електронна структура. Амините като органични основи, взаимодействие с вода и киселини. Анилин, неговата структура, причини за отслабването на основните свойства в сравнение с амините от лимитиращата серия. Получаване на анилин от нитробензен (реакция на Зинин), значение в развитието на органичния синтез.
Структурата на аминокиселините, техните физични свойства. Изомерия на аминокиселините. Аминокиселините като амфотерни органични съединения. Синтез на пептиди, тяхната структура. Биологично значение на аминокиселините.
Обща концепция за хетероцикличните съединения.Пиридин и пирол като представители на азотсъдържащи хетероцикли, тяхната електронна структура, ароматен характер, различия в проявата на основните свойства. Пуринови и пиримидинови бази, включени в нуклеинова киселина.
Протеините като биополимери. Основни аминокиселини, които образуват протеини. Първична, вторична и третична структура на протеините. Свойства на протеините: хидролиза, денатурация, цветни реакции. Преобразуване на хранителни протеини в тялото. Напредък в изследването на структурата и синтеза на протеини.
Състав на нуклеинови киселини (ДНК, РНК). Структурата на нуклеотидите. Принципът на комплементарност при изграждането на двойната спирала на ДНК. Ролята на нуклеиновите киселини в живота на организмите.
Общи понятия за химията на високомолекулни съединения: мономер, полимер, структурна единица, степен на полимеризация, средна молекулна маса. Основните методи за синтез на високомолекулни съединения са полимеризация и поликондензация. Линейна, разклонена и пространствена структура на полимерите. Аморфна и кристална структура. Зависимост на свойствата на полимера от структурата.
Термопластични и термоактивни полимери. Полиетилен, полипропилен, полистирол, полиметилметакрилат, фенолформалдехидни смоли, тяхната структура, свойства, приложение. Композитни материали, характеристики на техните свойства, перспективи за използване.
Проблемът за синтеза на каучук и неговото решение. Разнообразието от видове синтетични каучуци, техните специфични свойства и приложения. Стереорегулярни гуми.
Синтетични влакна. Полиестерни (лавсан) и полиамидни (найлонови) влакна, тяхната структура, свойства, практическо приложение.
Проблеми на по-нататъшното подобряване на полимерните материали.
Демонстрации
Определяне на елементния състав на метан (или смес от пропан-бутан) от продукти на горенето.
Модели на въглеводородни и халогенопроизводни молекули.
Съотношението на наситени въглеводороди към разтвори на киселини, основи и калиев перманганат.
Изгаряне на етилен, взаимодействие на етилен с бромна вода и разтвор на калиев перманганат.
Показване на мостри на продукти от полиетилен и полипропилен.
Разлагане на каучук при нагряване и тестване за ненаситеност на продуктите от разлагането.
Получаване на ацетилен (по карбидния метод), изгарянето му, взаимодействие с бромна вода и разтвор на калиев перманганат.
Бензолът като разтворител, изгаряне на бензен. 9. Съотношението на бензен към бромна вода и разтвор на калиев перманганат.
Нитриране на бензен.
Окисление на толуен.
Количествено отделяне на водород от етилов алкохол.
Сравнение на имоти в хомоложни серии(разтворимост във вода, горене, взаимодействие с натрий).
Взаимодействие на етилов алкохол с бромоводород.
Получаване на етилацетат.
Взаимодействие на глицерол с натрий.
Изместване на фенол от натриев фенолат с въглеродна киселина.
Взаимодействие на стеаринова и олеинова киселини с алкали.
Хидролиза на сапун.
Съотношението на олеинова киселина към бромна вода и разтвор на калиев перманганат.
Проби от монозахариди, дизахариди и полизахариди.
Взаимодействие на глюкоза с амонячен разтвор на сребърен оксид, връзка с фуксинова киселина.
Хидролиза на захароза.
Хидролиза на целулоза.
Експерименти с метиламин (или друг летлив амин): горене, алкални свойства на разтвора, образуване на соли.
Доказателство за наличието на функционални групи в разтвори на аминокиселини.
Взаимодействие на анилин с солна киселинаи бромна вода.
Боядисване на плат с анилинова боя.
Образци от пластмаси, синтетичен каучук и синтетични влакна. Тестване на пластмаси, синтетичен каучук и синтетични влакна за електропроводимост.
Сравнение на свойствата на термопластични и термоактивни полимери.
Лабораторни опити
Моделиране на въглеводородни молекули.
Получаване на етилен и експерименти с него.
Връзката на каучука и каучука с органичните разтворители.
Разтваряне на глицерин във вода, неговата хигроскопичност.
Взаимодействие на глицерол с меден (II) хидроксид.
Окисляване на мравчен (или ацеталдехид) със сребърен оксид и меден (II) хидроксид.
Взаимодействие на алдехид с фуксинова киселина.
Окисляване на алкохол до алдехид.
Разтворимост на ацетон във вода, ацетон като разтворител, съотношение на ацетон към окислители.
Получаване на оцетна киселина от сол, опити с нея.
Решаване на експериментални задачи за разпознаване на органични вещества.
Съотношението на мазнини към вода и органични разтворители.
Доказателство за ненаситения характер на мазнините.
Осапунване на мазнини.
Сравнение на свойствата на сапун и синтетични детергенти.
Взаимодействие на разтвор на глюкоза с меден (II) хидроксид.
Взаимодействие на захароза с метални хидроксиди.
Взаимодействие на нишесте с йод, хидролиза на нишесте.
Запознаване с образци на естествени и изкуствени влакна.
Решаване на експериментални задачи за получаване и разпознаване на органични вещества.
Изследване на свойствата на термопластичните полимери (полиетилен, полистирол и др.): термопластичност, запалимост, връзка с разтвори на киселини, основи, окислители.
Откриване на хлор в поливинилхлорид.
Връзка на синтетичните влакна с разтвори на киселини и основи.
Получаване на нишки от найлонова смола или лавсанова смола.
Практически уроци
Приготвяне и изследване на свойствата на органични вещества (етилен, оцетна киселина и др.).
Разпознаване на органични вещества по характерни реакции.
Определяне дали дадено вещество принадлежи към определен клас.
Синтез на органични вещества (бромоетан, естер).
Хидролиза на мазнини и въглехидрати.
Експериментално установяване на генетични връзки между вещества от различни класове.
Разпознаване на пластмаси и химически влакна, изследване на техните свойства.
Изчислено задачи
Намиране на молекулната формула на газообразен въглеводород въз основа на неговата плътност и масова част от елементи или продукти на горене.
ХИМИЯ И ЖИВОТ (10 часа)
Химични процеси в живите организми. Биологично активни вещества. Химия и здраве. Проблеми, свързани с употребата на лекарства.
Химията в ежедневието. Перилни и почистващи препарати. Правила за безопасна работа с битова химия.
Общи принципи на химичната технология. Естествени източници на химикали.
Полимери. Пластмаси, влакна, каучук. Нови вещества и материали в технологията.
Химическото замърсяване на околната среда и последствията от него.
Проблеми на безопасната употреба на вещества и химични реакции в модерен живот. Токсични, запалими и експлозивни вещества.
Източници на химическа информация: образователни, научни и научно-популярни публикации, компютърни бази данни, Интернет ресурси.
Демонстрации
Образци на лекарствени продукти.
Образци на витамини.
Разлагане на водороден пероксид с помощта на неорганичен катализатор (манганов (IV) оксид) и ензим (каталаза).
Действие на слюнчената амилаза върху нишестето.
Мостри от керамика, метал и стъклокерамика и изделия от тях.
Проби от токсични, запалими и експлозивни вещества.
Практически уроци
Представяне на мостри на лекарствени продукти.
Представяне на проби от витамини.
Представяне на проби от химически санитарни и хигиенни продукти.
Запознаване с образци на керамика, металокерамика и изделия от тях.
Изучаване на инструкции за употреба на медицински, експлозивни, токсични и запалими лекарства, използвани в бита.
РЕЗЕРВНО ВРЕМЕ - 21 часа.
ИЗИСКВАНИЯ КЪМ НИВОТО НА ЗАВЪРШЕНАТА ПОДГОТОВКА
В резултат на изучаването на химия на ниво профил ученикът трябва
знам/разбирам
· ролята на химията в природните науки, нейната връзка с другите природни науки, значение в живота на съвременното общество;
· най-важните химични понятия: вещество, химичен елемент, атом, молекула, маса на атоми и молекули, йон, радикал, алотропия, нуклиди и изотопи, атомни с -, стр -, д -орбитали, химическа връзка, електроотрицателност, валентност, степен на окисление, хибридизация на орбитали, пространствена структура на молекули, мол, моларна маса, моларен обем, вещества с молекулярна и немолекулна структура, сложни съединения, дисперсни системи, истински разтвори, електролитна дисоциация, киселинно-базови реакции във водни разтвори, хидролиза, окисление и редукция, електролиза, скорост на химичната реакция, механизъм на реакцията, катализа, топлинен ефект на реакцията, енталпия, топлина на образуване, ентропия, химично равновесие, равновесие константа, въглероден скелет, функционална група, хомология, структурна и пространствена изомерия, индуктивни и мезомерни ефекти, електрофил, нуклеофил, основни типове реакции в неорганичната и органичната химия;
· основни закони на химията: закон за запазване на масата на веществата, периодичен закон, закон за постоянство на състава, закон на Авогадро, закон на Хес, закон за действие на масите в кинетиката и термодинамиката;
· основни теории на химията: атомна структура, химическо свързване, електролитна дисоциация, киселини и основи, структура на органични съединения (включително стереохимия), химична кинетикаи химична термодинамика;
· класификация и номенклатуранеорганични и органични съединения;
· естествени изворивъглеводороди и методи за преработката им;
· вещества и материали, широко използвани в практиката: основни метали и сплави, графит, кварц, стъкло, цимент, минерални торове, минерални и органични киселини, алкали, амоняк, въглеводороди, фенол, анилин, метанол, етанол, етиленгликол, глицерин, формалдехид, ацеталдехид, ацетон, глюкоза, захароза , нишесте, фибри, аминокиселини, протеини, изкуствени влакна, каучук, пластмаси, мазнини, сапуни и детергенти;
да бъде в състояние да
· обадете се изучавани вещества по „тривиална” и международна номенклатура;
· определи : валентност и степен на окисление на химичните елементи, йонен заряд, тип химична връзка, пространствена структура на молекулите, вид кристална решетка, естество на средата във водни разтвори, окислител и редуктор, посока на изместване на равновесието под въздействието на различни фактори, изомери и хомолози, принадлежност на веществата към различни класове органични съединения, характер на взаимното влияние на атомите в молекулите, видове реакции в неорганичната и органичната химия;
· характеризират : с - , стр- И д-елементи според позицията им в периодичната система на Д.И.Менделеев; общи химични свойства на металите, неметалите, основните класове неорганични съединения; структура и свойства на органичните съединения (въглеводороди, алкохоли, феноли, алдехиди и кетони, карбоксилни киселини, амини, аминокиселини и въглехидрати);
· обясни : зависимост на свойствата на химичния елемент и образуваните от него вещества от тяхното положение в периодичната система D.I. Менделеев; зависимост на свойствата на неорганичните вещества от техния състав и структура; същност и начини на образуване на химичните връзки; зависимостта на скоростта на химичната реакция от различни фактори, реактивността на органичните съединения от структурата на техните молекули;
· извършете химичен експериментчрез: разпознаване на най-важните неорганични и органични вещества; получаване на специфични вещества, принадлежащи към изучаваните класове съединения;
· поведение, ръководенеизчисления с използване на химични формули и реакционни уравнения;
· осъзнавамсамостоятелно търсене на химическа информация с помощта на различни източници (справочни, научни и научно-популярни публикации, компютърни бази данни, интернет ресурси); използват компютърни технологии за обработка и предаване на информация и представянето й в различни форми;
използват придобитите знания и умения в практически дейности и ежедневието, за да:
· разбиране глобални проблемипредизвикателства пред човечеството: екологични, енергийни и суровини;
· обяснения на химични явления, срещащи се в природата, бита и производството;
· екологично съзнателно поведение в околната среда;
· оценка на въздействието на химическото замърсяване на околната среда върху човешкото тяло и други живи организми;
· безопасна работа с вещества в лабораторията, у дома и на работното място;
· определяне на възможността за протичане на химични трансформации при различни условия и оценка на последствията от тях;
· разпознаване и идентифициране на основни вещества и материали;
· оценка на качеството на питейната вода и отделните хранителни продукти;
· критична оценка на надеждността на химическата информация, идваща от различни източници.